La Enfermedad Inflamatoria Intestinal (EII) se considera una enfermedad sistémica por su alta prevalencia de manifestaciones en otros órganos. Hasta el 50% de los pacientes pueden llegar a tener compromiso extraintestinal, principalmente en articulaciones, piel y ojos, causando un significativo deterioro en la calidad de vida.
La posibilidad de tener algún compromiso extraintestinal aumenta a mayor tiempo de evolución de la enfermedad, aunque muchas veces estas manifestaciones no tienen relación con la actividad inflamatoria en el intestino.
El compromiso de otros órganos puede ocurrir por distintos fenómenos inflamatorios o como consecuencia del tratamiento inmunosupresor o inmunomodulador que reciben los pacientes con EII. En ambos casos se debe poner al paciente en el contexto de su enfermedad sistémica y siempre evaluar el riesgobeneficio al momento de decidir el tratamiento.
Inflammatory Bowel Disease (IBD) is considered a systemic disease due to the high prevalence of the extraintestinal manifestations. Up to 50% of patients may have extraintestinal involvement, mainly in joints, skin and eyes, which could entail a worsening in the patients’ quality of life.
The risk of extraintestinal involvement increases with the duration of the disease. Nevertheless, these manifestations are not always related with the inflammatory activity in the intestine.
The involvement of other organs can occur secondary to different inflammatory phenomena or as a consequence of the immunosuppressive or immunomodulatory treatment received by patients with IBD. In both cases, patients should be placed in the context of their systemic disease and always assess the risk-benefit at the time of deciding the treatment.
Las manifestaciones extraintestinales (MEI) de la enfermedad inflamatoria intestinal (EII), constituyen un grupo heterogéneo de enfermedades que afectan a una diversidad de órganos y sistemas como el musculoesquelético, mucocutáneo, ocular, hepático, entre otros. Por este motivo, muchas veces es considerada una enfermedad inflamatoria sistémica. Estas manifestaciones tienen un impacto negativo adicional al que ya tienen en su calidad de vida los pacientes con EII1.
La prevalencia de las manifestaciones extraintestinales va desde 6 a 47%2. En estudios publicados por Marzano et al., la manifestaciones extra intestinales fueron identificadas en 43% de 580 pacientes con Enfermedad de Crohn (EC) y en un 31% de 370 pacientes con Colitis Ulcerosa (CU)3.
Las MEI no siempre se relacionan con la actividad de la EII. Hasta un 25% de estas pueden aparecer antes del diagnóstico del compromiso intestinal, con un promedio de latencia al diagnóstico de 5 meses2.
Lo anterior explica la importancia de saber identificar y sospechar las MEI en forma oportuna y así diagnosticar a tiempo una EII, disminuyendo el riesgo de progresión de la patología y de sus potenciales complicaciones.
Luego de las articulaciones, la piel es el órgano extraintestinal más afectado4. Con respecto al compromiso visual, se ha descrito una prevalencia de entre el 1 y 72%5,6,7,8,9,10,11,12.
En un estudio retrospectivo realizado en 316 pacientes atendidos por el grupo multidisciplinario de EII en Clínica Las Condes, las manifestaciones articulares se encontraron en 34% de los pacientes con CU y 44% de los portadores de EC, las dermatológicas en el 3 y 4% para CU y EC, respectivamente y las oculares en el 2% de pacientes con CU y 1% en aquellos con EC13.
Manifestaciones ReumatológicasLas manifestaciones músculo esqueléticas en paciente con EII se clasifican dentro las pelviespondiloartropatías y pueden dividirse en compromiso articular periférico (artritis tipo 1 y 2, artralgia sin artritis, entesitis o dactilitis) y compromiso de esqueleto axial (lumbago inflamatorio, sacroileitis aislada, espondilitis anquilosante)14,15,16. De manera adicional se observa un aumento en la frecuencia de otras patologías como osteopenia, osteoporosis y fibromialgia.
Compromiso articular periféricoa. Artritis tipo 1Corresponde a una oligoartritis (menos de 5 articulaciones inflamadas) asimétrica asociada con las reactivaciones de la EII. Afecta de manera predominante las articulaciones de las extremidades inferiores (rodillas, tobillos), no es erosiva y tiene una evolución que es autolimitada en relación al curso del cuadro intestinal. Su prevalencia es de 3.6-6%16,17,18 y se observa relación con la presencia del antígeno HLA-B27.
b. Artritis tipo 2Se presenta como una poliartritis simétrica de pequeñas articulaciones, de evolución progresiva que se presenta independiente del estadio de la enfermedad intestinal con un curso más agresivo que el observado en la artritis tipo 1 y potencialmente puede causar erosiones y deformación. Tiene una prevalencia de 2.5-4%16,17,18 y no tiene relación con la presencia de HLA-B27. En su diagnóstico diferencial debe descartarse la artritis reumatoide y otras enfermedades autoinmunes como lupus eritematoso sistémico.
c. Entesitis (Figura 1)Se refiere a la inflamación de la zona de unión del tendón con el hueso (entesis). Clínicamente se presenta como dolor y aumento de volumen en la inserción, siendo más frecuente observarlo en el tendón de Aquiles, fascia plantar (inserción del calcáneo), zona de inserción del tendón patelar en la rodilla. El diagnóstico es clínico, pero la ecografía de partes blandas presta ayuda como apoyo, siendo característico observar edema del tendón, peritendinitis y calcificación del tendón. Su prevalencia según los distintos grupos es de 6 a 50%16,18. figura 1
d. Dactilitis (Figura 2)Corresponde a al desarrollo de dolor y edema que compromete todo un dedo y que afecta hasta 4% de los pacientes con EII16,18. El diagnóstico es clínico, aunque el uso de ecografía y/o resonancia magnética permiten una mejor caracterización del cuadro, pudiéndose observar tenosinovitis del tendón flexor y sinovitis a nivel de la articulación con o sin compromiso de partes blandas extratendíneas y compromiso del extensor. figura 2
e. Artralgia y FibromialgiaEl dolor articular no inflamatorio es más común que la artritis en EII, su prevalencia en los distintos grupos va de entre 5.3 a 6%. Se caracteriza por la presencia de zonas de dolor a nivel de articulaciones, migratorio sin evidencia de inflamación. Tiene alguna similitud con los síntomas de fibromialgia, pero en esta última el dolor es generalizado y con una duración de tiempo mayor a 3 meses, asociados a otros síntomas como fatigabilidad e insomnio. La prevalencia de fibromialgia va de entre 3 a 37%16,17,18.
Compromiso axiala. Lumbago inflamatorioEs el rasgo clínico más característico en pacientes con compromiso axial y se presenta como dolor lumbar de inicio insidioso, de más de 3 meses de duración, predominio nocturno, asociado a rigidez matinal y que mejora con la actividad. En los pacientes con EII puede observarse como único síntoma, sin evidencia de sacroileitis o cambios que sugieran una espondilitis franca a nivel de imágenes. Su prevalencia es variable entre 17-22%19,20.
b. Sacroileitis aisladaLa sacroileitis aislada se observaba inicialmente hasta en un 16% en el periodo en que el diagnóstico dependía exclusivamente de alteraciones a nivel de radiografías simples. Actualmente, con el uso de la Resonancia Nuclear Magnética, se ha observado que puede estar presente hasta en el 46% de los casos21. Característicamente es unilateral, no está relacionada con la presencia del antígeno HLA-B27 y en muchos casos es asintomática.
c. Espondilitis AnquilosanteSe caracteriza por la presencia de lumbago inflamatorio con o sin limitación de los rangos de columna lumbar asociado a evidencia radiológica de sacroileitis. La aparición de esta enfermedad puede preceder en años al debut de la enfermedad intestinal y su evolución es independiente de la actividad de esta última.
En el año 2009 se introdujeron los criterios ASAS que incluyen la presencia de sacroileitis en imágenes y al menos un criterio clínico (lumbago inflamatorio, artritis, entesitis, dactilitis, uveítis, psoriasis, respuesta a AINES, historia familiar, presencia de HLA-B27, o PCR elevada) o presencia de HLA-B27 con otros dos rasgos clínicos. La sensibilidad y especificidad de estos criterios es del 82.9 y 84.4%, respectivamente. En EII su prevalencia es de entre 1 a 11.4%22,23.
Osteopatía metabólicaa. Osteopenia y osteoporosisLa EII se asocia a un riesgo incrementado de osteopenia y osteoporosis. Las tasas de prevalencia oscilan entre el 2 y el 30% para la osteoporosis y entre el 40 y 50% para la osteopenia 24,25.
La pérdida de masa ósea es un proceso de etiología multifactorial. Además de las causas comunes aplicables a la población general (edad, sexo, sedentarismo, tabaquismo), en los pacientes con EII existen factores nutricionales (malnutrición, ingesta pobre de calcio, déficit de vitaminas D y K), factores iatrogénicos (uso de corticoides) y factores relacionados con el propio proceso inflamatorio de la enfermedad.
Tratamiento de las Manifestaciones ReumatologicasEl tratamiento del compromiso articular asociado a la EII dependerá del tipo de expresión clínica de cada paciente.
En el caso de la artritis periférica los objetivos del tratamiento son disminución del dolor, inflamación y rigidez, así como permitir una capacidad funcional conservada en el tiempo.
En la artritis tipo 1, que tiene una evolución autolimitada y dependiente del componente digestivo, los fármacos de elección son los analgésicos como paracetamol – tramadol o, en el caso de las monoartritis, la infiltración con corticoides también es una opción común. El uso de anti inflamatorios no esteroidales (AINES) en estos pacientes es controversial debido al riesgo que existiría de reactivación de la enfermedad de base o deterioro de los síntomas ya presentes26,27,28. Estudios sugieren que si es necesario utilizar este tipo de fármacos, los pertenecientes a la familia de los COX-2 serían más seguros29,30. Un estudio utilizó eterocoxib en dosis de 60-20mg/día por 3 meses sin observarse exacerbación de la enfermedad tanto en CU o EC31. Resultados similares se han observado con el uso de celecoxib. Por lo tanto, la evidencia sugiere que el uso de eterocoxib o celecoxib por periodos de tiempo acotados (7-14 días) en estos pacientes sería seguro. La artritis tipo 2 al tener una evolución independiente y más bien crónica, en muchos casos puede requerir de terapia más específica. Entre las opciones que se tienen en estos casos están la sulfasalazina en dosis de 500mg hasta 3 gr/día32,33, en pacientes refractarios o con efectos secundarios el metotrexato, azatioprina y leflunomida, aunque para los últimos no se cuenta con estudios randomizados para poder demostrar eficacia, por lo que se debe evaluar caso a caso34. Por último, en pacientes refractarios a las opciones previas, el uso de anticuerpos en contra del factor de necrosis tumoral alfa (anti-TNF) ha demostrado tener un efecto beneficioso en el manejo de este tipo de artritis34.
En el caso de la entesitis y dactilitis, la primera línea de terapia corresponde al uso de AINES tipo COX-2, según lo descrito en el párrafo anterior. De manera complementaria, se puede agregar la infiltración como una opción terapéutica local y con rápida respuesta. En casos refractarios, existe la opción de iniciar sulfasalazina o metotrexato34. El uso de biológicos también ha mostrado eficacia como lo muestran estudios tanto con etarnecept y adalimumab35.
En pacientes con compromiso axial la terapia presenta varios componentes, siendo inicialmente la terapia física y el ejercicio fundamentales para disminuir el dolor, mejorar la movilidad y sobre todo, mantener la función. En pacientes con lumbago inflamatorio sin imágenes o sacroiletis aislada los AINES son la primera línea de tratamiento farmacológico observándose utilidad también con el uso de sulfasalazina34. En los pacientes con espondilitis anquilosante este no es el caso y no se observa beneficio con el uso de este compuesto o metotrexato o leflunomida. En este grupo de pacientes, la alternativa de terapia son los biológicos principalmente anti-TNF36,37,38, debiendo estos ser considerados precozmente en pacientes refractarios o con contraindicaciones al uso de AINES. Otra alternativa reciente con relación a biológicos es el uso de secukinumab (inhibidor de IL-17ª) en dosis de 150mg/mes, pero no hay trabajos respecto a su efectividad en EII, por lo tanto es una segunda opción en espondilitis refractaria a anti- TNF y con enfermedad intestinal estable39.
El tratamiento del compromiso osteometabólico en pacientes con EII no difiere de lo que se aplica en la población general. Es por lo tanto necesario corregir o minimizar conductas de riesgo (tabaquismo, sedentarismo), suplementación (vitamina D-Calcio–hormonoterapia de reemplazo) y el uso de terapia antiresortiva (denosumab–bifosfonatos) en pacientes con osteoporosis o fracturas osteoporóticas40.
Manifestaciones DermatológicasDatos recientes de una cohorte de pacientes suizos con EII, muestran que la prevalencia de manifestaciones cutáneas en EC y CU es de un 19.2% y 9.5%, respectivamente41.
Las manifestaciones dermatológicas de la EII se pueden clasificar según su relación con el mecanismo fisiopatológico en cuatro categorías: Específicas, reactivas, asociadas e inducidas por el tratamiento2,3.
Manifestaciones cutáneas específicasSon lesiones que se caracterizan por tener los mismos hallazgos histológicos que la EC. Pueden encontrarse en la zona perianal, cavidad oral o a distancia, denominándose enfermedad de Crohn metastásica.
Las manifestaciones de la enfermedad perianal en la EC son variadas. Estas incluyen plicomas, fisuras, úlceras, abscesos y fístulas42.
La afectación perianal corresponde, en general, a la primera manifestación de la EC. Las fisuras afectan a un 21-35% de los pacientes con EC. Estas lesiones se diferencian de las fisuras anales clásicas por no ubicarse en la línea media43.
Similares a las lesiones perianales, pueden encontrarse lesiones específicas en la mucosa de la cavidad oral, incluyendo ulceraciones lineales, fibromas mucosos, apariencia de empedrado en la mucosa (que representa la inflamación granulomatosa), además de fisuras en lengua, labios y mucogingivitis44.
El uso de infliximab en pacientes portadores de EC con fístulas, sería beneficioso. En un estudio realizado por Sands et al., se realizó seguimiento por 54 semanas a dos grupos de pacientes con fístulas en EC. De ellos, el 19% de los pacientes en placebo se mantuvo sin fístulas activas, versus el 36% en el grupo con infliximab45.
La EC metastásica puede tener distintas formas clínicas, como placas eritematosas, nódulos abscedados o tumores ulcerados. El diagnóstico diferencial debe hacerse con entidades como el pioderma gangrenoso. Como se dijo, la histología es igual a la vista en lesiones propias de la enfermedad, sin embargo, no existe contigüidad entre las lesiones y la afectación intestinal46.
La presencia de EC metastásica no se relaciona con la actividad intestinal. Un ejemplo de esto fue visto en una paciente con EC tratada por el grupo multidisciplinario de EII de Clínica las Condes, quien estando totalmente asintomática desde el punto de vista intestinal, presentó nódulos abscedados en extremidades inferiores (fig. 3). La biopsia de piel mostró infiltrado inflamatorio extenso con granulomas necrotizantes, descartando otras enfermedades granulomatosas, se diagnosticó EC metastásica. Simultáneamente, presentó una uveítis anterior bilateral. Por la presencia de manifestaciones extraintestinales fue tratada con infliximab, con muy buena respuesta clínica.
Manifestaciones cutáneas reactivasA diferencia del grupo anterior, estas no exhiben las características histológicas de la enfermedad de base, sin embargo, comparten el mismo mecanismo patogénico. En este grupo se encuentran las dermatosis neutrofílicas como el pioderma gangrenoso y el síndrome de Sweet.
a. Pioderma GangrenosoLa incidencia del pioderma gangrenoso (PG) en CU se ha reportado de 0.6 a 2.1%, observándose más frecuentemente que en EC47,48. Clínicamente puede tener varios tipos de presentación, comenzando como pústulas eritematosas, hasta úlceras que compromete todo el grosor de la piel, con bordes definidos y abundante exudado. Es una dermatosis severa debilitante que puede presentar intenso dolor. Si bien puede ubicarse en cualquier lugar del cuerpo, aparece con mayor frecuencia en la cara anterior de las piernas y a nivel periostomal. La etiología de esta condición comprende una disfunción neutrofílica, con presencia de citoquinas inflamatorias y predisposición genética49. Un hallazgo clínico de PG es el fenómeno de patergia, que puede encontrarse en esta y otras dermatosis neutrofílicas. Se caracteriza por una respuesta inflamatoria cutanea secundaria a pequeños traumas que producen disrupción de la epidermis, esto genera la aparición de pápulas o pústulas en la zona afectada o bien la activación de una lesión preexistente. Es común de ver cuando se realiza aseo quirúrgico de un PG, observándose empeoramiento del cuadro.
El tratamiento de primera línea se basa en inmunosupresión sistémica con corticoides y ciclosporina, pero se debe poner en contexto de la actividad de la EII, ya que podría ser indicativo el uso agentes biológicos anti-TNF como primera alternativa48,50. El estudio STOP-GAP (Study of treatment for pyoderma gangrenosum) comparó en forma ciega, aleatoria y multicéntrica el uso de prednisolona y ciclosporina, mostrando similitud en la velocidad de curación y en el porcentaje de curación de ambos grupos, teniendo los efectos adversos conocidos para cada fármaco. Este estudio confirmó la necesidad de contar con evidencia de nuevas alternativas terapéuticas.51
b. Síndrome de SweetEn 1988 se describió la relación entre EII y el síndrome de Sweet. Esta infrecuente entidad, se presenta más comúnmente en EC y en mujeres. Se conoce como una dermatosis neutrofílica aguda febril y se caracteriza por placas o nódulos infiltrados en extremidades, tronco y cara. Se presenta con compromiso del estado general, artritis y síntomas oculares. Además de su mayor prevalencia en EII, se asocial a infecciones y cáncer52,53.
El enfrentamiento terapéutico inicial, al igual que en PG, es con corticoides y manejo de la patología de base.
Manifestaciones cutáneas asociadasSon aquellas que no comparten el mismo mecanismo patológico de la EII, pero se observan asociadas con mayor frecuencia a esta. En este grupo se encuentran el eritema nodoso (EN), vasculitis, psoriasis, hidrosadenitis y lesiones de la mucosa oral3,44.
a. Eritema NodosoEs la manifestación cutánea más frecuentes en pacientes con EII (3 a 15%). Se observa principalmente en pacientes mujeres con EC. Clínicamente se presenta como nódulos dolorosos, eritemato violáceos, con mayor frecuencia en la cara anterior de piernas, pero también se pueden encontrar en muslos o tronco. En el estudio histológico se observa infiltrado inflamatorio neutrofílico y paniculitis54.
La aparición de EN generalmente tiene relación con la actividad de la enfermedad de base, además estas mejorarían con el manejo del cuadro digestivo. Los pacientes con lesiones leves pueden tratarse con antiinflamatorios no esteroidales, corticoides sistémicos, yoduro de potasio y medidas físicas de reposo5.
En presencia de EN se debe descartar enfermedades neoplásicas como linfomas, infecciones por Streptoccoco, tuberculosis, sífilis secundaria y Yersinia entre otras2. También, se relaciona con el uso de sulfonamidas, anticonceptivos orales y embarazo.
b. PsoriasisLas reacciones psoriasiformes asociadas a EII son frecuentes (7-11%)55.
Se describen marcadores genéticos vinculados tanto a EC como a psoriasis, identificados en regiones específicas de ciertos cromosomas. Ambas son enfermedades inflamatorias crónicas mediadas por linfocitos Th1y citoquinas como TNF-alfa, IFN-gamma e IL-12. Esto toma especial relevancia en el momento de decidir el tratamiento sistémico56.
La presentación leve o moderada de psoriasis puede tratarse con corticoides tópicos, ácido salicílico y análogos de la vitamina D. Los casos severos deben tratarse con metotrexato, ciclosporina o agentes anti-TNF.
c. VasculitisLa frecuencia de vasculitis en pacientes con EII es muy baja y puede observarse de manera polimorfa. Clínicamente se puede presentar como púrpura palpable, urticaria y úlceras necróticas en extremidades inferiores. Es mandatorio realizar una biopsia de piel para confirmar el diagnóstico y excluir otras patologías. En la histología se observa una vasculitis leucocitoclástica caracterizada por infiltrado dérmico perivascular compuesto de neutrófilos con cariorrexis y necrosis fibrinoide de la pared de los vasos57.
El tratamiento debe ser precoz con corticoides sistémicos y eventualmente asociado a otro inmunosupresor como metotrexato o ciclosporina.
d. Hidrosadenitis supurativaLa hidrosadenitis supurativa es una condición crónica caracterizada por nódulos, abscesos y tractos sinusales localizado en regiones de glándulas apocrinas en la región axilar, inguinal y perianal. Las lesiones son recurrentes y afectan significativamente la calidad de vida. La etiopatogenia no está bien clara, pero citoquinas inflamatorias como TNF alfa, IL-1β, IL-10, IL-17 e IL12/23 están involucradas en su desarrollo, al igual que en la EII. Los pacientes con EII tienen 9 veces más riesgo de desarrollar HS comparado con la población general y se asocia más a EC. Varios autores plantean que la hidrosadenitis perianal puede ser confundida con EC perianal. En general, el manejo de estas lesiones en el contexto de EII es supeditado al manejo de la patología de base58.
e. Lesiones oralesLas lesiones orales son muy comunes en pacientes con EII afectando a un 5 a 50% de los pacientes44.
Dentro de las lesiones asociadas a EII, se encuentran la periodontitis, úlceras recurrentes o aftas y la queilitis angular.
La periodontitis es una condición frecuente en la población general. Puede manifestarse de manera aguda o crónica. Es la respuesta inflamatoria a la placa bacteriana encontrada en los surcos gingivales. Esta respuesta conlleva a la destrucción de los tejidos de soporte del diente, desde ligamentos periodontales hasta disminución del hueso alveolar, lo que finalmente termina en la pérdida dentaria. En los pacientes con EII, la periodontitis crónica suele manifestarse de manera más agresiva2,44.
Las aftas o úlceras orales recurrentes corresponden a lesiones únicas o múltiples, generalmente ovaladas, con malla de fibrina y habitualmente muy dolorosas. En la población general, la prevalencia puede alcanzar un 20%.
La etiología de las aftas no está dilucidada. Pueden ser primarias, secundarias o asociadas a otras enfermedades sistémicas como Behçet o EII59.
La queilitis angular también corresponde a una lesión frecuente en la población general, pero es más prevalente en los pacientes con EII. Se presenta como eritema con o sin fisuras dolorosas en los ángulos labiales. Se asocia a infecciones locales fúngicas o bacterianas2,44.
Manifestaciones cutáneas inducidas por el tratamiento de EIIEn términos generales, los pacientes con EII son tratados con tiopurinas (azatioprina) y/o fármacos anti-TNF (infliximab, adalimumab).
En nuestra población, basado en la realidad económica y consensos internacionales, es común que la mayoría de los pacientes inicien tratamiento con azatioprina.
La asociación entre azatioprina y exposición a radiación ultra violeta A aumenta los radicales libres de oxigeno que generan mutación en el ADN y aumento de cáncer de piel no melanoma (CPNM)60 y de linfomas. La evidencia muestra que el mayor riesgo de desarrollar CPNM ocurre en pacientes mayores de 50 años que han recibido azatioprina por más de 4 años61.
Sabiendo esto, no hay estudios que analicen el potencial riesgo de desarrollar CPNM versus el beneficio del control de la inflamación. Su uso debe ser individualizado para cada paciente y las potenciales complicaciones deben ser discutidas62.
El uso de agentes que bloquean el TNF alfa, ha significado un éxito en el manejo de la EII y otras enfermedades inflamatorias. Sin embargo, al usar estos medicamentos pueden observarse reacciones adversas y paradojales hasta en un 10% de los pacientes. Dentro de estas, es común observar reacciones locales en el sitio de inyección, infecciones cutáneas y reacciones psoriasiformes. Menos comunes, pero descritas en la literatura se encuentran las vasculitis, síndrome lupus-like y reacciones severas como síndrome de Stevens-Johnson y necrolisis epidérmica tóxica.
También existe una mayor incidencia de cáncer de piel al usar anti-TNF, pero se desconoce el mecanismo patológico4.
Como recomendación general, antes de iniciar tratamiento inmunosupresor o inmunomodulador, especialmente con azatioprina, se debe realizar un examen físico dermatológico completo, recomendar protección solar estricta y controlar anualmente durante el tratamiento.
Manifestaciones OcularesComo se dijo previamente, la prevalencia de compromiso visual se ha descrito entre el 1 y 72%5,6,7,8,9,10,11,12. Esta gran variabilidad es producto de las diferentes poblaciones estudiadas, de las patologías incluidas en la definición de compromiso ocular y del tipo de centro donde se realiza el estudio (primarios o de derivación).
Al igual que otras MEI de la EII, se cree que el compromiso oftalmológico puede ser producido por complejos inmunes circulantes, mimetismo molecular entre bacterias del tubo digestivo y órganos extraintestinales, respuesta inmune cruzada a antígenos compartidos por el tracto intestinal y otros órganos, y al efecto de algunas mutaciones genéticas (ie NOD2). También se ha planteado que la presencia del fenotipo HLA B27, podría contribuir a una disbiosis en el tubo digestivo que lleve a un quiebre de la homeostasis inmunológica y a la ruptura de la barrera epitelial intestinal, produciendo translocación de bacterias y otros productos hacia la vía sistémica, desencadenando finalmente, procesos inflamatorios en órganos satélites.
La aparición y curso de este compromiso ocular puede ocurrir independientemente del estado de la EII.
Por otro lado, el sistema visual puede verse comprometido también por complicaciones asociadas a los fármacos usados en el manejo de la EII.
Compromiso ocular inflamatorioLas manifestaciones oftalmológicas inflamatorias más frecuentes son el ojo seco, la uveítis anterior, epiescleritis y escleritis anterior, sin embargo, también se ha descrito la ocurrencia de queratitis ulcerativa periférica, uveítis intermedia y posterior, panuveítis, escleritis posterior y vasculitis retinal11,63,64,65,66,67,68,69,70,71.
a. Síndrome de ojo secoEl ojo seco es una manifestación ocular común en varias enfermedades autoinmunes. Su prevalencia en la EII puede llegar a ser sobre el 50%11. Si bien muchas veces es asintomático y se detecta solo mediante pruebas objetivas (ie. test de Schirmer, tiempo de ruptura del film lagrimal y osmolaridad lagrimal), el paciente puede quejarse de sensación de arenilla, ardor ocular, lagrimeo reflejo y ojo rojo.
Su manejo se basa en el control de la patología de base más el uso de lágrimas artificiales en gotas o gel. Los casos más severos pueden requerir oclusión temporal o permanente de los puntos lagrimales para disminuir el drenaje de la lágrima.
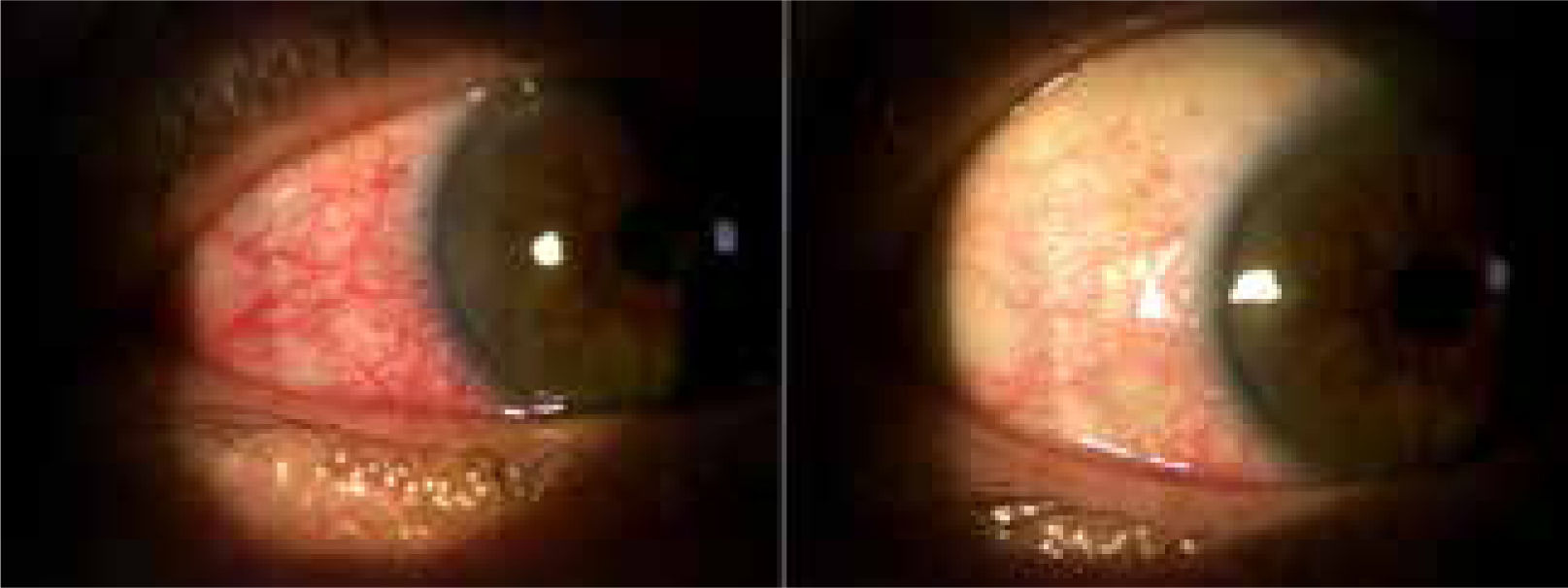
b. EpiescleritisCorresponde a una inflamación de los vasos epiesclerales y conjuntivales. Yilmaz et al.8, refiere una prevalencia del 3.5% en su serie. Clínicamente se manifiesta como un ojo rojo y dolor. Al examen físico, los vasos ingurgitados que determinan el ojo rojo son móviles mediante una tórula o cotonito. Además, al instilar colirio de vasoconstrictor (Fenilefrina), hay un blanqueamiento significativo del ojo (fig. 4). Estos dos elementos, ayudan a diferenciarlo de la escleritis.
Generalmente responde bien al tratamiento con corticoides tópicos.
c. EscleritisA diferencia de la epiescleritis, los vasos comprometidos son más profundos. El ojo rojo es más violáceo y doloroso. Al palpar el globo ocular, aparece un dolor exquisito. Los vasos esclerales congestivos no son móviles al desplazar la conjuntiva con una tórula y la aplicación de Fenilefrina tiene poco efecto sobre el ojo rojo.
La ubicación más frecuente de la inflamación escleral es anterior, aunque hay también casos descritos de escleritis posterior en pacientes con EII.
Si bien, el tratamiento de primera línea es con AINES, su uso puede estar limitado en pacientes con EII. En estos casos, el uso de corticoides regionales o sistémicos es preferible. En caso de falta de respuesta, necesidad de ahorrar corticoides o de efectos adversos secundarios a esta terapia, el uso de inmunosupresores como el metotrexato ha mostrado ser efectivo.
d. Uveítis anteriorCorresponde a un proceso inflamatorio intraocular, específicamente del iris y cuerpo ciliar.
Se ha reportado entre un 5-10% de los pacientes con EEI, siendo algo más frecuente en la EC5,6,8,72. Turkapar et al7, refiere hasta un 34% de prevalencia en pacientes con EII que además son HLA B27(+).
Clínicamente se presenta como un ojo rojo, dolor, fotofobia y en algunos casos con baja de visión. Al examen destaca un ojo rojo periquerático, depósitos celulares en endotelio corneal (precipitados queráticos), células en cámara anterior, flare, miosis y sinequias posteriores (adherencias patológicas entre el iris y cristalino). La catarata, glaucoma y edema macular pueden aparecer como complicaciones secundarias al proceso inflamatorio ocular.
El tratamiento se basa en colirios cicloplégicos para aliviar el dolor y evitar sinequias posteriores, junto con corticoides tópicos, oculares, perioculares o sistémicos. Los casos más severos pueden requerir inmunosupresión. Los fármacos más usados y que son efectivos tanto a nivel ocular como para el compromiso sistémico son el metotrexato y la azatioprina. La terapia biológica, especialmente los anticuerpos anti-TNF, han mostrado también su efectividad para el manejo de las uveítis.
Compromiso ocular secundario al tratamiento de la EIIAdemás del proceso inflamatorio que puede afectar al ojo secundario a la enfermedad de base, el uso de corticoides sistémicos e inmunosupresores pueden afectar el sistema visual.
La catarata, hipertensión ocular, glaucoma y la corioretinopatía central serosa pueden ser complicaciones del uso de corticoides. Por otro lado, la inmunosupresión farmacológica que se busca en estos pacientes puede llevar a infecciones oculares severas.
a. CataratasSi bien el uso crónico de corticoides tópicos es un factor importante para el desarrollo de cataratas, su administración por vía sistémica por tiempo prolongado puede llevar al mismo resultado. Becker73 señala que en pacientes con artritis reumatoide con dosis moderada de prednisona (10mg/día) por más de 2 años, 30-40% desarrolla catarata. Esta figura se eleva a 80-100% con dosis >15mg/día por más de 4 años.
b. Hipertensión ocular y glaucomaEl alza de presión intraocular secundaria al uso de corticoides se ha descrito por eventualmente cualquier vía de administración (tópica, periocular, intraocular, sistémica, inhalatoria, intranasal o de aplicación dérmica), siendo mucho más frecuente en la vía tópica y local.
Si el uso de corticoides no ha sido por tiempo prolongado, la presión intraocular puede normalizarse al suspender el fármaco. No obstante, muchas veces es necesario el uso de drogas para el control de la presión intraocular. La cirugía se reserva para los casos más refractarios.
Una hipertensión ocular mantenida en el tiempo afectará las fibras del nervio óptico, lo que se traducirá en pérdida de campo visual, produciéndose el glaucoma. De no mediar tratamiento, se puede llegar a una ceguera irreversible.
c. Corioretinopatía central serosa (CRCS)La CRCS es una enfermedad idiopática caracterizada por desprendimiento seroso de la retina neurosensorial. Dentro de su patogenia, se ha descrito un aumento de la permeabilidad de los vasos coroídeos, produciendose puntos de filtración único o múltiples y defectos de barrera a nivel del epitelio pigmentario retinal. Fármacos como los corticoides han sido asociados a la aparición de esta patología. Clínicamente se manifiesta con baja de visión central, metamorfopsias, escotoma central y disminución de la saturación del color. Al examen físico, es característico un desprendiemiento de retina seroso a nivel del polo posterior. Si bien el diagnóstico es eminentemente clínico, la tomografía de coherencia óptica (OCT) macular y la angiografía retinal con fluoresceína e indocianina verde permiten apoyar el diagnóstico (fig. 5)
Normalmente es una patología autolimitada, con buen pronóstico visual, pero en caso de uso de corticoides, se debe tratar de suspender o disminuir su uso. Fármacos como la espironolactona, el láser térmico y la terapia fotodinámica son otras modalidades de tratamiento que han mostrado efectividad.
d. Infecciones oportunistasLos pacientes con EII en tratamiento inmunosupresor pueden desarrollar infecciones oculares severas. Los tejidos que más gravemente pueden verse comprometidos son la retina y coroides. Infecciones por virus de la familia herpes (simplex, zoster), citomegalovirus, pneumocistis jirovencii y toxoplasma gondii pueden aumentar su incidencia en pacientes inmunosuprimdos (fig. 6).
ConclusiónLos pacientes con EII pueden presentar frecuentemente compromiso de otros órganos, como la piel, las articulaciones y el ojo, por lo que es recomendable que sean evaluados y tratados por un equipo médico multidisciplinario. Como varias manifestaciones extraintestinales no tienen relación con la actividad inflamatoria del intestino, se debe conocer y sospechar su asociación para realizar un diagnóstico y tratamiento oportuno, disminuyendo complicaciones y mejorando la calidad de vida de nuestros pacientes.
Además del compromiso inflamatorio extraintestinal, descrito en el contexto de una EII, es común encontrar manifestaciones como consecuencia del tratamiento inmunosupresor prolongado o de los fármacos inmunomoduladores que controlan la enfermedad de base. Estos efectos pueden ser minimizados si se detectan precozmente y se evalúa cada paciente en forma individual.
Se recomienda especialmente la evaluación periódica de los pacientes con EII por reumatólogos, dermatólogos y oftalmólogos que estén familiarizados con las enfermedades asociadas a esta enfermedad y que tengan una comunicación fluida con los gastroenterólogos tratantes, para mejorar el diagnóstico y tratamiento.
Declaración conflicto de interesesLos autores declaran no haber recibido fondos para escribir el artículo.
Referencias no citadas73.