Identificar el uso clínico de la metadona como analgésico en el manejo del dolor oncológico en ancianos.
Material y métodosSe realizó una revisión sistemática de la literatura sobre el uso específico de la metadona en ancianos con dolor oncológico en las bases de datos MEDLINE, COCHRANE DATABASE y SCOPUS. Se llevó a cabo una segunda búsqueda en MEDLINE de estudios clínicos y revisiones sistemáticas del uso de metadona en dolor oncológico, seleccionando aquellos en los que la edad media de los pacientes fuese ≥65 años.
ResultadosEn la primera búsqueda se obtuvieron 4 artículos y de la segunda 7 estudios, ninguno de ellos específicos del uso de la metadona en ancianos con cáncer.
ConclusionesNo existen datos suficientes del uso de la metadona como analgésico en el anciano con cáncer. Dadas sus peculiaridades características farmacológicas es necesario su uso por personal experto. Se proponen unas recomendaciones para su empleo como analgésico en el tratamiento del dolor oncológico en el anciano.
To identify the clinical use of methadone as an analgesic in the management of cancer pain in elderly patients.
Material and methodsWe performed a systemic review of the literature on the specific use of methadone in elderly with cancer pain in MEDLINE, COCHRANE DATABASE and SCOPUS. A second search was conducted in MEDLINE to look for clinical trials and systematic review of the use of methadone in cancer pain, selecting only those in which the mean age of patients was ≥65 years old.
ResultsFour articles were obtained in the first search, and from the second 7 clinical trials, none of them specific to methadone use in elderly patients with cancer.
ConclusionsThere are insufficient data on the use of methadone as an analgesic in the elderly with cancer. Given its pharmacological characteristics it must be used by trained personnel. Several recommendations are proposed for its use as an analgesic in the treatment of cancer pain in the elderly.
El número de pacientes ancianos con cáncer se va incrementando con el envejecimiento de la población; de hecho, los ancianos constituyen el grupo de población que padece con más frecuencia cáncer1. El 50% de los tumores se diagnostican en pacientes de 70 años o más2. Por otra parte, el 80% de los pacientes con cáncer avanzado presentarán dolor moderado o severo a lo largo de su enfermedad3,4.
El manejo farmacológico del dolor en el anciano es complicado dadas las diferencias en la absorción, la distribución, el metabolismo y la excreción de los fármacos.
En los últimos años se ha incrementado el interés por el uso de la metadona en pacientes con dolor.
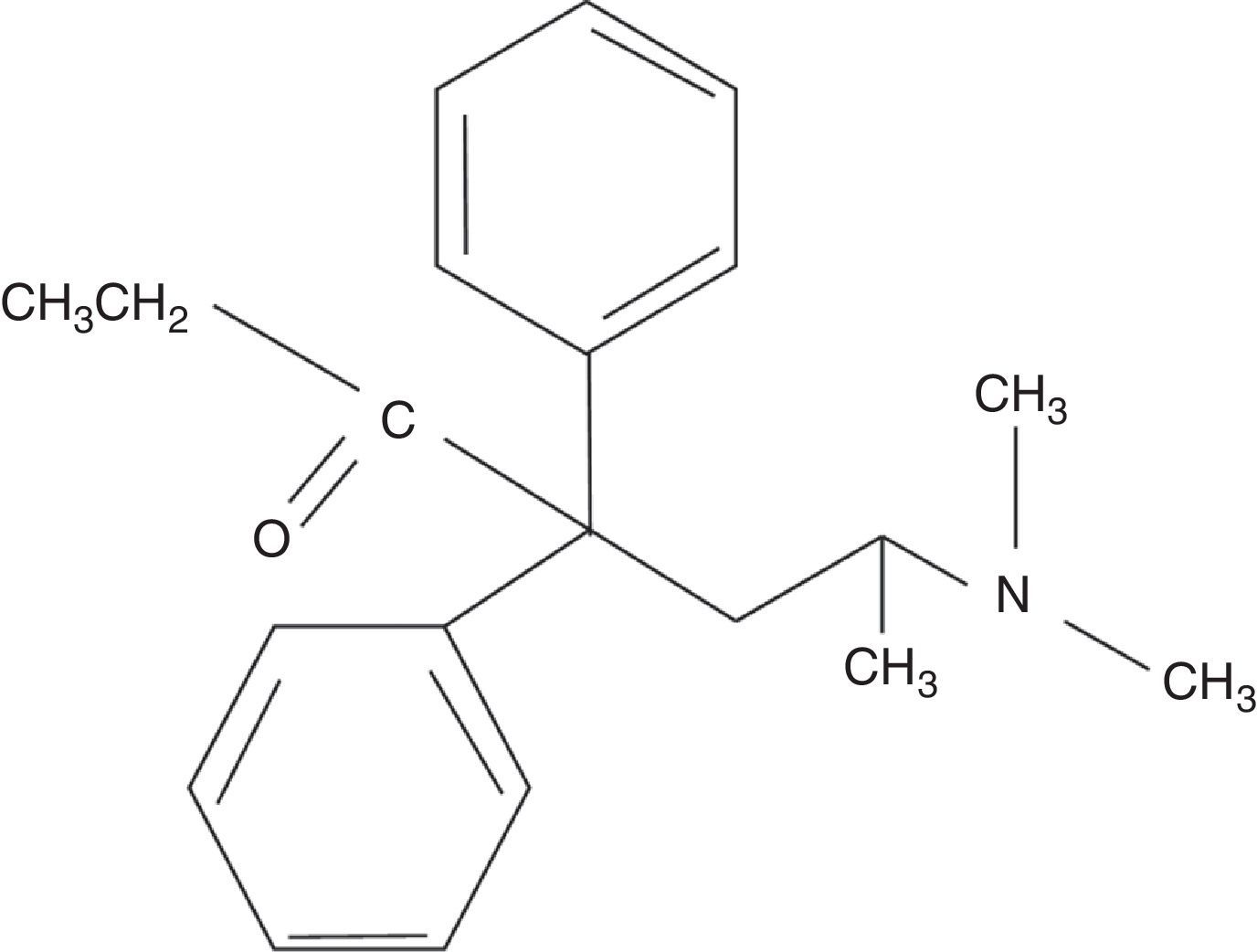
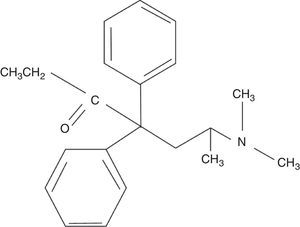
La metadona es un opiáceo sintético de la clase estructural de las difenilpropilaminas5 (fig. 1). Es un potente agonista de los receptores opioides mu, kappa y delta6. Posee un efecto antagónico sobre el receptor N-metil-D-aspartato e inhibe la recaptación de serotonina y noradrenalina7–9. Su acción agonista mu le confiere su principal actividad analgésica. Su acción sobre los receptores N-metil-D-aspartato y la inhibición sobre las monoaminas sugieren que puede tener un papel relevante en el tratamiento del dolor neuropático10.
La metadona es un fármaco básico y lipofílico, características que favorecen una buena absorción por cualquiera de las vías de administración. Administrada oralmente, se absorbe rápidamente en el tracto gastrointestinal con una biodisponibilidad media del 80%11,12. Se distribuye rápidamente (2-3h) seguido de una fase de eliminación lenta (15-60h)11, pudiendo ser más elevada en ancianos (hasta 120h)13. Se alcanza un nivel estable del fármaco hacia los 7-14 días de haberlo iniciado. Tiene un elevado volumen de distribución (3,59L/kg). Se une en un porcentaje elevado (60-90%) a proteínas plasmáticas, principalmente la α-glucoproteína14,15. Su administración repetida produce una acumulación en los tejidos grasos que favorece su alto volumen de distribución y su fuerte unión a proteínas plasmáticas14. Estas características le confieren una vida media plasmática elevada de aproximadamente 24h [13-100h]14. Es metabolizada por N-metilación en el hígado y la pared intestinal a través del citocromo P45011, lo que implica un importante riesgo de interacciones farmacológicas. Se elimina principalmente por vía renal (30%) y biliar (60%)14, de tal manera que su eliminación no se afecta sustancialmente en casos de insuficiencia renal o hepática16.
Su efectividad como analgésico en el control del dolor oncológico está ampliamente estudiada17–19. Sin embargo, su uso en los ancianos no está bien definido, recomendándose a personal experto20.
El objetivo de este artículo es ofrecer al lector una revisión sistemática de la literatura. Asimismo, se proponen unas recomendaciones de uso en pacientes ancianos con cáncer avanzado.
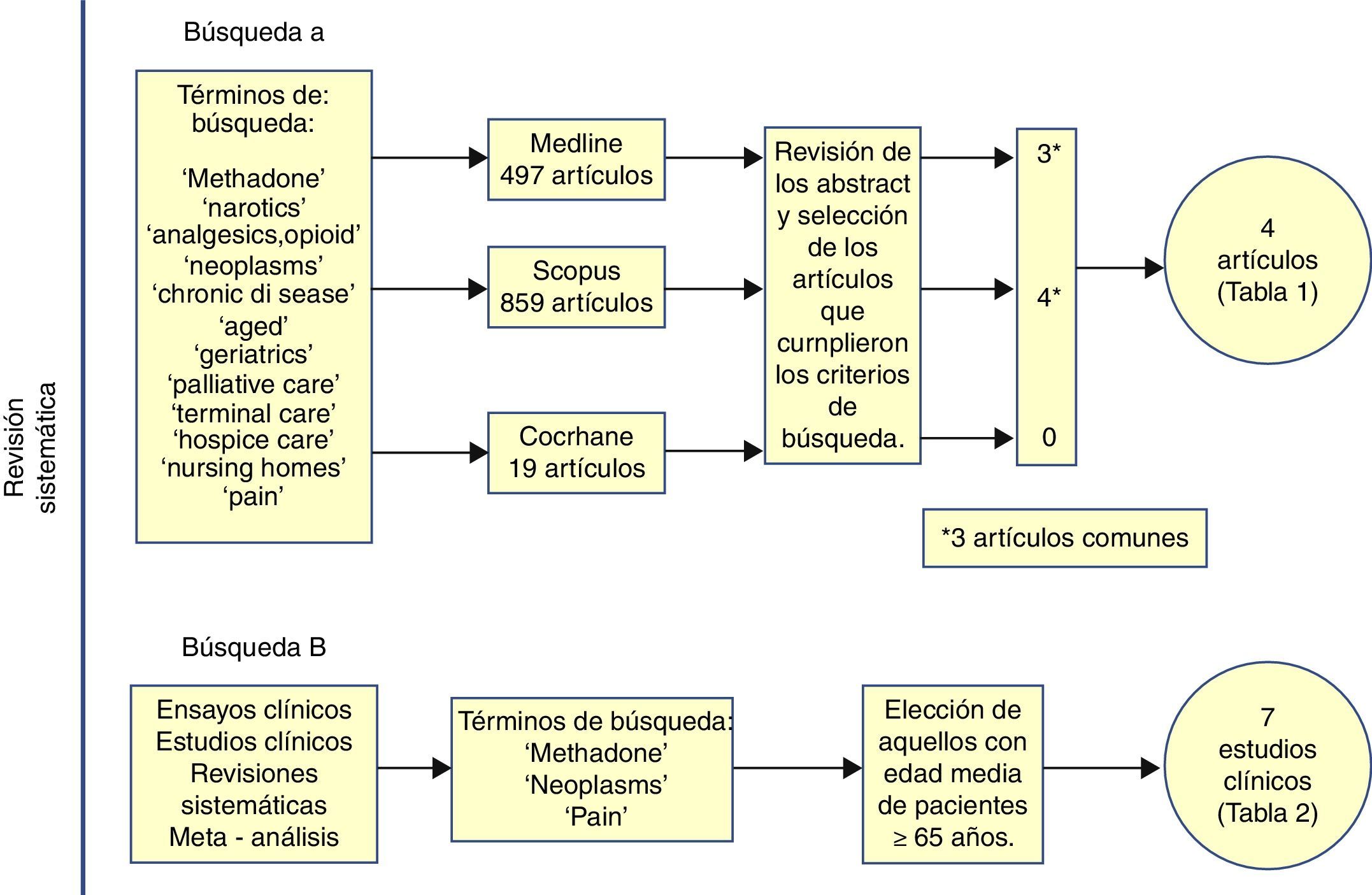
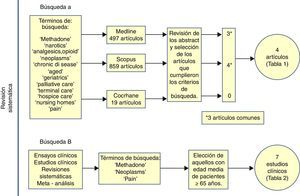
Material y métodosSe realizó una revisión sistemática de la literatura en las siguientes bases de datos: MEDLINE (1960-2011), COCHRANE DATABASE (-2011) y SCOPUS (-2011). Se utilizaron los siguientes términos de búsqueda y asociaciones entre ellos: «Methadone», «narcotics», «analgesics, opioid», «neoplasms», «chronic disease», «aged», «geriatrics», «palliative care», «terminal care», «hospice care», «nursing homes» y «pain»(fig. 2).
Se analizaron los abstracts de estos artículos y se seleccionaron aquellos que en el abstract aparecieran los siguientes aspectos: ancianos, metadona y dolor oncológico. Los artículos fueron revisados por 2 revisores (MT y CVC) de manera independiente. En caso de existir alguna duda, un tercer revisor (JGB) analizaba el documento.
Ante la escasez de información encontrada se realizó una búsqueda sistemática de estudios clínicos, ensayos clínicos y metaanálisis en MEDLINE(1960-2012) que incluía los términos «Methadone», «Neoplasms» y «Pain» con el objetivo de identificar la respuesta analgésica y los efectos secundarios aparecidos de forma específica dentro de la población mayor de 65 años incluida en estos estudios. Se siguió la misma metodología que en la primera revisión. Dos revisores (MT y JGB) analizaron los abstracts de los documentos seleccionados siguiendo los siguientes criterios: estudios clínicos, ensayos clínicos o metaanálisis sobre el uso de la metadona para el tratamiento del dolor oncológico y que la muestra de dichos estudios tuviese una edad media ≥65 años.
En ninguna de las 2 revisiones hubo discrepancias entre las selecciones de los artículos.
ResultadosEn la primera búsqueda se revisaron 497 artículos en MEDLINE, 859 en SCOPUS y 19 en COCHRANE, de los cuales 4 artículos cumplieron los criterios definidos (tabla 1). En la búsqueda de ensayos clínicos se analizaron 66 estudios en los que en 7 trabajos la edad media de la población estudiada fue ≥65 años, ninguno de ellos dirigido de manera específica a la población anciana. De estos 7, en 2 se mencionaba un uso específico de metadona en ancianos (tabla 2).
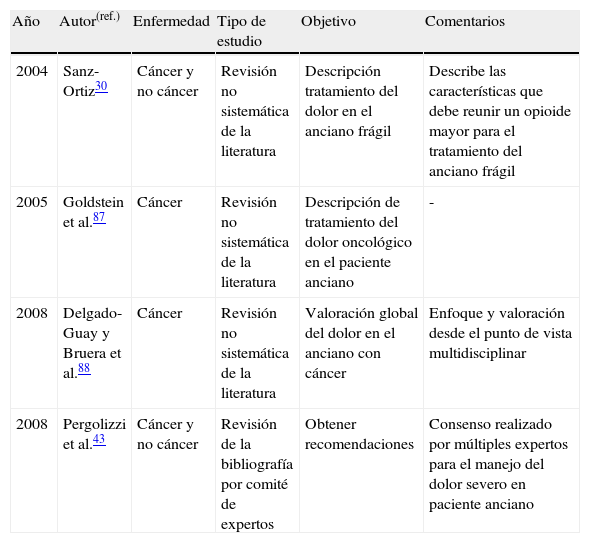
Artículos que cumplían los criterios elaborados en la búsqueda 1
| Año | Autor(ref.) | Enfermedad | Tipo de estudio | Objetivo | Comentarios |
| 2004 | Sanz-Ortiz30 | Cáncer y no cáncer | Revisión no sistemática de la literatura | Descripción tratamiento del dolor en el anciano frágil | Describe las características que debe reunir un opioide mayor para el tratamiento del anciano frágil |
| 2005 | Goldstein et al.87 | Cáncer | Revisión no sistemática de la literatura | Descripción de tratamiento del dolor oncológico en el paciente anciano | - |
| 2008 | Delgado-Guay y Bruera et al.88 | Cáncer | Revisión no sistemática de la literatura | Valoración global del dolor en el anciano con cáncer | Enfoque y valoración desde el punto de vista multidisciplinar |
| 2008 | Pergolizzi et al.43 | Cáncer y no cáncer | Revisión de la bibliografía por comité de expertos | Obtener recomendaciones | Consenso realizado por múltiples expertos para el manejo del dolor severo en paciente anciano |
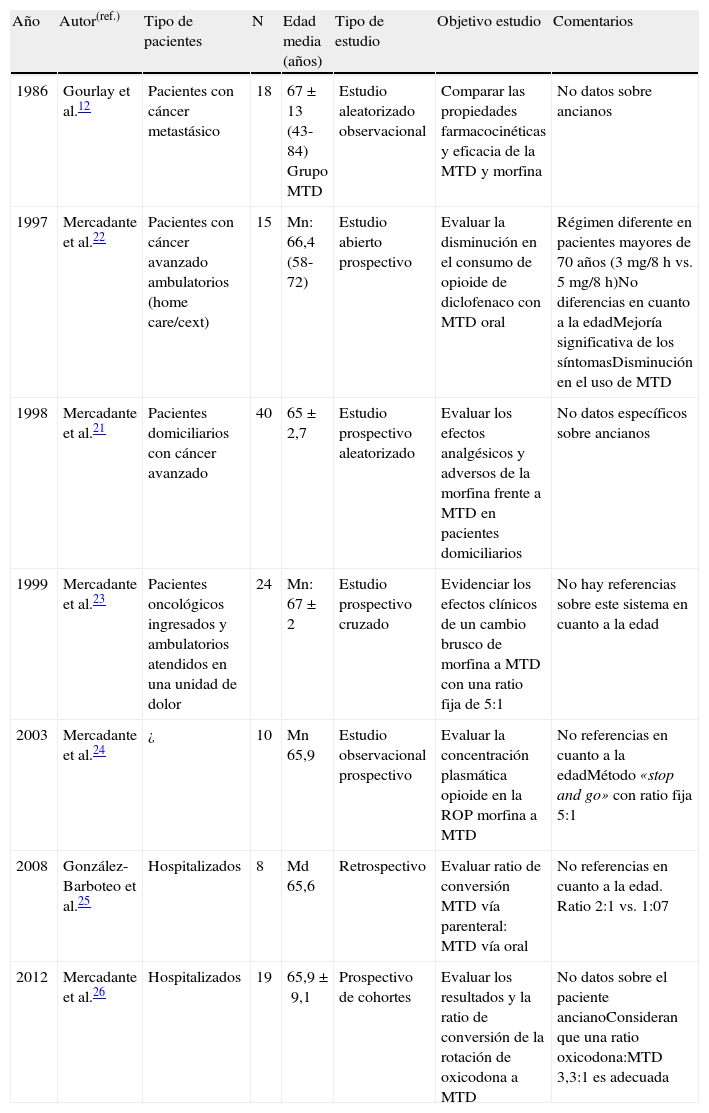
Estudios clínicos sobre el uso de la metadona en dolor oncológico con muestras de pacientes con edades medias ≥65 años
| Año | Autor(ref.) | Tipo de pacientes | N | Edad media (años) | Tipo de estudio | Objetivo estudio | Comentarios |
| 1986 | Gourlay et al.12 | Pacientes con cáncer metastásico | 18 | 67±13 (43-84) Grupo MTD | Estudio aleatorizado observacional | Comparar las propiedades farmacocinéticas y eficacia de la MTD y morfina | No datos sobre ancianos |
| 1997 | Mercadante et al.22 | Pacientes con cáncer avanzado ambulatorios (home care/cext) | 15 | Mn: 66,4 (58-72) | Estudio abierto prospectivo | Evaluar la disminución en el consumo de opioide de diclofenaco con MTD oral | Régimen diferente en pacientes mayores de 70 años (3mg/8h vs. 5mg/8h)No diferencias en cuanto a la edadMejoría significativa de los síntomasDisminución en el uso de MTD |
| 1998 | Mercadante et al.21 | Pacientes domiciliarios con cáncer avanzado | 40 | 65±2,7 | Estudio prospectivo aleatorizado | Evaluar los efectos analgésicos y adversos de la morfina frente a MTD en pacientes domiciliarios | No datos específicos sobre ancianos |
| 1999 | Mercadante et al.23 | Pacientes oncológicos ingresados y ambulatorios atendidos en una unidad de dolor | 24 | Mn: 67±2 | Estudio prospectivo cruzado | Evidenciar los efectos clínicos de un cambio brusco de morfina a MTD con una ratio fija de 5:1 | No hay referencias sobre este sistema en cuanto a la edad |
| 2003 | Mercadante et al.24 | ¿ | 10 | Mn 65,9 | Estudio observacional prospectivo | Evaluar la concentración plasmática opioide en la ROP morfina a MTD | No referencias en cuanto a la edadMétodo «stop and go» con ratio fija 5:1 |
| 2008 | González-Barboteo et al.25 | Hospitalizados | 8 | Md 65,6 | Retrospectivo | Evaluar ratio de conversión MTD vía parenteral: MTD vía oral | No referencias en cuanto a la edad. Ratio 2:1 vs. 1:07 |
| 2012 | Mercadante et al.26 | Hospitalizados | 19 | 65,9±9,1 | Prospectivo de cohortes | Evaluar los resultados y la ratio de conversión de la rotación de oxicodona a MTD | No datos sobre el paciente ancianoConsideran que una ratio oxicodona:MTD 3,3:1 es adecuada |
Md: media; Mn: mediana; MTD: metadona; ROP: rotación de opioides.
La información obtenida se resume en los apartados siguientes. Se ha completado con otras referencias relacionadas y textos referentes en analgesia y geriatría.
DiscusiónEn las búsquedas realizadas no hemos encontrado estudios específicos del uso de la metadona como analgésico en el anciano con cáncer. Los diferentes estudios de uso de la metadona en cáncer avanzado con poblaciones cuya edad media fue ≥65 años (65±2,7-67±13] en un total de 134 pacientes estudiados no describen aspectos que diferencien la población anciana de la joven. Son estudios que abordan diferentes aspectos del tratamiento analgésico con metadona como la comparación del uso de morfina frente a metadona12,21, uso concomitante de metadona y diclofenaco22, el uso de una ratio fija entre morfina y metadona (5:1)23, el cambio de un opioide a metadona de forma inmediata (método «stop and go»)24, el paso de metadona parenteral a oral25 y uso de una ratio de conversión entre oxicodona y metadona26 (tabla 2).
En cuanto a información referente a la población anciana destaca el estudio de Mercadante et al.22 en el cual evalúan el impacto del uso de diclofenaco en el consumo de metadona. En este estudio arbitrariamente aplican a los pacientes mayores de 70 años una dosis inicial de metadona inferior (3mg/8h) frente a la pauta de 5mg/8h administrada en pacientes más jóvenes. Observan que la administración de diclofenaco permite mejorar el dolor y disminuir las dosis de metadona. No analizan dichos resultados por edad.
En el estudio con mayor número de pacientes21 se analizan las diferencias existentes en el uso de morfina versus metadona en pacientes domiciliarios en relación a la eficacia en el control del dolor y la aparición de efectos secundarios. Dicho estudio muestra un control del dolor y efectos secundarios similares en ambos grupos aunque en el grupo de metadona presentan dosis más bajas de opioide y escasa necesidad de reajustar la dosis inicial. Tampoco existen datos sobre el anciano.
En el estudio en el cual la edad media de los pacientes fue superior (67±2 años)23 se analizó el efecto del cambio brusco con ratio fija de morfina a metadona 5:1. Los resultados señalan una mejoría significativa del dolor y de la toxicidad atribuida a la morfina en el 79% de los pacientes. Durante el seguimiento no se requirieron modificaciones de la pauta inicial de metadona en la mayoría de los pacientes. Los autores afirman que la ratio y el método de cambio de morfina a metadona propuestos son eficaces y seguros. No mencionan su efecto en ancianos.
Por último, hay que mencionar el estudio de González-Barboteo et al.25 por su relevancia clínica. Corresponde a un estudio retrospectivo en el que se observan las dosis antes y después del paso de metadona por vía parenteral a vía oral, así como la aparición de efectos secundarios. Los autores recomienda utilizar una ratio metadona parenteral oral 1: 1,2.
Esta escasez de información nos obliga a aplicar los conocimientos sobre la metadona en la población general y aspectos particulares de los opioides en la población anciana.
Uso de opioides en el paciente ancianoEn el paciente anciano se producen una serie de cambios estructurales, bioquímicos y funcionales, que conllevan una serie de cambios en la farmacocinética y biodisponibilidad de los fármacos en el organismo27. Entre estos cambios destaca una disminución progresiva de la tasa de filtración glomerular que puede provocar la acumulación de metabolitos activos como el morfin-3-glucurónido28.
La reducción de la masa hepática junto con la de los niveles de monooxigenasas y citocromos provoca una reducción del 30-40% de la eliminación de los agentes metabolizados por el hígado. El envejecimiento afecta principalmente a las reacciones tipo i (enzimas del citocromo P450), mientras que rara vez influye en las reacciones tipo ii (glucoronización), por lo que la biodisponibilididad de fármacos que se eliminen en el primer paso hepático se verá aumentada29. Como consecuencia, hay un aumento de la biodisponibilidad oral, prolongación de la vida media y disminución del aclaramiento renal de metabolitos activos30.
El aumento de edad se asocia a un incremento de la grasa y a una reducción total del volumen de agua, por lo que aumenta el volumen de distribución de fármacos lipofílicos (p. ej. metadona) y disminuye el volumen de distribución de fármacos hidrofílicos. Por otra parte, el estado nutricional de los ancianos frecuentemente no es óptimo y la albúmina sérica puede estar también disminuida, así como la concentración de hemoglobina. Todo ello condiciona un volumen de distribución reducido, con el consiguiente aumento de la concentración sérica y de la toxicidad31.
Los ancianos a menudo presentan un pH gástrico aumentado, una reducción de la movilidad gástrica e intestinal, y una disminución de la actividad enzimática y de la absorción. Estos cambios provocan tránsitos intestinales prolongados y estreñimiento. El uso de opioides empeora este cuadro32.
Existen pocos datos en la literatura en cuanto al uso específico de opioides en ancianos con dolor oncológico. Muchas de las recomendaciones de su uso clínico se basan en opiniones de expertos. Sus efectos secundarios han provocado que los facultativos sean reacios a su uso33. Sin embargo, un uso correcto y el tener en cuenta una serie de precauciones permiten un uso correcto con escasa toxicidad. Existen estudios que comparan la eficacia y la tolerabilidad a los opioides, como el fentanilo transdérmico34, la morfina35 y la buprenorfina sublingual36 donde se observa que los ancianos responden tan bien, o mejor, al tratamiento opioide que pacientes jóvenes. Al mismo tiempo, la percepción sensorial del dolor se encuentra bien preservada en los ancianos, pero la habilidad de expresar el dolor se altera, en especial con la demencia avanzada37 hecho que no impide realizar una adecuada evaluación del dolor.
Si tenemos en cuenta la aparición de efectos secundarios hay que mencionar que la neurotoxicidad opioide puede parecer con mayor frecuencia en las personas ancianas en casos de dosis altas, periodos de exposición prologados, estado cognitivo límite o alterado previamente, deshidratación, insuficiencia renal y uso concomitante de psicotropos38–40.
La aparición de depresión respiratoria se asocia a una titulación rápida, a interacción con otros fármacos depresores del SNC o a sobredosificación accidental. Todos los opioides son dosis-dependientes a la hora de inducir depresión respiratoria. El riesgo de desarrollar depresión respiratoria es edad-dependiente con 2,8; 5,4 y 8,7 veces más riesgo de presentarla en personas de 61-70 años, 71-80 años y mayores de 80 años respectivamente, n comparación con pacientes entre 16-45 años (todos p<0,05)41.
El abuso de prescripciones opioides en los ancianos no es un fenómeno raro. Desafortunadamente, existen pocos datos que recojan la epidemiología del abuso/adicción a opioides en ancianos y cómo detectarlo o prevenirlo42.
Uso de metadona como analgésico en el dolor oncológicoEn el caso concreto de la metadona, como se ha comentado previamente no existen datos específicos de su uso43. Todas las recomendaciones dadas se basan en datos extrapolados en otras poblaciones y opiniones de expertos. A continuación se exponen algunas consideraciones del uso de la metadona.
Vías de administraciónLa metadona puede utilizarse por vía oral, rectal, intravenosa y subcutánea.
Su administración vía rectal es una alternativa a la administración oral en aquellos pacientes que presentan náuseas, vómitos, disfagia o malabsorción. Produce un rápido alivio del dolor debido a la rápida absorción, que normalmente se completa a los 30minutos de la administración del fármaco19,44,45. La farmacocinética es similar a la administración oral, con una rápida y extensa distribución inicial y una lenta fase de eliminación. La ratio entre la vía rectal y la oral es 1:1. Las desventajas que presenta la administración rectal son el malestar en su administración y la limitación de la cantidad de dosis de las preparaciones comerciales. Los resultados clínicos y la estabilidad de los niveles sanguíneos sugieren que los supositorios son una vía de administración segura y efectiva19. La administración intravenosa puede realizarse mediante inyecciones o bombas de infusión continuada. Produce un incremento del 23% de la concentración (respecto a la administración oral) debido a la ausencia de metabolismo en la pared intestinal vía CYP3A4 y al evitar el primer paso hepático14.
También se puede administrar por vía subcutánea. Esta vía de administración es igual de efectiva que la vía intravenosa pero plantea como inconvenientes reacciones irritativas en el punto de inyección. Para algunos autores este hecho obedece más a los excipientes que acompañan a la metadona que al principio activo46. Para disminuir estos efectos se recomienda rotar el punto de inserción y diluir la dosis de metadona46.
La vía epidural se ha usado en el postoperatorio de pacientes con dolor, así como en el control del dolor oncológico47,48.
DosificaciónHabitualmente se recomienda el uso de metadona como opioide de segunda o tercera línea49, aunque se podría utilizar como alternativa a otros opioides en primera línea por su bajo coste en países en vías de desarrollo50.
Varios estudios describen rotaciones satisfactorias de opioides a metadona en pacientes que han presentado efectos secundarios o no han conseguido una analgesia adecuada con los opioides previos17,18,23,51. Sin embargo, existe la dificultad al rotar desde otro opioide a metadona debido a la variación en la ratio equianalgésica de un individuo a otro. Esta ratio varía según la cantidad administrada del opioide previo. A diferencia de lo que ocurre con otros opioides, aparece más toxicidad de manera más frecuente en pacientes previamente expuestos a dosis altas de otros opioides, lo cual provoca que se tenga que actuar con mayor cautela52.
La mayoría de los estudios encontrados muestran que la rotación de otros opioides a metadona se puede realizar de la misma manera pero con otros opioides calculando previamente la dosis equivalente de morfina y realizar el cambio posteriormente. Se han propuesto diversas maneras para pasar de un opioide a metadona por vía oral (tabla 3).
Principales métodos de conversión de morfina oral a metadona oral
| Método Ripamonti et al.89 | |
| DEMOD previa | Ratio |
| 30-90mg/día | 4:1 |
| 90-300mg/día | 8:1 |
| >300mg/día | 12:1 |
| Método Mercadante et al.23 | |
| DEMOD previa | Fija 5:1 |
| Método Bruera y Sweeney52 | |
| DEMOD previa | |
| <100mg/día | Suspender opioide previo e inicio de 5mg/8h MTD vo y 5mg de MTD como DE |
| >100mg/día | 1.er día: disminuir un 30-50% opioide previo y ratio 10:1 |
| 2.o día: disminuir un 30-50% opioide previo y aumentar MTD si persiste dolor | |
| 3.er día: retirar opioide previo y mantener MTD/8h y uso de rescate 10% dosis total diaria | |
DE: dosis extra; DEMOD: dosis equivalente de morfina oral diaria; MTD: metadona.
En pacientes que inicien la toma de metadona y previamente se encuentren en tratamiento con un analgésico de segundo escalón, se recomienda un inicio de dosis de 3-5mg/8h vía oral. En pacientes ancianos o frágiles, se recomienda un inicio de dosis de 3mg/12h vía oral. Se recomienda utilizar un sexto de la dosis oral diaria como dosis de rescate. Los ajustes de la dosis total diaria deberán hacerse cada 72h. La dosis estable no se obtendrá hasta los 10-15 días de haber comenzado con el fármaco53.
En el caso de utilizar metadona por vía parenteral (intravenosa o subcutánea) no está bien definida la ratio entre metadona oral y parenteral; se ha sugerido utilizar la ratio 2:114,54–56 y la conversión de metadona parenteral a oral, 1:254. Sin embargo, se ha puesto en alerta que dicha ratio puede provocar toxicidad excesiva, recomendándose una ratio metadona por vía parenteral: metadona oral 1:1.2. Esta propuesta es compatible con la biodisponibilidad del fármaco25.
MonitorizaciónLos primeros días tras el cambio se aconseja la monitorización de la frecuencia cardíaca, frecuencia respiratoria y presión arterial, intensidad del dolor, realización de ECG seriados (uno al inicio del fármaco y otro cuando se complete la titulación) y la aparición de signos de neurotoxicidad57.
Dada la vida media larga de la metadona, se recomienda mantener el seguimiento varios días después tras la rotación debido a la posibilidad de toxicidad tardía secundaria a su acumulación52.
Usos clínicosEntendiendo la farmacocinética de la metadona, puede ser un fármaco seguro y alternativo al uso de otros opioides cuando se prescribe por personas experimentadas en su uso.
Está indicada para el tratamiento del dolor moderado a severo tanto oncológico como no oncológico ante dolor no controlado con otros opioides, toxicidad a los mismos o en ambas circunstancias. Por sus características podría ser un opioide útil en el tratamiento del dolor neuropático58–60 y en pacientes con dolor y antecedentes de drogadicción61.
Dada la ausencia de metabolitos activos conocidos, se puede utilizar en pacientes con insuficiencia renal62. También se ha propuesto su uso en pacientes con dolor y oclusión intestinal63.
Se ha descrito que la metadona inhibe la hiperplasia de células pulmonares tumorales induciendo su apoptosis64 y que posee un menor efecto inmunosupresor que la morfina, al no suspender la función de las células killer65.
Como otros opioides, la metadona también posee un efecto antitusígeno66.
Efectos secundariosLos típicos de los otros opioides tales como somnolencia, náuseas, mareo, estreñimiento, retención urinaria y depresión respiratoria también pueden aparecer con el uso de la metadona.
En cuanto al estreñimiento, destaca que aparece más tarde en pacientes tratados con metadona que con otros opioides67,68.
Se ha hipotetizado que la metadona no podría generar reacciones neurotóxicas debido a la falta de metabolitos activos; sin embargo, en la literatura hay casos que describen la aparición de mioclonus38,69, movimientos coréicos70, síndrome serotoninérgico y mutismo71.
Cuando la metadona se administra a dosis altas (>600mg/día) bloquea los canales de calcio requeridos para la despolarización rápida del músculo cardíaco lo cual explica el riesgo de arritmias cardíacas, sobre todo si se utilizan otros fármacos que interaccionen a nivel del CYP3A4 o existe historia previa de arritmias72. En pacientes tratados con metadona intravenosa se ha descrito prolongación del intervalo QT, sin relevancia clínica73. No obstante, se recomienda evitar el uso concomitante de metadona y fármacos que prolonguen el intervalo QT, así como inhibidores l CYP3A474.
Otros efectos secundarios descritos son fatiga, disforia o euforia, prurito, aumento de la sudoración e impotencia10.
La metadona está contraindicada en pacientes con depresión respiratoria y/o alergia a algún componente o excipiente de la misma. Se ha de administrar de manera cautelosa en aquellos pacientes que presenten confusión, aumento de la presión intracraneal, asma bronquial severa y enfermedades crónicas obstructivas pulmonares, ya que su administración puede exacerbar estos síntomas.
Interacciones farmacológicasHay muchas interacciones farmacológicas que se relacionan con la administración de la metadona y el sistema del citocromo P45075,76. Otros factores que pueden influir en la farmacocinética de la metadona son los polimorfismos de la P-glucoproteína, las isoformas de CYP1A2, el genotipo de α1-AG, coanalgésicos y el pH urinario14 (tabla 4).
Interacciones farmacológicas de la metadona
| Tipo de interacción | Efecto clínico | Tipo de enzima | Fármacos |
| Inhibe el metabolismo de la metadona | Intensifica analgesiaRiesgo de efectos secundarios | CYP3A4 | Antifúngicos: ketoconazol, fluconazol, itraconazol |
| AntibióticosMacrólidos: eritromicina, claritromicinaQuinolonas: ciprofloxacino | |||
| Tuberculostáticos: isoniacida | |||
| Anti-H2: cimetidina | |||
| Inhibidor de la bomba de protones: omeprazol | |||
| Benzodiacepinas: diazepam | |||
| Bloqueantes de canales de Ca: verapamilo, diltiazem y nifedipino | |||
| Dihidroergotamina | |||
| Zumo de uva | |||
| Consumiciones aisladas de alcohol | |||
| CYP3A4CYP1A2CYP2D6 | Inhibidores selectivos de la recaptación de serotonina: fluvoxamina, norfluoxetina, paroxetina, duloxetina, antidepresivos tricíclicos, mirtazapina | ||
| Acelera el metabolismo de la metadona | Analgesia insuficienteSíndrome de abstinencia | CYP3A4 | Antiepilépticos: carbamacepina, fenitoína, fenobarbital |
| Tuberculostáticos: rifampicina, rifabutina | |||
| Corticoides: dexametasona | |||
| Terapias antirretrovirales:Inhibidores de proteasa: ritonavir, lopinavirInhibidores nucleósidos de la trascriptasa inversa: efavirenz, vevirapina | |||
| Diuréticos: espironolactona | |||
| Neurolépticos: risperidona | |||
| Antibiótico: ácido fusídico | |||
| Consumo regular de alcohol | |||
| CYP1A2 | Consumo de cigarrillos | ||
| Inhibidores del metabolismo de otros fármacos por la metadona | CYP2A6 | Antidepresivos tricíclicos: amitriptilina, nortriptilina, imipramina, desipramina | |
| Neuropépticos: risperidona | |||
| Inhibidores nucleósidos de la transcriptasa inversa: zidovudina | |||
| Otros antidepresivos: venlafaxina, duloxetina | |||
| Opioides: tramadol, codeína |
Los ancianos son especialmente vulnerables a las interacciones farmacológicas, debido a que sufren enfermedades crónicas con polifarmacia asociada, así como debido a una disminución de la actividad del citocromo P45077.
Recomendaciones de uso de la metadona en el paciente ancianoDebemos considerar el uso de la metadona en la población anciana en determinadas circunstancias como paciente con dolor de difícil control o neuropático, situaciones de insuficiencia renal o hepática78 (tabla 5). Si el paciente anciano es alérgico a los derivados del fenantreno (codeína, hidrocodona, morfina y oxicodona) o toma fármacos inhibidores del CYP2D6 (amiodarona, duloxetina, fluoxetina, haloperidol, entre otros) que afectan el aclaramiento de ciertos opioides (codeína, tramadol, oxicodona e hidrocodona) la metadona es una opción terapéutica razonable79.
Recomendaciones de uso de metadona como analgésico en el paciente anciano con dolor oncológico
| 1. No se recomienda como opioide de primera línea2. Utilizar por personal experto3. Considerar el uso de metadona en el paciente anciano con dolor oncológico en:Dolor de difícil control o dolor neuropáticoInsuficiencia renal o hepáticaAlergia a derivados del fenantreno (codeína, hidrocodona, morfina y oxicodona)Uso concomitante de fármacos inhibidores de CYP2D6 (amiodarona, duloxetina, fluoxetina, haloperidol, por ejemplo).4. Dosis de inicio: mitad de dosis que en jóvenes (1-3mg/8h)5. Pautar analgesia de rescate: opioide de liberación rápida y vida media corta como fentanilo, morfina u oxicodonaEn caso de utilizar metadona como fármaco de rescate utilizar un sexto de la dosis total diaria6. Titulación de dosis: cada 72h sumando a la dosis basal la dosis total correspondiente al número de dosis de rescate o aumentando un un tercio la dosis basal diaria7. Uso ambulatorio por personal experto, presencia de cuidador efectivo y circunstancias que aseguren un seguimiento estrecho8. En caso de pasar metadona vía parenteral a vía oral, utilizar la ratio 1:1,29. Si se realiza una rotación de un opioide a metadonaRealizar conversión teniendo en cuenta la dosis total diaria del opioide previoDisminuir la dosis un 30-50% y realizar el cambio a metadona utilizando una de las tablas de conversión expuestas (tabla 3)Informar al paciente y a la familia del posible incremento inicial de dolor o aparición de efectos secundariosPautar analgesia de rescateRealizar una estrecha monitorización los 4-5 días posteriores |
No se recomienda su uso como opioide de primera línea, y siempre administrada por personal experto49,80.
A la hora de iniciar metadona, comenzar con la mitad de dosis que en pacientes jóvenes (1-3mg/8h)81,82.
Se podría utilizar de forma ambulatoria pero por personal experto, con presencia de cuidador efectivo y en circunstancias en que se pueda asegurar un seguimiento estrecho81,82. El uso con AINE podría potenciar los efectos analgésicos de la metadona e incluso disminuir la dosis22. Sin embargo, tenemos que tener en cuenta los riesgos de uso de AINE en pacientes con insuficiencia renal y antecedente de gastropatía.
En caso de pasar metadona vía parenteral a vía oral, utilizar una ratio más conservadora (1:1,2)25. Si se realiza una rotación de un opioide a metadona, realizar la conversión teniendo en cuenta la dosis total diaria del opioide previo, disminuir la dosis entre un 30-50% y realizar el cambio a metadona utilizando una tabla de conversión (tabla 3), así como realizar una estrecha monitorización los 4-5 días posteriores83,84. En una revisión sistemática reciente sobre la rotación de un opioide a metadona85 (se extrae de los estudios analizados), no se ha encontrado que la edad sea un factor independiente asociado a la ratio empleada. Esta revisión no tuvo en cuenta si los estudios estaban realizados en pacientes oncológicos.
Por último, hay que destacar que el dolor oncológico en el anciano debe evaluarse dentro de un entorno multidisciplinar utilizando no solo intervenciones farmacológicas, sino también no farmacológicas, para mejorar la calidad de vida y disminuir el sufrimiento del paciente86.
En conclusión, son necesarios estudios específicos de uso de metadona en el paciente anciano que nos ayuden a manejar este fármaco en esta población.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores deseamos expresar nuestro sincero agradecimiento a Manel Candela por su labor como asesor bibliográfico.