La demencia es un potente predictor de dependencia que hace que sean esas personas las que vivan más años con discapacidad. Es la enfermedad crónica que mayor dependencia ocasiona a los 12, a los 24 y a los 36 meses de su evolución, por delante de otras enfermedades discapacitantes, como el ictus, la enfermedad de Parkinson o las enfermedades cardiovasculares.
Somos muchos los que conocemos las consecuencias devastadoras de las demencias, pero pocos sabemos reconocer los síntomas en las fases iniciales. Para poder combatir este hecho es necesario promover una mayor información pública y una mayor formación a los profesionales de la salud.
Es necesario avanzar en 3 campos para poder desarrollar una mejor atención en las distintas fases evolutivas de las demencias: considerar la demencia como una prioridad de salud pública, combatir la creencia equívoca de que no se puede hacer nada para los pacientes diagnosticados de demencia y, finalmente, no por ello menos importante, saber reconocer la demencia incipiente.
Decir que las personas con demencia reciben con menor frecuencia atención paliativa de confort que aquellos pacientes diagnosticados de cáncer a pesar de compartir, claramente, la necesidad de cuidados en fases avanzadas de la enfermedad y a pesar de ser demandada frecuentemente por familiares y cuidadores
A forma de resumen, decir que podemos actuar y mejorar en el diagnóstico precoz de la enfermedad, de la misma forma que lo podemos hacer en las distintas fases evolutivas de la demencia y, así, poder retardar y/o minimizar la dependencia y, finalmente, mejorar las medidas de confort al final de la enfermedad.
Because dementia is a powerful predictor of dependence, people with this disease are those that live longest with disability. Dementia is the chronic disease provoking the greatest dependence at 12, 24, and 36 months after diagnosis, ahead of other diseases such as stroke, Parkinson's disease and cardiovascular disease.
Many of us are aware of the devastating consequences of dementia, but few know how to recognize the symptoms in the initial phases. To rectify this situation, increased public information and training for health professionals is required.
To improve the care of the distinct phases of dementia, progress must be made in three areas: dementia must be considered a public health priority, the erroneous belief that nothing can be done for patients with a diagnosis of dementia must be combatted and, finally, no less importantly, knowledge of how to recognize incipient dementia must be acquired.
People with dementia less frequently receive palliative care than patients with cancer, despite clearly sharing the need for care in the advances stages of the disease and frequent requests by relatives and carers.
In summary, action can be taken to improve the early diagnosis of dementia and the care of the distinct phases of the disease, thus delaying and/or minimizing dependency. Finally, comfort measures at the end stage can be improved.
Siendo la demencia una enfermedad altamente prevalente, uno se pregunta si el día a día o la rutina de nuestra práctica clínica diaria nos hacen considerar aquello que es usual como si fuese lo más normal.
Al inicio del proceso demencial solemos preguntarnos si el diagnóstico que hemos efectuado es correcto, en particular en estadios iniciales de la enfermedad e incluso en fases precedentes, a las que llamamos predemencia. A lo largo de la evolución de la enfermedad, estamos pendientes de aquellos procesos que, de forma específica, se asocian a este síndrome geriátrico, como los síntomas psicológicos y conductuales. En las fases finales, acostumbramos a informar a los familiares y/o cuidadores de las posibles complicaciones ante las que nos encontraremos. Sin embargo, ¿tenemos claro aquello que hemos de hacer en los estadios iniciales para diagnosticar lo más precozmente una demencia?; ¿actuamos de forma correcta en las distintas fases evolutivas de la enfermedad?, y finalmente ¿podemos mejorar nuestra práctica clínica en la fase final de una enfermedad crónica evolutiva como la demencia?
Es por todo ello que, a modo de reflexión, a lo largo de este artículo nos basaremos en los estadios iniciales, intermedios y finales del síndrome demencial, preguntándonos qué es lo que hacemos de forma habitual y, en realidad, qué es lo que deberíamos hacer o podríamos mejorar (tabla 1).
Estadios iniciales, intermedios y finales del síndrome demencial
| Fase inicial diagnóstica (aquello que hemos de conocer y priorizar): |
| Envejecimiento usual |
| DCL |
| Demencia |
| Fases evolutivas de la demencia (aquello que deberíamos hacer y aquello que no): |
| GDS 3-4: pérdida de peso frente a alimentación paranteral por sonda en fases finales |
| GDS 4-5: caídas frente a sujeciones en fases intermedias y finales |
| GDS 6-7: síntomas mal definidos frente a enfermedades no diagnosticadas ni tratadas |
| Fase final de la demencia: |
| Niveles de intensidad terapéutica |
| Toma de decisions |
DCL: deterioro cognitivo leve; GDS: Global Deterioration Scale.
Es en la etapa inicial de diagnóstico en la que solemos tener duda de si estamos frente a una demencia (que puede iniciar su expresión sintomática hasta 10 años antes de ser diagnosticada) o ante un envejecimiento usual1. No quisiéramos extendernos en terminología y es por ello que definiremos la demencia, de forma escueta y práctica, como aquella alteración de las funciones cognitivas, suficientemente grave como para impedir el poder desarrollar una vida social y/o laboral dentro de la normalidad. Ante esta sencilla definición, hemos de conocer si ello corresponde a un envejecimiento normal o usual, clásicamente ligado a una pérdida de la función psicofísica o si, en realidad, nos encontramos ante un deterioro cognitivo leve (DCL). En geriatría, hemos aprendido que, en situaciones como la que estamos describiendo, será el seguimiento evolutivo el que nos dará el diagnóstico. No son lo mismo el envejecimiento usual, el DCL, ni la demencia; sin embargo, en múltiples ocasiones será el seguimiento evolutivo el que nos dará la respuesta de si estamos frente a un envejecimiento usual o ante un DCL que evolucionará, o no, a demencia1.
Envejecimiento normalHablamos de envejecimiento normal al encontrarnos delante de un rendimiento cognitivo distinto al del adulto joven, en el que apreciamos una disminución en la velocidad de procesar la información, junto con una disminución en las tareas de atención dicótica, una disminución de algunas tareas visuoespaciales y, además, una pérdida del recuerdo diferido, que no será tan acentuada ante el recuerdo a corto plazo en el tiempo. Ello se conjuga con una mayor comprensión verbal, un incremento de nuestro vocabulario y la experiencia práctica que hemos acumulado a lo largo de nuestra vida. Este rendimiento cognitivo distinto al del adulto más joven, propio del envejecimiento usual, se caracteriza por no interferir en las actividades de la vida diaria.
Deterioro cognitivo leveHemos de extendernos en el DCL2, siendo nuestro objetivo primordial su detección precoz. En la práctica clínica habitual no estamos dando importancia al DCL ni a las implicaciones que ello, a nivel práctico y ético, conlleva. Sin poderlo objetivar, tenemos la impresión de que, por lo general, a excepción de geriatras, neurólogos y otros profesionales sensibilizados, no damos la importancia que tiene el poder diferenciar entre envejecimiento usual y DCL. Este hecho conlleva desconocimiento, lo que comporta una falta de diagnóstico y, por ello, de desinformación a la persona mayor que, preocupada por sus déficits incipientes, nos solicita opinión. Si el título del artículo es “¿Qué hacer y qué no a lo largo del proceso demencial? Diálogo y ayuda”, decimos que aquí tenemos nuestra primera reflexión: hemos de tener un conocimiento, lo más riguroso posible, sobre el DCL y saber lo importante que es dar una información veraz, que requiere de una buena exploración neuropsicológica, una visita médica especializada y un correcto seguimiento evolutivo. Esto es lo que deberíamos hacer. Empecemos a cambiar nuestra rutina habitual y dejemos de quitar importancia a hechos transcendentales, como podría ser la amnesia leve referida por muchos de nuestros ancianos, por poner un ejemplo usual. Cuando una persona mayor se queja de forma subjetiva, dicha queja puede ir dirigida a un único dominio (memoria, atención, orientación, nominación, etc.). Cuando el dominio afectado es la memoria, hablamos de DCL amnésico y su seguimiento evolutivo, en múltiples ocasiones, nos lleva a una enfermedad de Alzheimer. En otras ocasiones, la queja subjetiva puede ir referenciada a distintos dominios de forma conjunta (memoria y atención; atención y nominación; memoria, atención y nominación, etc.) recibiendo el nombre de DCL multidominio. Delante de un DCL multidominio, en el que se encuentra presente el déficit subjetivo de memoria, hablaremos de DCL multidominio amnésico, y su seguimiento evolutivo, en distintas ocasiones, nos llevará a un deterioro cognitivo vascular. Si hay un DCL que no progresa a demencia, en múltiples ocasiones y a lo largo del seguimiento evolutivo, éste sería el DCL multidominio no amnésico. A efectos prácticos, también en esta ocasión es muy importante saber que las personas afectadas de DCL no tienen dificultad en desarrollar, de forma independiente, las actividades de la vida diaria.
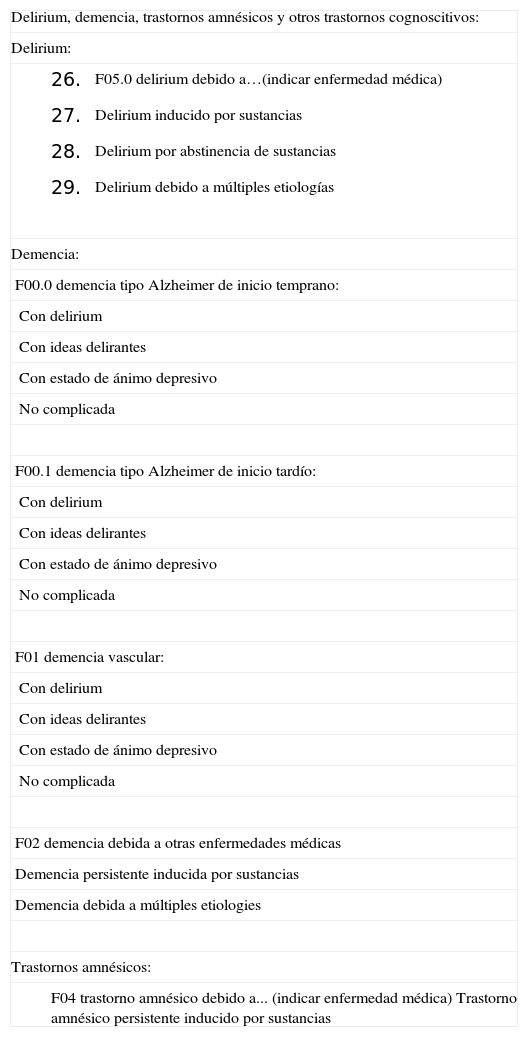
Demencia establecidaLa tercera entidad a la que haremos referencia dentro de la primera fase de diagnóstico será la demencia establecida. En esta situación, la alteración a nivel del rendimiento cognitivo genera dependencia creciente en la ejecución de las actividades de la vida diaria3. Muchos de los profesionales que aplican sus conocimientos en sanidad desconocen el mundo de la demencia y no saben diferenciar entre distintos tipos de demencia, sin saber que esto puede comportar connotaciones asistenciales diferenciales muy importantes4. Así, ante una demencia que, ya en fases iniciales, se presenta con síndrome extrapiramidal, hemos de pensar en demencia de cuerpos de Lewy; si la demencia se acompaña de caídas e incontinencia, pensaremos en hidrocefalia normotensiva; si la progresión de la demencia es muy rápida, deberíamos descartar una enfermedad producida por priones y, finalmente, si nos encontramos ante disfunción ejecutiva y alteración de la conducta en fases inciales, hemos de tener presente la demencia frontotemporal. Por ello, volvemos a insistir en la enorme importancia que tienen el poder efectuar una buena valoración neuropsicológica, una visita médica especializada, un correcto seguimiento evolutivo y una única clasificación, como la utilizada en referencia a los criterios DSM-IV (Diagnostic and Statistical Manual of Mental Disorders-IV) (tabla 2).
Criterios DSM-IV (Diagnostic and Statistical Manual of Mental Disorders-IV)
| Delirium, demencia, trastornos amnésicos y otros trastornos cognoscitivos: |
| Delirium: |
|
| Demencia: |
| F00.0 demencia tipo Alzheimer de inicio temprano: |
| Con delirium |
| Con ideas delirantes |
| Con estado de ánimo depresivo |
| No complicada |
| F00.1 demencia tipo Alzheimer de inicio tardío: |
| Con delirium |
| Con ideas delirantes |
| Con estado de ánimo depresivo |
| No complicada |
| F01 demencia vascular: |
| Con delirium |
| Con ideas delirantes |
| Con estado de ánimo depresivo |
| No complicada |
| F02 demencia debida a otras enfermedades médicas |
| Demencia persistente inducida por sustancias |
| Demencia debida a múltiples etiologies |
| Trastornos amnésicos: |
|
Una vez diagnosticada la demencia, en sus distintas fases evolutivas de inicio a final, utilizando la Global Deterioration Scale-Funtional Assessment Staging5 (GDS-FAST), hemos de tener un amplio conocimiento sobre ellas, dado que están repletas de características diferenciales.
Del estudio realizado desde urgencias por nuestro grupo6, se desprende que en fases iniciales del síndrome demencial (DCL o demencia preclínica con GDS 3), la descompensación de su pluripatología crónica (enfermedad pulmonar obstructiva crónica [EPOC], insuficiencia cardíaca [IC], etc.) es la causa más frecuente de ingreso en planta de hospitalización y, normalmente, estos estadios iniciales suelen acompañarse de pérdida de peso; en fases intermedias (GDS 4-5), en las que persiste la descompensación de su pluripatología crónica, como causa de ingreso, empiezan a coger fuerza otros diagnósticos como las caídas y las fracturas óseas; sin embargo, en fases avanzadas (GDS 6-7) se constata la descompensación de la patología crónica aunque, en esta ocasión, registrada como síntomas mal definidos, dado que se trata de la forma atípica y, por ello, difícil de diagnosticar, en que en estos pacientes se manifiestan los síntomas (fig. 1), no reconociéndose patologías frecuentes en esta fase, como serían las úlceras, el estreñimiento y/o la impactación fecal, el dolor, las contracturas o la epilepsia, entre otras muchas más.
Fase inicialLa pérdida de peso, que se da en la fase inicial de la demencia, refleja una posible malnutrición por hipercatabolismo, propio de esta enfermedad en dichos estadios, o por distintas causas asociadas a la demencia en fase inicial y que requieren de una valoración geriátrica integral exhaustiva para llegar a detectarlas (pérdida de actividades instrumentales de la vida diaria, como el comprar, el cocinar, etc.; situación de fragilidad social y el olvidar comer, entre otras muchas circunstancias). Sabemos que una intervención en esta fase en forma de corrección de los factores desencadenantes, como podría ser una correcta suplementación nutricional o la simple supervisión de una correcta alimentación diaria, junto con otras actuaciones, puede ser altamente beneficiosa en estos estadios iniciales, al igual que lo es en las posteriores fases evolutivas de la enfermedad, pudiendo retardar e, incluso, evitar la frontera entre el abandono del tratamiento y la distanasia, que puede aparecer en las fases más avanzadas de la enfermedad. Sin embargo, al inicio de la enfermedad, no solemos hacer una buena valoración nutricional, como la que solemos realizar en fases más avanzadas del síndrome. Por otro lado, nos empeñamos en no descuidar dicha valoración e intervención nutricional en estadios finales, en los que los beneficios de la nutrición enteral por sonda nasogástrica o bien percutánea son mucho más controvertidos7,8.
A forma de ejemplo práctico, aplicaremos los principios de la Bioética9,10 en la toma de decisión sobre la nutrición enteral por sonda (ya sea nasogástrica o bien percutánea) en etapas muy evolucionadas de la enfermedad. Con ello, intentaremos dar un poco más de fuerza a que, precisamente, es en estadios iniciales de la demencia cuanto más beneficiosa puede ser una buena valoración e intervención nutricional y, sin embargo, es en las fases más avanzadas de la enfermedad en las que solemos plantearnos nutrir por vía enteral a través de sonda, que tiene un valor, cuanto menos, cuestionado.
Basándonos en los principios de la Bioética descritos en 1979 por los bioeticistas Beauchamp y Childress8, hay 2 principios que nos definen aquello que todos estamos obligados a no hacer. El principio de la no maleficencia, que nos obliga a no hacer el mal a las personas, es decir, tratar a todas las personas con igual condición y respeto, y el principio de justicia, que obliga a tratar a todas las personas con la misma consideración y respeto a nivel social, y a no discriminarlas por ningún motivo, llegando a establecer la igualdad de oportunidades. Si aplicamos el principio de no maleficencia en las fases avanzadas de la demencia, planteándonos la nutrición enteral por sonda deberíamos saber que puede incrementarse el riesgo de neumonía11 y el de otras infecciones graves (sinusitis, meningitis y peritonitis); además, se incrementa el riesgo de mortalidad, y todo esto sin tener la certeza de que se produzca un mayor bienestar. Con el principio de justicia, podríamos enriquecer el principio de no maleficencia al reforzarlo con la voluntad explícita de las personas, reflejada en el documento de voluntades anticipadas (en Cataluña publicado en el Diari Oficial de la Generalitat de Catalunya 3303-11.1.2001) avalado ante notario, delante de 3 testigos mayores de edad, sin relación de parentesco dos de ellos, sin ir en contra de la ordenanza jurídica o de la buena práctica clínica.
Los otros 2 principios de la Bioética nos reflejan aquello autorizado, aquello que cada uno puede hacer libremente. El principio de autonomía obliga a considerar que todas las personas son, por principio, mientras no se demuestre lo contrario, capaces de tomar decisiones respecto a la aceptación o no de todo aquello que afecte a su proyecto vital; mientras que el principio de beneficencia obliga a hacer el bien a las personas, procurando el mayor beneficio posible, limitando al máximo los riesgos y perjuicios. Si aplicamos el principio de autonomía al tema que nos ocupa de la nutrición enteral por sonda, la personas tendrían derecho a no aceptar la distanasia, también conocida como obstinación o encarnizamiento terapéutico, lo que en este caso, entendido como enfermedad crónica, evolutiva e irreversible, nos viene avalado por el no tener evidencia sobre la reducción de la neumonía por aspiración11, así como de otras infecciones. Tampoco tenemos evidencia de que prolongue la la vida12. La supervivencia es de 7,5 meses tras la aplicación de una sonda percutánea enteral de alimentación (PEG), habiendo una mortalidad del 63% al año de haber sido instaurada y del 81,3% a los 3 años. En el 18,7% de los pacientes que seguía con vida tras 3 años de haberles instaurado una PEG, uno se pregunta si se hizo un buen diagnóstico o si se llegó, en su momento, a replantear la posibilidad de poder retirar la nutrición enteral por sonda y seguir con la alimentación oral. También hemos de hacer constar que no tenemos evidencia de que el instaurar una nutrición enteral en estas fases avanzadas de la demencia mejore los resultados clínicos de la evolución de las úlceras por presión13. Llegados a este punto, cada vez tenemos más claro que estamos obligados a dar continuidad al tratamiento alternativo para así poder aumentar el confort de los pacientes afectados de demencia en estadio final y el de sus familiares y/o cuidadores, que es lo que se correspondería con el principio de la beneficencia.
A forma de resumen, respecto a la nutrición, cabe decir que tenemos argumentos para hacer una valoración e intervención nutricional en las fases precoces de la demencia, al igual que lo hacemos en las demás fases evolutivas. De igual manera, tenemos motivos consecuentes para replantearnos la nutrición enteral como intervención nutricional en la fase final de la enfermedad14.
Fase intermediaEn las fases intermedias de la enfermedad, lo que correspondería a los estadios GDS 4 y 5, hemos observado cómo irrumpen las caídas y las fracturas6, con lo que el hacer una buena valoración e intervención sobre el riesgo de caídas (lo que puede incluir modificaciones del entorno y una buena nutrición calórico-proteica, entre otras intervenciones) podría ayudarnos a evitar y/o a retardar la pérdida funcional, la institucionalización y la muerte. Éste es un aspecto que suele escaparse del conocimiento de los profesionales que, a nivel general, intervienen en la atención a aquellos pacientes que, afectos de demencia en estadios intermedios, deberían seguir con un buen grado de autonomía en la comunidad, utilizando los recursos sanitarios comunes a la mayoría de la población. Sin embargo y en contraposición, en los estadiajes intermedios y en los avanzados de la enfermedad, utilizamos la sujeciones mecánicas cuando éstas sólo deberían ser utilizadas en caso de riesgo evidente y no controlable con otras medidas, dado que incrementan el número de caídas que acaban en fractura, aumentan el número de otras lesiones e incrementan el riesgo de muerte15–17.
De forma similar a lo argumentado previamente con la nutrición, cabe decir que en fases intermedias de la demencia no se suele hacer valoración e intervención sobre el riesgo de caídas con posibilidad de fractura y, sin embargo, en estadios avanzados, indicamos sujeciones que nos pueden aportar las mismas complicaciones que la no intervención sobre caídas en estadios intermedios.
Fase avanzadaEn la fase avanzada del síndrome demencial, en múltiples ocasiones, aquellas enfermedades que conllevan un ingreso hospitalario (EPOC, IC, cardiopatía isquémica [CI], etc.) lo hacen con el diagnóstico principal codificado de síntomas mal definidos6. Podríamos interpretar esto como presentación atípica de la enfermedad, si bien lo propio es que se trate de una forma típica de enfermar, sin embargo, desconocida o difícil de diagnosticar para aquellos profesionales que atienden a estos pacientes en urgencias sin haber recibido una formación reglada al respecto. Lo cierto es que no se codifica la neumonía, ni la IC, ni la EPOC, ni la colecistitis, entre otras muchas patologías que los pacientes con demencia avanzada presentan.
Llegados a este punto, nos podemos plantear distintas preguntas, entre las que analizaremos las 4 siguientes: ¿los pacientes con demencia avanzada están más enfermos que el resto de la población de la misma edad y sin demencia?; ¿estos enfermos con demencia avanzada gastan más recursos que aquellos que están libres de dicha enfermedad?; ¿hay diferencias entre las situaciones comórbidas y los distintos tipos de demencia? y, finalmente, ¿por qué motivo y hasta cuándo hemos de seguir tratando la patología crónica en los pacientes con demencia en fase avanzada?
¿Los pacientes con demencia avanzada están más enfermos que el resto de la población de la misma edad y sin demencia?Para responder nos apoyaremos en un estudio transversal en el que intervinieron un hospital de agudos y 7 centros de atención primaria de Estados Unidos18–20, utilizándose la novena Clasificación Internacional de Enfermedades, la Chronic Disease Score (CDS) y y el diagnóstico comórbido realizado por 10 médicos. En dicho estudio se observó que las 10 enfermedades crónicas más comunes en el año previo a la recogida de datos para efectuar el estudio fueron artritis, IC, CI, cáncer (CA), EPOC, diabetes mellitus (DM), accidente vascular cerebral, hipertensión arterial (HTA), enfermedad renal y enfermedad hepática. Los enfermos con demencia presentaban un promedio de 2,4 enfermedades crónicas, utilizando 5,1 medicamentos para su control; además, el 50% recibía fármacos con acción anticolinérgica y el 20%, antipsicóticos. Al comparar los pacientes afectados de demencia con aquellos que estaban exentos de ésta, apreciaron que la comorbilidad era similar (2,4 frente a 2,3); sin embargo, la CDS referida al número de fármacos utilizados para estabilizar la patología crónica era superior en los pacientes libres de síndrome demencial (5,8 frente a 6,2).
A forma de resumen y en respuesta a la pregunta, uno llega a la conclusión de que en la población con demencia las situaciones de comorbilidad médica llegan a ser comunes; además, a pesar del déficit colinérgico que presentan estos pacientes, el 50% podría llegar a recibir fármacos con acción anticolinérgica y un porcentaje nada despreciable reciben neurolépticos. Por ello, a forma de reflexión, hemos de incorporar esta complejidad médica, ya que estos pacientes aportan menos sintomatología, el 50% tiene enfermedades tratables no diagnosticadas y a misma comorbilidad reciben menos tratamiento óptimo.
¿Estos enfermos con demencia avanzada gastan más recursos que aquellos que están libres de dicha enfermedad?De la segunda pregunta, en el estudio retrospectivo21 en el que se compararon enfermos con y sin enfermedad de Alzheimer, aquellos que estaban diagnosticados de enfermedad de Alzheimer presentaban mayores costes anuales al requerir más hospitalizaciones y mayor porcentaje de institucionalización; sin embargo, en 6 de las 10 primeras patologías crónicas que presentaban, su atención fue más cara en comparación con los pacientes con enfermedad de Alzheimer leve, en quienes esto sucedía en 8 de los 10 primeros procesos patológicos. Un dato importante a tener en cuenta es que aquellos pacientes con síndrome demencial tratados con inhibidores de la acetil colinesterasa (IACE) presentan menores costes en referencia a la utilización de recursos y aseguranzas.
De este artículo, a forma de resumen, cabe decir que los pacientes con demencia utilizan más recursos y que su atención es más cara, sobre todo en aquéllos con mayor comorbilidad; conjuntamente, los estadios más avanzados y la no utilización de IACE se asocian a mayor coste. Por todo ello, creemos que un mejor conocimiento médico de estas enfermedades puede mejorar, sin duda, la situación actual.
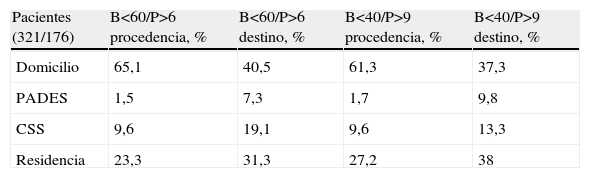
Al revisar los datos en nuestro registro6, de aquellos pacientes atendidos en el segundo semestre del año 2005 apreciamos que los más evolucionados, por ello con mayor deterioro psicofuncional, al alta del hospital retornaban menos a su domicilio, utilizando en mayor proporción los equipos de soporte geriátrico comunitario, y tenían mayor requerimiento de ingreso en centros sociosanitarios y en centros residenciales (tabla 3).
Destino al alta hospitalaria según dependencia psicofuncional
| Pacientes (321/176) | B<60/P>6 procedencia, % | B<60/P>6 destino, % | B<40/P>9 procedencia, % | B<40/P>9 destino, % |
| Domicilio | 65,1 | 40,5 | 61,3 | 37,3 |
| PADES | 1,5 | 7,3 | 1,7 | 9,8 |
| CSS | 9,6 | 19,1 | 9,6 | 13,3 |
| Residencia | 23,3 | 31,3 | 27,2 | 38 |
B: Barthel; CSS: centro sociosanitario; PADES: Programa de Atención Domiciliaria Equipo de Soporte; P: Pfeiffer.
Centrándonos en la tercera de las preguntas, intentaremos responder a si hay diferencias entre las situaciones comórbidas y el tipo de demencia guiados por un estudio prospectivo descriptivo de más de 30.000 personas, de las que la mitad presentaban demencia22. De estos pacientes se revisó a aquellos que eran multiingresadores, buscándose la asociación entre el tipo de demencia diagnosticada y la presencia de HTA, DM, fibrilación auricular (FA), IC y anemia. En esta ocasión, a diferencia de otros estudios, la enfermedad de Alzheimer y la demencia comórbida tenían menos presencia de HTA, DM, IC y FA, lo que no se correlacionaría con los datos aportados por otros autores; los pacientes diagnosticados de deterioro cognitivo vascular, si bien tenían menos probabilidad de estar diagnosticados de IC, presentaban más DM. Finalmente, parece ser que la anemia no se asocia a ningún tipo de demencia. De ello se desprende que, en realidad, hay diferencias en las situaciones comórbidas según el tipo de demencia.
Con la respuesta a estas 3 preguntas previas, sabemos que la comorbilidad en la demencia en fase avanzada existe; además, ésta se incrementa a medida que el síndrome demencial va evolucionando. También conocemos que esta comorbilidad se expresa de forma atípica. Consecuentemente, hemos de tener registrada toda aquella comorbilidad conocida y alta sospecha de aquélla añadida de nuevo (contracturas, úlceras, disfagia, epilepsia, etc.), sabiendo que un buen conocimiento de la patología nos permite un tratamiento afín en la mayoría de las ocasiones.
¿Por qué motivo y hasta cuándo hemos de seguir tratando la patología crónica en los pacientes con demencia en fase avanzada?En otras palabras: ¿hasta cuándo y por qué motivo hemos de mantener las situaciones comórbidas en fase estable?
El motivo parece fácil de deducir: manteniendo la estabilidad clínica mejoraremos el estadio de la demencia (o, al menos, no lo empeoramos) y reduciremos el número de derivaciones a diferentes niveles asistenciales, con lo que reduciremos el número de profesionales que han de atender a estos pacientes y, por ello, también minimizaremos los cambios en la prescripción farmacológica. Es de esta forma como evitaremos generar iatrogenia y aumentaremos el confort de los pacientes con demencia en fase avanzada. El hasta cuándo ya es más difícil de responder; sin embargo, sabiendo que estamos hablando de un período evolutivo de enfermedad en fase GDS-FAST 7 a–f, en el que la media de cada una de las fases (a, b, c, d, e y f) es de 12 meses llegando a hablar de fase final en el período 7 e-f, nuestra práctica clínica diaria nos hace ser activos hasta el inicio de esta fase final, siendo conservadores a partir de ella e incluso antes, según haya sido la forma de llegar a dichas fases.
El tener que controlar la comorbilidad hasta las fases más avanzadas de la demencia debería conseguirse con fármacos administrados preferentemente por vía oral, a dosis muy ajustadas, utilizando un mismo fármaco para el manejo de distintas patologías y con posologías lo más cómodas posible.
Fase final de la demenciaEntrando en el cuarto y último apartado del artículo, se nos hace necesario referenciar que las personas diagnosticadas de demencia reciben con menor frecuencia que los pacientes diagnosticados de CA atención paliativa de confort. Sin embargo, ambas situaciones, CA y demencia, en fases avanzadas de la enfermedad, comparten de forma clara necesidad de cuidados. Además, el solicitar atención paliativa de confort suele ser una demanda frecuente por parte de familiares y cuidadores.
En estas fases avanzadas, el considerar y ajustar un régimen de medicamentos es esencial para ofrecer una mayor atención, dado que muchos de los tratamientos crónicos pueden llegar a suspenderse cerca del final de la vida para así promover el confort y reducir la carga al paciente, haciendo referencia a los efectos adversos y también a los costos derivados de éstos. A forma de ejemplo, el estricto control farmacológico de la HTA puede aportar claro beneficio sintomático en aquellos pacientes diagnosticados de demencia e IC, y que, posiblemente, fallecerán por progresión de su IC. Sin embargo, el beneficio a corto plazo en el control estricto de la tensión arterial sin IC no sólo es escaso, sino que además puede llegar a ser perjudicial dados los efectos secundarios. Siguiendo los criterios Beears, en el último año de vida, el 44% de los beneficiarios de Medicare recibió, como mínimo, un medicamento considerado inapropiado. En fases avanzadas de la enfermedad, como podrían ser los estadios 6e y 7 del GDS-FAST, los pacientes están en mayor riesgo de recibir tratamientos y curas demasiado agresivos, pudiendo intensificarse aquellos síntomas físicos y psicológicos, como son el dolor por contracturas e inmovilidad, la agitación y el estreñimiento, entre otros muchos.
El estudio de Holmes et al23 planteó identificar aquellos medicamentos prescritos en una muestra de 34 pacientes diagnosticados de demencia en estadios comprendidos entre el 6e y el 7c del GDS-FAST, en la que la media de edad correspondía a los 83,8 años y la de medicamentos que tomaba cada paciente era de 6,5. Conjuntamente, buscó el consensuar unos criterios de prescripción en aquellas personas diagnosticadas de demencia en estadios avanzados de la enfermedad, en quienes se buscó la paliación de síntomas utilizando un proceso Delphi modificado, basado en 3 rondas de opinión sobre 581 medicamentos. Además, el grupo participante en dicho proceso Delphi, formado por 12 médicos, podía incorporar medicamentos nuevos que consideraran de interés, no incluidos en el listado inicial de los 581 medicamentos. Dichos participantes recibieron formación explícita sobre la recomendación conceptual de los fármacos analizados y sobre su recomendación en los estadios 6e, 7a, 7b y 7c de la demencia. La tercera ronda de opinión entre los 12 participantes se efectuó después de haber recibido la información sobre los resultados obtenidos en las dos rondas previas. Se llegó a consenso siempre que se obtuvo acuerdo entre 7 o más de los 12 participantes. El consenso se clasificó en medicamentos que siempre son apropiados, aquellos que lo son a veces, los poco apropiados y, finalmente, aquellos que nunca son apropiados. Existió un apartado de medicamentos en los que no se conseguió el consenso. Los medicamentos siempre apropiados eran aquéllos útiles en atención paliativa y que podían tener continuidad o ser iniciada su prescripción sin reservas (broncodilatadores, productos utilizados en las úlceras por presión, antiepilépticos, analgésicos opioides y no opioides, antieméticos, laxantes, etc.); los apropiados a veces hacían referencia al grupo de medicamentos utilizados en función de sus indicaciones en cuidados paliativos y podían ser prescritos o no retirados (diuréticos, antipsicóticos, insulina y una larga lista); los poco apropiados rara vez se utilizaban en atención paliativa, posiblemente se retiraban y era altamente improbable que se prescribieran (anticoagulantes, antiarrítmicos, bifosfonatos, etc.); los nunca apropiados, en principio, no tenían ninguna utilidad en cuidados paliativos, y no había de iniciarse o retirarse su prescripción (hipolipeminates, antiagregantes [no se incluyó el ácido acetilsalicílico], memantina e IACE, etc.).
Finalmente, evaluó el uso adecuado, o no, de los medicamentos sobre la base de los criterios de consenso preestablecidos a través del proceso Delphi modificado que hemos referenciado. El resultado de la evaluación muestra que había un 5% de los medicamentos prescritos en la muestra estudiada de 34 pacientes que nunca sería apropiado y afectaba al 29% de la muestra; un 4% de los medicamentos prescritos sería poco apropiado, recibiendolos el 21% de los pacientes estudiados; apropiados a veces se daba en el 37% de los medicamentos prescritos, tomándolos el 91% de los pacientes; de los medicamentos siempre apropiados, que correspondían al 31% de los medicamentos prescritos, se administraban al 71% de los pacientes estudiados. De todos los medicamentos evaluados, cincuenta y uno (53%) correspondían al grupo de fármacos en el que no llegaron a consensuar y éstos se administraban a un total de 24 pacientes, lo que correspondía al 71% de la muestra evaluada.
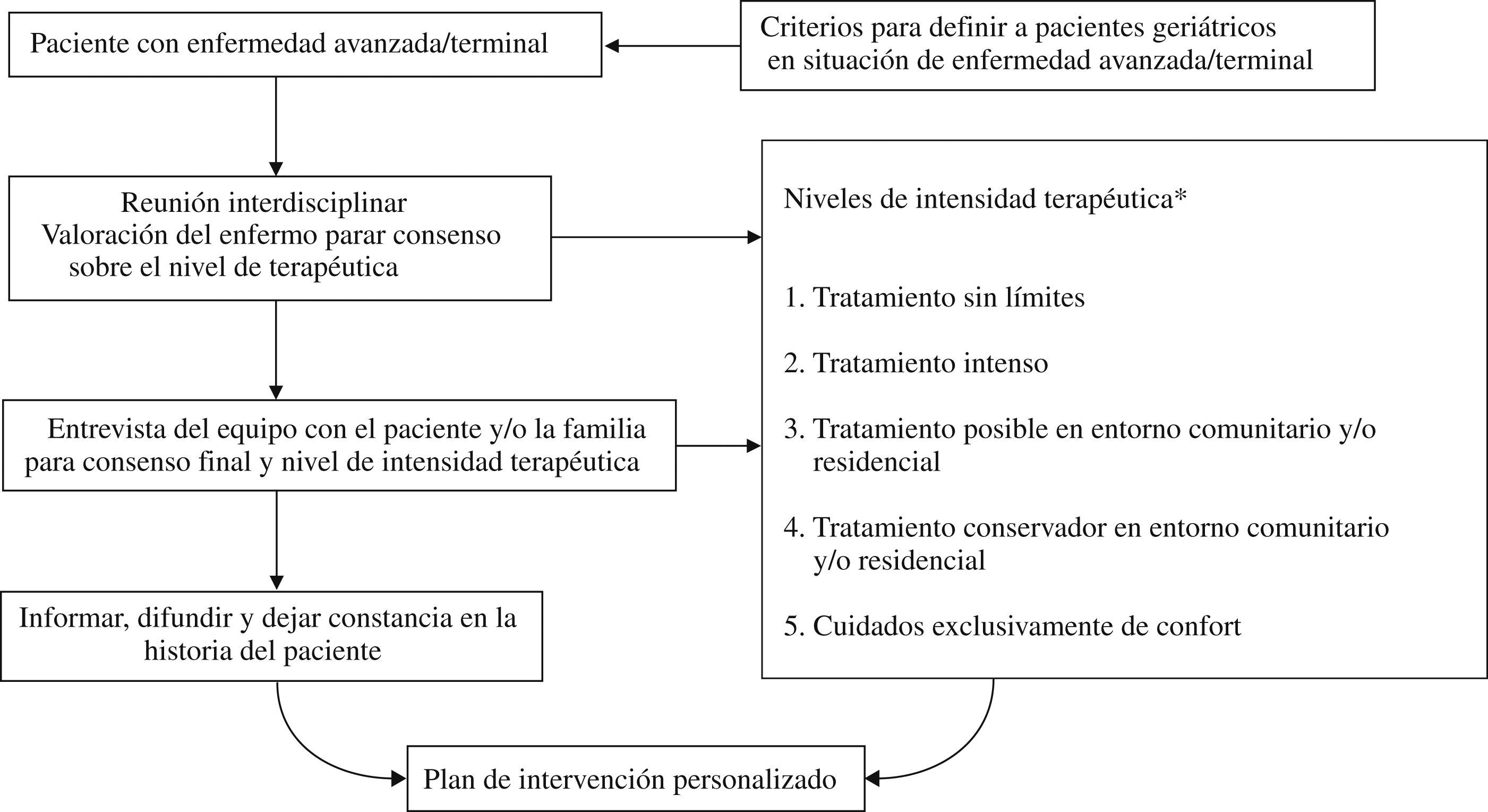
Medidas como la aportada en este estudio, en que se ha llegado a un consenso a través de un proceso Delphi, nos pueden ayudar en la toma de decisiones al final de la vida. Sin embargo, tenemos dificultad en definir fase avanzada y fase final de enfermedad, aun teniendo, en el caso de la demencia, la escala de estadiaje GDS-FAST5, en que existe un promedio de 7 meses entre el nivel 7a y el 7b, y entre éste y el 7c, dependiendo si se pasa o no de forma gradual de un nivel al otro. En todo caso, hemos de llegar a un consenso en definir enfermedad en fase terminal, lo que podría conseguirse, como expresa Robles24, si se exponen los casos a debate entre diferentes profesionales con alto nivel de conocimiento sobre la enfermedad en cuestión (en el caso de la demencia, neurólogos, geriatras, psiquiatras y distintos generalistas). Una vez definida la enfermedad en fase terminal, deberíamos consensuar unos niveles de intensidad terapéutica como los descritos en el Rogers Memorial Veterans Hospital25 (tabla 4). Si el paciente con demencia, desde el inicio de la enfermedad tiene un equipo asistencial interdisciplinario de referencia, el cual aplica unos criterios consensuados de estadiaje de la enfermedad, unos niveles de intensidad terapéutica que se adapten a estos estadios y, finalmente, una definición consensuada de enfermedad en fase terminal, restaría que mediante las reuniones interdisplinarias se llegara al consenso acerca del estadio y del nivel de intensidad terapéutica, el cual se tendrá que consensuar con el paciente y/o los familiares-cuidadores, informando, difundiendo y dejando constancia del consenso final en la historia clínica del paciente. Por la dificultad que ello comporta, tal y como expresamos en la (fig. 2), en cada caso se debería formular un plan de intervención personalizada24.
Niveles de intensidad terapéutica*
|
Los autores declaran no tener ningún conflicto de intereses.
A Fernando Gómez-Busto por sus correcciones enriquecedoras y a Francesc Formiga por haber proyectado la práctica diaria, expresada en unas jornadas, en este monográfico.