INTRODUCCION
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo que causa una progresiva pérdida de memoria, alteraciones conductuales y psicológicas y pérdida de autonomía, además de una sobrecarga familiar y del entorno social. La posibilidad de que la causa de la enfermedad sea una interacción entre predisposición genética y factores ambientales ha provocado que actualmente los tratamientos sean globalizadores, con el fin de que puedan abordar las diversas necesidades que plantea el paciente y sus familiares1. Estos tratamientos intentan mejorar los recursos del paciente y los cuidadores. Así, no sólo se sustentan en el tratamiento farmacológico, sino en programas de estimulación cognitiva2-5, conductual6,7 o ambiental8,9, así como en el mantenimiento de las habilidades residuales y las actividades de la vida diaria o la recuperación de lo olvidado10,11.
El tratamiento farmacológico per se sólo apunta a un alivio sintomático. Estudios llevados a cabo sobre los efectos a corto plazo del tratamiento farmacológico con donepezilo en la EA recogen una mejora tanto en áreas cognitivas como en tareas de la vida diaria12,13. Otros encuentran que este fármaco actúa eficazmente tanto en funciones cognitivas como en el humor14,15, mientras que algunos investigadores aseguran que el riesgo de deterioro comparado con el grupo que recibe placebo se reduce en un 38%16. Sin embargo, parece que los fármacos son incapaces de evitar el deterioro a largo plazo de los pacientes, lo que justifica la búsqueda de alternativas como los tratamientos no farmacológicos. Estos tratamientos parten de la idea de que, a pesar del declive propio de la EA, los pacientes mantienen la capacidad para aprender en los estadios leve y moderado17. El aprendizaje se manifiesta en los cambios de conducta, adecuación a nuevos estímulos y ambientes, y en la mejora de habilidades instrumentales18. Los efectos en el pensamiento representativo son menores, ya que en estas fases se encuentra muy deteriorado19. En una revisión realizada por Spector et al20, con tratamientos no farmacológicos de orientación a la realidad de menos de un año de duración, encuentran mejoría en el área cognitiva; otros investigadores han encontrado los mismos resultados con programas de estimulación cognitiva21. No ocurre lo mismo en otras investigaciones que recogen resultados negativos tras evaluar el seguimiento del tratamiento con estimulación cognitiva22. Algunos investigadores consideran que la eficacia de los tratamientos, tanto en tareas cognitivas como funcionales, está en la sistematización23. Estudios recientes apuestan por el mantenimiento de los tratamientos a largo plazo de más de un año de duración, ya que la sistematización de la intervención en el tiempo puede proporcionar más beneficios, como muestran los resultados de investigaciones llevadas a cabo con tratamientos farmacológicos con donepezilo24-26. Algunos trabajos realizados con tratamiento combinado de estimulación cognitiva y donepezilo recogen también resultados positivos, tanto en funciones cognitivas como en mejora de la calidad de vida27. No obstante, otros investigadores aseguran que los resultados en este tipo de intervenciones breves no se generalizan en otros contextos28. Aun así, es fundamental reconocer que los resultados de estudios realizados con más de 2 años de duración, independientemente del tratamiento aplicado, donepezilo o estimulación cognitiva, muestran que los individuos presentan la progresión del declive característico de la EA29,30. Otros investigadores aseguran que la eficacia de los tratamientos con memantina en los EA moderados debe valorarse en aspectos como ahorrar costes sanitarios, aumentar la independencia del paciente y retrasar la institucionalización31. En este sentido, otros investigadores aseguran que el hecho de que esta enfermedad sea progresiva no debe disuadirnos de seguir aplicando los tratamientos tanto farmacológicos como cognitivos y conductuales por el efecto positivo que tienen en la calidad de vida, tanto del paciente como de sus familias17.
De la revisión presentada se desprende que, hoy por hoy, los tratamientos multidimensionales pretenden retrasar el mayor tiempo posible el deterioro y mejorar la calidad de vida de los pacientes, de sus familias y del entorno social27. El objetivo de nuestro estudio es mostrar que si se mantiene un tratamiento combinado de fármaco y estimulación en períodos moderadamente avanzados de la EA, el deterioro global del estatus cognitivo se producirá de un modo más gradual y menos intenso.
MATERIAL Y MÉTODOS
Sujetos
La muestra inicial consistió en 50 pacientes con EA que presentaban un estadio FAST ≥ 4, con una edad media ± desviación estándar de 77,9 ± 6,2 años, que asistían al Centro de Estancias Diurnas Odón Alonso de León. Todos los sujetos presentan un nivel educativo básico. La Gerencia Territorial de Servicios Sociales de León derivaron a los sujetos. Todos los pacientes incluidos en el estudio estaban diagnosticados de EA al menos un año antes de iniciar el estudio y los que tomaban fármaco iniciaron el tratamiento con el estudio, que el Servicio de Geriatría y Neurología del Hospital de León prescribió.
A su inclusión, todos los sujetos cumplían el criterio del DSM-IIIR y NINCDS-ADRDA para la demencia tipo Alzheimer32. El Comité Ético Médico en el Hospital de León aprobó el proyecto. Para su participación, todos los cuidadores o representantes legales firmaron el consentimiento informado.
Los criterios de exclusión fueron: demencia grave (FAST ≥ 6), pérdida de toda capacidad para el discurso, pérdida de habilidades psicomotoras básicas (vestirse, orientarse en el espacio familiar, comer), no seguir órdenes secuenciadas, que presentasen depresión según el Servicio de Neurología o que no prestasen su consentimiento. Tras una primera selección se excluyó a 7 pacientes que presentaban un grado de deterioro grave.
A todos los sujetos se les aplicaron 3 escalas especializadas: Mini-Mental State Examination (MMSE)33, la Alzheimer's Disease Assessment Scale (ADAS-Cog)34 y el Functional Staging of Dementia of the Alzheimer's Type (FAST)35.
Intervención
Se asignó a los pacientes a los diferentes grupos de tratamiento de modo aleatorizado y ciego al evaluador, según orden de lista. Se aplicaron 2 tipos diferentes de tratamiento: a) un tratamiento farmacológico mediante donepezilo a dosis diaria de 10 mg, y b) un programa de estimulación cognitiva que comprendía 7 áreas de estimulación: a) orientación con 2 grados de dificultad que los determinaba el tipo de pregunta (aparece una imagen de la catedral y se pregunta ¿vives en León? o ¿dónde vives?, según el grado de dificultad); b) esquema corporal (imitar ejercicios que aparecen en la pantalla o recordar y repetir los ejercicios de la pantalla, según el grado de dificultad); c) familia y sociedad (aparecen la imagen de una familia y se pregunta quién es el hijo de todas las personas que aparecen en pantalla o que nos digan el grado de parentesco, según el grado de dificultad); d) cuidado de sí mismo (aparece secuencias de poner algo al fuego y lo que se debe o no hacer); e) reminiscencia (aparecen imágenes de personas conocidas, así como monumentos y se pregunta quién o qué es, según el grado de dificultad); f) actividades de la vida diaria (aparecen secuencias de ir a la compra, coger un autobús, recoger la mesa), y g) animales, personas o cosas (relacionar imágenes que aparecen en pantalla según oficios, convivencia, lugares habituales). Este programa estaba informatizado y se llevó a cabo en grupos de 4 personas. Los estímulos visuales consistían en fotografías de situaciones cotidianas a través del ordenador y una pantalla de televisor. El investigador informaba de los éxitos y los fracasos y daba pautas para ejecutar las tareas a modo de preguntas directas o más abstractas, según los 2 grados de dificultad. Las imágenes se acompañaban de efectos de sonido cuando así se requería (sonido de un autobús, batir un huevo, sonidos de animales, etc.). Era importante que las sesiones se hicieran en grupo, porque aumentaba el grado de motivación de los individuos36. Los individuos acudían al centro de día a recibir exclusivamente el programa de estimulación cognitiva mencionado diariamente, de lunes a viernes, con una duración de 45 min y los fines de semana las familias reforzaban los ejercicios en casa.
La muestra se subdividió en 4 grupos según el tratamiento administrado: grupo 1 (n = 12 sujetos), que recibió estimulación cognitiva; grupo 2 (n = 13), que recibió tratamiento farmacológico; grupo 3 (n = 12), que recibió tratamiento combinado (fármaco y estimulación cognitiva), y grupo 4 (n = 13), sin tratamiento.
El tiempo medio de la investigación ha sido de 2 años. Aunque la muestra inicial era de 50 pacientes, en el último año de estudio fallecieron 10, con la siguiente distribución: en el grupo 1, 2 sujetos; en el 2, 2 pacientes, y en el 3 también 2 sujetos. Finalmente, el grupo 4, compuesto por 13 sujetos que no recibían ningún tratamiento, cuando dejaban de acudir al centro, se les visitaba a domicilio una vez al mes para ver cómo se encontraban. En este grupo, en el último año fallecieron 4 sujetos.
Al cabo del primer y segundo año se realizó una evaluación de retest con las mismas pruebas del inicio de la investigación.
Análisis de datos
Las variables dependientes consideradas en este estudio fueron las pruebas MMSE, ADAS-Cog y la escala FAST. Los análisis de datos para las puntuaciones de estas pruebas se han realizado en todos los casos del mismo modo, mediante un ANOVA para medidas repetidas 4 × 3 (tratamiento × medida). Es decir, 4 tipos de tratamiento (farmacológico, cognitivo, combinado y control) y 3 evaluaciones a los pacientes (línea de base, 1.ª medida, 2.ª medida). En el caso del FAST, sólo se han considerado como significativas las comparaciones en las que las puntuaciones bajan o suben una unidad entera (de 4 a 3, de 4 a 5, etc.). Adicionalmente, se han realizado comparaciones a posteriori de medias corregidas siguiendo la técnica de Bonferroni. Para todas las comparaciones se estimó significativa una diferencia con p < 0,05.
RESULTADOS
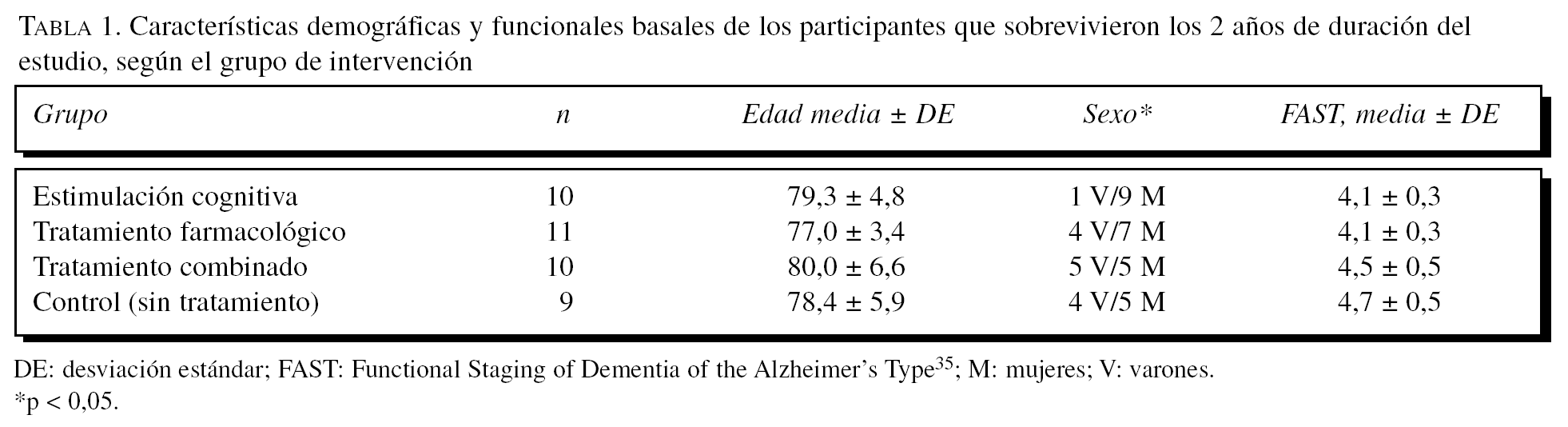
En la tabla 1 se describen los datos clínicos y demográficos generales de los participantes, en los que se observa que son similares en cuanto a edad y valores iniciales del FAST, pero no así en cuanto a la distribución por sexos.
Cambios en el MMSE
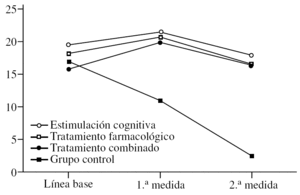
Para el MMSE se puede observar (fig. 1) que tanto los efectos principales de «tratamiento» y «medida» como la interacción entre éstos son significativos. En primer lugar, se describe un efecto significativo del «tratamiento» (F3,36 = 29,14; p < 0,0001) en el sentido de que el grupo control muestra globalmente puntuaciones más bajas que el resto de los grupos (diferencia estimada de 10 puntos). Además, las comparaciones de medias entre control y los otros grupos son siempre muy significativas (p < 0,0001). Sin embargo, no hay diferencias entre los grupos que reciben tratamiento entre sí (p > 0,05). También es significativo el efecto de la «medida» (F2,72 = 29,14; p < 0,0001). En este caso, lo que se observa es que, independientemente del tratamiento recibido, hay una ligera mejora en la 1.a medida (p < 0,05) después de iniciarse el tratamiento, seguida de una bajada acentuada de las puntuaciones en la 2.a medida (p < 0,0001). Finalmente, se estimó el efecto de la interacción «tratamiento» * «medida» (F6,72 = 53,31; p < 0,0001), cuyos resultados significativos se analizan de 2 modos. Primero, se determinan las diferencias entre grupos con la fijación de la «medida». Así se observa que, en la línea de base, el grupo de tratamiento combinado tiene valores MMSE significativamente más bajos que el grupo de estimulación cognitiva (p < 0,001), aunque en general el grupo combinado tiene puntuaciones más bajas en comparación con los otros grupos. En la 1.a medida, el grupo control muestra puntuaciones significativamente más bajas que el resto de los grupos (p < 0,0001), lo que se repite exactamente en la 2.a medida (p < 0,0001). Para complementar estos análisis, se evalúan las diferencias entre medidas con la fijación de cada grupo. En el grupo de estimulación cognitiva hay una subida de las puntuaciones en la 1.a medida tras iniciarse el tratamiento (p < 0,001) y una bajada en la 2.a medida. Esta bajada en la 2.a medida es significativa tanto en comparación con la línea de base (p < 0,05), aunque débil y mucho más fuerte si se compara con la 1.a medida (p < 0,0001). En el grupo de tratamiento farmacológico ocurre exactamente lo mismo con los mismos valores de significación. El grupo de tratamiento combinado es ligeramente distinto, en el sentido de que hay una subida de puntuaciones en la 1.a medida postratamiento (p < 0,0001) y una bajada en la 2.a medida (p < 0,0001); sin embargo, en este caso las medidas de línea de base y la 2.a medida se mantienen iguales, lo cual podría indicar que este grupo se deteriora menos. No obstante, aquí es donde hay que tener en cuenta que este grupo de pacientes tiene un MMSE significativamente más bajo que los otros grupos, lo cual puede afectar a la interpretación del efecto. Finalmente, el grupo control es completamente diferente de los otros grupos, ya que se va produciendo una bajada paulatina de las puntuaciones, que es especialmente intensa al comparar la 1.a medida con la 2.a (p < 0,0001).
Figura 1.Variación del MMSE (Mini-Mental State Examination) según el grupo de tratamiento.
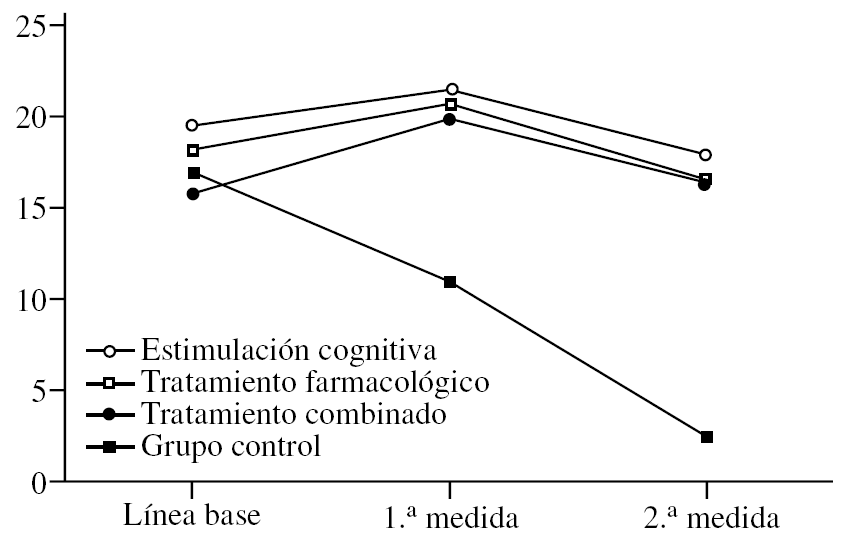
Variación del ADAS-Cog
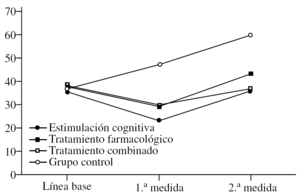
El ADAS-Cog se comporta de una manera muy similar al MMSE (fig. 2). El efecto principal de «tratamiento» es significativo (F3,36 = 10,66; p < 0,0001) e idéntico a lo reflejado más arriba, es decir, que el grupo control tiene puntuaciones más bajas de forma global, sin tener en cuenta el momento en el que se les mida (p < 0,0001). De igual modo, no hay diferencias en los grupos con tratamiento. El efecto de la «medida» (F2,72 = 67,11; p < 0,0001) también es idéntico a lo reseñado para el MMSE. En este caso, las puntuaciones bajan en la 1.ª medida tras el tratamiento y suben significativamente en la 2.ª, de tal modo que no son sólo superiores a la 1.ª medida (p < 0,0001), sino incluso superiores a la línea de base (p < 0,0001). Esto indica que todos los pacientes, independientemente del tratamiento que reciban, se deterioran a los 2 años, al menos según el ADAS. Por último, se describe la interacción «tratamiento» × «medida» con una relación significativa (F6,72 = 19,19; p < 0,0001). De nuevo se observan las diferencias entre grupos con la fijación de la «medida». En la línea de base no hay diferencias entre grupos, lo cual es distinto al MMSE donde el grupo de tratamiento combinado puntuaba más bajo. En la 1.ª medida, se observa que el grupo control puntúa más alto que los otros (p < 0,0001), lo cual se confirma en la 2.ª medida (p < 0,0001). Esto último es muy importante, ya que demuestra que a pesar de que los pacientes tratados se deterioran en la 2.ª medida hasta alcanzar o empeorar los valores de la línea de base, ese deterioro es menor que en el grupo control, cuyas puntuaciones siempre se mantienen a un grado mucho más alto.
Figura 2.Variación de la escala ADAS-Cog (Alzheimer's Disease Assessment Scale) según el grupo de tratamiento.
Por último, una vez fijado el grupo, se analiza el efecto de la «medida». Así, en el grupo de estimulación cognitiva se aprecia una bajada significativa de las puntuaciones en la 1.ª medida (p < 0,0001) y una subida en la 2.ª (p < 0,0001), que mantiene las puntuaciones igual que en la línea de base. En el grupo de tratamiento farmacológico ocurre exactamente lo mismo, bajada en la 1.ª medida (p < 0,0001) y subida en la 2.ª. Lo que ocurre en este caso es que las puntuaciones suben por encima de lo visto en línea de base, aunque esa diferencia no es estadísticamente significativa. Si lo hubiera sido se podría haber afirmado más categóricamente que este grupo se deteriora más a largo plazo. El grupo de tratamiento combinado se comporta de igual modo, bajada en la 1.ª medida y subida en la 2.ª. Aquí de nuevo hay una pequeña diferencia en la 2.ª medida, ya que, aunque las puntuaciones suben, no llegan a alcanzar la línea de base. Del mismo modo que con el grupo de tratamiento farmacológico (pero justo al contrario), si esa diferencia hubiera sido significativa, se podría postular que este grupo se deteriora menos que los demás a largo plazo, pero la diferencia no es significativa. Finalmente, en el grupo control se observa la subida paulatina de las puntuaciones con cada medida (p < 0,0001).
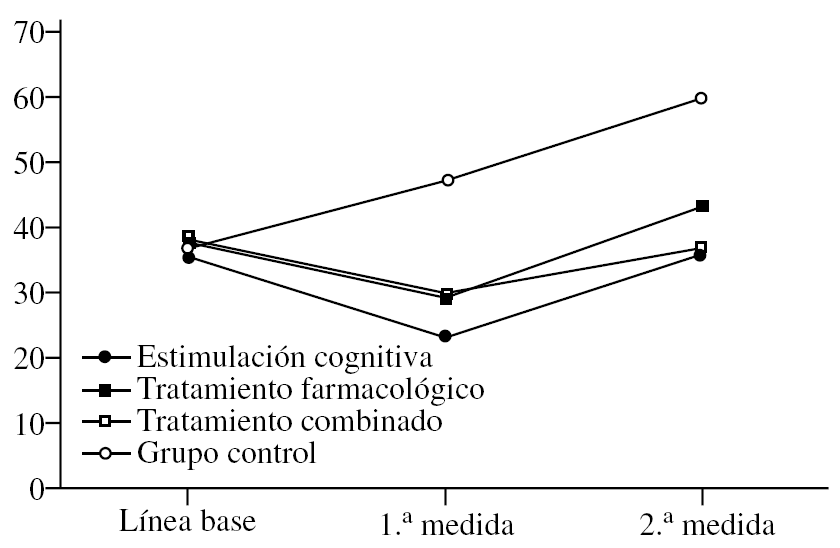
Cambios en la escala FAST
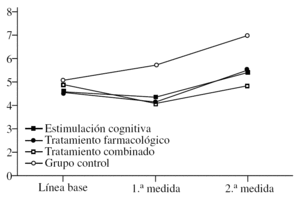
En primer lugar, se analiza el efecto del «tratamiento» (F3,36 = 24,20; p < 0,0001) que sigue la tendencia marcada por las anteriores pruebas, es decir, el FAST es más alto de forma global en el grupo control, sin tener en cuenta el momento en que se mide. No hay diferencias en los otros grupos (fig. 3). Sin embargo, en el efecto de la «medida», aunque los resultados son significativos (F2,72 = 75,38; p < 0,0001), su interpretación es diferente. Dado que sólo se han considerado significativas las diferencias en las que se aumenta o se baja una unidad entera en la escala FAST, no hay diferencias entre la línea de base y la 1.ª medida tras iniciar el tratamiento (el FAST se mantiene en 4), pero sí entre la 2.ª medida y las restantes (p < 0,0001), ya que los pacientes empeoran de modo general hasta obtener un FAST medio de 5. Aunque este análisis considera a los grupos de forma global, sin tener en cuenta las diferencias por tratamiento, la conclusión es que los pacientes empeoran a largo plazo. La interacción «tratamiento» × «medida» (F6,72 = 10,12; p < 0,0001) permite observar que los valores del FAST se modifican en cada medida y en cada grupo. Así, partiendo de que no hay diferencias en la línea de base (la gravedad es idéntica), tras la 1.ª medida postratamiento se establecen claras diferencias entre los controles y el resto de los grupos (p < 0,0001), ya que, mientras éstos suben a FAST 5, los restantes grupos tienden a bajar hacia el estadio 3. En la 2.ª medida, los controles han empeorado todavía más hasta llegar como media a FAST 6, mientras los otros se mantienen cerca del 5. En este punto parece que los que han recibido tratamiento farmacológico están ligeramente peor (FAST 5) que los del combinado (FAST 4), pero es una diferencia muy ligera y no significativa. Lo que sí se puede afirmar es que los participantes en el grupo de tratamiento combinado se mantienen como media en la última medida en FAST 4, mientras todos los demás están en estadio 5 (farmacológico y cognitivo) o 6 (control). Si se analizan las diferencias por «medida» independientemente del grupo, se observa que el grupo de estimulación cognitiva presenta FAST más alto en la 2.ª medida comparado con la 1.ª y con la línea de base, lo que indica deterioro a largo plazo. El grupo de tratamiento farmacológico es especial en este caso, ya que mejora mucho en la 1.ª medida (según el FAST), pero también empeora significativamente en la 2.ª medida en la comparación tanto con la línea de base como respecto a la 1.ª medida (p < 0,0001). En el grupo combinado las puntuaciones mejoran en la 1.ª medida (p < 0,0001) y luego empeoran otra vez hasta ponerse al nivel de la línea de base, aunque a diferencia de los de tratamiento farmacológico no se deterioran significativamente con respecto a la línea de base. Como en las escalas anteriores, el grupo control se va deteriorando significativamente con cada medida (p < 0,0001).
Figura 3.Variación del FAST (Functional Staging of Dementia of the Alzheimer's Type) según el grupo de tratamiento.
Como resumen, parece que todos los grupos salvo el control mejoran significativamente en la 1.ª medida tras el inicio del tratamiento. Las diferencias, aunque muy leves, aparecen en la 2.ª medida. De modo general, todos empeoran, no obstante en los grupos cognitivo y farmacológico ese deterioro es incluso superior del que aparecía en la línea de base, mientras que en el grupo combinado parece que el deterioro es menor, y los pacientes se mantienen en valores similares a los del inicio.
DISCUSION
Los resultados presentados demuestran que en el primer año de tratamiento los individuos que presentan deterioro cognitivo moderado y que han recibido tratamiento, tanto combinado como estimulación cognitiva y farmacológica, mejoran significativamente en las pruebas del MMSE, ADAS-Cog y FAST. Por el contrario, el grupo de control muestra puntuaciones significativamente más bajas en todas las pruebas. En este sentido, la comparación con los resultados de otras investigaciones muestran algunas diferencias. Se describen tanto mejoras en aspectos cognitivos2-5,20-22 como en aspectos conductuales6-9, funcionales10,11 y emocionales (menor ansiedad). Estos últimos síntomas son referidos tanto por parte del paciente14,15 como de sus cuidadores, expresado por ellos verbalmente37. Sin embargo, en el presente estudio se ha comprobado que tras el segundo año de seguimiento todos los individuos se deterioran independientemente del tratamiento aplicado; evolución similar a la descrita en estudios llevados a cabo con individuos que presentan deterioro cognitivo leve38. Los individuos con EA, independientemente de la fase de deterioro en la que se encuentren, muestran mejora cognitiva, estabilización funcional y menos problemas conductuales39,40 cuando reciben tratamiento a corto plazo. Sin embargo, esta mejora no continúa a largo plazo y la enfermedad presenta la progresión característica, aunque menos intensa y más gradual que los que no recibieron ningún tratamiento. Por otro lado, entre los familiares de los pacientes que reciben tratamiento también se observan menos quejas de conducta al igual que han encontrado otros investigadores30,41,42. Otros aseguran que la progresión del paciente en un año no tiene relación con la proporción del declive en un futuro29. En nuestro estudio tampoco hemos podido observar una regularidad en las puntuaciones al comparar las puntaciones del primer año y el segundo.
La evolución de la enfermedad es diferente según sea el grado de deterioro en el que se encuentra el individuo y el tratamiento recibido. En nuestro estudio, los grupos con deterioro moderado que recibieron tratamiento combinado han mantenido a largo plazo las puntuaciones de todas las pruebas en línea de base. El grupo que ha recibido sólo estimulación cognitiva se ha comportado de modo similar, ya que ha mantenido en valores de línea de base las puntuaciones en el ADAS-Cog, prueba que mide de modo más sensible los cambios de los individuos en deterioro como lo muestran otros investigadores43. Sin embargo, el grupo que recibió exclusivamente tratamiento farmacológico pareció estar sujeto a un proceso de más deterioro cognitivo que el resto de los grupos.
Los individuos que reciben tratamiento farmacológico muestran una evolución diferente, según el grado de deterioro. Los individuos con deterioro moderado se benefician de éste durante el primer año12-16 y se deterioran por debajo de la línea de base en el segundo año. Sin embargo, los individuos con un estadio leve inician el deterioro al año de seguimiento. En este sentido, algunos estudios han recomendado el tratamiento cognitivo en las fases iniciales de la enfermedad y no es hasta fases más avanzadas de la enfermedad cuando habría de sumarse el tratamiento farmacológico44. No obstante, nuestros datos demuestran que, tanto en un grado de deterioro como en otro, los grupos de pacientes tratados muestran un declive menos intenso y progresivo con respecto a los individuos del grupo de control. Esto indica que los pacientes, independientemente del deterioro, se benefician del tratamiento en términos de que la enfermedad no progresa con tanta virulencia como en los que no reciben tratamiento. Según nuestros resultados, los individuos que reciben tratamiento bajan sus puntuaciones dentro de los parámetros esperados, mientras que el grupo de control baja sus puntuaciones anuales en el MMSE por debajo de la pérdida anual aceptada de 1,8-4,2 puntos17,27.
El hecho de que los individuos con mayor deterioro se beneficien más de los tratamientos que los individuos que tienen un menor deterioro puede comprobarse en estudios de otros autores, en los que se señala que a corto plazo la proporción de mejora en los individuos con un grado de deterioro leve es de 1,5 puntos en el MMSE, mientras que los individuos con un grado de deterioro moderado es de 3,25 puntos45. En este estudio hemos constatado que estos mismos resultados se confirman a largo plazo.
La efectividad de las intervenciones se mide en cuanto que mantienen durante más tiempo la independencia, suponen menos coste económico y emocional, tanto a las familias como a la sociedad, retrasan la institucionalización del paciente y, finalmente, a pesar de una tendencia progresiva hacia el deterioro, ésta parece lejos de ser tan intensa y devastadora como la que presentan los individuos que no reciben ningún tipo de tratamiento28,31. Nosotros hemos observado que los individuos del grupo de control bajan una media de 6,62 y de 8,29 puntos el primer y segundo año, respectivamente. Además, de las 10 personas fallecidas en el seguimiento del segundo año, 4 pertenecían al grupo que no recibían tratamiento y 6 habían sido institucionalizadas durante el estudio; de lo que podemos concluir que los individuos que no reciben tratamiento y/o se institucionalizan tienen más posibilidades de empeorar, como también han encontrado otros investigadores31.
El hecho de comprobar que el tratamiento retarda el deterioro o incluso que se pueda revertir parcialmente10,11 hace que se planteen consideraciones éticas, como la de cuándo conviene comenzar a intervenir con los individuos que presentan deterioro cognitivo. Por otro lado, si se plantea tratamiento, ¿cuál sería más conveniente: fármaco o estimulación? A pesar del gran esfuerzo que desde la investigación se hace para entender las señales, los síntomas y las causas subyacentes de la demencia, se ha dedicado poca atención a la demencia temprana característica de las personas que no han alcanzado los 65 años46. No obstante, en algunos de los estudios farmacológicos, llevados a cabo con individuos en etapas tempranas de enfermedad, se asegura que, a fecha de hoy, a pesar de que ningún fármaco cura la EA, sí se retrasa el deterioro. A este respecto, estos investigadores plantean iniciar el tratamiento con fármacos cuando el individuo todavía no cumple el criterio de diagnóstico de EA, es decir, cuando presenta deterioro cognitivo leve, ya que podría cambiar la evolución de la enfermedad, lo que para el paciente puede suponer alargar la autonomía y mejorar su calidad de vida1. No obstante, se precisan más investigaciones en este sentido para concluir datos más certeros.
Las investigaciones con tratamiento de estimulación cognitiva en estadios tempranos de la EA son más habituales y los resultados son esperanzadores, ya que algunos investigadores hablan de neurogénesis en los individuos que se mantienen física e intelectualmente activos47. Estudios recientes proponen tratamientos de psicoestimulación más ecológicos32,48, con el fin de que lleguen a mayor número de población. Consideramos este tipo de propuesta muy acertada, si tenemos en cuenta que, con la edad disminuye la estimulación cognitiva49, y que la transición del envejecimiento normal a la EA parece ser continuo y no discreto50.
Entre las limitaciones del presente trabajo se encuentran el bajo número de participantes en cada grupo de intervención, así como las pérdidas ocurridas durante el seguimiento, aunque los resultados homogéneos apuntan a la consolidación de los resultados presentados.
Las investigaciones futuras deben dirigirse a estudiar la eficacia de los tratamientos combinados lo más tempranamente posible, sin esperar a que la demencia se haga explícita, y poder medir de modo objetivo lo que esto también supone para los cuidadores.
Este trabajo ha sido premiado en el XLVII Congreso Nacional de la Sociedad Española de Geriatría y Gerontología celebrado en Málaga del 8 al 11 de junio de 2005.
Correspondencia: Dr. T. Ortiz Alonso.
Departamento de Psiquiatría y Psicología Médica.
Facultad de Medicina. Pabellón 3. Universidad Complutense de Madrid. 28040 Madrid. España.
Correo electrónico: tortiz@med.ucm.es
Recibido el 16-11-2005; aceptado el 7-9-2006.