Determinadas sustancias (factores de crecimiento y hormonas) tienen propiedades osteoinductivas y añadidas a un biomaterial osteoconductivo aumentan sus propiedades de neoformación ósea.
MaterialesQuince conejos de la raza Nueva Zelanda.
Los biomateriales y factores utilizados fueron: cemento de fosfato tricálcico (Calcibon®), hormona de crecimiento humana y plasma rico en plaquetas PRP.
MétodoCada conejo fue intervenido en ambas tibias donde se le realizó un defecto de 6mm.
Los animales de experimentación se repartieron en los siguientes grupos:
- -
Grupo control (regeneración solo con TCP).
- -
Grupo PRP (regeneración con TCP+PRP).
- -
Grupo GH (regeneración con TCP+GH).
Todos los animales fueron sacrificados a los 28 días. Se valoró el aspecto del defecto crítico comprobando su relleno. Histológicamente valoramos la respuesta tisular, la presencia de tejido óseo neoformado, y el aspecto del biomaterial. Se realizó la morfometría con analizador de imágenes MIP 45. Usamos el test ANOVA para el estudio estadístico mediante el programa Statgraphics.
ResultadosEl aspecto macroscópico del defecto crítico, fue mejor en el grupo PRP y en el grupo GH que en el grupo control. Histológicamente se observó mayor neoformación ósea en los grupos PRP y GH.
El estudio morfométrico no detectó diferencias significativas en la neoformación ósea entre el grupo PRP y control. Se detectó mayor neoformación ósea en el grupo GH (p = 0,03) frente a los otros dos grupos.
ConclusiónLa GH facilita la regeneración ósea en defectos críticos, rellenos con cemento de fosfato cálcico, en el período de tiempo estudiado en conejos de Nueva Zelanda.
Many substances (growth factors and hormones) have osteoinduction properties and when added to some osteoconduction biomaterial they accelerate bone neoformation properties.
MaterialsThe materials included 15 New Zealand rabbits, calcium phosphate cement (Calcibon®), human growth hormone (GH), and plasma rich in platelets (PRP).
MethodsEach animal was operated on in both proximal tibias and a critical size bone defect of 6mm of diameter was made.
The animals were separated into the following study groups:
- -
Control (regeneration only by Calcibon®).
- -
PRP (regeneration by Calcibon® and PRP).
- -
GH (regeneration by Calcibon® and GH).
All the animals were sacrificed at 28 days. An evaluation was made of the appearance of the proximal extreme of rabbit tibiae in all the animals, and to check the filling of the critical size defect. A histological assessment was made of the tissue response, the presence of new bone formation, and the appearance of the biomaterial. Morphometry was performed using the MIP 45 image analyser. ANOVA statistical analysis was performed using the Statgraphics software application.
ResultsThe macroscopic appearance of the critical defect was better in the PRP and the GH group than in the control group. Histologically greater new bone formation was found in the PRP and GH groups.
No statistically significant differences were detected in the morphometric study between bone formation observed in the PRP group and the control group. Significant differences in increased bone formation were found in the GH group (p=0.03) compared to the other two groups.
ConclusionGH facilitates bone regeneration in critical defects filled with calcium phosphate cement in the time period studied in New Zealand rabbits.
Es una situación frecuente, en la clínica diaria, la necesidad de lograr una regeneración ósea en situaciones en las que la capacidad regenerativa espontánea del sujeto es insuficiente.
La mayoría de las lesiones óseas que presentan una cavidad son autorregenerables ya que su tamaño no alcanza el del llamado «defecto crítico». Se define como «defecto crítico» la dimensión de una cavidad cuyo cierre o regeneración no se produce de forma espontánea.
La formulación de las cerámicas de fosfatos de calcio como cementos óseos, ha permitido contar con nuevos materiales para la regeneración ósea, debido a que el producto de su proceso de reacción es, en la mayoría de los casos, una hidroxiapatita muy similar a la biológica.
Además de los sustitutos óseos, otra línea de investigación encaminada a facilitar la regeneración ósea es el desarrollo y utilización de diversos factores de crecimiento y hormonas.
Los factores de crecimiento más sencillos de aplicar por las características de su obtención son los del plasma rico en plaquetas (PRP)1.
Las plaquetas transportan los factores de crecimiento plaquetarios2: «platelet derived growth factor» y el «vascular endothelial growth factor», además de «transforming growth factor-beta» y «bone sialoprotein».
Por otro lado, y con respecto al papel de las hormonas en la regeneración ósea, se ha puesto de manifiesto en numerosos estudios la relación entre la hormona de crecimiento (GH) y el metabolismo óseo. En efecto, una acción importante de la hormona de crecimiento a nivel óseo se centra sobre las células formadoras de hueso3. El aumento en la proliferación de los osteoblastos llevado a cabo por la GH, se traduciría en la aparición de un mayor número de estas células a nivel del defecto crítico, y la diferenciación celular temprana aceleraría notablemente la síntesis y la mineralización de la matriz osteoide. Todo ello favorecería el proceso de regeneración ósea en el defecto crítico.
A pesar del amplio arsenal de injertos y sustitutos óseos, hoy en día, sigue sin haberse resuelto totalmente el problema de la consecución de una regeneración ósea absolutamente satisfactoria tras la utilización de los mismos.
Este trabajo es un paso más hacia la búsqueda de nuevos métodos que consigan la regeneración ósea total en situaciones de cavidades óseas con defecto crítico.
Materiales y metodologíaMaterialesPara la realización de este trabajo y como animales de experimentación se utilizaron 15 conejos de la raza Nueva Zelanda, sanos, machos y adultos de entre 8 y 12 meses, procedentes del Centro de Experimentación Animal de la Facultad de Medicina de la Universidad de Alcalá que cumple la normativa nacional e internacional sobre experimentación animal.
Los animales se mantuvieron vivos y en estado de buena salud hasta transcurridos los 28 días después de la intervención, con acceso directo a agua y comida ad libitum.
Instrumental quirúrgico: se utilizó el instrumental habitual para intervenciones quirúrgicas sobre tejido óseo. Se utilizó un contraángulo acoplado a motor quirúrgico con sistema de irrigación y una fresa trefina de 6mm de diámetro adaptada al contraángulo.
Se han utilizado los siguientes productos:
- A.
Cemento de fosfato tricálcico (Calcibon®): es un cemento basado en fosfato cálcico. Se presenta separado en dos componentes: polvo y líquido. Al realizar la mezcla, en el momento de la intervención quirúrgica, se forma carbonato cálcico fosfato apatito, formado por cristales de pequeño tamaño parecidos a la fase inorgánica del tejido óseo.
- B.
Hormona de crecimiento. Norditropin Simplex® 15mg/1,5ml. Contiene una hormona de crecimiento humana biosintética, denominada somatropina, idéntica a la hormona de crecimiento humana.
- C.
PRP. Procedente de la sangre del propio animal y obtenido según el método específico descrito más tarde.
Material histológico y morfométrico:
- A.
Equipo de corte histológico: EXAKT® Cutting Grinding System (Exakt Apparatebau, Nordersted, Alemania) para tejidos duros, formado por sierra de diamante y pulidora con discos de granos de distintos diámetros.
- B.
Soluciones de tinción histológica.
- C.
Software de imagen bidimensional para estudio cuantitativo de las muestras (MIP-45).
- D.
Microscopio óptico y cámara óptica convencional para estudio histológico.
- E.
Material morfométrico: microscopio óptico, sistema informático y aplicación informática para MIP-45.
- F.
Software para estudio estadístico Statgraphics plus v. 5.1.
Los animales, se repartieron en tres grupos:
- •
Grupo control, formado por 5 animales en los que se utilizó solamente fosfato tricálcico como material de relleno del defecto creado en la metáfisis tibial.
- •
Grupo PRP, formado por 5 animales utilizando como material de relleno fosfato tricálcico bañado con PRP.
- •
Grupo GH, formado por 5 animales utilizando como material de relleno fosfato tricálcico bañado con hormona de crecimiento.
A. Técnica quirúrgica:
- -
La anestesia de todos los animales de experimentación fue realizada mediante clorhidrato de ketamina a dosis de 5mg/kg de peso.
- -
Preparación de PRP: El grupo PRP, formado por 5 animales, requería la obtención de plasma rico en plaquetas, previo a la intervención quirúrgica. Para conseguir PRP de cada animal se siguió la técnica descrita por Anitua et al.4.
- -
Preparación del fosfato tricálcico (Calcibon®):
Para preparar el fosfato tricálcico se mezclan los componentes sólido y líquido del mismo. Se disuelven 3,3 g de polvo en 1 cc. de líquido de Calcibon®, se mezcla durante un minuto y se esperan 4 minutos antes de colocarlo en defecto óseo.
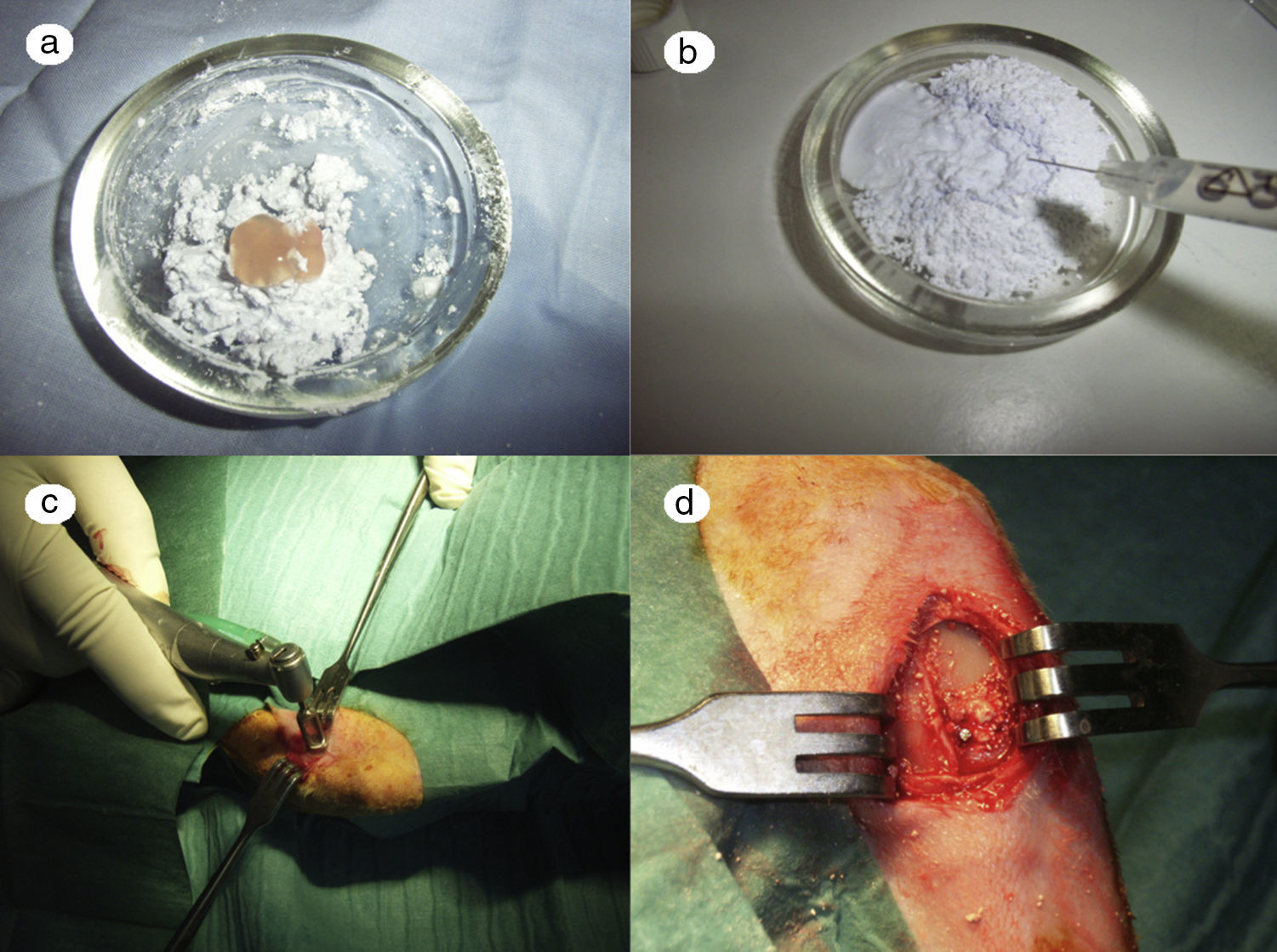
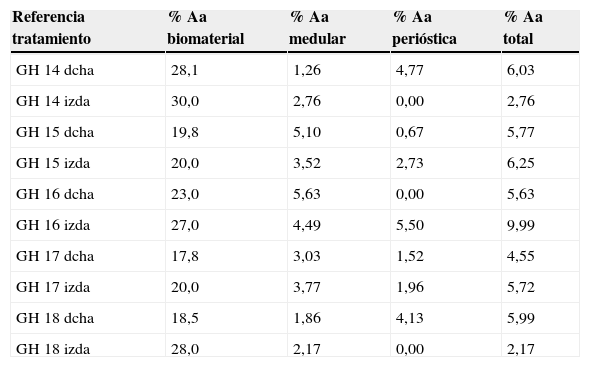
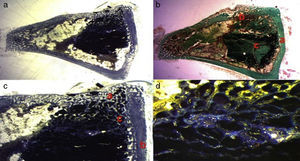
En el caso del grupo PRP, el material de relleno se realizó mezclando cemento de fosfato tricálcico con 1 cc. de PRP (fig. 1a) y realizando la mezcla durante un minuto.
En el caso del grupo GH, se utilizó como material de relleno fosfato tricálcico bañado con hormona de crecimiento (fig. 1b), se añadieron 4 UI de hormona de crecimiento.- Preparación del defecto óseo: cada conejo fue intervenido en ambas tibias sucesivamente realizando sendos defectos óseos. Ambos defectos se trataron con el mismo tipo de relleno en las dos tibias según el grupo experimental al que perteneciese el animal (control, PRP o GH).
Tras rasurar la zona operatoria sobre la tibia, se procedió a la desinfección de la superficie cutánea mediante povidona yodada. A continuación, se practicó una incisión sagital, de unos 4cm, a nivel de la cara interna en el extremo proximal de la tibia, separando cuidadosamente el periostio y exponiendo el hueso. Se realizó un defecto circular experimental mediante una fresa trefina de 6mm de diámetro montada en contraángulo (fig. 1c). Se eligió esa zona basándonos en la bibliografía previa, ya que la región metafisaria responde más intensamente a los estímulos que la diáfisis tibial5.
Los defectos óseos se rellenaron posteriormente solo con fosfato tricálcico, o con este y PRP o GH, según el grupo experimental (fig. 1d). La intervención se llevó a cabo en las dos extremidades del animal.
La zona del defecto rellenado se marcó con aguja de Kirschner de 1,2×4mm., para identificarla posteriormente en el estudio histológico (fig. 1d).
Por último, se suturó cuidadosamente el periostio con sutura reabsorbible y la piel con seda.
Obtención de las muestras de estudio: todos los animales fueron sacrificados a los 28 días de la cirugía mediante inyección letal de barbitúricos (pentotal sódico).
B. Estudio macroscópico: el estudio macroscópico valoró el aspecto de la región proximal de la tibia de los animales una vez disecadas las partes blandas. Se valoró el aspecto de la porción proximal de la tibia en los 3 grupos de experimentales, comprobando el relleno del defecto crítico en todos los animales.
C. Estudio de microscopía óptica
Una vez obtenidas las tibias se fijaron en formol al 5% previamente tamponado a pH 7 para evitar la descalcificación. Posteriormente, las muestras se procesaron en la Unidad de Anatomía y Embriología Humana de la Facultad de Medicina de la Universidad de Alcalá, donde se continuó el control de su fijación en formol.
A continuación se estudió la regeneración ósea desde el punto de vista histológico e histomorfométrico en muestras de tejido óseo sin descalcificar. Para ello se utilizó el sistema de corte y pulido Exakt®.
El siguiente paso lo constituyó la inclusión de la muestra en un polímero. Se obtuvo así un bloque de metacrilato con las tibias incluidas. A continuación, se cortaron las muestras con la banda de corte diamante del sistema Exakt®, obteniéndose 5 cortes por muestra para su posterior estudio histológico. Los cortes se realizaron perpendiculares al eje longitudinal de la diáfisis tibial, siguiendo un plano transversal, para poder valorar toda la cavidad, desde la profundidad hasta la zona superficial de la misma.
Se utilizaron las tinciones habituales para el estudio del tejido óseo en el laboratorio:
- -
Tricrómico de Masson.
- -
Hematoxilina-eosina.
- -
Azul de toluidina.
Se valoraron las siguientes variables histológicas:
- •
Tejido óseo maduro: se caracteriza porque su matriz ósea (sustancia intersticial mineralizada) se organiza formando lamelas o laminillas óseas de 3 a 7μm de espesor. Las células del hueso maduro son los osteocitos y ocupan unos espacios denominados lagunas, dispuestos, al igual que las laminillas, de manera concéntrica.
- •
Las láminas son paralelas y concéntricas.
- •
Tejido óseo neoformado: contiene una proporción de osteocitos relativamente más alta, con lagunas de tamaño más grandes que las que aparecen en el hueso maduro y las fibras de colágeno siguiendo varias direcciones.
- •
Cantidad y el aspecto del biomaterial (cemento de fosfato cálcico): también se estudió histológicamente el aspecto que presentaba el biomaterial colocado dentro de cavidad realizada de forma experimental en la tibia.
- •
Respuesta del tejido óseo al biomaterial: se buscaron signos de reacción inflamatoria como puede ser la aparición de linfocitos o células de cuerpo extraño. Por último, investigó la posible existencia de signos de reacción alérgica, como es la presencia de eosinófilos.
D. Estudio morfométricoDespués del estudio histológico cualitativo se realizó el análisis cuantitativo mediante morfometría bidimensional.
Este nos permitió cuantificar de forma objetiva la fracción de tejido óseo neoformado que se regeneró en las cavidades de los distintos grupos. Para ello, recurrimos a la utilización de un software, analizador de imágenes, llamado MIP-45.
D.1. Técnica de estudio:
Como estimador de medida, se utilizó una plantilla de puntos, diseñada de tal modo que cada punto tiene un área asociada de 1mm2. El recuento de los puntos de impacto nos permitió obtener los valores de nuestras variables.
D.2. Variables del estudio histomorfométrico. Para la obtención de las variables de estudio, precisamos calcular previamente, las siguientes áreas:
- 1.
Área total de la muestra: incluye el área ocupada por todo el hueso, y el área ocupada por la cavidad medular.
- 2.
Área del hueso cortical.
- 3.
Área de hueso neoformado que subdividimos en:
- a.
Área de hueso neoformado dentro de la cavidad medular.
- b.
Área de hueso neoformado fuera de la cavidad medular.
- a.
- 4.
Área ocupada por el biomaterial remanente.
Una vez calculadas las áreas anteriores, las variables de estudio fueron determinadas en las cinco secciones o cortes obtenidos de la tibia de cada animal. Estas variables fueron las siguientes:
- 1.
Densidad de área del biomaterial remanente (% Aa biomaterial):área biomaterialárea total×100
- 2.
Densidad de área de neoformación ósea en la cavidad medular (% Aa medular):área de neoformación ósea en la cavidad medularárea total×100
- 3.
Densidad de área de neoformación ósea fuera de la cavidad medular (% Aa perióstica):área de neoformación ósea fuera de la cavidad medularárea total×100
- 4.
Densidad de área de neoformación ósea total (% Aa total):área de neoformación ósea dentro+área de neoformación ósea fueraárea total×100
D.4. Estudio de la fiabilidad del método. Para comprobar el grado de fiabilidad con el que se va a establecer la morfometría, se realizó un estudio piloto previo para muestras dependientes, con el objetivo de valorar la exactitud del estimador o sonda (unidad de medición) utilizado, a través del cálculo del coeficiente de error para esa sonda. Dicho estudio, permitió diseñar una sonda de medición para las muestras, que consistió en una plantilla de puntos con 1mm2 de área asociada al punto.
El estudio de fiabilidad, su cálculo y metodología fueron los siguientes:
Cálculo de la fiabilidad del muestreo para muestras dependientes: cortes paralelos entre sí, perpendiculares al eje longitudinal de la muestra (cortes Cavalieri): el coeficiente de error, es un concepto estadístico, que nos permite conocer el grado de precisión del estimador utilizado. Su valor dependerá del número de unidades de muestreo y del tamaño del estimador (es decir, de la distancia entre los puntos de la plantilla medidora). Este dato nos permitirá conocer cuál es el valor mínimo que necesitamos de cortes de una misma muestra, así como la distancia mínima entre los puntos utilizados para su medición, de manera que los datos obtenidos utilizando estas dos constantes nos permita realizar un cálculo estadístico fiable.
E. Estudio estadístico: se valoraron las diferencias significativas entre los grupos del estudio mediante el análisis de la varianza (ANOVA) utilizando el programa Statgraphics versión 5.1.
Resultados- I.
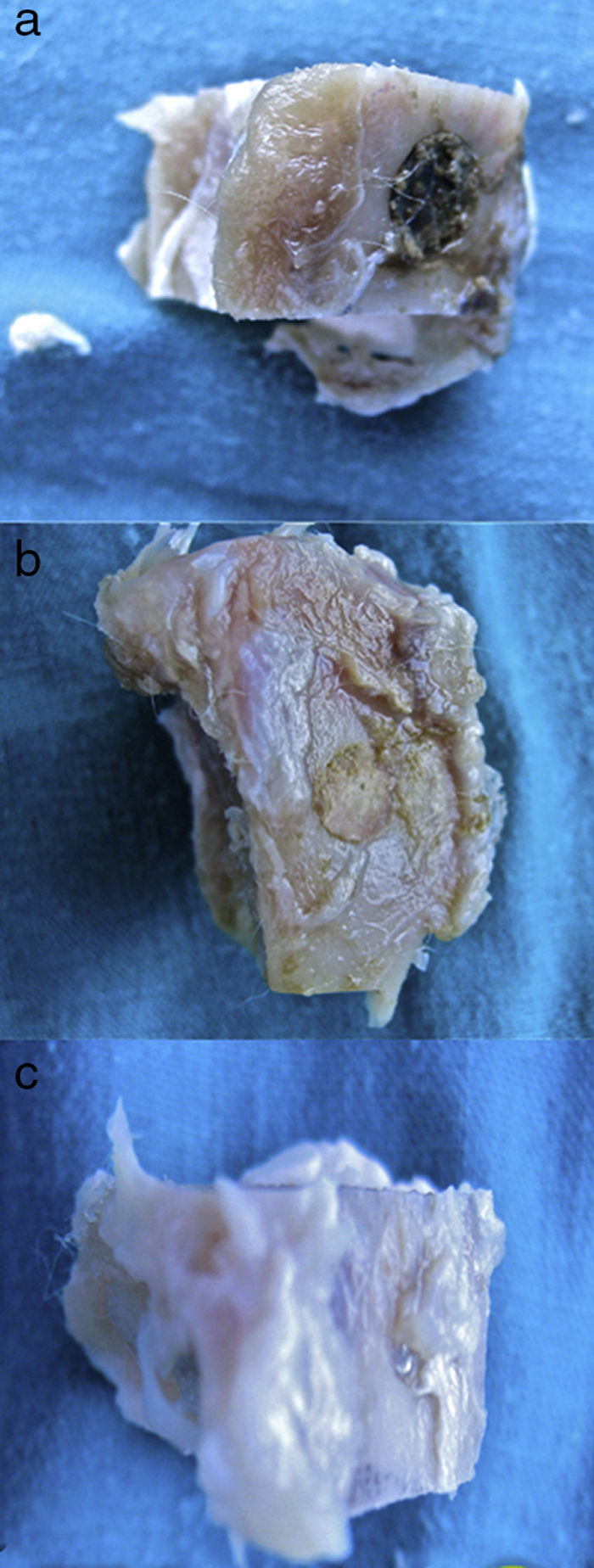
Resultados macroscópicos: se realizó un reconocimiento de la zona intervenida en las tibias 28 días antes.
- 1.
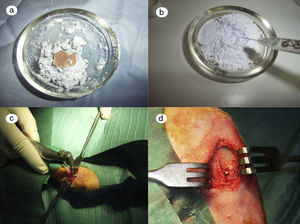
En el grupo control (fig. 2a) las muestras no presentaban aspecto de integración del cemento de fosfato cálcico colocado en la intervención. Claramente se diferenciaban la zona del defecto crítico, el cemento aparecía como una masa amorfa que rellenaba el defecto sin ningún tipo de integración.
- 2.
En el grupo PRP (fig. 2b), por un lado, se observaba buen relleno del defecto crítico y, por otro, el cemento daba la impresión de haber producido mejor integración ósea que en el grupo control.
- 3.
Al observar el defecto crítico realizado en la tibia de los conejos operados del grupo GH (fig. 2c), macroscópicamente el relleno parecía mejor osteointegrado y era difícil diferenciar el tejido óseo del defecto rellenado. En la figura 2c se observa la zona del defecto crítico, marcada con aguja de Kirschner, que difícilmente se diferencia del resto de la cortical.
- 1.
- II.
Resultados histológicos: el estudio histológico nos permitió valorar y comparar histológicamente la formación de tejido óseo y la presencia de biomaterial dentro del defecto crítico entre los 3 grupos estudiados. En los cortes transversales se observó el hueso maduro, el hueso inmaduro, el biomaterial residual, la aguja de Kirshner, que nos sirvió para marcar el defecto óseo crítico, así como la presencia de tejido conjuntivo y de médula ósea.
- 1.
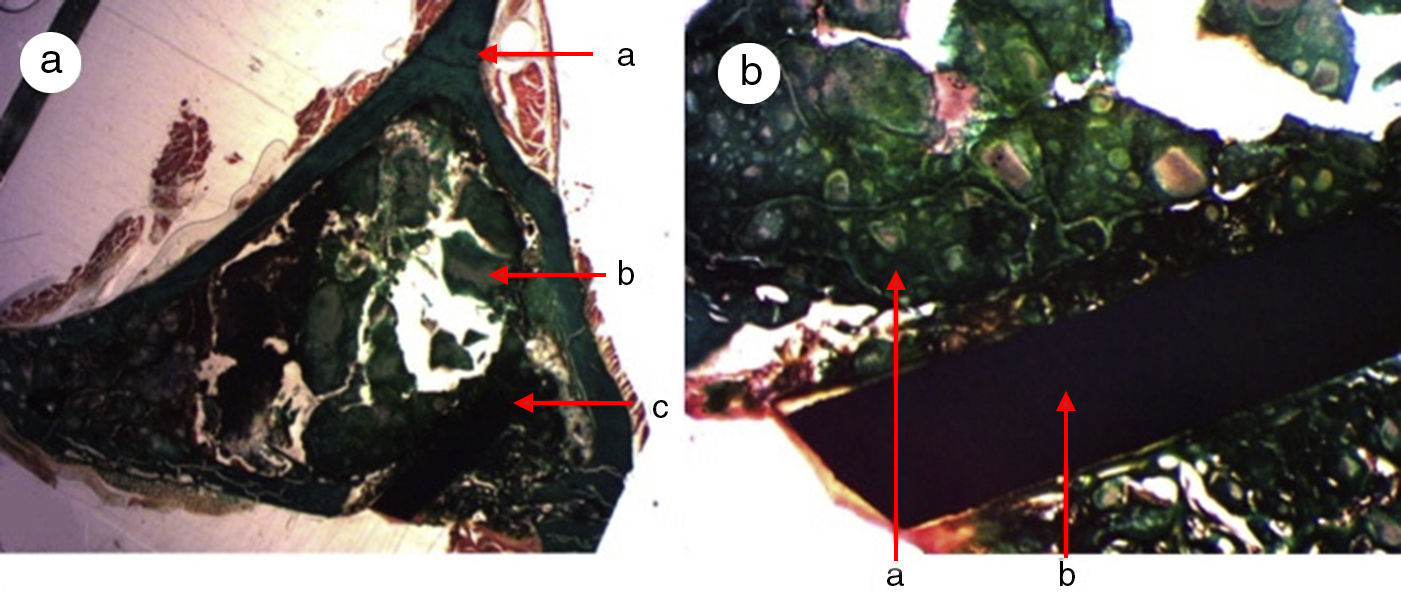
En el grupo control (a-b) se observaron una gran cantidad de partículas del fosfato tricálcico (Calcibon®) repartidos por todo el área de la muestra, teñidos pálidamente por la hematoxilina, con un tono verdoso en las preparaciones de tricrómico de Masson y con un aspecto grisáceo en las preparaciones de azul de toluidina.
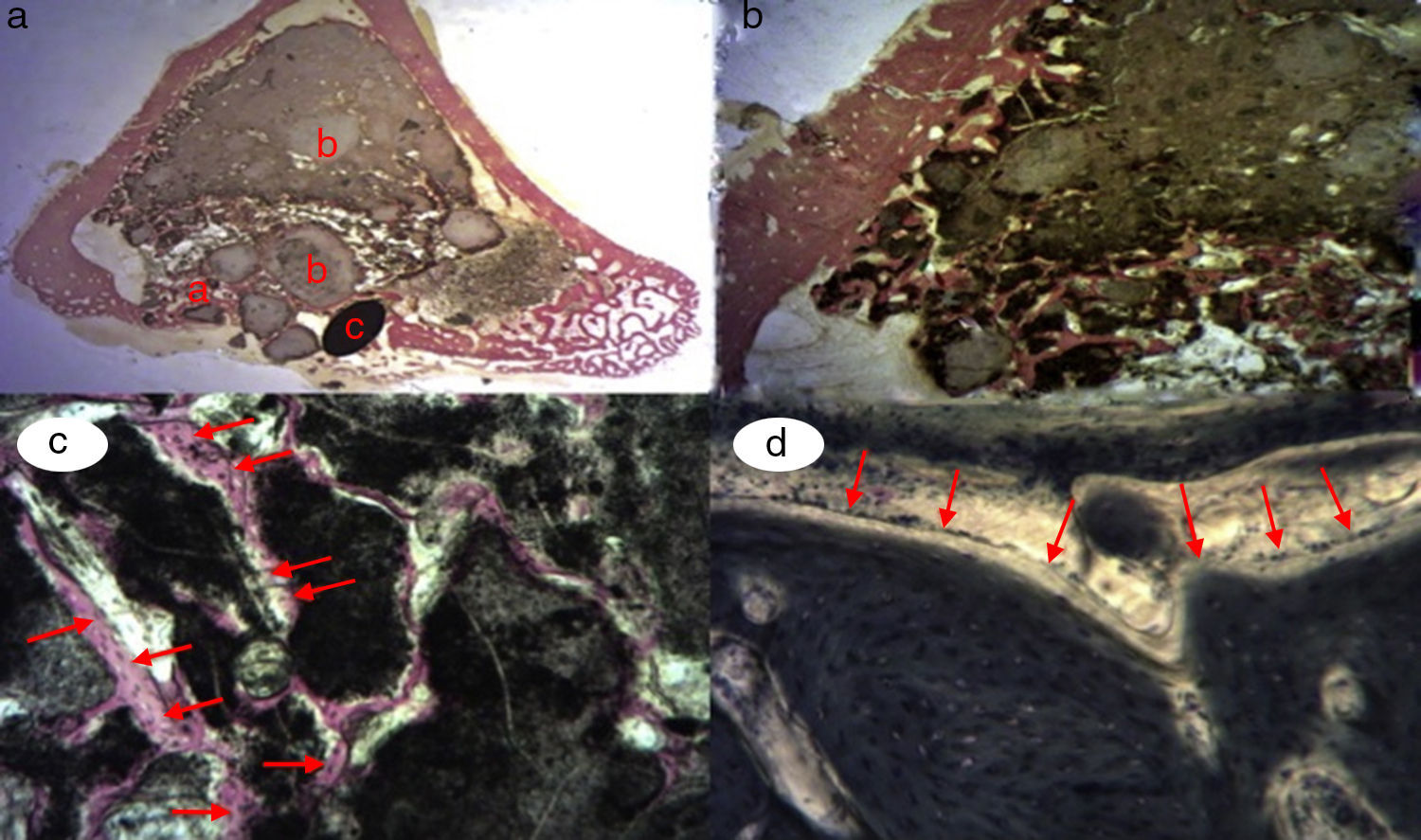
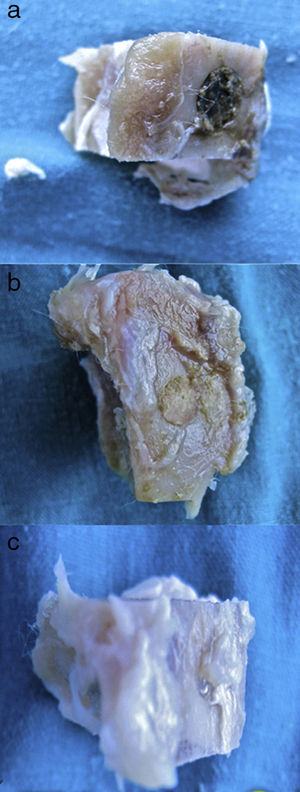
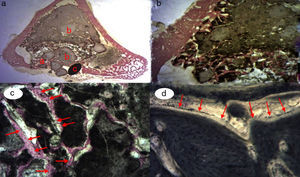
Figura 3.Histología grupo control. a) Conejo grupo control 15 aumentos. Corte transversal tinción de tricrómico de Masson. Aspecto general. Se diferencia el tejido óseo de la cortical (a), el cemento de fosfato cálcico que rellena el canal medular (b) y el defecto crítico cortical marcado con aguja de Kirschner (c). b) Conejo grupo control 30 aumentos. Tinción de tricrómico de Masson. Aguja de Kirschner utilizada como marcador (a), rodeado de biomaterial (b) en la zona del defecto crítico. No se observa formación de tejido óseo.
(0,15MB).Se observó escasa actividad de neoformación, con algunas trabéculas jóvenes, cortas y aisladas, cercanas a la superficie externa e interna de la cortical, así como entre las partículas del cemento cálcico. No se encontraron osteoblastos ni osteoclastos.
- 2.
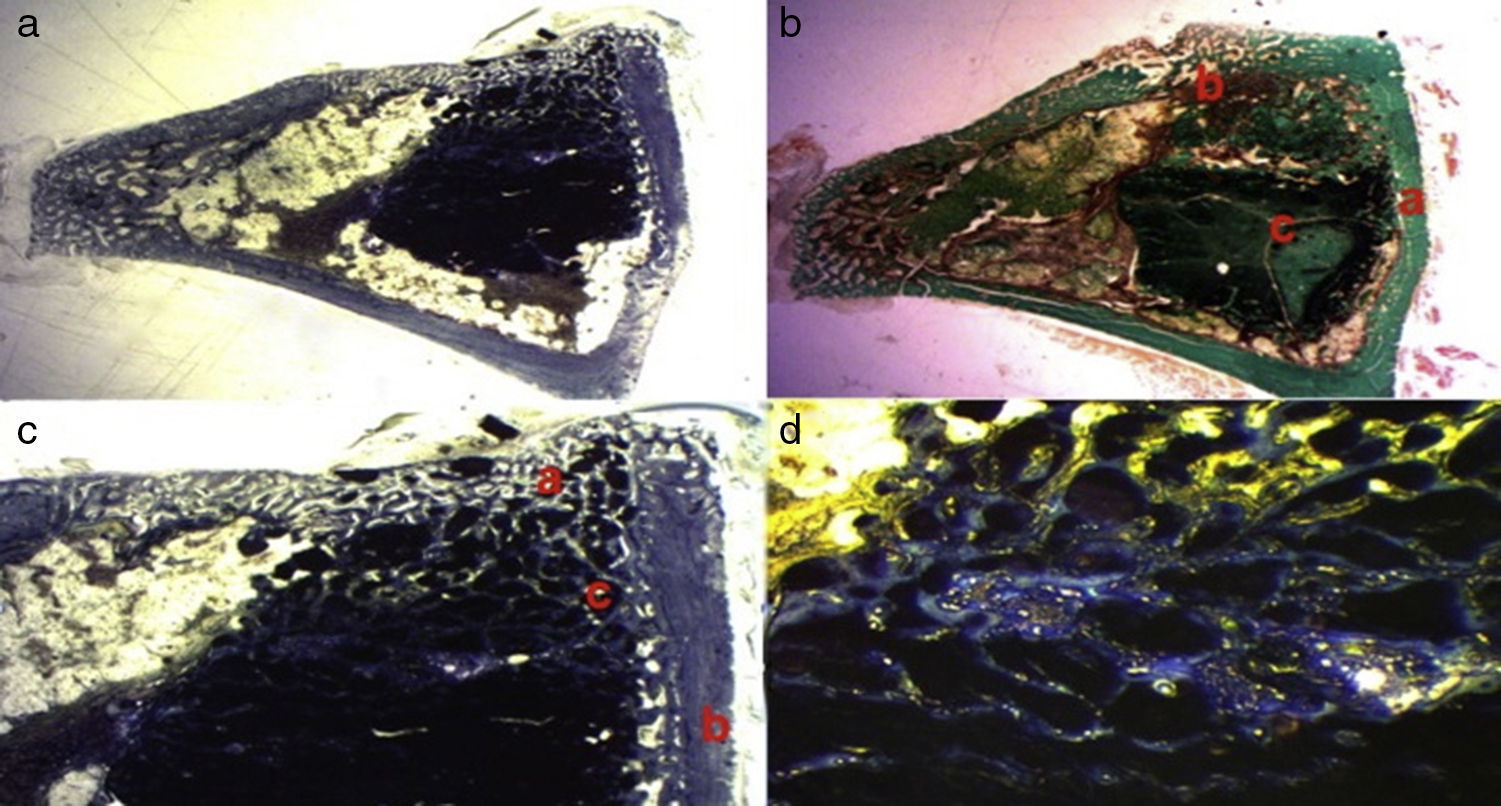
En el grupo PRP (relleno de cemento de fosfato cálcico+PRP) (figs. 4a-d) se observó mayor formación de tejido óseo inmaduro rellenando, tanto el defecto crítico, como los espacios entre las partículas del biomaterial en comparación con el grupo control. No se encontró tejido inflamatorio y solo escaso tejido conjuntivo. El fosfato tricálcico se presentaba como masa amorfa y no observamos actividad osteoclástica.
Figura 4.a) Corte transversal. Tinción tricrómico de Masson. Aspecto global de fosfato cálcico+PRP: se observa mayor formación ósea en la zona del defecto crítico y entre las partículas del cemento cálcico. b) Conejo grupo PRP, 30 aumentos. Al doble de aumento que en la imagen anterior. (a) Hueso neoformado (inmaduro) rellenando el defecto. (b) Hueso maduro de la cortical. (c) Hueso entre las partículas del biomaterial. c) Conejo grupo PRP 15 aumentos. Corte transversal. Tinción de Masson. Aspecto general: (a) cortical, (b) hueso neoformado y (c) biomaterial. d) Conejo grupo PRP, 30 aumentos. Hueso inmaduro entre las partículas del fosfato cálcico. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
(0,23MB). - 3.
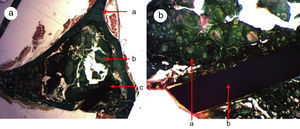
En el grupo GH (relleno de cemento de fosfato cálcico+GH) (figs. 5a-d), se observó el mayor grado de neoformación ósea en forma de tejido óseo inmaduro en comparación con los cortes histológicos del grupo control y grupo PRP. Se evidenciaron numerosas trabéculas óseas entre las partículas de biomaterial. Cabe destacar que la formación del tejido óseo era mayor en el defecto y dentro del canal medular en comparación con los cortes del grupo control y PRP. Estas observaciones sugieren mayor actividad osteoblástica debido al efecto de la GH en este grupo. No se observó actividad osteoclástica ni tejido inflamatorio.
Figura 5.Histología grupo GH. a) Conejo grupo GH, 15 aumentos. Imagen general tinción hematoxilina eosina. (a) tejido óseo neoformado entre las partículas del biomaterial (b) en la zona del defecto cortical, marcado con aguja de Kirschner (c). b) Conejo grupo GH, 30 aumentos. Tinción hematoxilina eosina. Tejido óseo neoformado en contacto con biomaterial. c) Conejo grupo GH, 60 aumentos. Tejido óseo neoformado (flechas) en contacto con el biomaterial (fosfato tricálcico+GH). d) Conejo grupo GH, 100 aumentos. Tinción azul toluidina. Frente de osteoblastos (flechas). El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
(0,23MB).
- 1.
- III.
Resultados morfométricos: una vez confirmada la fiabilidad del estudio se obtuvieron los resultados de las variables propuestas (tablas 1–3).
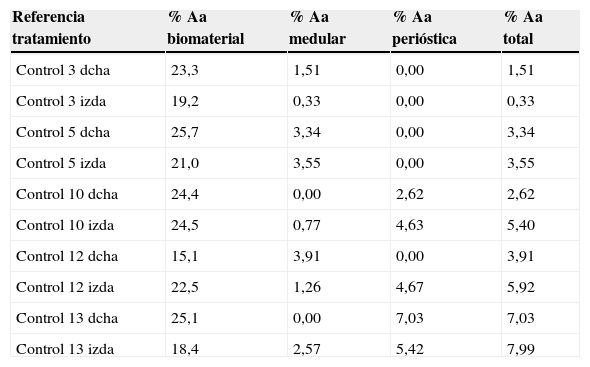
Tabla 1.Resultados de la morfometría grupo control
Referencia tratamiento % Aa biomaterial % Aa medular % Aa perióstica % Aa total Control 3 dcha 23,3 1,51 0,00 1,51 Control 3 izda 19,2 0,33 0,00 0,33 Control 5 dcha 25,7 3,34 0,00 3,34 Control 5 izda 21,0 3,55 0,00 3,55 Control 10 dcha 24,4 0,00 2,62 2,62 Control 10 izda 24,5 0,77 4,63 5,40 Control 12 dcha 15,1 3,91 0,00 3,91 Control 12 izda 22,5 1,26 4,67 5,92 Control 13 dcha 25,1 0,00 7,03 7,03 Control 13 izda 18,4 2,57 5,42 7,99 Tabla 2.Resultados de la morfometría grupo PRP
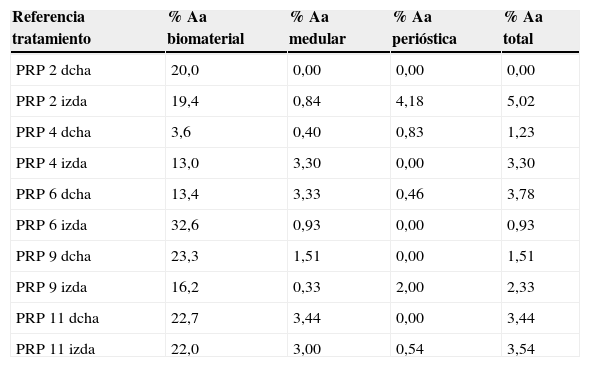
Referencia tratamiento % Aa biomaterial % Aa medular % Aa perióstica % Aa total PRP 2 dcha 20,0 0,00 0,00 0,00 PRP 2 izda 19,4 0,84 4,18 5,02 PRP 4 dcha 3,6 0,40 0,83 1,23 PRP 4 izda 13,0 3,30 0,00 3,30 PRP 6 dcha 13,4 3,33 0,46 3,78 PRP 6 izda 32,6 0,93 0,00 0,93 PRP 9 dcha 23,3 1,51 0,00 1,51 PRP 9 izda 16,2 0,33 2,00 2,33 PRP 11 dcha 22,7 3,44 0,00 3,44 PRP 11 izda 22,0 3,00 0,54 3,54 Tabla 3.Resultados de la morfometría grupo GH
Referencia tratamiento % Aa biomaterial % Aa medular % Aa perióstica % Aa total GH 14 dcha 28,1 1,26 4,77 6,03 GH 14 izda 30,0 2,76 0,00 2,76 GH 15 dcha 19,8 5,10 0,67 5,77 GH 15 izda 20,0 3,52 2,73 6,25 GH 16 dcha 23,0 5,63 0,00 5,63 GH 16 izda 27,0 4,49 5,50 9,99 GH 17 dcha 17,8 3,03 1,52 4,55 GH 17 izda 20,0 3,77 1,96 5,72 GH 18 dcha 18,5 1,86 4,13 5,99 GH 18 izda 28,0 2,17 0,00 2,17 - IV.
Resultados estadísticos de los datos morfométricos: utilizando el software Statgraphics 5.1., aplicamos el test ANOVA buscando diferencias estadísticamente significativas entre los tres grupos de estudio:
- 1.
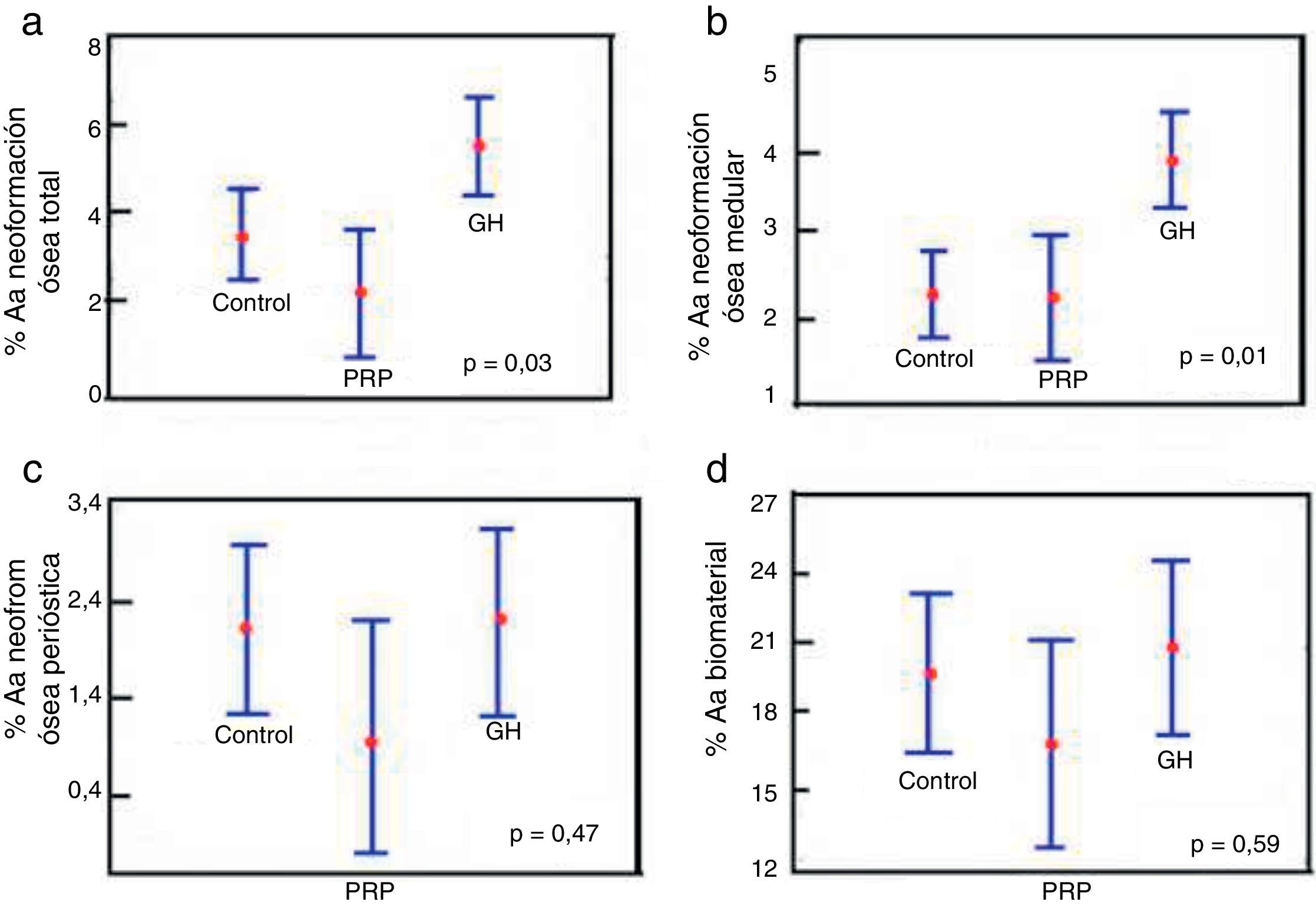
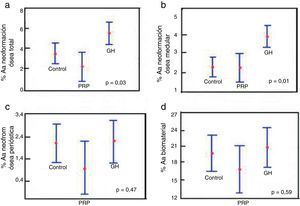
Comparación de % Aa total entre los grupos control, PRP y GH: en cuanto al hueso neoformado total en los grupos control, PRP y GH, encontramos valores porcentuales claramente mayores en el grupo GH (p<0,05), (fig. 6a).
Figura 6.Resultados estadísticos del estudio morfométrico. a) ANOVA de la densidad de área de neoformación ósea total. b) ANOVA de la densidad de área de neoformación ósea en la cavidad medular. c) ANOVA de la densidad de área de neoformación ósea fuera del canal medular. d) ANOVA de la densidad de área del biomaterial persistente.
(0,18MB). - 2.
Comparación de % Aa medular entre los grupos control, PRP y GH: encontramos mayor neoformación ósea dentro del conducto o cavidad medular en el grupo GH en comparación con el grupo control y el grupo PRP, siendo la diferencia estadísticamente significativa (p<0,05). Este resultado demuestra que la GH tiene efecto positivo sobre la neoformación ósea en comparación con PRP (fig. 6b).
- 3.
Comparación % Aa perióstica entre los grupos control, PRP y GH: no encontramos grandes diferencias en el valor porcentual de hueso neoformado fuera del defecto relleno comparando los grupos control, PRP y GH. Esto podría ser explicado por la técnica quirúrgica realizada, en la que se ha llevado a cabo el cierre perióstico a través de la sutura en todos los animales, por lo que no habría salido ningún factor de crecimiento u hormona fuera del periostio. Esto justificaría que la neoformación ósea sea similar en los tres grupos (fig. 6c).
- 4.
Comparación % Aa biomaterial entre los grupos control, PRP y GH: no se encontraron diferencias significativas en el porcentaje de biomaterial entre el grupo de control, PRP y GH. En el plazo estudiado de 28 días, no parece haberse activado el proceso de reabsorción del cemento de fosfato cálcico (fig. 6d).
- 1.
A/. Especie de animal:
Se eligió el conejo como modelo experimental porque alcanza la «madurez esquelética» en torno a los 8-10 meses y ostenta un verdadero remodelado cortical con un «turnover óseo» más acelerado que el de otras especies6. Esto lo convierte en un modelo apropiado para el estudio de fármacos que regulan dicho remodelado. El modelo más idóneo lo constituyen algunas especies de primates, pero la investigación con estos modelos es costosa, laboriosa y no exenta de riesgos6.
La localización elegida con mayor frecuencia es la tibia del animal por su facilidad de acceso7,8.
B/. Influencia del sexo: la utilización de machos en nuestro estudio se fundamenta en que no están sujetos a cambios cíclicos hormonales. Pensamos que la utilización de hembras podría aumentar la variabilidad de los resultados9.
C/. Influencia de la edad: en conejos se han descrito una serie de diferencias morfológicas que pueden explicar una intensidad de regeneración menor en animales viejos10.
En nuestro trabajo se han utilizado animales de entre 8 y 12 meses de edad, cuyo crecimiento esquelético ha terminado. A esta edad los conejos ya no muestran la excelente calidad osteorregenerativa que exhiben con menos de 2 meses de vida11.
Zona y tamaño del defecto óseoLos estudios de la regeneración ósea en conejos se han realizado en diferentes localizaciones anatómicas: la mandíbula12, el fémur13, y la calvaria14 para valorar la reparación ósea después de un daño provocado.
La tibia ha sido utilizada por algunos autores15,16 para provocar defectos óseos. En particular, la tibia proximal, en su cara medial, tiene una situación anatomoquirúrgica susceptible para poder provocar defectos óseos, debido a que presenta una superficie amplia y ligeramente convexa, que no posee inserciones musculares. Más que de la localización anatómica, la reparación de los defectos óseos dependerá del tamaño del mismo17.
En la literatura, los defectos óseos tibiales más utilizados en conejos han sido los defectos de espesor cortical total con forma circular de 3, 6 y 8mm de diámetro14.
Hemos elegido utilizar defectos de 6mm, de acuerdo con autores como Katthagen et al.18 que consideran que estos defectos no regeneran espontáneamente.
Biomateriales utilizadosHistóricamente, se han utilizado autoinjertos, aloinjertos óseos además de una gran variedad de biomateriales para poder reparar defectos óseos.
El sustituto óseo ideal sería el que fuera biocompatible, biorreabsorbible, osteoconductivo, de estructura similar al hueso, de fácil utilización clínica y económicamente barato.
Entre los materiales de mayor interés para reconstruir defectos óseos se encuentran los biomateriales cerámicos, debido a sus reconocidas propiedades osteoconductivas, comprobada biocompatibilidad, capacidad de biodegradación, disponibilidad cuantitativamente ilimitada, aptitud para la vehiculización de fármacos y condiciones apropiadas para ser empleados como moldes para la ingeniería de tejidos. A este grupo pertenece el cemento de fosfato α-tricálcico19,20.
Sin embargo, tras repasar la literatura, no hemos encontrado estudios en los que se lleve a cabo una evaluación y comparación del efecto que producen la mezcla de cemento de fosfato cálcico con factores plaquetarios u hormona de crecimiento sobre la regeneración ósea espontánea, utilizando una metodología cuantitativa y un modelo de defecto óseo en animales.
Factores de crecimiento utilizadosA/. El PRP: el PRP se considera como un biomaterial regenerativo que favorece la circulación de las células madres, proliferación de fibroblastos y síntesis de colágeno tipo I21.
Nuestros resultados morfométricos no demostraron un efecto positivo de la PRP sobre la regeneración ósea. Coincidimos con trabajos de otros autores que tampoco han demostrado efecto positivo de la PRP sobre la regeneración ósea22.
Teniendo en cuenta el comprobado efecto positivo de los factores de crecimiento plaquetarios sobre los procesos de la regeneración ósea, parece ser que la causa de las diferencias entre los trabajos se debe a los distintos procedimientos de obtención de PRP utilizados por los autores. Se ha comprobado una gran variación de la concentración de factores de crecimiento según la metodología de obtención23.
En el futuro parece ser necesario protocolizar esta metodología para conseguir la concentración exacta de factores de crecimiento plaquetario necesaria para obtener un efecto óptimo sobre la regeneración ósea.
B/. Hormona de crecimiento: la GH estimula la producción de colágeno y de proteínas no colágenas por los osteoblastos; y, además, al estimular la síntesis de los factores de crecimiento semejantes a la insulina (IGF) por el hígado y los propios osteoblastos, favorece la diferenciación de los preosteoblastos y la proliferación de osteoblastos24,25.
El interés de estas acciones sobre el tejido óseo a nivel de defectos críticos radica en la posibilidad de la aplicación local de la GH a nivel clínico.
Los datos obtenidos en nuestro trabajo de investigación, con la aplicación local de GH, han mostrado diferencias histomorfométricas significativas entre el grupo control y el grupo GH. A los 28 días de la cirugía, la GH en una dosis de 4UI (1,2mg.), local aumentó significativamente los parámetros de osteorregeneración: la densidad de área de neoformación ósea en la cavidad medular.
En este sentido, coincidimos con los datos obtenidos por Blom y Tresguerres26,27.
En la bibliografía hemos encontrado referencias de la utilización de la GH28 como agente terapéutico, mediante aplicación sistémica, en tratamiento de fracturas. Todos los autores coinciden en su efecto positivo sobre la curación de las fracturas, no obstante, la mayoría han reportado efectos sistémicos adversos28,29. Sin embargo, hay pocos estudios sobre su utilización local, y los que se han encontrado, no informan de efectos sistémicos30. Este hecho podría justificar su interés clínico mediante su uso a través de aplicación local, con lo que se obtendrían los beneficios que esta hormona aporta a la curación de las lesiones óseas, y se evitarían los efectos secundarios que podría tener si se aplicara vía sistémica.
ConclusionesDe acuerdo con los resultados obtenidos de este estudio, se pueden extraer las siguientes conclusiones:
- 1.
El aspecto macroscópico del defecto crítico, tras su tratamiento, es mejor en el grupo con PRP y en el grupo con GH que en el grupo control.
- 2.
Histológicamente se observó neoformación ósea, tanto dentro del defecto como fuera del mismo, en los tres grupos.
- 3.
El estudio cuantitativo morfométrico no detectó, sin embargo, diferencias estadísticamente significativas entre la neoformación ósea habida en el grupo con PRP y el grupo control.
- 4.
Se detectaron diferencias estadísticamente significativas que indicaban mayor neoformación ósea en el grupo con GH frente a los otros dos grupos.
Conclusión final: la GH facilita la regeneración ósea en defectos críticos, rellenos con cemento de fosfato cálcico, en el período de tiempo estudiado en conejos de raza Nueva Zelanda.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.