Una artrodesis vertebral consiste en la combinación de un sistema de estabilización mecánica de 2 o más segmentos vertebrales con una sustancia biológica que promueva la osteogénesis, con el objetivo de conseguir la fusión permanente entre zonas más o menos extensas de dichos segmentos.
En una artrodesis vertebral, el aporte biológico por excelencia es el autoinjerto; sin embargo, su obtención genera una alta incidencia de morbilidad y, en casos de artrodesis de más de un espacio intervertebral, la cantidad disponible suele ser insuficiente. El tiempo de extracción e implantación prolonga la intervención quirúrgica, aumentando la exposición y riesgo a sangrado e infección. Por ello, actualmente hay una búsqueda de sustancias que posean las propiedades del autoinjerto evitando la morbilidad y tiempo de cirugía añadido que genera extraer el autoinjerto.
En este trabajo se estudia la interacción biomecánica-biología en la artrodesis vertebral.
Spinal arthrodesis consists of a combination of a system of mechanical stabilisation of one or more vertebral segments with a biological substance that promotes osteoneogenesis, with aim of achieving the permanent fusion between areas more or less the same size of these segments.
In spinal arthrodesis, the biological support par excellence is the autograft. However, obtaining this involves a high incidence of morbidity and, in cases of arthrodesis of more than one intervertebral space, the quantity available is usually insufficient. The extraction and implantation time prolongs the surgery, increasing the exposure to and risk of bleeding and infection. For these reasons, there is a search for substances that possess the properties of the autograft, avoiding the morbidity and added surgical time required to extract the autograft.
The biomechanical-biological interaction in vertebral arthrodesis has been studied in this article.
Técnicamente, una artrodesis vertebral consiste en la combinación de un sistema de estabilización mecánica de varios segmentos vertebrales con una sustancia biológica que promueva la osteogénesis, con el objetivo de conseguir la fusión permanente entre zonas más o menos extensas de dichos segmentos1–4. De hecho la artrodesis vertebral, una vez que se han decorticado las partes a fijar, se asemeja conceptualmente al tratamiento de múltiples focos de fractura sucesivos1,2 mediante un sistema de osteosíntesis integral que solidariza los fragmentos y utiliza los principios básicos de la osteosíntesis (fig. 1).
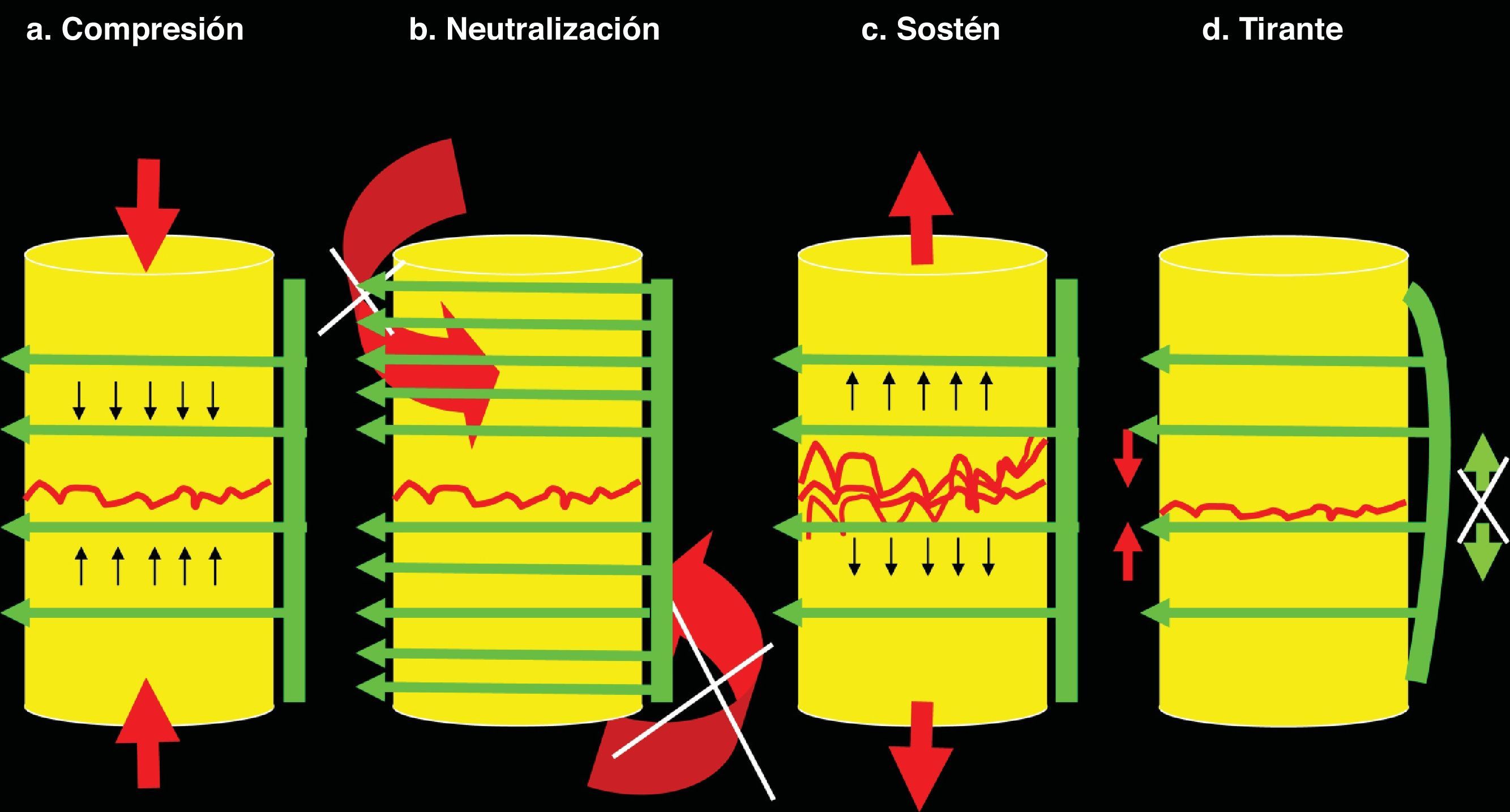
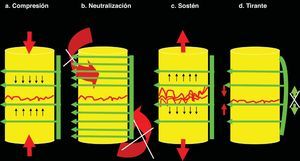
Principios básicos de la osteosíntesis. En cualquier osteosíntesis sea de hueso largo (diafisaria, epifisaria, metafisaria), corto o del raquis se aplican al menos uno de los 4 principios fundamentales de la osteosíntesis. 1a. Compresión. La compresión consiste en someter la fractura a fuerzas confluentes de vectores contrarios. Cuando hay un espacio considerable entre el fragmento superior e inferior –o entre un cuerpo vertebral superior e inferior (espacio intersomático)– se debe colocar un injerto tricortical que estará sometido a compresión (entre los 2 cuerpos vertebrales), pero que provocará sostén (a estos cuerpos vertebrales entre sí, evitando que se aproximen). Produce gran estabilidad, pero desaparece pasadas aproximadamente 3-4 semanas. Por ello hay que añadirle, al menos, neutralización. 1b. Neutralización. La neutralización previene las fuerzas rotatorias y tangenciales («cizallantes») que desplazan los fragmentos entre sí. Debe aplicarse tras los otros principios. No es posible aplicar compresión tras neutralización porque los fragmentos no progresan entre sí hasta unirse. La neutralización debe aplicarse siempre después de la compresión 1c. Sostén. El principio de sostén mantiene la altura de los fragmentos. Es aplicable en casos de fractura por conminuta en la osteosíntesis diafisaria o en casos de fractura por compresión del cuerpo vertebral tras mantener la altura mediante tracción posterior con un sistema pedicular. 1d. Tirante. El principio del tirante combina la compresión anterior sobre hueso (o injerto) con prevención de distracción posterior gracias al implante. El ejemplo más característico es el obenque de olecranon. Se aplica en el raquis cuando se realiza una artrodesis 360° con autoinjerto o sustituto intersomático más sistema pedicular posterior.
En la artrodesis posterolateral del raquis se conviene en coincidir que la instrumentación pedicular con autoinjerto es el sistema de osteosíntesis más estable, mientras que en la intersomática lo es la tutorización en sostén-neutralización mediante placas o barras solidarizadas a tornillos en los cuerpos vertebrales, junto con un elemento de estabilización intersomático a compresión-sostén, como un autoinjerto cortical1–3. Por tanto, junto al constructo mecánico es necesario un aporte biológico que consiga la fusión5 tisular ya que, de lo contrario, el material acaba rompiéndose por fatiga y el constructo fracasa. Más aún, la formación de hueso con fusión tisular de los elementos artrodesados debe poseer la suficiente robustez para aguantar la solicitación mecánica6, por ello en algunos casos se combina la fijación posterolateral con la anterior, lo que se conoce como artrodesis en 360° (figs. 2 y 3). De este modo, en cualquier acción terapéutica la planificación biomecánica y biológica deben ir juntas para que el objetivo del tratamiento se alcance con éxito1–3.
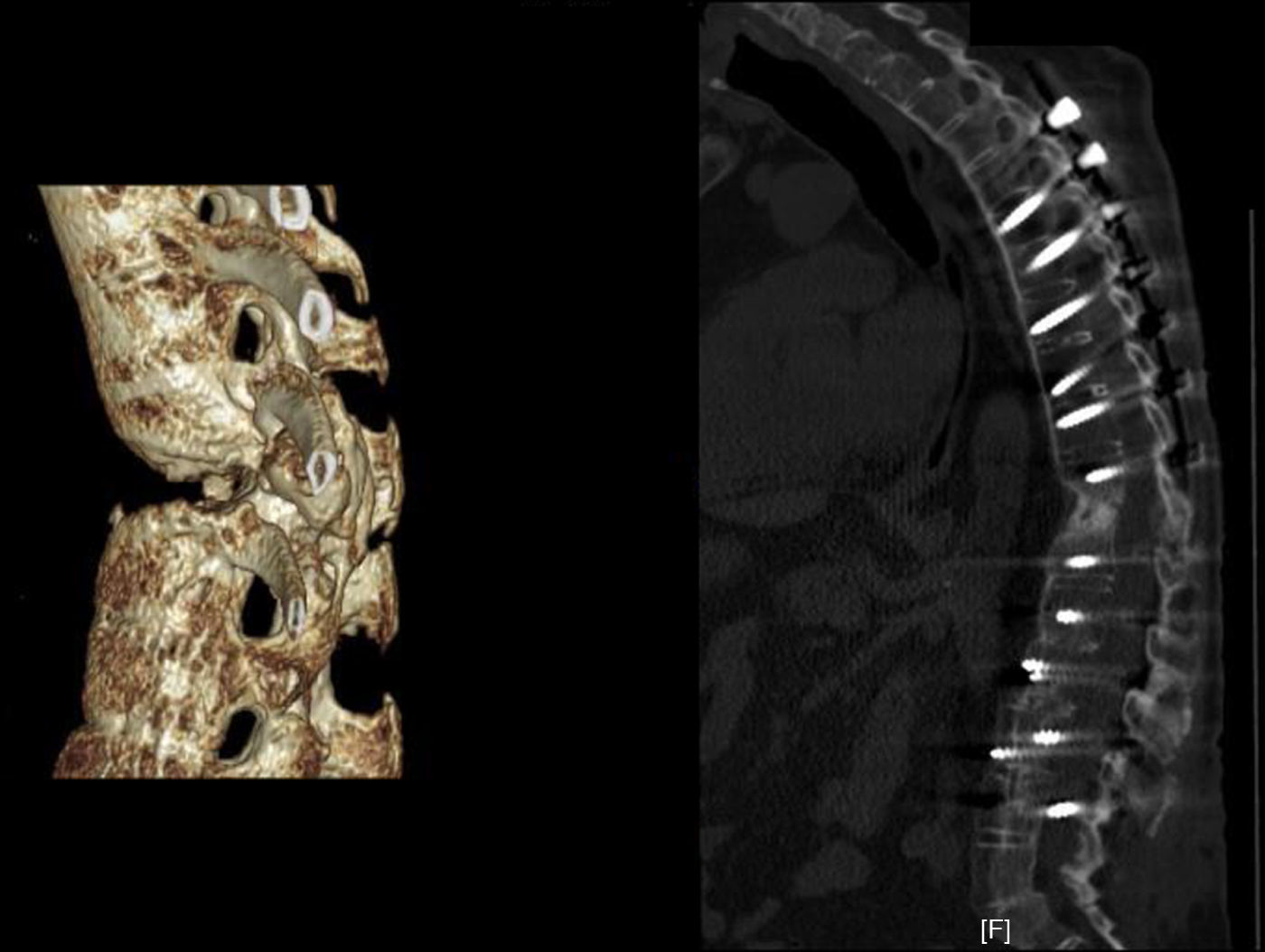
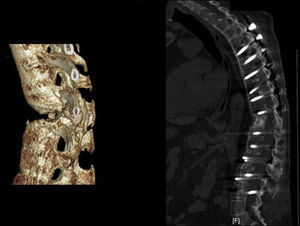
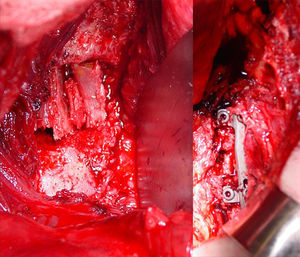
Aplicación del principio del tirante con aumento de la neutralización. 2a. Imagen de TC 3D de un paciente diabético con espondilitis anquilopoyética en tratamiento mediante hemodiálisis. 2b. Abordaje anterior con autoinjerto tricortical de cresta ilíaca intersomático por vía anterior combinado con instrumentación posterior. Se han extendido, a diferencia del caso anterior, el número de vertebras fijadas posteriormente debido a la porosis vertebral típica de esta enfermedad. El constructo biomecánico es estable porque comprime anteriormente pero sometido a fracaso posterior si se fijan pocos niveles debido al mal anclaje de los tornillos pediculares.
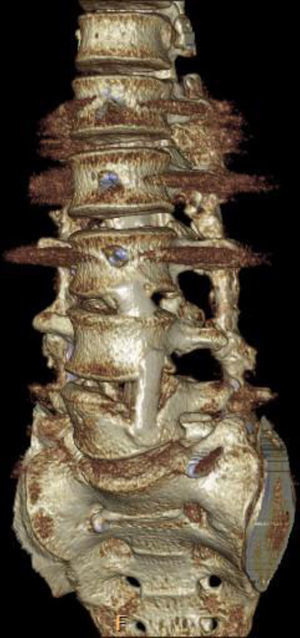
Aplicación del principio del tirante con autoinjerto de peroné. Principio del tirante aplicado en un paciente con tuberculosis a varios niveles lumbares. Autoinjerto de peroné intersomático que proporciona buen sostén con compresión interfragmentaria de los injertos entre los cuerpos vertebrales. Combinación con artrodesis mediante instrumentación pedicular posterior en 360°. Tras más de un año de seguimiento se aprecia fusión de los autoinjertos de peroné a los cuerpos vertebrales.
Algunos claros ejemplos de esto lo ofrecen la escoliosis, la espondilitis anquilopoyética (fig. 2) o la tuberculosis (fig. 3). En la escoliosis no es infrecuente la no consolidación posterolateral, con rotura de las barras de osteosíntesis, mucho más frecuente y precoz cuando se utilizaba una sola barra posterolateral que con el sistema pedicular actual de 2 barras; con todo, las roturas de los sistema actuales con 2 barras siguen apareciendo, si bien esto ocurre tras varios años en los que el material acaba rompiéndose por fatiga. En la espondilitis anquilopoyética, dado que el raquis actúa como una diáfisis, es necesario aplicar una instrumentación larga que aumente la neutralización, ya que los tornillos tienen un mal anclaje en unos cuerpos vertebrales que están poróticos y la solicitación mecánica en una instrumentación corta puede hacerla fracasar; este tipo de osteosíntesis es similar al necesario en una diáfisis cuando se aplica una placa de neutralización, dado que en el raquis el enclavamiento es técnicamente imposible. No obstante, la fusión espinal posterolateral tiene una peculiaridad puesto que en ella no se trata de reponer la anatomía original, sino de formar un puente óseo heterotópico donde anteriormente no existía hueso, lo que podría ser el origen del alto fracaso clínico observado7,8.
En una artrodesis vertebral el aporte biológico por excelencia es el autoinjerto; sin embargo, su obtención genera una alta incidencia de morbilidad y, en casos de artrodesis de más de un espacio intervertebral, la cantidad disponible suele ser insuficiente. Además, el tiempo extra que requiere su extracción e implantación hace que la intervención quirúrgica se prolongue, aumentando la exposición y riesgo a sangrado e infección. La búsqueda de sustancias que posean las propiedades osteogénicas del autoinjerto aparece ante la necesidad de aporte biológico para promover la formación terapéutica de hueso evitando los inconvenientes del autoinjerto.
A las sustancias alternativas al autoinjerto se les conoce comúnmente con el nombre de sustitutos óseos. Un sustituto es una sustancia que hace las veces de otra5, mientras que un sucedáneo una sustancia que, por tener propiedades parecidas a las de otra, puede reemplazarla5. La denominación de sustituto óseo vendría a concluir que consiste en una sustancia que, por tener sus propiedades, hace las veces del hueso, si bien como no existe ninguna sustancia que posea células vivas, característica fundamental del hueso, se puede afirmar que los sustitutos óseos no existen, lo que existen son sucedáneos que tienen algunas características del hueso, pero no la fundamental: las células6.
El aporte biológico, sea el autoinjerto o un mal llamado sustituto, debe poseer, idealmente, capacidades osteogénicas, capacidades osteoinductoras y capacidades osteoconductoras, evitando provocar respuestas inmunológicas9.
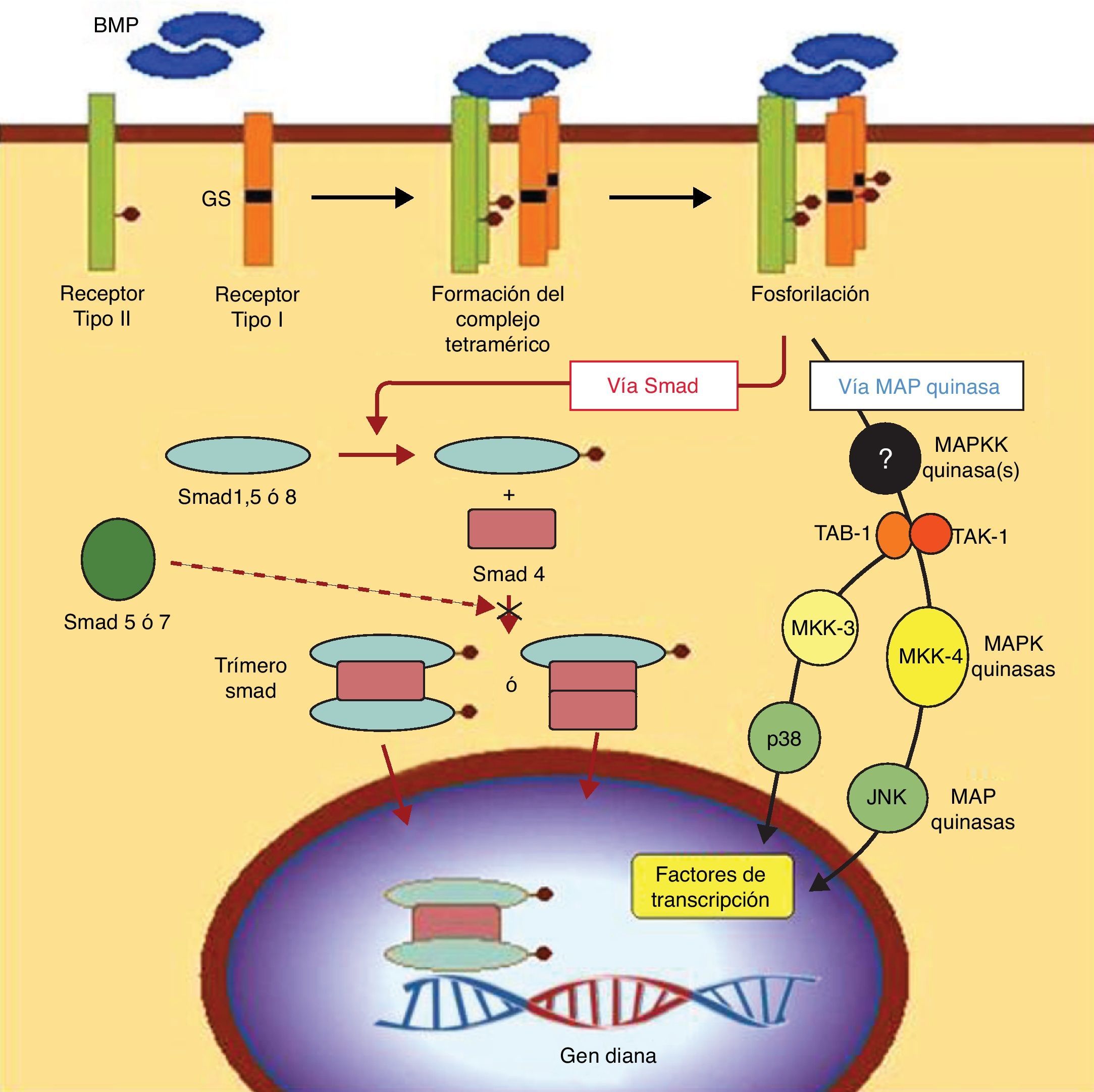
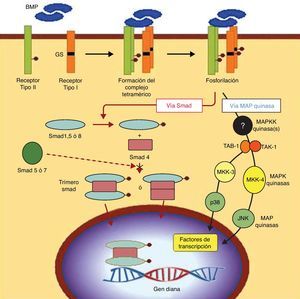
OsteogénesisLa osteogénesis es el hecho fundamental en la consolidación eficaz de una artrodesis. Consiste en la diferenciación de las células mesenquimales troncales multipotentes (MSC, del inglés, mesenchymal stem cell) hacia células del linaje osteogénico, los llamados preosteoblastos10. Se trata de un proceso complejo en cuya base se encuentra la acción de unas proteínas de la familia de los TGF-beta, llamadas proteínas morfogenéticas de hueso (BMP, del inglés, bone morphogenetic protein). Estas proteínas, actuando sobre los receptores específicos de la membrana de las MSC, desencadenan una cascada de señalización intracelular regulada por otras proteínas que son factores de transcripción, llamadas proteínas «smad» (fig. 4). Bajo el nombre de preosteoblastos, en realidad, se incluyen varios tipos de células con diferentes grados de diferenciación que van desde la propia MSC indiferenciada hasta el osteoblasto diferenciado que sintetiza la sustancia osteoide que lo engloba, pasando a diferenciarse de forma terminal en osteocito, que permanece en las lagunas óseas como la célula mantenedora del tejido óseo diferenciado. La sustancia osteoide cuando se mineraliza constituye el hueso. El hueso está constituido, pues, por la sustancia osteoide mineralizada y las células de la estirpe ósea (las MSC, los osteoblastos, sus precursores los preosteoblastos, y sus células finales los osteocitos). Además de estas células del linaje osteoblástico, en el hueso existen también los osteoclastos, células multinucleadas de una estirpe diferente que procede de los monocitos y pertenecen al linaje macrófagico, estando dedicadas a la resorción ósea. Por tanto, las MSC se diferencian a preosteoblastos cuando reciben en sus receptores de membrana a las BMP, sin embargo, si reciben otro tipo de molécula señalizadora se diferencian hacia otros linajes celulares como condroblastos, adipocitos, o fibroblastos; por ello a las MSC también se les denomina células troncales multipotenciales, porque desde este tronco común pueden diferenciarse en distintos linajes mesodérmicos que constituyen tejidos diferentes del mismo origen. Cabe insistir, por tanto, que son las células del linaje osteogénico las que producen la sustancia osteoide que posteriormente se mineraliza para constituir el hueso y que sin células osteoblásticas no hay hueso 1,11.
Señalización de las BMP. Vía de señalización transduccional a través de receptors BMPs. Los dominios intracelulares de los receptores tipo i presentan una región característica GS (rica en glicina y serina), localizada en posición N-terminal a las regiones serina-treonina quinasa. Tras la unión del ligando BMP, el receptor tipo ii fosforila la región GS del receptor tipo i, lo que supone un proceso crucial en la transducción de la señal por medio de los receptores serina-treonina quinasa. La cascada Smad es iniciada por ciertas proteínas Smad fosforiladas por medio del receptor i, así como por las vías representadas por 2 cascadas proteín-quinasa activadas (MAPK). En cualquier caso, la consecuencia final de este proceso de señalización es la regulación de genes de transcripción en el núcleo celular.
La osteoinducción es la capacidad que tienen determinadas moléculas para ligarse a la membrana de las células competentes (las MSC) e inducir su multiplicación y diferenciación al linaje preosteoblástico. Estas, como a otras que ejercen parecidas acciones en el organismo, se les conoce como factores de crecimiento (GF, del inglés, growth factor); los GF son moléculas de señalización porque transmiten la señal a las MSC de que hay que multiplicarse y ulteriormente diferenciarse. Existen muchas familias de factores de crecimiento que ejercen distintos efectos según el tipo y grado de diferenciación celulares. Posiblemente, la familia de factores de crecimiento más importante en el tejido óseo es la de los factores transformantes beta (TGF beta, del inglés transforming growth factor) y, dentro de estos, las BMP12.
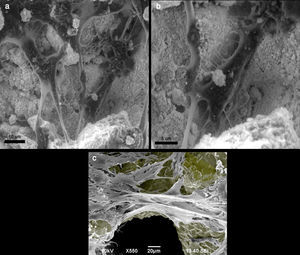
OsteoconducciónPuesto que el hueso es un tejido con abundante matriz extracelular en el que el componente celular es minoritario, aunque imprescindible como se ha dicho antes, la osteobiología ha tratado siempre de favorecer la formación de hueso usando soportes estructurales de diferente naturaleza, naturales o artificiales, pero siempre con capacidad de dejarse colonizar por el hueso nuevo formado por las células, es decir soportes osteoconductores. La osteoconducción es el complemento a la osteoinducción y subsiguiente osteogénesis. Para que el hueso crezca debe hacerlo sobre alguna superficie, y mejor aún sobre una estructura fundamentalmente tridimensional, como es el hueso fisiológico. A los sustitutos que actúan como andamiaje (scaffolds) para que el hueso crezca sobre ellos, se les denomina osteoconductores, pudiendo ser una trabécula ósea ya existente o un material artificial (fig. 5). Un sustituto óseo es osteoconductor si su superficie es biocompatible con el crecimiento celular y posee una microestructura con una porosidad apropiada de 200-400 micras. Actualmente, sintetizar un material con una estructura y naturaleza osteoconductora de las características referidas es fácil, sin embargo, no conocemos las características de la osteinducción en cuanto a número de células por unidad de volumen, tipo de molécula, dosis, cadencia y orden de liberación. La moderna ingeniería de tejidos (TE, del inglés, Tissue Engineering) trata de responder a esas preguntas mediante la realización ex vivo de constructos compuestos por scaffolds, células y biomoléculas que tratan de ser una aproximación a la producción controlada de sustitutos del autoinjerto, en el que la limitación de la cantidad no sea el problema13 (fig. 5).
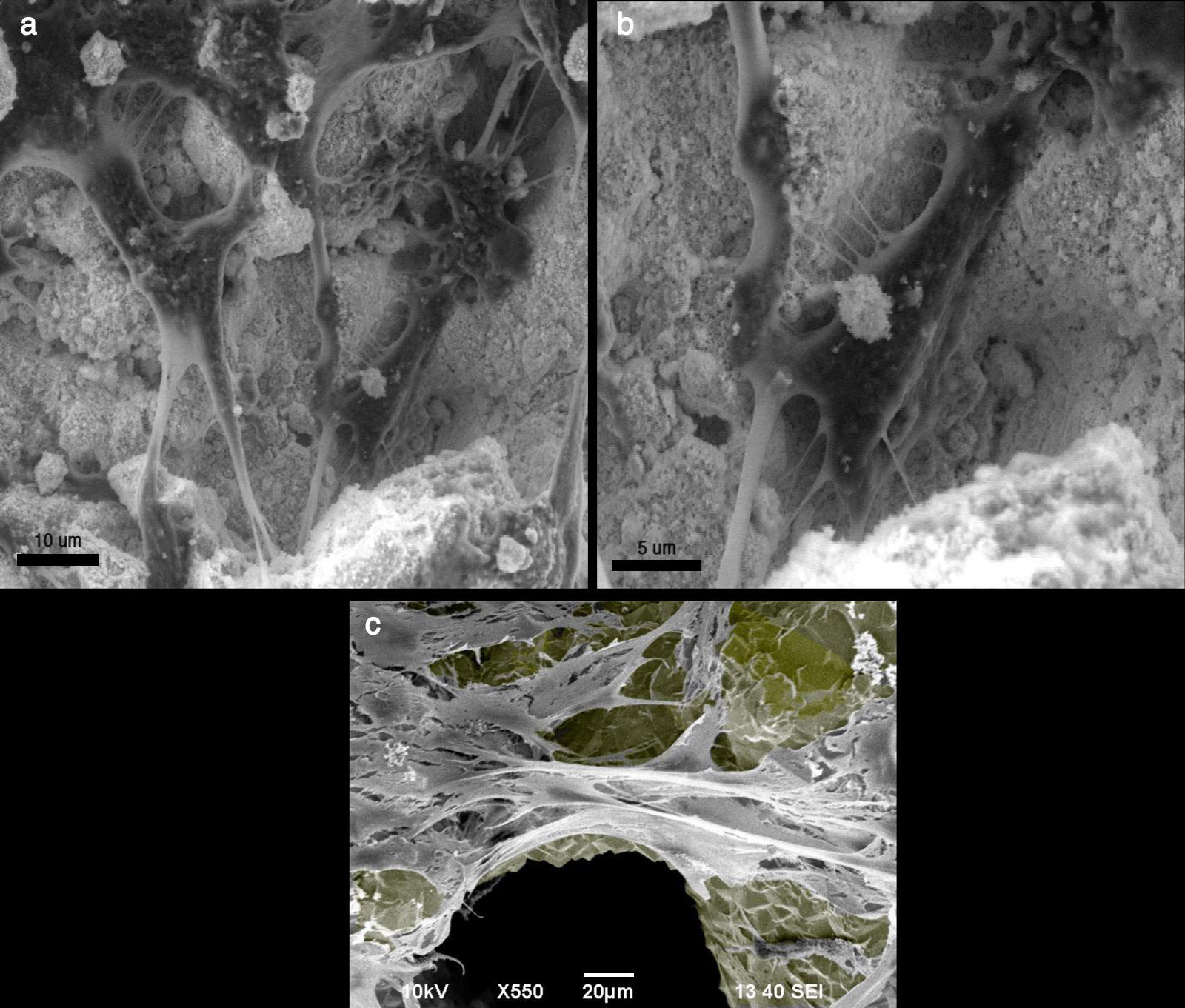
a y b. Preosteoblasto de ratón MC3T3-E1 creciendo en cristal de hidroxiapatita, observado con microscopio electrónico de superficie. Las células se fijaron con formalina y deshidratadas antes de su observación en el microscopio electrónico. 5c. Preosteoblasto de ratón MC3T3-E1 creciendo en una estructura trabecular de titanio, observada a microscopio electrónico de superficie. A la superficie de titanio se le ha dado un color gris para resaltar el contraste.
Así pues, osteogénesis fundamentada en el manejo de los tres elementos de la TE, las células que produzcan hueso, osteoinducción, las biomoléculas que inducen a las células apropiadamente, y la osteoconducción, fundamentada en los materiales que soportan estructuralmente al hueso en crecimiento, constituyen la base de la terapéutica del tejido óseo. Cuando se trata de TE para el tejido óseo es imprescindible añadir no solo la vascularización, sino un quinto elemento cual es la biomecánica adecuada, sin el cual la progresión del injerto no será la deseada. Por ello se ha convenido en denominar «concepto del diamante» al manejo de estos 5 elementos de la reparación ósea14,15. Habitualmente, la TE en sentido amplio añade el elemento vascular imprescindible para la viabilidad del constructo, que en el caso del hueso adquiere especial relevancia, no así en otras situaciones como cuando se trata de constructos encaminados a la reparación de cartílago. Cualquier situación clínica en que falte una de estas 5 variables evolucionará a un resultado no deseado14,15.
BiomecánicaPrincipios de la osteosíntesis del raquisExisten muchos estudios sobre la biomecánica del raquis, desde los clásicos de White y Panjabi16–22 hasta las casi 7.000 referencias bibliográficas que aparecen actualmente en Medline bajo la búsqueda «spine biomechanics».
En la artrodesis posterolateral del raquis se utiliza, efectivamente, una instrumentación pedicular y en la intersomática la placa o barras atornilladas al cuerpo vertebral en sostén-neutralización junto con un elemento de estabilización intersomático a compresión-sostén1–4; sin embargo, este es un análisis puramente llevado a la minimización de la mecánica. El campo donde se realiza este constructo está vivo y, al ser biológicamente activo, debe tenerse en cuenta la interacción biomecánica-biología1–4.
El aporte biológico estándar es el autoinjerto. El conocimiento básico de la fisiología del autoinjerto en general y, en particular en raquis, se ha adquirido a partir de animales de experimentación, haciendo que la inferencia humana no sea del todo fiable. El hueso esponjoso posee mayor celularidad que el cortical mientras que este es más robusto23. La estructura esponjosa permite a las células osteoprogenitoras mejor osteoconducción, a la vez que a la vascularización permite infiltrar mejor el tejido. La invasión vascular del autoinjerto esponjoso comienza al segundo día postimplantación, disminuyendo las propiedades mecánicas del injerto, para recuperarlas tras varios meses24. El hueso cortical posee una vida biológica más lenta que el esponjoso, por ello tarda de 6 a 24 semanas en perder el 75% de su resistencia y propiedades mecánicas25, recuperándolas a las 48 semanas26 postimplantación. Conocer estos tiempos es importante para el seguimiento postoperatorio y la consideración de que una artrodesis ha consolidado definitivamente. De hecho, uno de los problemas fundamentales para asegurar que una artrodesis ha consolidado está en la sensibilidad de las pruebas diagnósticas. Las pruebas diagnósticas de imagen, utilizadas habitualmente en la clínica, muestran un escaso valor predictivo en los primeros meses, mejorando su exactitud pasados los primeros 12 meses. Las radiografías ganan valor predictivo con el tiempo, mientras que la tomografía computarizada, dándose también este hecho, posee mayor valor predictivo con más precocidad. La tomografía computarizada tras 12 meses tiene un altísimo valor predictivo.
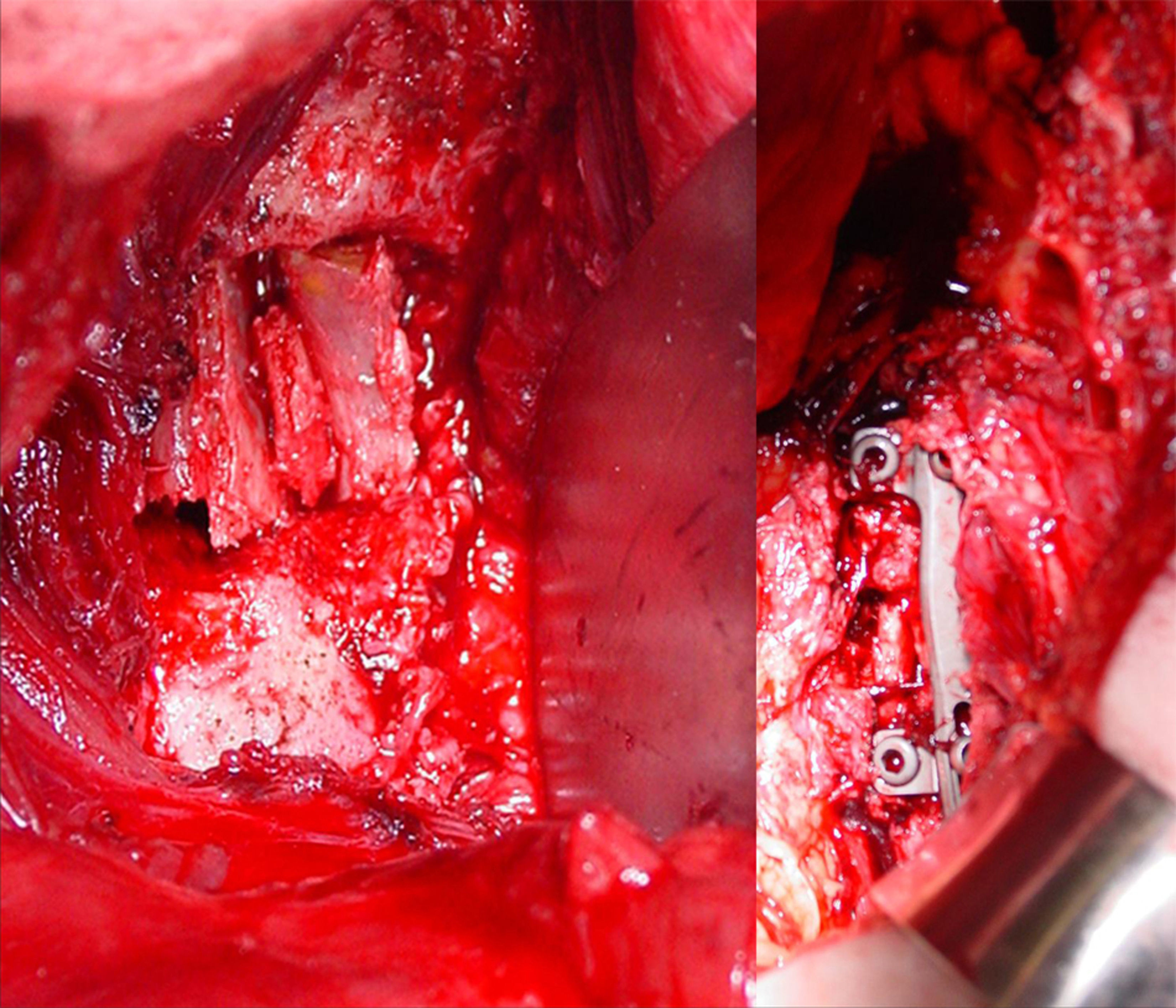
De este modo, atendiendo a las propiedades biomecánicas y biológicas del autoinjerto cortical y esponjoso, la artrodesis posterior siempre se beneficia del injerto esponjoso porque se requiere exclusivamente gran capacidad osteogénica sin sostén mecánico por el injerto, mientras que el cortical (tricortical de cresta ilíaca o cortical de peroné) es el indicado para la artrodesis intersomática anterior por su capacidad de soportar la compresión entre los dos cuerpos vertebrales y servir de sostén para evitar el colapso (figs. 2 y 3). En los abordajes anteriores al raquis torácico o toracolumbar mediante toracotomía se puede utilizar la costilla extirpada como soporte estructural intersomático; estos casos, si no van acompañados de fijación posterior, se deben combinar con una instrumentación anterior intersomática con placa o barras atornilladas al cuerpo vertebral en efecto sostén-neutralización (fig. 6). Los fragmentos de costilla constituyen injertos corticales autólogos que poseen, por tanto, capacidad osteogénica pero no tienen la resistencia del tricortical de cresta ilíaca o del cortical puro de peroné. Por consiguiente, no pueden someterse a compresión interfragmentaria completa de forma que ejerzan principios de sostén, necesitándose un sistema de osteosíntesis que aplique no solo neutralización sino también un sostén sólido1–4 (figs. 2 y 3). En ningún caso, la compresión anterior de los injertos costales debe ser parte estable de la osteosíntesis y en los casos en que se combinen con una instrumentación posterior se debe aumentar el número de espacios fijados para proporcionar mayor neutralización. Si el injerto intersomático utilizado es tricortical se puede utilizar una instrumentación pedicular corta de solo 2 segmentos vertebrales pero cuidando que el injerto quede a compresión y la instrumentación, sin sostén, solo en neutralización; en estos casos moldeando las barras (por ejemplo dando solo ligera lordosis en el raquis lumbar) puede conseguirse un efecto de tirante que aumente la estabilidad, absorbiéndose la compresión anterior por el injerto y la distracción posterior por el implante1–4 (figs. 2 y 3). Como estudiaremos más adelante, las características de los materiales para construir las barras permiten mayor o menos rigidez y ductilidad de las mismas; por otra parte, el injerto anterior cortical puede sustituirse, bajo los mismos principios de compresión-sostén, por una caja sintética, sin embargo este procedimiento ocasiona importantes problemas como también veremos más adelante.
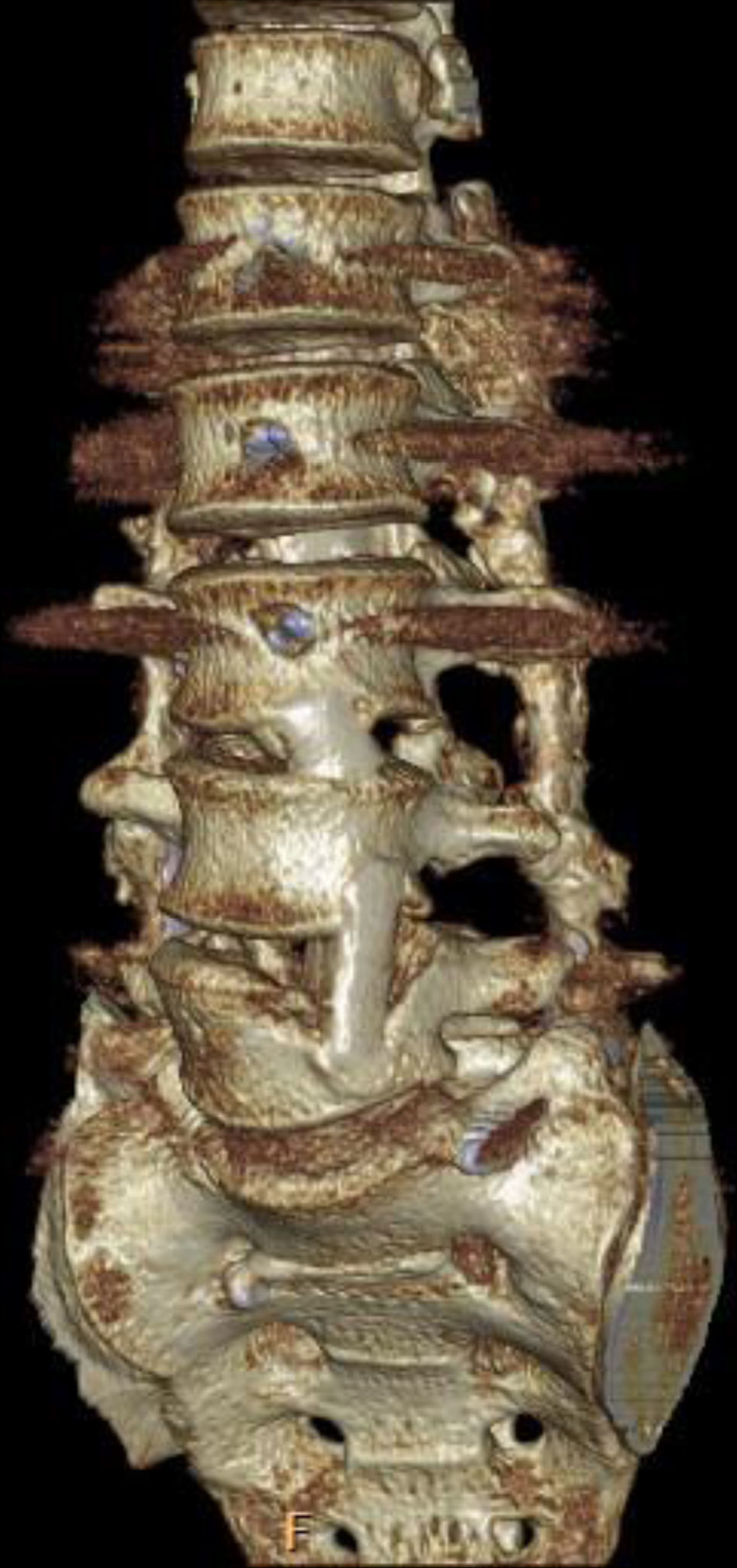
Aplicación del principio de sostén y neutralización por vía anterior. Abordaje intersomático anterior en un paciente con espodilodiscitis de L1. La utilización de la costilla en empalizada, extirpada en el abordaje quirúrgico, permite la fusión anterior pero no proporciona un efecto de sostén suficiente, como lo hace el injerto tricortical, por lo que se combina con una placa anterior que sostiene el espacio intervertebral y neutraliza la rotación. En algunos casos, cuando la síntesis no es estable (por ejemplo en hueso osteoporótico), conviene añadir una fijación pedicular posterior.
En cualquier montaje biomecánico de fijación de fracturas o de artrodesis vertebral, los tejidos están sometidos a solicitaciones mecánicas; esto significa que también lo están las células a través de la matriz extracelular. El mecanismo de mecanotransducción (conversión de estímulos mecánicos en liberación molecular que provoca respuesta celular dependiente de la naturaleza del estímulo) no es muy conocido, a pesar de que desde hace más de un siglo se conoce este hecho de forma empírica con el nombre de ley de Wolf. Clínicamente se observa en un hueso largo que cuando, en determinadas localizaciones, una fractura o foco de artrodesis no están bien vascularizados e inmovilizados el movimiento provoca una no consolidación a la vez que formación de tejido fibroso, conocida con el nombre de no unión o pseudoartrosis atrófica que requiere la extirpación del callo fibroso, la aportación de flujo vascular mediante decorticación y avivamiento de los extremos óseos, aporte de células vivas mediante autoinjerto, además de la llegada de neovascularización y fijación adecuada. Sin embargo cuando la fractura está bien vascularizada pero no inmovilizada, se produce un foco de no unión constituido, fundamentalmente, por tejido condral que, simplemente al inmovilizarlo adecuadamente, acaba por formar tejido óseo con consolidación del foco; de este modo, un hecho mecánico condiciona uno biológico1. La traducción celular de este fenómeno consiste en que las MSC ante estímulos mecánicos distintos reaccionan diferenciándose a linajes celulares diferentes, sea osteoblástico, condroblástico o fibroblástico. Este es un mecanismo claro de mecanotransducción y se aprecia con más facilidad en la diáfisis de los huesos largos que en el raquis porque en este la lejanía entre los focos a artrodesar dificulta la llegada de la vascularización y aunque los extremos óseos hayan sido cuidadosamente decorticados dejando un lecho sangrante bien vascularizado, en la no consolidación del raquis el tejido interpuesto suele ser de naturaleza fibrosa. Observar en el raquis una «pata de elefante» característica de la no unión hipertrófica es excepcional. En virtud de lo dicho, el primer paso de una artrodesis vertebral es la decorticación meticulosa de los elementos a artrodesar, sean posteriores o anteriores, para asegurar la llegada de vascularización y, por ende de células, al foco de fusión. Tras ello, la combinación de los principios biomecánicos enunciados es fundamental, sin perjuicio de que, en la práctica, la decorticación con aporte de injerto pueda postergarse al final para evitar el sangrado durante toda la cirugía y eludir la molestia que ello supone para colocar la instrumentación. Empero, siendo fundamental, la decorticación meticulosa del lecho receptor hasta hueso sangrante no garantiza el éxito de la artrodesis dado que los extremos óseos quedan alejados entre sí y los fragmentos (vértebras) permanecen móviles.
La mecanotransducción donde mejor se ha estudiado ha sido en el tejido tendinoso y este conocimiento se ha inferido al resto del tejido conectivo, entre otros al hueso. Puesto que las células a través de la matriz extracelular están sometidas a estímulos mecánicos, las moléculas liberadas por estas desencadenan una cascada molecular que lleva a una expresión génica diferente que depende del estímulo y, por tanto, con síntesis proteica distinta27. De hecho, la producción de proteína de la matriz extracelular aumenta cuando se liberan cantidades superiores de factores de crecimiento debido a estímulos mecánicos28,29. La remodelación de la matriz está influenciada por los estímulos mecánicos que incitan la secreción de metaloproteasas30,31. Diferentes cargas mecánicas llevan a proporciones y naturaleza distintas de matriz extracelular (esta es la simple explicación básica de la ley de Wolf). Esto significa que cuando el constructo osteosíntesis–injerto está rígido desencadena una respuesta molecular y celular distinta a si presenta grados de movilidad diversa. En una osteosíntesis diafisaria, según se utilice un sistema rígido como la placa a compresión-neutralización o no rígido como el clavo no fresado y cerrojado, se observa este hecho1–4. Por otra parte, en una interfaz entre materiales de distinta rigidez sometida a estímulos mecánicos de carga con fuerzas cizallantes, se impide la integración biológica entre ambos materiales. Esto se ha visto en la interfaz no cementada platillo óseo tibial–bandeja tibial de las artroplastias de rodilla, canal femoral–vástago protésico y, por supuesto, en la de platillos vertebrales–cajas intersomáticas. Cuando no hay estabilidad primaria se debe recurrir a la cementación, la cual produce una integración inmediata pero también tendrá unos años de vida limitados al producirse en un tejido vivo. La cementación de las cajas intersomáticas es un procedimiento no estudiado ya que se pretende que las cajas consigan la osteointegración secundaria tras una estabilidad primaria.
Por tanto, la combinación adecuada del microambiente biológico con la osteosíntesis es de capital importancia. Si se utiliza un buen autoinjerto rico en células pero con una construcción biomecánica errónea, el resultado final no será el deseado, del mismo modo que ocurrirá si se utiliza una buena osteosíntesis con un injerto biológicamente pobre o un simple sustituto. Esto es lo que ocurre cuando bien se realiza una osteosíntesis defectuosa o cuando se coloca un sustituto como una matriz cálcica porosa sin factores de crecimiento que osteoinduzcan, ni células que sean osteoinducidas al linaje osteogénico, especialmente en pacientes ancianos cuya población de MSC es sustancialmente escasa32.
El raquis es un ejemplo característico de la necesidad del constructo adecuado1–4. Las células responden dependiendo del acoplamiento osteosíntesis-injerto. Puesto que en un modelo biomecánico la artrodesis espinal consiste en la fijación de múltiples focos de fractura una vez que se han decorticado las partes a fijar, los principios fundamentales de cualquier osteosíntesis (compresión, neutralización, soporte o tirante) juegan un papel fundamental cuando se incluye el injerto o su sustituto como parte de la osteosíntesis. Un injerto intersomático tricortical o una caja intersomática son un ejemplo de ello. La artrodesis del raquis presenta, además, un reto añadido puesto que, según se ha dicho, la distancia entre los elementos posteriores en la artrodesis intertransversa es grande y más aún en la artrodesis anterior intersomática1. Junto al problema de interfaz, en las cajas hay un problema biológico puesto que la distancia entre las superficies de tejido vivo a fijar es muy larga y aunque la caja se rellene de autoinjerto, este pierde propiedades biológicas fácilmente por esta lejanía al lecho vascular sano1.
Existe unanimidad de que, con independencia de la biomecánica que combina autoinjerto-instrumentación, la biología dicta que el injerto debe ser autólogo, tricortical o esponjoso dependiendo de su acoplamiento biomecánico. Sin embargo, en el raquis, en los casos de artrodesis en más de 2 niveles resulta difícil el aporte de autoinjerto en cantidad suficiente debido a la escasez del mismo y la morbilidad que genera su colección, el tiempo extra que requiere su extracción e implantación aumentando la exposición y riesgo de sangrado e infección. Esto ha incitado a la búsqueda de alternativas biológicas que han de poseer capacidades osteoinductoras, osteogénicas y osteoconductoras, evitando provocar respuestas inmunológicas9. La biología de la consolidación de una fractura o una artrodesis siempre es la misma: células indiferenciadas (MSC) que se multiplican y diferencian a otras capaces de sintetizar sustancia osteoide que se mineraliza y fusiona los segmentos.
BiologíaAutoinjertoDesde el punto de vista terapéutico, el autoinjerto es la fuente de células por excelencia, a lo que le acompaña el que posee factores de crecimiento y obviamente una estructura osteoconductora exactamente igual a la del hueso fisiológico no extraído. El autoinjerto posee un buen efecto volumen. Sin embargo la pérdida de propiedades, fundamentalmente células, durante el autotransplante33, la disponibilidad limitada y la morbilidad34 requieren nuevas búsquedas de fuentes celulares con capacidades de multiplicación y diferenciación. Una nueva técnica considerada menos invasiva que la toma de injerto es el fresado con aspiración-irrigación (Reamer Irrigator Aspirador [RIA]); esta técnica aparentemente proporciona mayores cantidades de células y factores de crecimiento que la toma de injerto abierta tradicional, evitando el dolor postoperatorio, la morbilidad y disminuyendo la estancia hospitalaria35–39. No obstante, los estudios clínicos del RIA no han asegurado aún su validez y actualmente se desconoce su papel en la artrodesis del raquis. La cantidad y calidad de las células presentes en el aspirado de médula no aseguran la osteogénesis porque la presencia de una cantidad importante de progenitores hematopoyéticos frente a MSC y progenitores del linaje mesengénico, deja estos en franca minoría, en perjuicio de la osteoinducción. La tasa de MSC por unidad de volumen es muy importante para el éxito del proceso, ya que la secreción paracrina de factores que estimulan a las propias MSC y a los progenitores osteogénicos procedentes de ellas, resulta de importancia decisiva en el proceso de proliferación/diferenciación osteogénica. Además, si el aspirado no se hace correctamente, la sangre es el elemento mayoritario, lo que diluye todavía más las biomoléculas activas. Por otra parte, el aspirado medular posee baja cantidad de BMPque en estos casos resultan imprescindibles para desencadenar la cascada osteoinductora en la zona artrodesada, sobre todo en las zonas alejadas del hueso decorticado, en cuya proximidad la osteoinducción es más fácil. Por tanto, en teoría, las perspectivas de la RIA en el raquis no son nada halagüeñas.
AloinjertoAunque algunas publicaciones asiladas han comunicado que el aloinjerto (injerto procedente de la misma especie) posee capacidades osteogénicas, su capacidad real se concentra en sus propiedades osteoinductoras (posee factores de crecimiento) y osteoconductoras (posee la porosidad del hueso, ya que es propiamente hueso sin células). Su utilización como alternativa al autoinjerto se basa en la ausencia de morbilidad en la extracción y en la disponibilidad. Como contrapartida, su capacidad de provocar rechazo inmunológico y la probabilidad de transmitir enfermedades han hecho que muchos cirujanos rechacen su uso. Empero, a pesar de la altísima prevalencia de uso, el riesgo es escasísimo40–42. Como el autoinjerto, el aloinjerto esponjoso posee mejores condiciones que el estructural y las mismas características mecánicas que en el autoinjerto43. Los factores de crecimiento, en especial las BMP, tienen gran capacidad de atracción de células diana (MSC y osteoprogenitores), pero como estas han de migrar desde las zonas decorticadas del huésped, la distancia, en estos casos, es un factor limitante. El aloinjerto aún se utiliza mucho actualmente en la artrodesis del raquis, debido a su disponibilidad.
MSC y artrodesis del raquisLa mesengénesis es el proceso de multiplicación y diferenciación de progenitores de la estirpe mesodérmica por el que las MSC dan lugar a linajes diferenciados, como el osteogénico. La secuencia MSC-preosteoblastos-osteoblastos-osteocitos es la génesis de la formación de hueso y, por tanto es lo que ocurre en la artrodesis vertebral.
Siendo la formación de hueso una propiedad exclusiva de los osteoblastos, para que haya una cantidad adecuada de hueso es necesario que haya una cantidad mínima de sus células precursoras. Como ocurre con cualquier otro tejido, en el hueso las células diferenciadas no son las que proliferan en la cuantía necesaria, sino que son las indiferenciadas (MSC y progenitores osteogénicos) las que llevan a cabo la multiplicación celular (fenómeno denominado «amplificación») para diferenciarse ulteriormente en osteoblastos, tras pasar por los tipos celulares intermedios. Todo este proceso está regulado por moléculas de señalización que son diferentes citoquinas como FGF, PDGF, VGF, IFG y diferentes TGFbeta, de las que las más destacadas son las BMP. El que las células menos diferenciadas se multipliquen más que las diferenciadas es un comportamiento habitual en todos los tejidos. Pero también es un fenómeno patológico; esto ocurre especialmente en el cáncer donde las células anaplásicas (menos diferenciadas) se multiplican más que las más diferenciadas, siendo de mayor crecimiento y peor pronóstico los tumores de células anaplásicas que los de células más diferenciadas. Por tanto, la multiplicación desde células menos diferenciadas es un mecanismo fisiológico; en el cáncer se altera la regulación de este mecanismo.
Lo anteriormente referido es muy importante en osteobiología porque ante un proceso de osteogénesis que quiera ser eficaz para conseguir una artrodesis terapéutica, el número de células osteogénicas debe superar un determinado umbral. Para ello, muchos progenitores más diferenciados pueden recapitular a menos diferenciados, recorriendo un camino ontogénico inverso hasta llegar a una estirpe celular capaz de multiplicarse de manera significativa, de forma que pueda afrontarse el proceso de reconstrucción ósea de manera más eficiente, partiendo de un elevado número de células sintetizadoras de matriz ósea44–48. Durante todo este proceso aparecen nuevos vasos que actúan como fuente de más MSC; publicaciones recientes han aportado evidencias sólidas del origen perivascular de las MSC49,50, lo que refuerza la importancia de la decorticación hasta hueso sangrante, sea en una no consolidación diafisaria o en la preparación de una artrodesis vertebral1, puesto que ello abre el camino a la llegada de MSC que no solo desencadenen la mesengénesis sino que además tienen un efecto trófico e inmunomodulador imprescindible para la función reparadora51.
De este modo, las MSC se consideran el centro de la osteogénesis y son objeto de investigaciones intensas para su uso terapéutico porque siendo las únicas capaces de diferenciarse hacia precursores osteogénicos para producir hueso su aparición fisiológica o mediante terapias avanzadas en el lugar que precisa reparación condiciona el éxito de la osteogénesis. Las características fundamentales aceptadas actualmente para definir a las MSC son las de población celular capaz de adherirse a la superficie de los frascos de cultivo y, bajo unas condiciones controladas, diferenciarse in vitro a células osteogénicas, condrogénicas, adipogénicas, miogénicas, tenogénicas o estromáticas del tejido hematopoyético10,52–55. Durante los últimos años se ha publicado la capacidad de las MSC para diferenciarse también a células epiteliales, endoteliales e, incluso, neuronales56–58, aunque esto último está sujeto a revisión.
Estas células poseen el mismo genotipo y fenotipo que sus descendientes y por ello mantienen la «troncalidad» (capacidad de diferenciarse a las líneas antes dichas). Estas características, no obstante, se han llegado a conocer mediante estudios in vitro donde las células pueden alterarse59,60. Las MSC humanas, además de su adhesividad al plástico, formar unidades de colonias (CFU, collonies forming units) en cultivos primarios y poseer la capacidad de diferenciarse a osteoblastos, adipocitos y condroblastos, deben expresar CD73, CD90, CD105, mientras que no deben expresar CD11b, CD14, CD19, CD34, CD45, CD79alpha, o las moléculas de superficie HLA-DR10,61. Por ello, cuando se dice que se han aportado células madre en un tratamiento a un foco de fractura o artrodesis como producto de un centrifugado, lo que se está haciendo es simplemente añadir un producto sanguíneo cuyo contenido en células que puedan diferenciarse a osteoblastos, además de desconocido, puede ser mínimo, ya que, en circunstancias normales, las MSC no circulan libremente por la sangre en cantidades significativas62. Por desgracia, actualmente, se realizan sobre los pacientes prácticas confusas con relación a trasplante de células.
Las MSC actúan en un espacio reducido, denominándose «nicho» a este hábitat, constituido por un espacio definido con un microambiente de moléculas que participan en la regulación de la amplificación y/o diferenciación. En general, el nicho posee células madre, células no madres, matriz extracelular y moléculas de señalización que interaccionan con las células para modular su biología13. Uno de los nichos mejor estudiados es el de las células madre hematopoyéticas (HSC) de la médula ósea donde el grado de sofisticación en la regulación de la quiescencia, proliferación y diferenciación de estas células es muy elevado, participando los osteoblastos de las laminillas óseas, células estromales, fibroblastos, endotelio, etc.63.
Durante los últimos años, las MSC se han utilizado experimentalmente como un método de promover la osteogénesis en la artrodesis raquídea. Los modelos mixtos de MSC con un transportador de hidroxiapatita y colágeno tipo i han mostrado una alta efectividad en conejo64. Sin embargo, todavía no se disponen de protocolos de laboratorio estandarizados para la manipulación celular y también cuales son los mejores transportadores65,66. Los nuevos materiales metálicos porosos como el titanio y tantalio también se han estudiado con resultados prometedores, especialmente para el raquis, sin embargo la combinación de estos materiales con las MSC aún no ha mostrado su efectividad clínica67 aunque los estudios in vitro son muy prometedores68.Recientemente, también los nanomateriales han irrumpido en el campo de la investigación biomédica con este propósito. La nano hidroxiapatita con colágeno y ácido poliláctico combinada con MSC derivadas del tejido adiposo han sido estudiados para promover la artrodesis vertebral posterolateral, con resultados esperanzadores, aunque hasta ahora solo en modelos de conejo69. En el mismo animal de experimentación se han combinado las MSC y los compuestos biocerámicos con ultrasonido pulsátil de baja intensidad, observándose que la osificación era encondral, similar a la producida en la especie humana70. Igualmente, en la columna cervical, la implantación de modelos de MSC alogénicas con hidroxiapatita y fosfato tricálcico como espaciadores intersomáticos ha mostrado formación ósea con buenos resultados en cuanto a bioseguridad, pero estos resultados no han superado a los del autoinjerto71. También se han desarrollado nuevos modelos de artrodesis vertebral con el objetivo de comparar el comportamiento mecánico de la fijación mediante instrumentación y la conseguida por las MSC modificadas genéticamente72; estos estudios, sin embargo, se llevaron a cabo en ratón mediante agujas de acero, un modelo biomecánico que en nada se parece al humano, siendo este uno de los problemas fundamentales de todos los estudios realizados8.
Además de lo referido, se han utilizado con relación a artrodesis de raquis experimental, desde modelos con polvos autólogos y cajas intersomáticas73 a combinaciones de MSC con oxígeno hiperbárico74, manipulaciones farmacológicas sobre MSC75,76, combinaciones de nuevos transportadores77, transducciones genéticas sobre MSC derivadas del tejido adiposo78–80, transfecciones genéticas81,82 o combinaciones de GF con MSC83, observándose incluso, en algunos casos, el efecto inhibidor sobre la osteogénesis al ensayar la terapia celular sin transportador84.
En artrodesis raquídea existe un objetivo indudable de sustituir el autoinjerto con su alta calidad osteogénica, pero con su alta morbilidad, por trasplante de células dentro del concepto de TE. La TE pretende crear o inducir la formación de un tejido específico en una localización concreta a través de seleccionar y manipular células incluidas en estructuras matriciales que le den soporte y unas moléculas que modulen el crecimiento celular85. Esta estructura viva necesita aporte vascular inmediato que continúe la vida del constructo y por ello, las técnicas de trasplante celular en el raquis, encuentran obstáculos, hasta ahora no resueltos, como la distancia que existe entre los 2 focos a artrodesar con la imposibilidad de que la vascularización recorra un camino tan lejano. Esta dificultad se da tanto en artrodesis intertransversa o intersomática, sea utilizando sustitutos óseos o cajas rellenas de los mismos. Los injertos mixtos en los que se combinen el aporte celular y vascular del hueso decorticado, con las MSC aportadas en el transportador adecuado y las BMP, que tienen gran poder quimiotáctico y diferenciador, adsorbida a esponjas de colágeno, pueden ser unas condiciones favorables para la osteoinducción en la artrodesis vertebral. Hasta ahora se están suministrando las BMP asociadas a scaffold colagénico, a concentraciones muy elevadas, lo que encarece el acto quirúrgico, además de introducir cierto grado de inseguridad por el paso de BMP a la circulación sistémica con los consiguientes efectos adversos no descartados totalmente86–88. La producción de BMP con dominios moleculares que las una específicamente al transportador, sin comprometer su eficacia, puede ser una solución a explorar clínicamente89.
Factores de crecimientoLa utilización de factores de crecimiento en la artrodesis de raquis se centra en las BMP, tras el fracaso de la utilización de concentrado de plaquetas90. Las BMP son proteínas multifuncionales, dentro de la superfamilia de factores de crecimiento TGF-b91, que tienen diferentes efectos sobre muchos tipos de tejidos en el organismo y modulan factores de crecimiento y diferenciación embriológico así como funciones celulares. Las BMP estimulan las células osteoprogenitoras del lecho óseo del huésped. Se han reconocido más de 20 tipos distintos, siendo las BMP-2, 4, 6, 7 y 9 las que poseen capacidades osteoinductoras con una relación sinérgica entre ellas92. Las moléculas de BMP se combinan in vivo para formar heterodímeros, siendo, por tanto, mucho más potentes en combinación que cuando se emplean de forma aislada93. Según parece, la cascada molecular para la diferenciación osteoblástica es una sucesión de interacciones de BMP con otras moléculas94, de este modo, la combinación de BMP con aloinjerto parece ser una atractiva combinación para la fusión vertebral lumbar. El aloinjerto es, además, un excelente transportador y osteoconductor. Las moléculas de BMP son relativamente solubles, siendo los transportadores menos solubles los indicados para mantener las BMP en el lugar de artrodesis95, reforzando así la utilización de aloinjerto como transportador. No, las estrategias actuales de aplicación de BMP para artrodesis de raquis en humanos pasa por administrarlas sin ningún transportador.
A pesar de la amplia experiencia publicada sobre la utilización de las BMP en cirugía del raquis1,96–100, así como sobre su seguridad99,100, en España no existen indicaciones aprobadas para las BMP en la columna vertebral, siendo su utilización mediante una petición individual para cada paciente al Ministerio de Sanidad como «uso compasivo».
Los resultados del uso de las BMP en raquis difieren si se consideran los modelos animales o la utilización clínica humana. Mientras que la BMP-7 recombinante en modelos caninos muestra un resultado superior al propio autoinjerto101, estos resultados no se consiguen en el humano ni siquiera cuando se utiliza aislada como pasta («putty»)98,99,102. Sin embargo los resultados de las BMPs son superiores a cualquier otro «sustituto óseo» y con una morbilidad nula en comparación con el autoinjerto98,99. Nuestro grupo, basado en estudios experimentales de otros autores103, en un estudio prospectivo aleatorizado con 5 años de seguimiento utilizando la BMP-7 (OP-1, Osigraft Stryker, Kalamazoo ®) como agente osteoinductor junto al aloinjerto como transportador con características también inductoras, y en comparación con el aloinjerto aislado en artrodesis lumbar, ha observado que los resultados son muy superiores y cercanos a la tasa de fusión del autoinjerto, lo que sugiere esta indicación cuando se precisa fusión lumbar en más de un nivel. Por otra parte, experimentalmente, nuestro grupo también ha desarrollado un método de capacitación osteogénica basado en cultivos 3D de células en geles de colágeno en presencia de un TGF-beta 1 con la adición de un dominio molecular que permite la selección de una población celular y la formación de hueso in vitro e in vivo en el animal de experimentación donde se implantan11. Las células seleccionadas mediante este método poseen un fenotipo mucho más osteogénico que cuando se realiza en cultivos 2D. En cualquier caso, cuando se trata de las BMP hay que tener presente que existen diferentes mecanismos en la diferenciación de las MSC humanas a la línea osteogénica según se induzcan por las BMP-2/4 o las BMP-6/7102.
Hasta la actualidad ha habido muchos estudios sobre la efectividad de las BMP en la fusión cervical1,40 y especialmente lumbar, posterolateral97–100 e intersomática141,104–107. Sin embargo, un reciente metaanálisis de ensayos clínicos controlados y aleatorizados para evaluar la efectividad clínica y radiográfica del autoinjerto y las BMP en la artrodesis posterolateral de raquis, mostró que aunque los resultados fueron superiores en el grupo de BMP, el papel exacto de cada BMP, la dosis y el transportador eran desconocidos108. Además mientras que el uso en la columna torácica y lumbar era seguro100, en la cervical se producía una inflamación de tales características que los pacientes habían manifestado disfagia e incluso insuficiencia respiratoria98,109–111. Por otra parte, no se ha documentado estenosis foraminal cuando se ha utilizado en cirugía con canal abierto112. Estudios recientes en indicaciones de uso compasivo («off-label») han mostrado que el 92,8% de 340.251 casos de utilización de BMP en cirugía raquídea muestra una tremenda dispersión en cuanto a las variables: las vías de acceso quirúrgico diferentes, la utilización en casos de cirugía primaria o de revisión, la localización en columna cervical, torácica o lumbar, la utilización de cajas, y las diferentes BMP, hacen que las conclusiones sean difíciles de alcanzar113.
Cajas intersomáticasEl conocimiento proporcionado por el injerto tricortical intersomático ha sido la base para el desarrollo de las diferentes técnicas e instrumentaciones para artrodesis intersomática1–4. El injerto tricortical proporciona un excelente sostén de los cuerpos vertebrales superior e inferior que someten al injerto a compresión interfragmentaria (figs. 2 y 3). Junto a ello, es necesaria una instrumentación que aporte neutralización. Cuando esta instrumentación es posterior mediante un sistema pedicular se consigue un efecto tirante ya que el injerto soporta la compresión anterior y el sistema pedicular la distracción posterior. La resistencia mecánica del autoinjerto tricortical a la compresión proporcionada por la vertebra superior e inferior junto con su actividad biológica ha sido la base para el diseño de las cajas intersomáticas en todas sus variantes de introducción anterior o posterior.
Sin embargo en las cajas, junto al problema de interfaz, hay un problema biológico puesto que la distancia entre las superficies de tejido vivo a fijar es muy larga y aunque la caja se rellene de autoinjerto, este pierde propiedades biológicas fácilmente por esta lejanía al lecho vascular sano. A las cajas intersomáticas se les aplica el principio de la compresión interfragmentaria considerando que la propia caja es un fragmento óseo que está bajo compresión y se fusiona al cuerpo vertebral superior e inferior. La caja asimila un principio de sostén evitando que el segmento se colapse. Pero, como en cualquier osteosíntesis, es necesario un sistema que aporte neutralización, que consiste en una placa o barra atornillada intersomática o, habitualmente, una instrumentación pedicular posterior. Este modelo asume que la caja tiene un módulo de elasticidad similar al de los cuerpos vertebrales superior e inferior y también una riqueza biológica análoga al portar injerto en su interior. Por ello, las cajas están construidas en titanio, metal cuyo módulo de elasticidad más se acerca al del hueso, además de otros materiales de alto peso molecular como el PEEK (polieteretercetona, material termoplástico semicristalino termoestable comercializado en 1978 para reforzar estructuras de carbono y revestimientos de piezas mecánicas no lubrificadas) que siempre buscan un módulo de elasticidad similar al óseo. Este principio es el que se aplica al autoinjerto tricortical, sin embargo, ni el módulo de elasticidad de las cajas y el hueso es el mismo, ni la riqueza biológica tampoco, lo que ha hecho que las cajas no se fusionen como parte de los cuerpos vertebrales superior e inferior y sean un implante con una tasa de movilización intolerable1,114-121.
MaterialesLos materiales utilizados para promover la osteogénesis en la artrodesis vertebral deben poseer propiedades físicas concretas (por ejemplo los sistemas de fijación pedicular), algunos de ellos propiedades biológicas (por ejemplo los sustitutos óseos) y, otros, ambas (por ejemplo las cajas). Por tanto, se puede afirmar que hay materiales para la función biomecánica de la artrodesis, para la biológica o para ambas6.
Las propiedades físicas más apreciadas en el uso ortopédico de implantes son rigidez, fuerza, ductilidad, resistencia a la corrosión, estructura de superficie y biocompatibilidad. Un material con una rigidez excesiva lo acerca a la ruptura, mientras que la ductilidad lo aleja. Algunos materiales, como el titanio utilizado en las barras del sistema pedicular, combinan un grado de rigidez-ductilidad adecuado para su función. Las distintas aleaciones de titanio y acero buscan una combinación adecuada de las propiedades físicas referidas6.
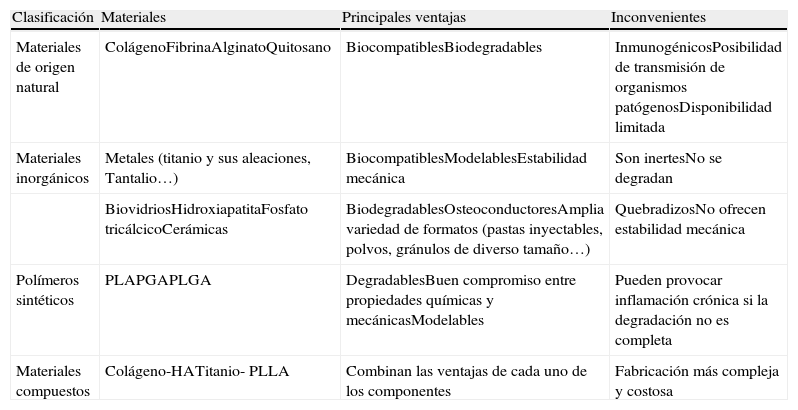
En general, los materiales empleados en cirugía pueden dividirse, según su composición, en 4 grupos distintos: los materiales naturales, los inorgánicos, los polímeros sintéticos y los materiales compuestos, además de combinaciones de distintos materiales (tabla 1). Un material destinado a osteosíntesis, por ejemplo un sistema pedicular, debe poseer rigidez y fuerza para mantener la osteosíntesis, y algún grado de ductilidad, no demasiado, para ser moldeado a las curvaturas fisiológicas del raquis; pero la estructura de su superficie no requiere facilitar la adhesión celular y la biocompatibilidad solo para no interferir en la fisiología del huésped o la osteogénesis. Cabría pensar que un sistema pedicular idealmente podría formar parte de la barra de hueso formada en la artrodesis posterolateral pero entonces habría que modificar su superficie y, preferentemente su estructura interna y hacerla más porosa, sin embargo, esto le restaría rigidez y fuerza. Por otra parte, una bondad del sistema pedicular consiste en que, a pesar de llegar a las 3 columnas del raquis (anterior, media y posterior), permite cierta elasticidad lo que hace que el injerto, una vez consolidado, reciba carga y no desaparezca, fenómeno indeseable conocido como «stress shielding». El «stress shileding», muy bien conocido en el hueso periimplante femoral de las artroplastias de cadera, es menos conocido y previsible en la cirugía del raquis.
Principales ventajas e inconvenientes de los distintos tipos de materiales empleados o propuestos como sustitutos de hueso6
| Clasificación | Materiales | Principales ventajas | Inconvenientes |
| Materiales de origen natural | ColágenoFibrinaAlginatoQuitosano | BiocompatiblesBiodegradables | InmunogénicosPosibilidad de transmisión de organismos patógenosDisponibilidad limitada |
| Materiales inorgánicos | Metales (titanio y sus aleaciones, Tantalio…) | BiocompatiblesModelablesEstabilidad mecánica | Son inertesNo se degradan |
| BiovidriosHidroxiapatitaFosfato tricálcicoCerámicas | BiodegradablesOsteoconductoresAmplia variedad de formatos (pastas inyectables, polvos, gránulos de diverso tamaño…) | QuebradizosNo ofrecen estabilidad mecánica | |
| Polímeros sintéticos | PLAPGAPLGA | DegradablesBuen compromiso entre propiedades químicas y mecánicasModelables | Pueden provocar inflamación crónica si la degradación no es completa |
| Materiales compuestos | Colágeno-HATitanio- PLLA | Combinan las ventajas de cada uno de los componentes | Fabricación más compleja y costosa |
HA: Hidroxiapatita; PLA: Ácido Poliláctico; PGA: Ácido Poliglicólico; PLGA: Ácido poliláctico-glicólico.
Los materiales destinados a promover la osteoconducción o la osteogénesis (fig. 5), los llamados sustitutos óseos, deben poseer, inexorablemente, biocompatibilidad, así como superficie y estructura que permitan la osteogénesis pero no suelen requerir rigidez y fuerza; en determinados casos un cierto grado de ductilidad puede ser útil pero probablemente se afectaría la organización de su estructura interna y sería a cambio de perder capacidad osteoconductora que afectaría a la osteogénesis. Por, una caja intersomática requerirá rigidez y fuerza para sostener los cuerpos vertebrales, acompañándose de biocompatibilidad y estructura osteoconductora. En una caja, que viene preformada con un diseño conveniente a ocupar el espacio intersomático, no es necesaria la ductilidad. Las cajas actuales cumplen perfectamente todos los requerimientos físicos, pero el problema para su aflojamiento no es físico sino biológico, aunque derivado, en gran parte, de que sus propiedades físicas son diferentes a las del hueso. En principio una caja intersomática muestra un anclaje muy sólido, sin embargo, progresivamente el lecho receptor, como tejido vivo, modifica sus propiedades físicas y la caja acaba aflojándose. Para que una caja no se aflojara debería poseer la misma rigidez, fuerza y ductilidad que el hueso, dejándose colonizar por el mismo para integrarse con el hueso sub y suprayacente como un mismo cuerpo físico.
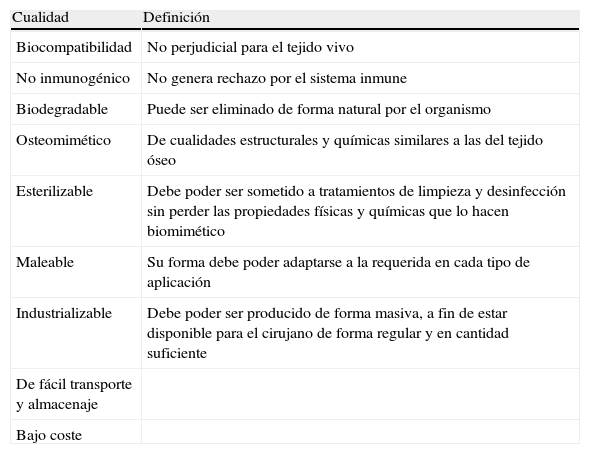
Para ser osteomimético (afinidad a verse cubierto de hueso) un material debe ser, idealmente, tridimensional y poroso, a fin de permitir su infiltración por vasos sanguíneos y células mesenquimales y osteoprogenitoras (fig. 5). Debe tener resistencia a la tensión y la compresión en grado similar a la resistencia del propio hueso. Además, debería tener afinidad por los factores de crecimiento osteoinductores, como las BMP. El osteomimetismo se complementa con la osteoconducción, es decir con la capacidad que tiene un material para permitir el crecimiento óseo en su superficie. El material osteoconductor ideal es aquel que cumpliera todos los requisitos detallados en la tabla 2.
Características de los materiales osteoconductores6
| Cualidad | Definición |
| Biocompatibilidad | No perjudicial para el tejido vivo |
| No inmunogénico | No genera rechazo por el sistema inmune |
| Biodegradable | Puede ser eliminado de forma natural por el organismo |
| Osteomimético | De cualidades estructurales y químicas similares a las del tejido óseo |
| Esterilizable | Debe poder ser sometido a tratamientos de limpieza y desinfección sin perder las propiedades físicas y químicas que lo hacen biomimético |
| Maleable | Su forma debe poder adaptarse a la requerida en cada tipo de aplicación |
| Industrializable | Debe poder ser producido de forma masiva, a fin de estar disponible para el cirujano de forma regular y en cantidad suficiente |
| De fácil transporte y almacenaje | |
| Bajo coste |
Dado que un material osteoconductor debe poder ser colonizado por células, principalmente (si bien no exclusivamente) MSC, preosteoblastos y progenitores vasculares, son de especial importancia las propiedades superficiales del material. La superficie debe ofrecer un hospedaje adecuado a las moléculas de adhesión celular, a través de las cuales las células se relacionarán con el material. Este hospedaje depende de la composición química, dureza y topología micro y nanoscópica de la superficie del material121. Muchas de las características requeridas las tienen los componentes de calcio y también el titanio (fig. 5). Ambos, componentes de calcio y titanio, son excelentes osteoconductores pero ni uno ni otro poseen propiedades osteogénicas ni osteoinductoras, por tanto, son necesarias las células y los factores de crecimiento. El fosfato cálcico es un buen osteoconductor que se reabsorbe con el tiempo. Del mismo modo, gracias a su modulo de elasticidad, biocompatibilidad y disponibilidad, el titanio es un metal muy utilizado para implantes ortopédicos. La superficie del titanio es excelente para el crecimiento celular y puede tratarse de tal forma que esta se incremente mediante un aumento de la rugosidad con lo que el área de crecimiento es superior6.
Una vez que un implante de titanio se introduce en un cuerpo vivo, el implante se cubre inmediatamente de una biocapa proteica en contacto con la sangre. Esta biocapa es una matriz provisional para la adhesión celular. La superficie puede determinar qué proteína se absorbe y la orientación de la adhesión. La adhesión celular comienza en el plazo de unos minutos, estando controlado este proceso por las características de la superficie (fig. 5). En los implantes ortopédicos, como están anodizados, la superficie no es realmente de titanio sino de óxido. Los iones metálicos se difunden a diferentes ritmos en el óxido, y el oxígeno se difunde desde el óxido al metal. Los iones biológicos se incorporan sobre el óxido con proteínas de absorción que sufren cambios con el tiempo. El tamaño, carga y estabilidad de la proteína afecta tanto a la llegada celular y velocidad de adhesión como a la interacción con la superficie. Se puede decir que este proceso está influido por las características de la superficie: topografía (cantidad de células adheridas), química (determina tipos de fuerzas intermoleculares), hidrofobicidad (determina cuáles y cuánto de cada una de las proteínas se ligan), heterogeneidad (diferentes dominios moleculares con diferentes proteínas) y potencial (influencia en la distribución de iones en solución e interacción proteica).
Los materiales, sean cuales fueren, se rigen por los mismos principios de la física, basándose estos en su estructura atómica. El proceso de fabricación de un material afecta a su composición y comportamiento futuro con relación a sus propiedades físicas. Los metales están hechos de cristales posicionados en una estructura tridimensional formando una misma red. Un implante típico para uso médico está constituido de muchos átomos dentro de un mismo cristal y muchos cristales constituyen un grano del material. Esta disposición condiciona las propiedades del mismo, además los defectos que tienen todos los cristales (zonas vacantes de átomos, dislocaciones, límites entre cristales, grietas, etc.) también participan de las características del material. Por ello es importante no dejarse seducir por el precio de los materiales a aplicar sino por las características técnicas y de fabricación, ya que un proceso de fabricación que deje, por ejemplo, pequeñas zonas vacantes de átomos o grietas no afectará al material si no recibe solicitación mecánica pero sí se romperá si la recibe. De este modo un material puede ser barato pero no costoefectivo. La elección de un material, por tanto, debe basarse en los requerimientos físicos y biológicos necesitados; en esta elección debe contemplarse el concepto de costoefectividad. Por otra parte, las características macroscópicas de los implantes influyen también de forma determinante en sus prestaciones. Por ejemplo, una barra para un sistema pedicular disminuye su rigidez 4 veces si simplemente su sección se lleva a la mitad.
Valoración de resultadosEn cualquier área científica, el conocimiento procede de la investigación, y, por tanto, los diseños de los estudios de investigación son muy importantes. En investigación clínica existen 2 tipos de estudios: los observacionales (el investigador observa durante un tiempo qué ocurre en 2 grupos de personas que comparten, antes de empezar el estudio, las mismas variables, excepto una en uno de los grupos motivo de estudio, sin que el investigador haya actuado modificando nada en ningún momento) y los experimentales (el investigador observa qué ocurre en 2 grupos de personas que comparten las mismas variables previas pero actúa en uno de los grupos aplicando un tratamiento).
Los estudios clínicos experimentales son los indicados para conocer el resultado de un tratamiento. De entre estos estudios, los ensayos clínicos controlados aleatorizados son el estándar de oro. Un ensayo clínico controlado es el que consigue que todas las variables previas al tratamiento sean iguales para todos los grupos evitando que los resultados finales estén condicionados porque las variables de los grupos no eran homogéneas. En los estudios sobre artrodesis de raquis hay muchas variables a controlar, entre ellas la edad, los antecedentes patológicos y de tratamientos previos, sean quirúrgicos o farmacológicos, utilizar el mismo tipo de instrumentación, seguimiento, etc.
Más en concreto, en relación con los sustitutos óseos la edad es una variable fundamental ya que siendo las MSC fundamentales para la osteogénesis y teniendo los pacientes ancianos una pobre población de MSC32, en un tamaño muestral pequeño el que se asignen más o menos pacientes jóvenes o ancianos alterará los resultados. Este es uno de los problemas más frecuentemente encontrado en los estudios clínicos sobre resultados en raquis con sustitutos óseos; se introducen pacientes que «han alcanzado la madurez ósea» y ello implica incluir, por ejemplo, intervalos de pacientes entre 20 años y 80 años. Este ejemplo es extensivo a cualquier variable. Otras variables, como si recibieron tratamiento con fármacos antireabsortivos u otros que interaccionen con la osteogénesis, o utilizar el mismo tipo de instrumentación son muy importantes y, sin embargo, se ignoran con frecuencia. Considerar que un ensayo clínico controlado aleatorizado es un estudio de calidad debe responderse más tras analizarlo críticamente que tras ver su simple denominación. Por ello, es exigible que los estudios controlen las variables atendiendo a las peculiaridades de la misma y amplíen el número de elementos en cada grupo de tal manera que el error aleatorio quede minimizado. No es esta la norma en los estudios sobre biología de la osteogénesis y su aplicación clínica. Especialmente en la artrodesis vertebral.
El ensayo clínico controlado debe aleatorizar la asignación de los individuos al grupo de tratados o no tratados de manera que no se intervenga de forma interesada para conseguir que el tratamiento sea mejor o peor. Sin embargo, las cohortes prospectivas consecutivas pueden conseguir mejor información que las simplemente aleatorizadas, ya que, considerando que los pacientes llegan en sí mismos de forma aleatorizada, algunas variables se pueden controlar con más facilidad.
También en investigación, como en cualquier diagnóstico, la precisión y exactitud de los métodos que verifican si ha habido fusión ósea es muy importante. La evaluación mediante radiografías simples presenta escasa fiabilidad, estando sometida a errores sistemáticos. Igualmente el tiempo de seguimiento, ya que el autoinjerto cortical puede fracasar a los 2 años y recuperar sus propiedades, si no se ha colapsado, a los 4 años. El aloinjerto puede reabsorberse antes1. En un estudio prospectivo aleatorizado donde se comparó la OP-1 en pasta («putty») con una mezcla de autoinjerto más gránulos de cerámica de calcio fosfato en artrodesis posterolateral lumbar, se observaron radiográficamente resultados similares al año de seguimiento. Sin embargo, los resultados fueron radicalmente distintos cuando se retiró la instrumentación y se exploró la masa de fusión; no solo la fusión con OP-1 fue mayor que el control, sino que el propio grupo de OP-1 mostraba peores resultados en la exploración quirúrgica que en la radiográfica99. Los estudios con tomografía computarizada espiral de alta velocidad (TC) también han mostrado mejor exactitud con una altísima concordancia69, sin embargo debido al riesgo radiactivo el seguimiento de estos pacientes no debe practicarse sistemáticamente mediante TC.
La inferencia de los estudios en animales al humano está condicionada por las distintas capacidades biológicas de unos y otros. Del mismo modo, los principios biomecánicos son también diferentes. En el conejo no existen diferencias significativas entre la fusión que proporciona el autoinjerto y el aloinjerto, circunstancia que sabemos no ocurre en humanos. Esta fusión es similar a la utilización de matriz ósea desmineralizada xenogénica84.
En definitiva, la artrodesis del raquis aún adolece de la falta de un sustituto óseo que mejore la capacidad osteogénica del autoinjerto a la vez que suprima su morbilidad. El diagnóstico de la fusión es otro problema no resuelto debido a la alta dosis radiactiva de la TC, y la evaluación de resultados requiere estudios prospectivos bien diseñados. La fijación con constructos de alta estabilidad primaria y aporte de autoinjerto sigue siendo el estándar.
Nivel de evidenciaNivel de evidencia v.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLos autores agradecen la financiación obtenida. Entre otras, DGICYT (SAF99-0133), MCYT (SAF2002-02183), FIS (PI021758), BIO2006-03599, SAF99-0133, Red de Terapia Celular RD06/0010/0014, CIBER CB06/01/1015, BIO2009-13903-C02-01, PLE2009-0163, PI10/02529, P07-CVI-2781, PI-0729-2010, and PAID BIO217. Consejería de Salud de la Junta de Andalucía Exp. 53/00. Exp. TCMR 0012/2006. PI-0437/2007 y P07-CVI-02781.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.