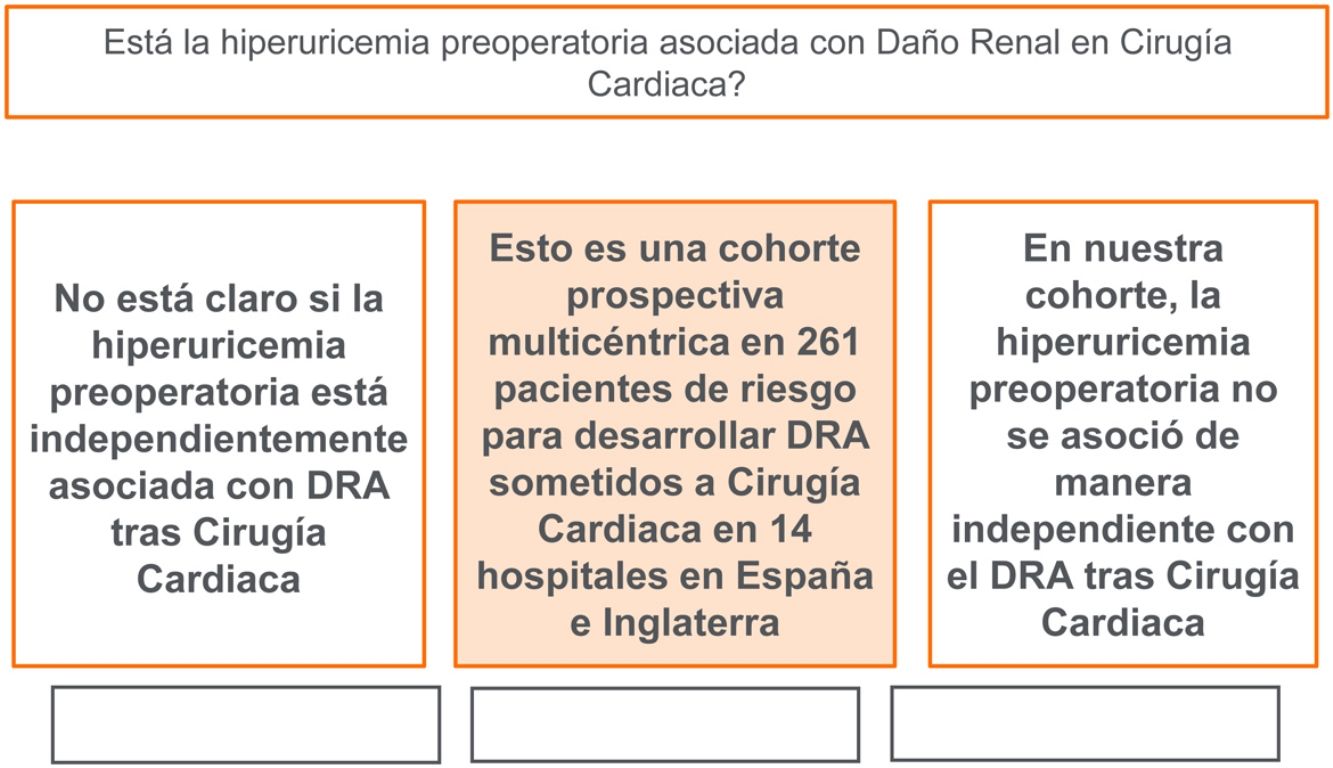
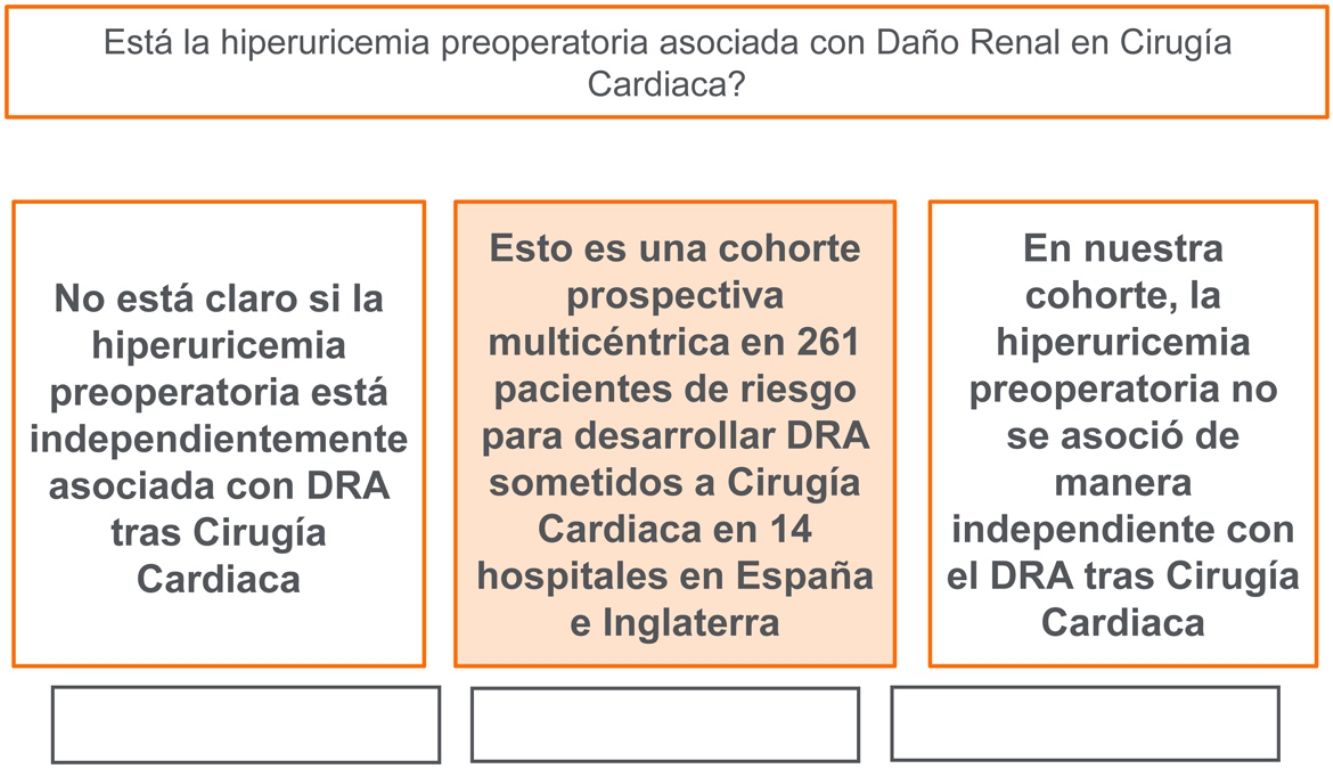
No está claro si la elevación de ácido úrico sérico (AUS) preoperatorio puede desempeñar un papel en el desarrollo de daño renal agudo (DRA) asociado a cirugía cardiaca (DRA-CS). Se realizó un estudio de cohortes para evaluar la influencia de la hiperuricemia en el DRA en pacientes de alto riesgo para desarrollar DRA-CS.
DiseñoEstudio de cohortes prospectivo multicéntrico.
EntornoCatorce hospitales universitarios en España y en Reino Unido.
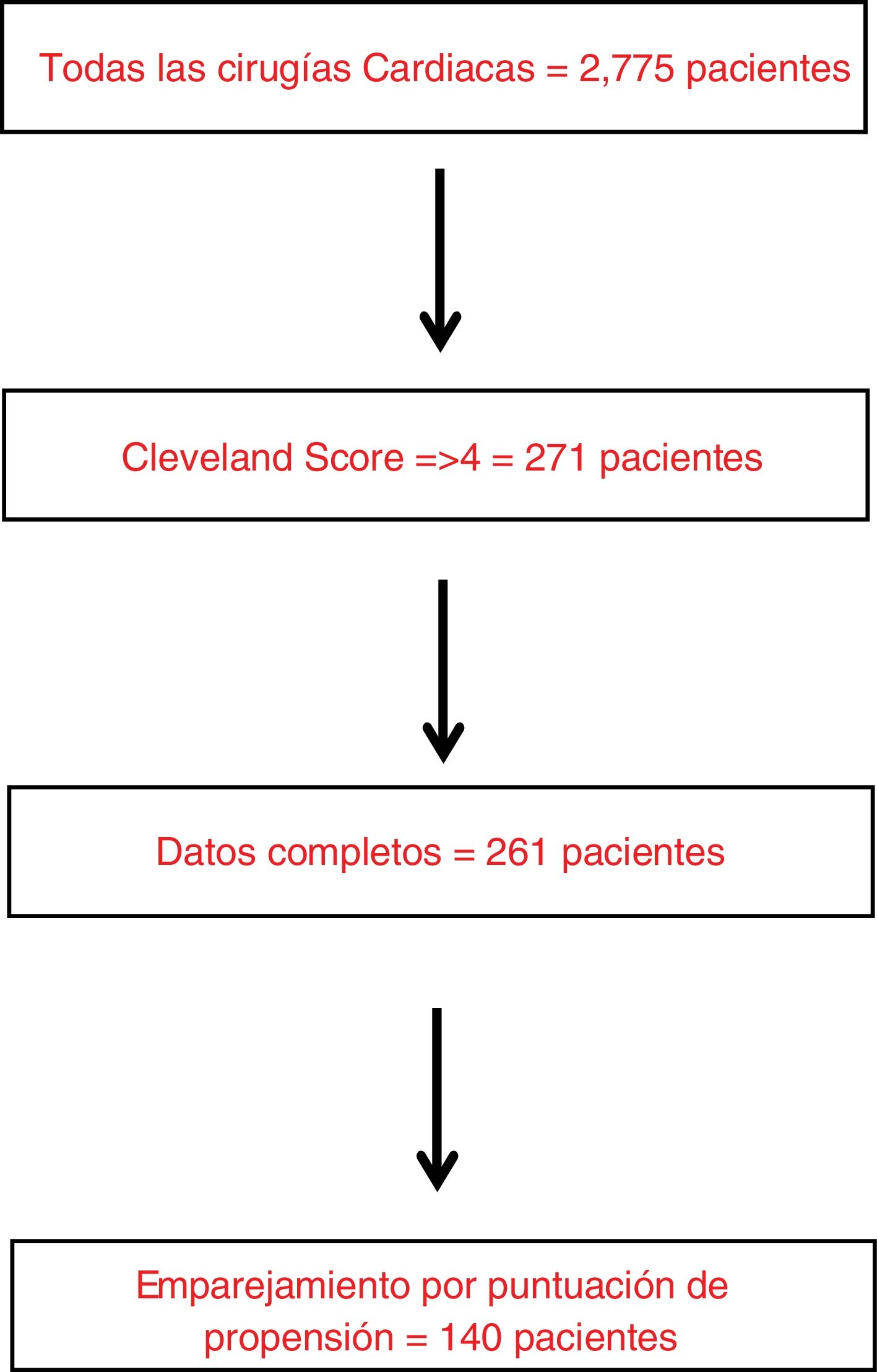
ParticipantesSe estudiaron a 261 pacientes consecutivos con alto riesgo de desarrollar DRA-CS, según una puntuación de Cleveland ≥4 puntos, de julio a diciembre de 2017.
IntervencionesNinguna.
Mediciones y resultados principalesSe utilizaron los criterios AKIN para la definición de DRA. Para determinar la asociación ajustada entre hiperuricemia (>=7mg/dL) e DRA se utilizaron modelos de regresión logística multivariable y análisis de pares emparejados por puntuaje de propensión.
El AUS preoperatorio elevado (>=7mg/dL) estaba presente en 190 pacientes (72,8%), mientras que la DRA-CS se produjo en 145 pacientes (55,5%). En los modelos de regresión logística multivariable, la hiperuricemia no se asoció con un aumento significativo del riesgo de DRA (Odds Ratio [OR] ajustado: 1,58; intervalo de confianza [IC] 95%: 0,81-3; p=0,17). En el análisis de emparejamiento por puntaje de propensión de 140 pacientes, el grupo de hiperuricemia experimentó probabilidades ajustadas similares de DRA (OR 1,05; IC 95%: 0,93-1,19; p=0,37).
ConclusionesLa hiperuricemia no se asoció con un mayor riesgo de DRA en esta cohorte de pacientes con alto riesgo de desarrollar DRA-CS.
It is unclear whether preoperative serum uric acid (SUA) elevation may play a role in the development of acute kidney injury (AKI) associated with cardiac surgery (CSA-AKI). We conducted a cohort study to evaluate the influence of preoperative hyperuricemia on AKI in patients at high risk for developing SC-AKI.
DesignMulticenter prospective international cohort study.
SettingFourteen university hospitals in Spain and the United Kingdom.
ParticipantsWe studied 261 consecutive patients at high risk of developing CSA-AKI, according to a Cleveland score ≥4 points, from July to December 2017.
InterventionsNone.
Measurements and Main ResultsAKIN criteria were used for the definition of AKI. Multivariable logistic regression models and propensity score-matched pairwise analysis were used to determine the adjusted association between preoperative hyperuricemia (> = 7 mg/dL) and AKI. Elevated preoperative AUS (> = 7 mg/dL) was present in 190 patients (72.8%), whereas CSA-AKI occurred in 145 patients (55.5%). In multivariable logistic regression models, hyperuricemia was not associated with a significantly increased risk of AKI (adjusted Odds Ratio [OR]: 1.58; 95% confidence interval [CI]: 0.81-3; p = 0.17). In propensity score-matched analysis of 140 patients, the hyperuricemia group experienced similar adjusted odds of AKI (OR 1.05, 95% CI 0.93-1.19, p = 0.37).
ConclusionsHyperuricemia was not associated with an increased risk of AKI in this cohort of patients undergoing cardiac surgery at high risk of developing CSA-AKI.
El daño renal agudo (DRA) posoperatorio es frecuente tras la cirugía cardiaca (DRA-CS). Se asocia a un empeoramiento de los resultados clínicos y la supervivencia a corto y largo plazo, así como a un aumento de los costes para el paciente1–3. Dado el gran número de intervenciones de cirugía cardiaca que se realizan anualmente en todo el mundo (más de un millón de intervenciones), se trata de un problema sanitario importante4. Los modelos predictivos que estiman el riesgo de DRA de los pacientes pueden ser útiles para optimizar los cuidados perioperatorios y prevenir el DRA en estos pacientes.
Cada vez hay más pruebas epidemiológicas y clínicas de que la hiperuricemia, incluso en concentraciones bajas sin causar la precipitación intratubular de cristales, puede desempeñar un papel en la patogénesis del DRA5. El ácido úrico sérico (AUS) puede desempeñar un papel en muchos de los mecanismos propuestos que conducen al DRA, como la inducción de la vasoconstricción renal6, la inflamación, la antiangiogénesis y el deterioro de la autorregulación7, además de desempeñar funciones importantes en las respuestas inmunitarias tanto adaptativas como innatas8,9.
Un estudio reciente ha evaluado la asociación entre las concentraciones preoperatorias elevadas de AUS y el desarrollo de DRA posoperatoria en una cohorte de pacientes sometidos a cirugía cardiaca10. Los datos de este estudio mostraron que la hiperuricemia preoperatoria estaba asociada con el DRA posoperatoria en pacientes sometidos a cirugía coronaria.
En nuestro estudio, pretendíamos determinar la asociación entre la hiperuricemia preoperatoria en pacientes de alto riesgo (puntuación de Cleveland >=4) sometidos a cirugía cardiaca, y el riesgo de desarrollar DRA.
MétodosDiseño del estudioEste estudio de cohortes prospectivo multicéntrico en 14 hospitales españoles y británicos incluyó a todos los pacientes consecutivos de 18 años o más con una puntuación Cleveland ≥4 sometidos a cirugía cardiaca entre julio y diciembre de 2017 (fig. 1). La puntuación de Cleveland es una escala bien validada para identificar a los pacientes con riesgo de DRA grave después de la cirugía cardiaca11. Se incluyeron todos los procedimientos de cirugía cardiaca (incluidos los casos de cirugía aórtica mayor que necesitaron circulación extracorpórea (CEC), excepto la pericardiectomía y el trasplante cardiaco. Además, se excluyeron los pacientes con insuficiencia renal grave preoperatoria (definida como necesidad de diálisis o filtración glomerular estimada [FGe] <15mL/min/1,73 m2) o las embarazadas.
Este estudio fue aprobado por los Comités de Ética de cada institución local y de conformidad con la declaración de Helsinki. El consentimiento informado fue firmado por el paciente o su sustituto en la toma de decisiones durante el periodo perioperatorio.
Exposición de interésLa cohorte se dividió en dos grupos, los pacientes que tenían un AUS >=7mg/dL (n=190) y aquellos que tenían un AUS <7mg/dL (n=71) en el preoperatorio. El AUS se midió en todos los pacientes, el mismo día, antes de la cirugía. Dado que el efecto oxidante del ácido úrico se manifiesta con un AUS >=5,5mg/dL12, se utilizó una variable categórica, y no continua. El umbral de 7mg/dL o más se utilizó basándose en estudios previos12,13.
Variable dependiente primariaLa variable dependiente primaria fue el DRA según la definición de los criterios de AKIN (estadios I, II o III)14. Para aplicar estos criterios, se midió la creatinina a las seis, 12, 24 y 48 horas del posoperatorio.
Análisis estadísticoSTATA Versión 13.0 (Stata-Corp. 2013. Software estadístico Stata: Release 13. College Station, TX: Stata Corp LP) se utilizó para todos los análisis estadísticos. Un valor p de 2 colas inferior a 0,05 definió la significación estadística.
Inicialmente, se utilizaron estadísticas descriptivas para caracterizar a los pacientes dentro de estratos definidos por sus niveles preoperatorios de AUS (es decir, AUS >=7 vs. AUS <7), así como por su desarrollo de DRA posoperatorio (DRA vs. no DRA). Las variables categóricas se describieron mediante porcentajes, y las variables continuas, mediante medias con desviaciones estándar o medianas con rangos intercuartílicos. Se utilizó la prueba de Shapiro-Wilk para determinar si las variables tenían una distribución normal.
A continuación se utilizó un modelo de regresión logística multivariable para estimar la asociación ajustada entre la hiperuricemia y los resultados posoperatorios de interés.
Las covariables incluidas fueron datos demográficos (edad, sexo), area de superficie corporal, reintervención, FGe basal, New York Heart Association [NYHA]), comorbilidades (diabetes mellitus, enfermedad pulmonar obstructiva crónica (EPOC), insuficiencia cardiaca congestiva (ICC), enfermedad renal crónica [ERC]), fracción de eyección ventricular izquierda (FEVI), puntuación de Cleveland basal y tiempo de CEC.
Todos los resultados se expresaron como Odds Ratio (OR) ajustadas con intervalos de confianza (IC) 95%. Se evaluó el rendimiento de estos modelos de regresión mediante varios enfoques diferentes: a) evaluación de la discriminación del modelo mediante el estadístico c, b) validación «bootstrap» interna con 1.000 réplicas, c) evaluación de cualquier multicolinealidad importante mediante el factor de inflación de la varianza, y d) un análisis de sensibilidad en el que se repitieron los análisis de regresión excluyendo covariables que podrían estar en la vía causal entre hiperuricemia y DRA.
También se utilizaron métodos de emparejamiento por puntuje de propensión (70 pares emparejados) para comparar los resultados de los pacientes con hiperuricemia frente a los que no la padecían. La puntuación de propensión se estimó utilizando el paquete «pscore» de Stata, que implementa un modelo de regresión «probit» con la hiperuricemia como variable independiente. Las variables predictoras clínicamente importantes incluidas en el modelo probit fueron demográficas (edad, sexo), area de superficie corporal, reintervención, FGe basal, NYHA), comorbilidades (diabetes mellitus, EPOC, ICC, ERC), FEVI, puntuación de Cleveland basal, tiempo de CEC y tiempo de pinzamiento aórtico.
Se realizó un emparejamiento 1:1 con el vecino más próximo utilizando el algoritmo «teffects psmatch» de Stata basado en la puntuación de propensión estimada. Se calcularon los efectos medios del tratamiento entre los individuos tratados utilizando el paquete «teffects» de Stata. A continuación, se expresaron los resultados como OR ajustadas con IC 95%.
El tamaño de la muestra se determinó por el número de pacientes elegibles que se sometieron a cirugía durante el periodo de tiempo de interés. Como se ha recomendado, no se realizó un cálculo de potencia post hoc, dado que sería metodológicamente inadecuado; en su lugar, se utilizaron los IC 95% para ayudar a interpretar los resultados del análisis15.
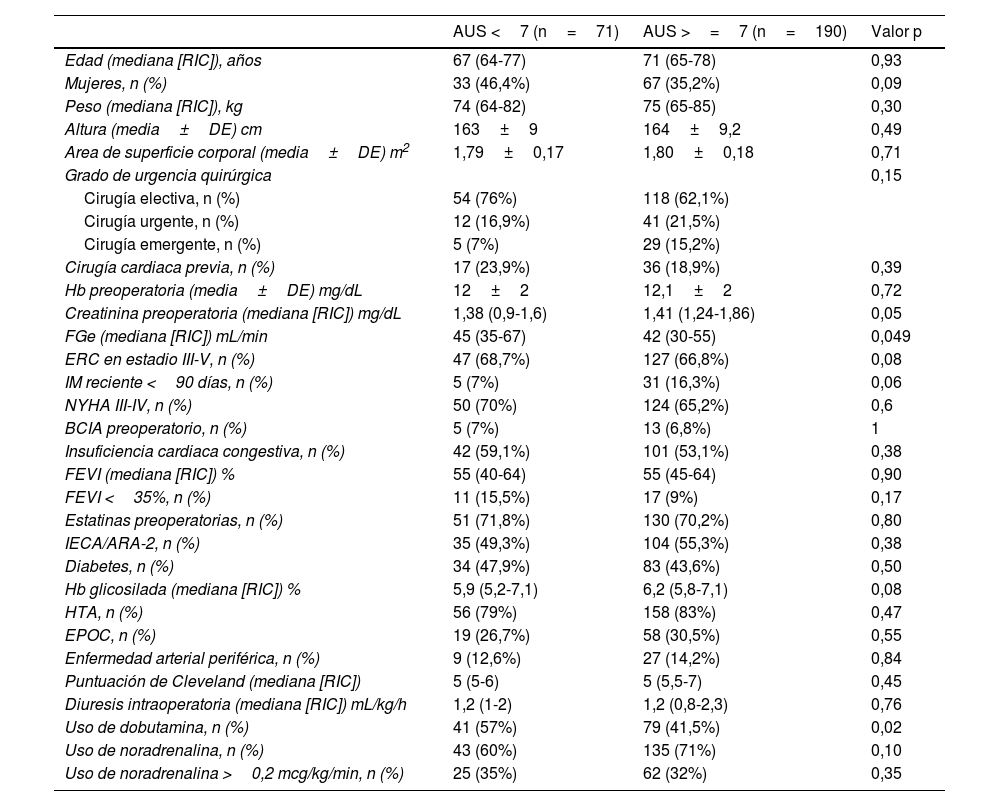
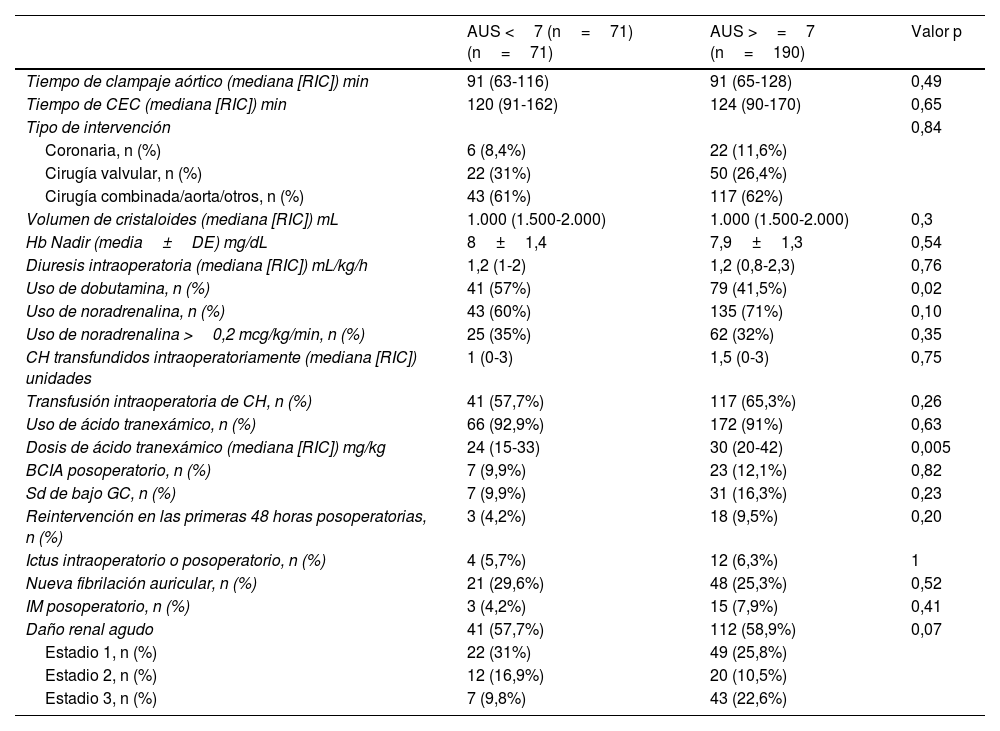
ResultadosDatos descriptivosNuestra cohorte incluyó 261 pacientes consecutivos sometidos a cirugía cardiaca y con mayor riesgo de desarrollar DRA posoperatoria, según una puntuación de Cleveland ≥4. Un total de 190 (72,8%) pacientes de nuestra cohorte eran hiperuricémicos (>=7mg/dL) en el preoperatorio. Se produjo DRA posoperatoria en 145 (55,5%) pacientes. Entre los pacientes de toda la cohorte, 41 (15,7%) fallecieron sin abandonar el hospital. Los pacientes del grupo de hiperuricemia presentaban una mayor carga de comorbilidad (p. ej., mayor peso, menor FGe, mayor creatinina preoperatoria y Hb A1C ligeramente superior (tabla 1). No se observaron diferencias entre ambos grupos en las caracteristicas intraoperatorias y complicaciones posoperatorias, salvo un menor porcentaje de pacientes usaron dobutamina y un uso de mayor dosis de ácido tranexámico en el grupo de hiperuricemia (tabla 2).
Características basales
| AUS <7 (n=71) | AUS >=7 (n=190) | Valor p | |
|---|---|---|---|
| Edad (mediana [RIC]), años | 67 (64-77) | 71 (65-78) | 0,93 |
| Mujeres, n (%) | 33 (46,4%) | 67 (35,2%) | 0,09 |
| Peso (mediana [RIC]), kg | 74 (64-82) | 75 (65-85) | 0,30 |
| Altura (media±DE) cm | 163±9 | 164±9,2 | 0,49 |
| Area de superficie corporal (media±DE) m2 | 1,79±0,17 | 1,80±0,18 | 0,71 |
| Grado de urgencia quirúrgica | 0,15 | ||
| Cirugía electiva, n (%) | 54 (76%) | 118 (62,1%) | |
| Cirugía urgente, n (%) | 12 (16,9%) | 41 (21,5%) | |
| Cirugía emergente, n (%) | 5 (7%) | 29 (15,2%) | |
| Cirugía cardiaca previa, n (%) | 17 (23,9%) | 36 (18,9%) | 0,39 |
| Hb preoperatoria (media±DE) mg/dL | 12±2 | 12,1±2 | 0,72 |
| Creatinina preoperatoria (mediana [RIC]) mg/dL | 1,38 (0,9-1,6) | 1,41 (1,24-1,86) | 0,05 |
| FGe (mediana [RIC]) mL/min | 45 (35-67) | 42 (30-55) | 0,049 |
| ERC en estadio III-V, n (%) | 47 (68,7%) | 127 (66,8%) | 0,08 |
| IM reciente <90 días, n (%) | 5 (7%) | 31 (16,3%) | 0,06 |
| NYHA III-IV, n (%) | 50 (70%) | 124 (65,2%) | 0,6 |
| BCIA preoperatorio, n (%) | 5 (7%) | 13 (6,8%) | 1 |
| Insuficiencia cardiaca congestiva, n (%) | 42 (59,1%) | 101 (53,1%) | 0,38 |
| FEVI (mediana [RIC]) % | 55 (40-64) | 55 (45-64) | 0,90 |
| FEVI <35%, n (%) | 11 (15,5%) | 17 (9%) | 0,17 |
| Estatinas preoperatorias, n (%) | 51 (71,8%) | 130 (70,2%) | 0,80 |
| IECA/ARA-2, n (%) | 35 (49,3%) | 104 (55,3%) | 0,38 |
| Diabetes, n (%) | 34 (47,9%) | 83 (43,6%) | 0,50 |
| Hb glicosilada (mediana [RIC]) % | 5,9 (5,2-7,1) | 6,2 (5,8-7,1) | 0,08 |
| HTA, n (%) | 56 (79%) | 158 (83%) | 0,47 |
| EPOC, n (%) | 19 (26,7%) | 58 (30,5%) | 0,55 |
| Enfermedad arterial periférica, n (%) | 9 (12,6%) | 27 (14,2%) | 0,84 |
| Puntuación de Cleveland (mediana [RIC]) | 5 (5-6) | 5 (5,5-7) | 0,45 |
| Diuresis intraoperatoria (mediana [RIC]) mL/kg/h | 1,2 (1-2) | 1,2 (0,8-2,3) | 0,76 |
| Uso de dobutamina, n (%) | 41 (57%) | 79 (41,5%) | 0,02 |
| Uso de noradrenalina, n (%) | 43 (60%) | 135 (71%) | 0,10 |
| Uso de noradrenalina >0,2 mcg/kg/min, n (%) | 25 (35%) | 62 (32%) | 0,35 |
AUS: ácido úrico sérico; BCIA: balón de contrapulsación intraaórtica; DE: desviación estándar.; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FGe: filtración glomerular estimada; FEVI: fracción de eyección del ventrículo izquierdo; Hb: hemoglobina; HTA: hipertensión arterial; IECA: inhibidores de la enzima convertidora de la angiotensina; IM: infarto de miocardio; NYHA: New York Heart Association; RIC: Rango Intercuartil.
Características intraoperatorias y complicaciones posoperatorias
| AUS <7 (n=71)(n=71) | AUS >=7 (n=190) | Valor p | |
|---|---|---|---|
| Tiempo de clampaje aórtico (mediana [RIC]) min | 91 (63-116) | 91 (65-128) | 0,49 |
| Tiempo de CEC (mediana [RIC]) min | 120 (91-162) | 124 (90-170) | 0,65 |
| Tipo de intervención | 0,84 | ||
| Coronaria, n (%) | 6 (8,4%) | 22 (11,6%) | |
| Cirugía valvular, n (%) | 22 (31%) | 50 (26,4%) | |
| Cirugía combinada/aorta/otros, n (%) | 43 (61%) | 117 (62%) | |
| Volumen de cristaloides (mediana [RIC]) mL | 1.000 (1.500-2.000) | 1.000 (1.500-2.000) | 0,3 |
| Hb Nadir (media±DE) mg/dL | 8±1,4 | 7,9±1,3 | 0,54 |
| Diuresis intraoperatoria (mediana [RIC]) mL/kg/h | 1,2 (1-2) | 1,2 (0,8-2,3) | 0,76 |
| Uso de dobutamina, n (%) | 41 (57%) | 79 (41,5%) | 0,02 |
| Uso de noradrenalina, n (%) | 43 (60%) | 135 (71%) | 0,10 |
| Uso de noradrenalina >0,2 mcg/kg/min, n (%) | 25 (35%) | 62 (32%) | 0,35 |
| CH transfundidos intraoperatoriamente (mediana [RIC]) unidades | 1 (0-3) | 1,5 (0-3) | 0,75 |
| Transfusión intraoperatoria de CH, n (%) | 41 (57,7%) | 117 (65,3%) | 0,26 |
| Uso de ácido tranexámico, n (%) | 66 (92,9%) | 172 (91%) | 0,63 |
| Dosis de ácido tranexámico (mediana [RIC]) mg/kg | 24 (15-33) | 30 (20-42) | 0,005 |
| BCIA posoperatorio, n (%) | 7 (9,9%) | 23 (12,1%) | 0,82 |
| Sd de bajo GC, n (%) | 7 (9,9%) | 31 (16,3%) | 0,23 |
| Reintervención en las primeras 48 horas posoperatorias, n (%) | 3 (4,2%) | 18 (9,5%) | 0,20 |
| Ictus intraoperatorio o posoperatorio, n (%) | 4 (5,7%) | 12 (6,3%) | 1 |
| Nueva fibrilación auricular, n (%) | 21 (29,6%) | 48 (25,3%) | 0,52 |
| IM posoperatorio, n (%) | 3 (4,2%) | 15 (7,9%) | 0,41 |
| Daño renal agudo | 41 (57,7%) | 112 (58,9%) | 0,07 |
| Estadio 1, n (%) | 22 (31%) | 49 (25,8%) | |
| Estadio 2, n (%) | 12 (16,9%) | 20 (10,5%) | |
| Estadio 3, n (%) | 7 (9,8%) | 43 (22,6%) |
AUS: ácido úrico sérico; BCIA: balón de contrapulsación intraaórtica; CEC: circulación extracorpórea; CH: concentrado de hematíes; DE: Desviación estándar; GC: gasto cardiaco; Hb: hemoglobina; IECA: Inhibidores de la enzima convertidora de la angiotensina; IM: infarto agudo de miocardio. RIC: rango intercuartil.
No se observaron diferencias estadisticamente significativas entre ambos grupos en cuanto a las probabilidades no ajustadas de DRA (OR 1,05; IC 95%: 0,6-1,8; p=0,86).
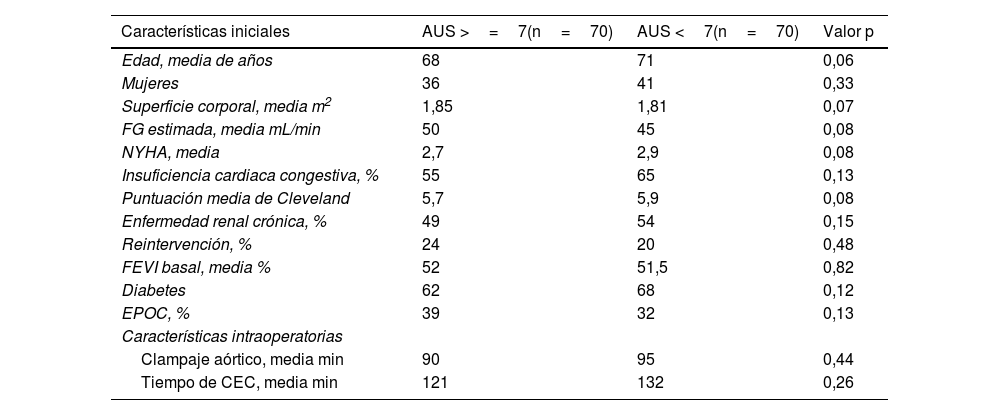
Análisis de emparejamiento por puntuación de propensiónTras el emparejamiento por puntaje de propensión, las características preoperatorias e intraoperatorias de los dos grupos fueron similares (tabla 3).
Características tras el análisis por pares de emparejamiento por puntuación de propensión
| Características iniciales | AUS >=7(n=70) | AUS <7(n=70) | Valor p |
|---|---|---|---|
| Edad, media de años | 68 | 71 | 0,06 |
| Mujeres | 36 | 41 | 0,33 |
| Superficie corporal, media m2 | 1,85 | 1,81 | 0,07 |
| FG estimada, media mL/min | 50 | 45 | 0,08 |
| NYHA, media | 2,7 | 2,9 | 0,08 |
| Insuficiencia cardiaca congestiva, % | 55 | 65 | 0,13 |
| Puntuación media de Cleveland | 5,7 | 5,9 | 0,08 |
| Enfermedad renal crónica, % | 49 | 54 | 0,15 |
| Reintervención, % | 24 | 20 | 0,48 |
| FEVI basal, media % | 52 | 51,5 | 0,82 |
| Diabetes | 62 | 68 | 0,12 |
| EPOC, % | 39 | 32 | 0,13 |
| Características intraoperatorias | |||
| Clampaje aórtico, media min | 90 | 95 | 0,44 |
| Tiempo de CEC, media min | 121 | 132 | 0,26 |
AUS: ácido úrico sérico; CEC: circulación extracorpórea; NYHA: New York Heart Association; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtración glomerular; EPOC: enfermedad pulmonar obstructiva crónica.
No hubo diferencias significativas entre los brazos con niveles elevados de AUS frente a los brazos con niveles normales de AUS con respecto a las probabilidades de DRA en el análisis de pares emparejados por puntuación de propensión (OR 1,05; IC 95%: 0,93-1,19; p=0,37) (tabla 4).
Diferencias ajustadas por riesgo para la variable dependiente primaria
| Resultados | AUS <7 vs: AUS >=7OR ajustada al riesgo (IC 95%) | Valor p |
|---|---|---|
| Modelo de regresión logística multivariable*: | ||
| OR 1,58 (0,81 - 3) | p=0,17 | |
| Modelo de regresión logística multivariable**: | ||
| Daño renal agudo | OR 1,72 (0,84 - 3,5) | p=0,13 |
| Análisis de emparejamiento por puntaje de propensión: | ||
| OR 1,05 (0,93-1,19) | p=0,37 |
AUS: ácido úrico sérico; OR: odds ratio.
Tras el ajuste del riesgo basado en el modelo de regresión logística multivariable, ser hiperuricémico (>=7mg/dL) en el preoperatorio no se asoció con un aumento significativo del riesgo de DRA (OR ajustado 1,58; IC 95%: 0,81-3; p=0,17) (tabla 4) en nuestra cohorte de pacientes de alto riesgo. El modelo de regresión mostró un rendimiento estable en la validación interna «bootstrap», sin evidencia de multicolinealidad significativa y buena discriminación (estadístico c 0,74). Como análisis de sensibilidad, se realizó un examen ajustado al riesgo mediante un modelo de regresión logística multivariable que incluía las covariables, uso de dobutamina intraoperatoria y dosis de ácido tranexámico en el modelo, y no se observaron diferencias en nuestro resultado primario, DRA - OR 1,72 (IC 95% 0,84-3,5); p=0,13 (tabla 4).
DiscusiónVarios estudios epidemiológicos han sugerido que la hiperuricemia se asocia con la hipertensión, las enfermedades cardiovasculares, la diabetes mellitus y la progresión de la ERC16–18. Además, se ha observado que la hiperuricemia se asocia a DRA en diferentes escenarios clínicos19,20. En los últimos años se han realizado varios estudios para estimar si la hiperuricemia era factor de riesgo independiente para aumentar la tasa y/o empeorar el pronóstico de la DRA en la población general. Uno de estos estudios es un metaanálisis realizado por Xu et al.12, en el que se observa una diferencia significativa en la tasa de DRA entre los pacientes con hiperuricemia y sin ella. La causalidad entre hiperuricemia y DRA en la población general es objeto de debate. Dos grandes ensayos clínicos aleatorizados han demostrado recientemente que el tratamiento de la hiperuricemia con alopurinol no modifica la progresión de la ERC en pacientes con enfermedad renal diabética de temprana a moderada21,22. Lo que sugiere que la hiperuricemia se asocia a un aumento de las comorbilidades, pero no tiene una relación independiente con la progresión de la ERC.
Los pacientes sometidos a cirugía cardiaca presentan niveles elevados de ácido úrico debido a la coexistencia de ICC23, ERC24,25, lesión por isquemia-reperfusión y tratamiento diurético. Tras la cirugía cardiaca, los niveles de ácido úrico pueden aumentar aún más, en el posoperatorio inmediato, en respuesta a la isquemia tisular o a la lesión renal26. En este sentido, el aumento del ASU podría reflejar un estado de estrés oxidativo, isquemia tisular o la presencia de vasoconstricción renal27.
Estos resultados concuerdan con otros estudios publicados que evalúan el efecto de la hiperuricemia sobre la función renal en la población sometida a cirugía cardiaca10,13,28–30.
Los datos de un estudio de cohortes retrospectivo, con 2.185 pacientes10, observaron que la hiperuricemia se asociaba a un aumento de la tasa del DRA. Sin embargo, esta cohorte incluía una población de pacientes diferente, con pacientes de más bajo riesgo de desarrollar DRA. Además, en el modelo de regresión logística no se incluyeron variables clínicas significativas importantes, como la ICC, la reintervención y la FEVI. Además, no se utilizó el análisis de pares de emparejamiento por puntuación de propensión para confirmar el análisis de regresión multivariable. Además, la capacidad de discriminación, medida por los estadísticos c, no mejoró significativamente cuando se incluyó el ácido úrico en el modelo multivariable.
Ahsan-Ejaz et al.,28 sugirieron que el ácido úrico podría ser un nuevo factor de riesgo de DRA en pacientes sometidos a determinadas cirugías cardiacas, como la reparación de aneurismas torácicos y la cirugía valvular aórtica o mitral. Sin embargo, se trataba de un estudio de cohortes con una muestra pequeña de 58 pacientes y con solo 18 casos de DRA.
Otro estudio observacional retrospectivo con 190 pacientes observó que los niveles preoperatorios de AUS estaban relacionados con el DRA posoperatorio en una relación curva en forma de J13. Sin embargo, esta cohorte incluía a pacientes de muy bajo riesgo, y 87% de los pacientes con DRA eran de grado AKIN I. Además, los resultados no se confirmaron mediante un análisis de emparejamiento por puntuación de propensión.
Los datos de un reciente estudio retrospectivo observacional de gran tamaño con 1.420 pacientes mostraron que los pacientes con niveles más altos de ácido úrico tenían una mayor incidencia de DRA29. Sin embargo, la cohorte incluía una población de pacientes diferente con pacientes de más bajo riesgo de desarrollar DRA. Además, en el modelo de regresión logística no se incluyeron variables clínicas significativas importantes, como la ICC, la reintervención, la FEVI y la arteriopatía periférica. Además, la hiperuricemia no se asoció a DRA grave. Además, no se utilizó el análisis de pares de emparejamiento por puntuación de propensión para confirmar el análisis de regresión multivariable.
Los datos de un estudio de cohortes retrospectivo con 1.019 pacientes observaron que la hiperuricemia (≥6,5mg/dL) estaba asociada a DRA30. Sin embargo, en el modelo de regresión logística no se incluyeron variables clínicas significativas importantes, como ICC, reintervención, diabetes mellitus, tipo de cirugía, cirugía de urgencia, EPOC y arteriopatía periférica. Además, la discriminación mediante estadísticos c no mejoró significativamente cuando se incluyó el ácido úrico en el modelo multivariable (AUROC 0,780 vs. 0,783 vs. 0,782). Además, no se utilizó el análisis de pares de emparejamiento por puntuación de propensión para confirmar el análisis de regresión multivariable.
Al contrario de la mayoría de estos estudios mencionados, en nuestro estudio de cohortes multicéntrico de 261 pacientes consecutivos con alto riesgo de desarrollar DRA-CS, se observó que la hiperuricemia preoperatoria (>=7g/dL), en comparación con el ácido úrico <7g/dL, no se asoció a riesgos significativamente mayores de DRA posoperatoria.
Deben tenerse en cuenta algunas limitaciones de nuestro estudio. En primer lugar, hubo diferencias basales significativas entre los grupos con hiperuricemia y sin hiperuricemia. Ajustamos estas diferencias para abordar esta cuestión con dos métodos diferentes: modelos de regresión y análisis de pares emparejados por puntuación de propensión. En segundo lugar, no podemos excluir la posibilidad de confusión residual no medida, como ocurre con la mayoría de los estudios observacionales. En tercer lugar, los IC 95% de nuestras estimaciones ajustadas fueron amplios. Así pues, aunque la estimación puntual es tranquilizadora, siguen siendo necesarios más estudios para confirmar la repercusión renal de la hiperuricemia en los pacientes de alto riesgo sometidos a cirugía. En cuarto lugar, la definición AKIN de DRA utilizada en nuestra cohorte incluye un período de tiempo de 48horas para los cambios agudos en la creatinina sérica, que podría ser demasiado corto, en comparación con el período de tiempo de siete días incluido en la definición KDIGO. Por último, en nuestra cohorte no se disponía de la tasa de pacientes en tratamiento de la hiperuricemia.
Los puntos fuertes de este estudio incluyen su población pragmática de cirugía cardiaca de alto riesgo en el mundo real, que incluye 14 hospitales, y el ajuste del riesgo mediante diferentes métodos (análisis de pares emparejados por puntuación de propensión y modelos de regresión logistica multivariable).
ConclusiónLa hiperuricemia preoperatoria en pacientes de alto riesgo no se asoció a un mayor riesgo de DRA-CS en este estudio de cohortes prospectivo multicéntrico.
Todos los autores han participado en los siguientes aspectos: 1) la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos, 2) la redacción del artículo o su revisión crítica en busca de contenido intelectual importante, 3) la aprobación final de la versión que se presentará, y 4) todos los autores aceptan ser responsables de todos los aspectos del trabajo para garantizar que las cuestiones relacionadas con la exactitud o la integridad de cualquier parte del trabajo se investiguen y resuelvan adecuadamente.
Declaración de autoríaTodos los autores han participado en los siguientes aspectos:
1) la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos, 2) la redacción del artículo o su revisión crítica en busca de contenido intelectual importante, 3) la aprobación final de la versión que se presentará, y 4) todos los autores aceptan ser responsables de todos los aspectos del trabajo para garantizar que las cuestiones relacionadas con la exactitud o la integridad de cualquier parte del trabajo se investiguen yresuelvan adecuadamente.
FinanciaciónEste estudio no cuenta con ninguna financiación ecónomica.
Conflicto de interesesLos autrores declaran que no tienen ningún tipo de conflicto de intereses.