La participación de mediadores lipídicos derivados del ácido araquidónico (AA) en la lesión hepatocelular de la cirrosis y su modulación por ácidos grasos omega-3 como los ácidos docosahexaenoico (DHA) y eicosapentaenoico (EPA) es un tema de interés creciente. El contenido de AA, EPA y DHA puede ser importante para explicar, entre otras funciones, el tono vasoconstrictor del hígado y la capacidad funcional (fagocitosis, producción de ROS) de las células inmunitarias observada en la cirrosis. El objetivo del trabajo fue estudiar las alteraciones en la composición de AA, DHA y EPA en plasma, membrana eritrocitaria y células inmunitarias de sangre periférica en pacientes con cirrosis y establecer su relación con el deterioro de la función hepática.
Pacientes y métodosSe analizó la composición de ácidos grasos de 42 pacientes con cirrosis clasificados según Child-Pugh y 10 controles sanos en plasma, membrana eritrocitaria y células mononucleares (PMBC) y polimorfonucleares (PMN) de sangre periférica por cromatografía de gases con detección por masas.
Resultados y conclusiones1) Los cirróticos presentan un descenso significativo en los porcentajes de AA, EPA y DHA en plasma y un descenso significativo de AA en membrana eritrocitaria. 2) El contenido de AA en plasma y en membrana eritrocitaria correlaciona con el deterioro en la función hepática (según Child-Pugh) y no depende de un deficitario aporte nutricional. 3) La composición en AA y DHA está alterada en los PBMC de cirróticos, lo que pudiera tener importancia en la funcionalidad de las células inmunitarias de estos enfermos.
The involvement of lipid mediators derived from arachidonic acid (AA) in cirrhosis hepatocellular injury and its modulation by omega-3 fatty acids, such as docosahexaenoic acid (DHA) and eicosapentaenoic (EPA) is a topic of growing interest. The content of AA, EPA and DHA may be important to explain, among other things, the vasoconstrictor tone of liver and functional capacity (phagocytosis, ROS production) of immune cells observed in cirrhosis. The objective was to study alterations in the composition of AA, DHA and EPA in plasma, erythrocyte membranes and peripheral blood immune cells in patients with cirrhosis and determine their relationship with liver function impairment.
Patients and methodsWe analyzed the fatty acid composition of 42 patients with cirrhosis using the Child-Pugh classification, and 10 healthy controls in plasma, erythrocyte membrane and mononuclear cells (PBMCs) and polymorphonuclear (PMN) from peripheral blood using gas chromatography with mass detection.
Results and conclusions1) Patients with cirrhosis showed significant decreases in the percentages of AA in plasma and erythrocyte membrane, as well as EPA and DHA in plasma. 2) AA content in plasma and erythrocyte membrane correlates with impaired liver function (Child scale) and it does not depend on a nutritional deficit. 3) AA and DHA composition varies also in PBMC (lymphocytes and monocytes) of cirrhosis, which may affect immune function of these cells.
El hígado es el órgano fundamental en la regulación del metabolismo lipídico y en la síntesis de ácidos grasos poliinsaturados (PUFA). El ácido araquidónico (AA, C20:4 n-6) es un PUFA de la serie omega-6 que se sintetiza en el organismo a partir del ácido linoleico (AL, C18:2 n-6). El AA participa como metabolito esencial precursor de la síntesis de eicosanoides1. Su principal reservorio funcional es la membrana celular donde se incorpora a triglicéridos, ésteres de colesterol y mayoritariamente a glicerofosfolípidos2,3. En respuesta a diferentes estímulos, el AA es liberado al citosol por la fosfolipasa A24 y rápidamente metabolizado por ciclooxigenasas (COX-1 y COX-2) y lipooxigenasas (5-LOX, 12-LOX, 15-LOX)5,6 produciendo múltiples eicosanoides como prostaglandinas, prostaciclinas, tromboxanos, y leucotrienos que participan en la respuesta inflamatoria, la agregación plaquetaria y la regulación del tono vasoconstrictor en función del tejido y tipo celular7,8.
Los principales PUFA de la serie omega-3 son el ácido eicosapentaenoico (EPA, C20:5 n-3) y el ácido docosahexanoico (DHA, C22:6 n-3). Se sintetizan de forma limitada en el organismo a partir del α-linolénico (ALA, C18:3 n-3). Al igual que el AA pueden ser almacenados en los glicerofosfolípidos de las membranas celulares y su importancia radica en que pueden competir con el AA por enzimas metabólicos comunes modulando la producción de eicosanoides9.
El deterioro en la función hepática producida en la cirrosis se ha relacionado con cambios en el perfil de ácidos grasos en plasma y en membrana del eritrocito10,11, con aumentos en la composición de ácidos grasos saturados y descensos en monoinsaturados, y principalmente, con descensos en el contenido de AA12.
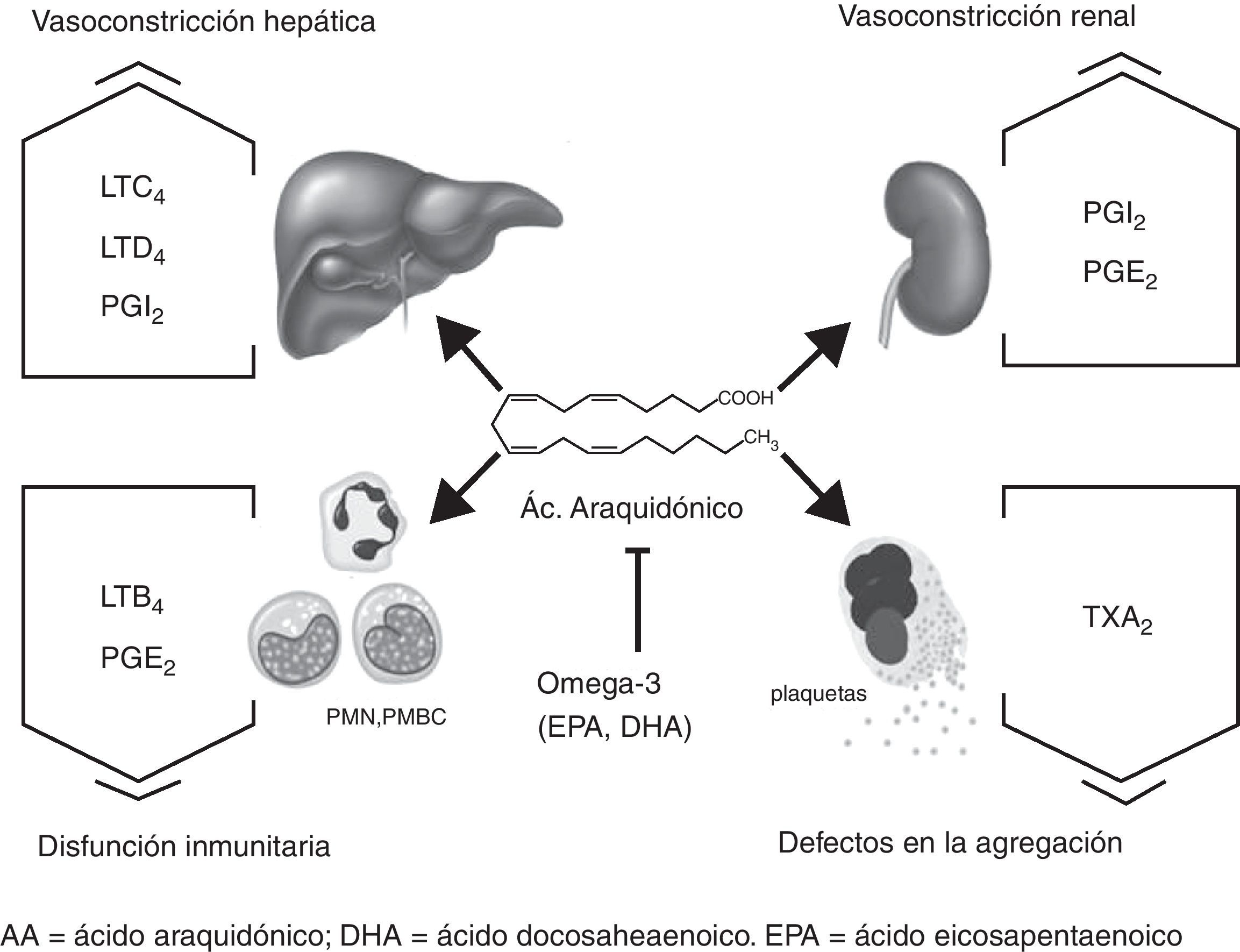
En la figura 1 se representan los posibles efectos mediados por el AA, y modulados por los PUFA n-3, en hígado, riñón, plaquetas y células del sistema inmunológico. La biodisponibilidad de AA en estos tejidos se asocia con el aumento del tono vasoconstrictor en hígado y riñón, así como con la disfunción inmunitaria y los defectos en la coagulación observados en la cirrosis. Existen muchos estudios que relacionan la producción de eicosanoides con patologías presentes en la cirrosis. Algunos autores han relacionado la cirrosis con un estado hipercatabólico que aumenta la síntesis hepática de eicosanoides proinflamatorios y vasoconstrictores13. Otros, relacionan déficits de AA con descensos en la producción renal de prostaglandinas vasodilatadoras en el síndrome hepatorrenal14.
Efectos mediados por el AA en células y tejidos en la cirrosis. El AA es metabolizado por la vía de la COX y LOX en diferentes eicosanoides dependiendo del tejido: CysLT (LTC4, LTD4), prostaciclinas (PGI2), prostaglandinas (PGE2), tromboxanos (TXA2) y leucotrienos (LTB4). La biodisponibilidad de AA en estos tejidos se asocia con el aumento del tono vasoconstrictor en hígado y riñón, así como a la disfunción inmunitaria y a los defectos en la coagulación observados en la cirrosis. Los ácidos grasos omega-3 (EPA y DHA) y sus metabolitos contrarrestan la acción del AA.
Por otra parte, están en revisión las alteraciones en la hemostasia primaria, agregación plaquetaria y la coagulación de los pacientes cirróticos15,16. En las plaquetas, el AA es precursor de eicosanoides proagregantes, como el tromboxano A2 que es sintetizado por acción de la COX-1, y de isoprostanos que son generados por oxidación no enzimática del AA por especies reactivas de oxígeno (ROS) liberadas por la actividad NADPH-oxidasa plaquetaria.
Así mismo, la cirrosis también se asocia con un fracaso en la capacidad fagocitaria del sistema inmunitario y retículo-endotelial hepático. Los cirróticos presentan mayor riesgo a padecer infecciones bacterianas. En células del sistema inmunitario a partir del AA se produce leucotrieno B4 (LTB4), un potente quimioatrayente, inductor de adhesión celular y de la liberación de enzimas hidrolíticos17 y que es esencial para la activación de NADPH-oxidasa citosólica del neutrófilo y la liberación de ROS18. Resulta plausible que anomalías en ácidos grasos puedan influir en la disfunción de las células inmunitarias observada en pacientes cirróticos19–21. El sistema retículo-endotelial está encargado en último término del aclaramiento de bacterias y antígenos como el lipopolisacárido bacteriano (LPS) mediante los macrófagos residentes o las células Kuppfer. Estas células cuando entran en contacto con el LPS producen cisteinil leucotrienos (CysLT) que contribuyen al tono vasoconstrictor en el hígado cirrótico, como lo demuestra recientemente, que el tratamiento con Montelukast®, antagonista de los receptores de CysLT, reduce la hipertensión portal en modelos animales22. Otras sustancias como el LTB4 y diversas prostaciclinas (PGE2, PGD2, PGF2, PGI2) relacionadas con la liberación de TNF-α, óxido nítrico y ROS en el hígado13 también son liberadas por los macrófagos en contacto con el LPS bacteriano. Aunque la célula de mayor trascendencia funcional sea el macrófago hepático, la evidente dificultad para su estudio en humanos, ha fomentado el estudio de células mononucleadas (PMBC) como modelo para examinar la función del macrófago en la cirrosis.
ObjetivoEl objetivo de este trabajo fue estudiar la composición de AA, DHA y EPA en células mononucleadas «Peripheral Mononuclear Blood Cells» (monocitos y linfocitos, PMBC) y Células Polimorfonucleadas «Polymorphonuclear Blood Cells» (granulocitos, PMN) de sangre periférica en pacientes con cirrosis. La composición de las células, se correlacionó con la obtenida en el plasma, reflejo del metabolismo hepático, y en la membrana eritrocitaria, marcador del estado global de ácidos grasos en el organismo23. Posteriormente, se relacionó la composición de estos ácidos grasos con el grado de deterioro de la función hepática de los pacientes con cirrosis.
Material y métodosRealizado en la Sección de Cromatografía del Servicio de Bioquímica Clínica del Hospital Ramón y Cajal durante un periodo de 2 años y con la colaboración del Servicio de Gastroenterología, se seleccionaron un total de 42 pacientes con cirrosis descompensada de diferentes etiologías (alcohólica, virus hepatitis B y C) y diferentes grados de deterioro de la función hepática clasificados según la escala Child-Pugh. Se incluyeron 4 pacientes Child A, 19 pacientes Child B y 19 pacientes Child C. Todos los pacientes con cirrosis mostraban un buen estado nutricional y presentaban un índice de masa corporal (IMC) superior a 18,5 kg/m2. Además, se seleccionaron 10 controles sanos.
Se obtuvieron para controles y pacientes 4 tipos de muestras: plasma, membranas eritrocitarias, PMBC y células PMN.
Obtención de plasma y membranas eritrocitarias: se partió de 3-5mL de sangre anticoagulada con EDTA-K3 que se centrifugó a 3.000rpm durante 15min y se separó la fase superior correspondiente al plasma. Las membranas eritrocitarias se obtuvieron tras un lavado con PBS y posterior lisado por choque osmótico con agua destilada fría. El lisado se centrifugó a 20.000g durante 20min obteniéndose el pellet correspondiente a las membranas de eritrocitos que se disolvió en PBS y se almacenó a -80°C para su posterior procesamiento.
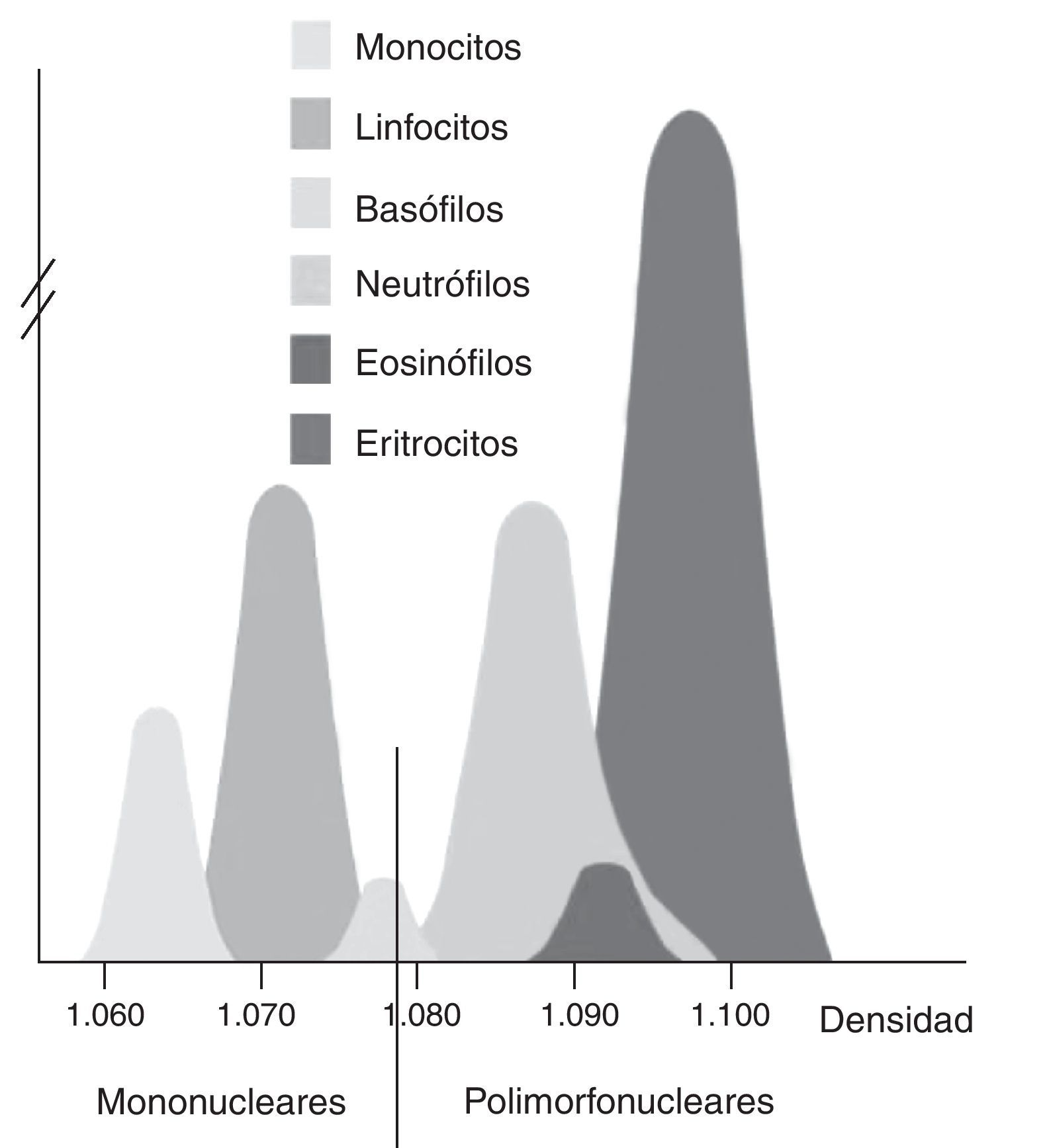
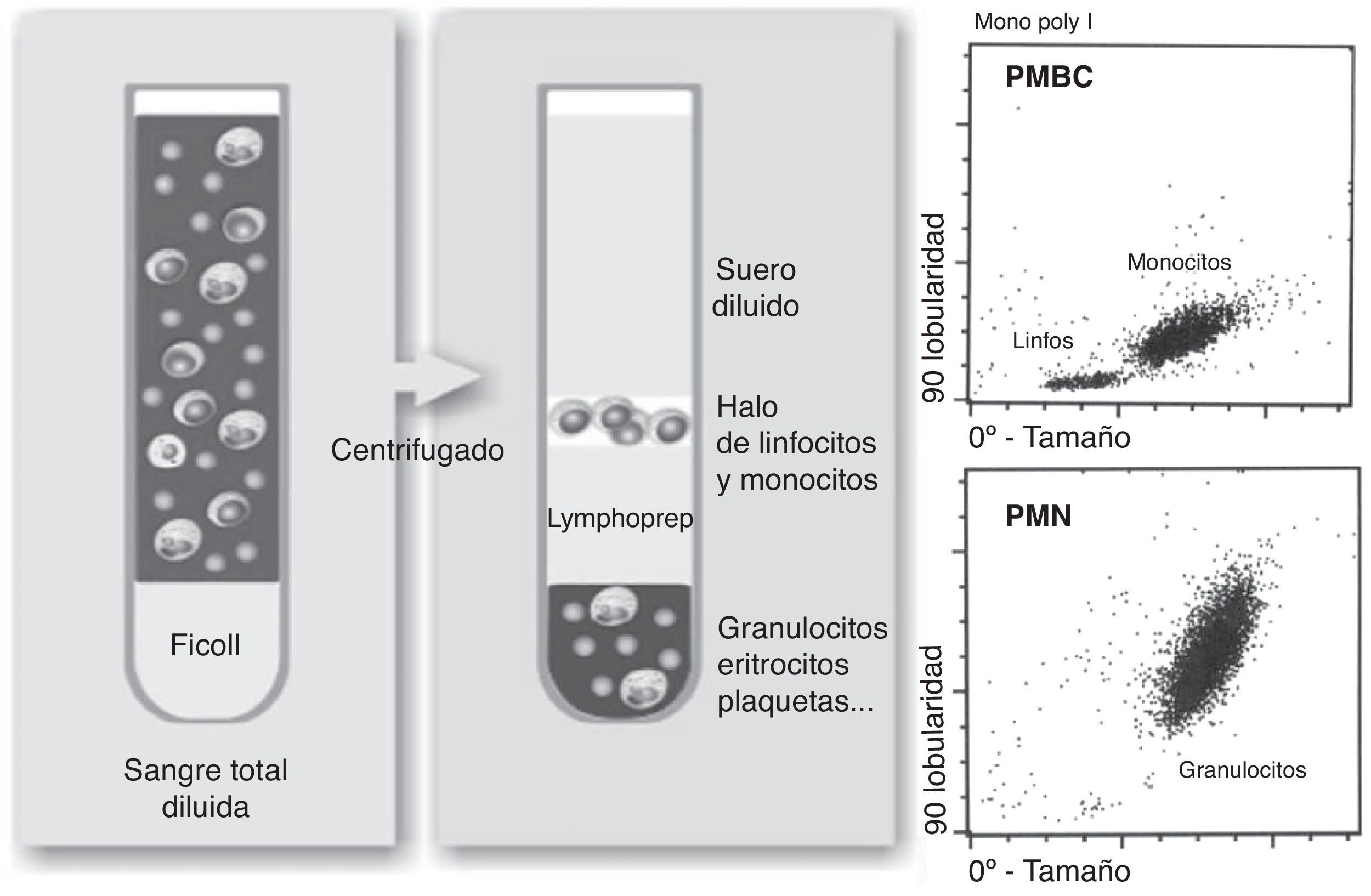
Aislamiento de células mononucleares (PMBC) y polimorfonuleares (PMN): el aislamiento se realizó utilizando el método descrito por Boyum et al.24. El método se basa en la diferente flotabilidad de cada tipo celular en un gradiente de desidad como se indica en la figura 2. La sangre anticoagulada con heparina (8mL) se diluyó con PBS y se depositó sobre el mismo volumen de Lymphoprep (densidad 1,077g/mL, Axis-Shield). Tras centrifugación a 1.900rpm durante 40min, los PMBC se aislaron de la interfase. Para el aislamiento de los PMN se descartó el plasma y el Lymphoprep. Se procedió a eliminar los eritrocitos contaminantes mediante sedimentación con dextrano al 6% y con solución de lisis. Aislados ambos tipos celulares, se resuspendieron en PBS y se comprobó su viabilidad, integridad y efectividad de la separación mediante un hemocitómetro como se muestra en la figura 3. Posteriormente se lisaron las células en KOH al 10% y se almacenaron a -80°C hasta su procesamiento.
Aislamiento de PMBC mediante gradiente de Lymphoprep. Se deposita la sangre diluida sobre el Lymphoprep y se centrifuga. Los linfocitos y monocitos (PMBC) se aislan en la interfase entre plasma y Lymphoprep. La fase inferior contiene los granulocitos (PMN) y eritrocitos. A la derecha se muestran las gráficas de citometría procedentes del aislamiento de PMBC y PMN.
Extracción de lípidos: para proceder al análisis de ácidos grasos en las muestras de células inmunitarias (PMBC y PMN) previamente se realizó una extracción de lípidos según el método de Folch25. La extracción se realizó utilizando 2mL de clorormo/metanol (2:1) y 500μL de muestra para mantener una proporción 1:4 y se mantuvo durante 2 horas en cámara fría. En las muestras de plasma y membrana eritrocitaria no fue necesario realizar extracción lipídica.
Análisis de AA, EPA y DHA por cromatografía de gases y detección por espectroscopía de masas: el análisis de ácidos grasos se realizó basándonos en el método descrito por Lepage y Roy26. Se partió de 100μL de muestra (plasma, extracto de membrana eritrocitaria, o extractos lipídicos de las células inmunitarias), a los que se añadieron 50μL de patrón interno (C17:0 y C23:0, 40μg/mL cada uno). Seguidamente se transesterifican con cloruro de acetilo en metanol (1,75mL de metanol y 100μL de cloruro de acetilo por muestra) durante 18 horas a 50°C. Los metilésteres de los ácidos grasos (FAME) obtenidos se analizaron por cromatografía de gases con detección por espectrometría de masas. La columna empleada fue una HP-INNOWAX® (30m, 0,25μM, 0,1mm). La temperatura del inyector se fijó a 250°C y las muestras se inyectaron en modo splitless. Se inyectó 1μL de muestra en los PMN y PMBC y 0,2μL de muestra para el plasma. El horno del cromatógrafo de gases operó a una temperatura inicial de 50°C hasta 200°C a 25°C/min, seguidamente se incrementó la temperatura hasta 230°C a 1,5°C/min y se mantuvo durante 8min. El tiempo total de cada inyección fue de 35min. El espectrómetro de masas operó en modo SIM (selective ion monitoring), con un dwell time de 25 msec. Se seleccionó un ión cuantificador y 3 iones cualificadores (cuant, q1, q2, q3) para C17:0, C23:0 y C20:0 (74, 55, 87, 143), para AA y EPA (79, 180, 150, 108) y para DHA (79, 166, 150, 108). La estabilidad del tiempo de retención se fijó utilizando bloqueo del tiempo de retención (RTL) respecto al pico del ácido araquídico (C20:0).
La concentración de AA, EPA y DHA se obtuvo tras integración de las señales correspondientes a los iones cuantificadores para estas sustancias e interpolación del valor de las áreas sobre las curvas de calibración a 6 niveles (100μg, 50μg, 25μg, 12,5μg, 6,25μg y 3.125μg) construidas a partir de un patrón de concentración conocida (GLC-462, NuCheck-INC) empleando el método del patrón interno. La composición porcentual de AA, EPA y DHA en cada muestra se realizó dividiendo la concentración de cada ácido graso por la concentración de ácidos grasos totales en cada muestra.
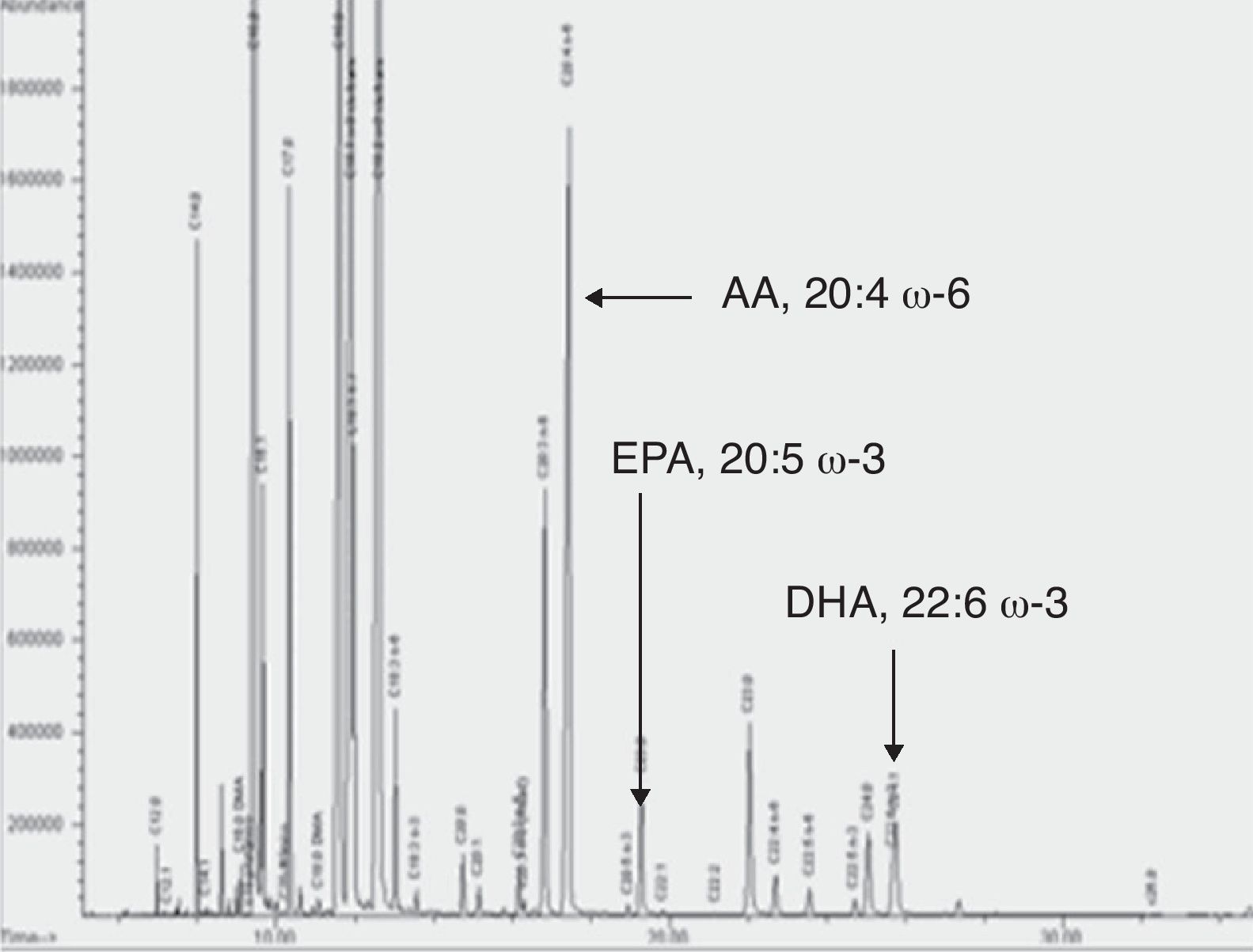
ResultadosEn la figura 4 se muestra un cromatograma como inyección representativa con la composición total de ácidos grasos en membrana eritrocitaria de uno de los pacientes estudiados. Se indican mediante flechas los picos correspondientes a AA, EPA y DHA. Cromatogramas similares se obtuvieron para plasma, PMBC y PMN.
Cromatograma de ácidos grasos de membrana eritrocitaria. Se muestra una inyección representativa con la composición total de ácidos grasos en la membrana eritrocitaria de uno de los pacientes estudiados. Se indica con flechas los picos correspondientes a AA, EPA y DHA. Cromatogramas similares se obtuvieron en las muestras de plasma, PMBC y PMN.
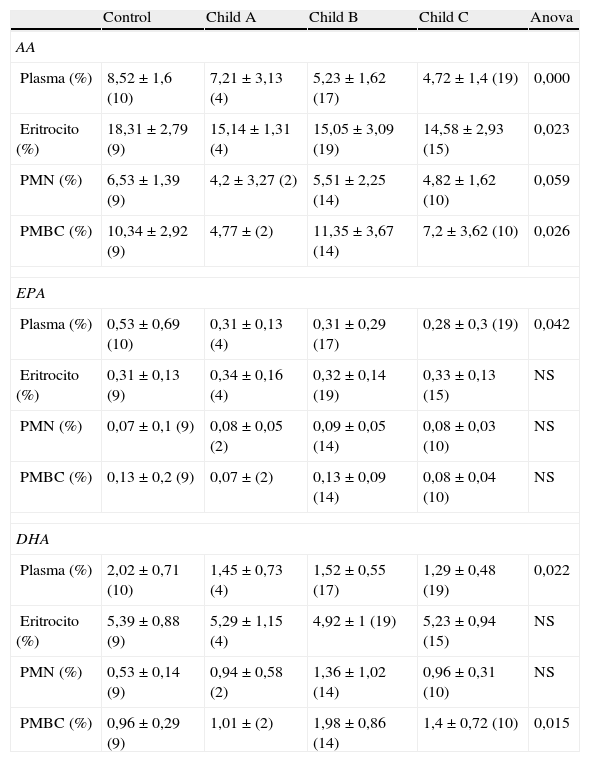
Los resultados de nuestro estudio ponen de manifiesto la presencia de anomalías en la composición de ácidos grasos en el plasma y en la membrana eritrocitaria de pacientes con cirrosis descompensada. La tabla 1 muestra los resultados de composición porcentual obtenidos de AA, DHA y EPA en las muestras de plasma, membrana eritrocitaria y células inmunitarias (PMBC y PMN) en controles y en pacientes cirróticos clasificados según Child-Pugh. Los resultados se expresan como la media±la desviación estándar y entre paréntesis se indica el número de muestras analizadas en cada caso. También se muestra el grado de significación obtenido tras el análisis ANOVA. Se marcan en negrita los resultados estadísticamente significativos. Como puede observarse en la tabla 1, en cirróticos se evidencia un descenso significativo en la composición porcentual de AA, DHA y EPA en plasma. Así mismo, se aprecia un descenso significativo de AA en membrana eritrocitaria y además se observaron diferencias significativas en la composición de AA y DHA en las PMBC. Sin embargo, para los granulocitos (PMN) no observamos cambios significativos en la composición porcentual de estos ácidos grasos.
Composición porcentual de AA, EPA Y DHA en controles y pacientes cirróticos. Los resultados se expresan como media porcentual±desviación estándar (n.° de muestras). Se destacan los resultados estadísticamente significativos
| Control | Child A | Child B | Child C | Anova | |
| AA | |||||
| Plasma (%) | 8,52±1,6 (10) | 7,21±3,13 (4) | 5,23±1,62 (17) | 4,72±1,4 (19) | 0,000 |
| Eritrocito (%) | 18,31±2,79 (9) | 15,14±1,31 (4) | 15,05±3,09 (19) | 14,58±2,93 (15) | 0,023 |
| PMN (%) | 6,53±1,39 (9) | 4,2±3,27 (2) | 5,51±2,25 (14) | 4,82±1,62 (10) | 0,059 |
| PMBC (%) | 10,34±2,92 (9) | 4,77±(2) | 11,35±3,67 (14) | 7,2±3,62 (10) | 0,026 |
| EPA | |||||
| Plasma (%) | 0,53±0,69 (10) | 0,31±0,13 (4) | 0,31±0,29 (17) | 0,28±0,3 (19) | 0,042 |
| Eritrocito (%) | 0,31±0,13 (9) | 0,34±0,16 (4) | 0,32±0,14 (19) | 0,33±0,13 (15) | NS |
| PMN (%) | 0,07±0,1 (9) | 0,08±0,05 (2) | 0,09±0,05 (14) | 0,08±0,03 (10) | NS |
| PMBC (%) | 0,13±0,2 (9) | 0,07±(2) | 0,13±0,09 (14) | 0,08±0,04 (10) | NS |
| DHA | |||||
| Plasma (%) | 2,02±0,71 (10) | 1,45±0,73 (4) | 1,52±0,55 (17) | 1,29±0,48 (19) | 0,022 |
| Eritrocito (%) | 5,39±0,88 (9) | 5,29±1,15 (4) | 4,92±1 (19) | 5,23±0,94 (15) | NS |
| PMN (%) | 0,53±0,14 (9) | 0,94±0,58 (2) | 1,36±1,02 (14) | 0,96±0,31 (10) | NS |
| PMBC (%) | 0,96±0,29 (9) | 1,01±(2) | 1,98±0,86 (14) | 1,4±0,72 (10) | 0,015 |
AA: ácido araquidónico; DHA: ácido docosahexaenoico; EPA: ácido eicosapentaenoico; NS: no significativo.
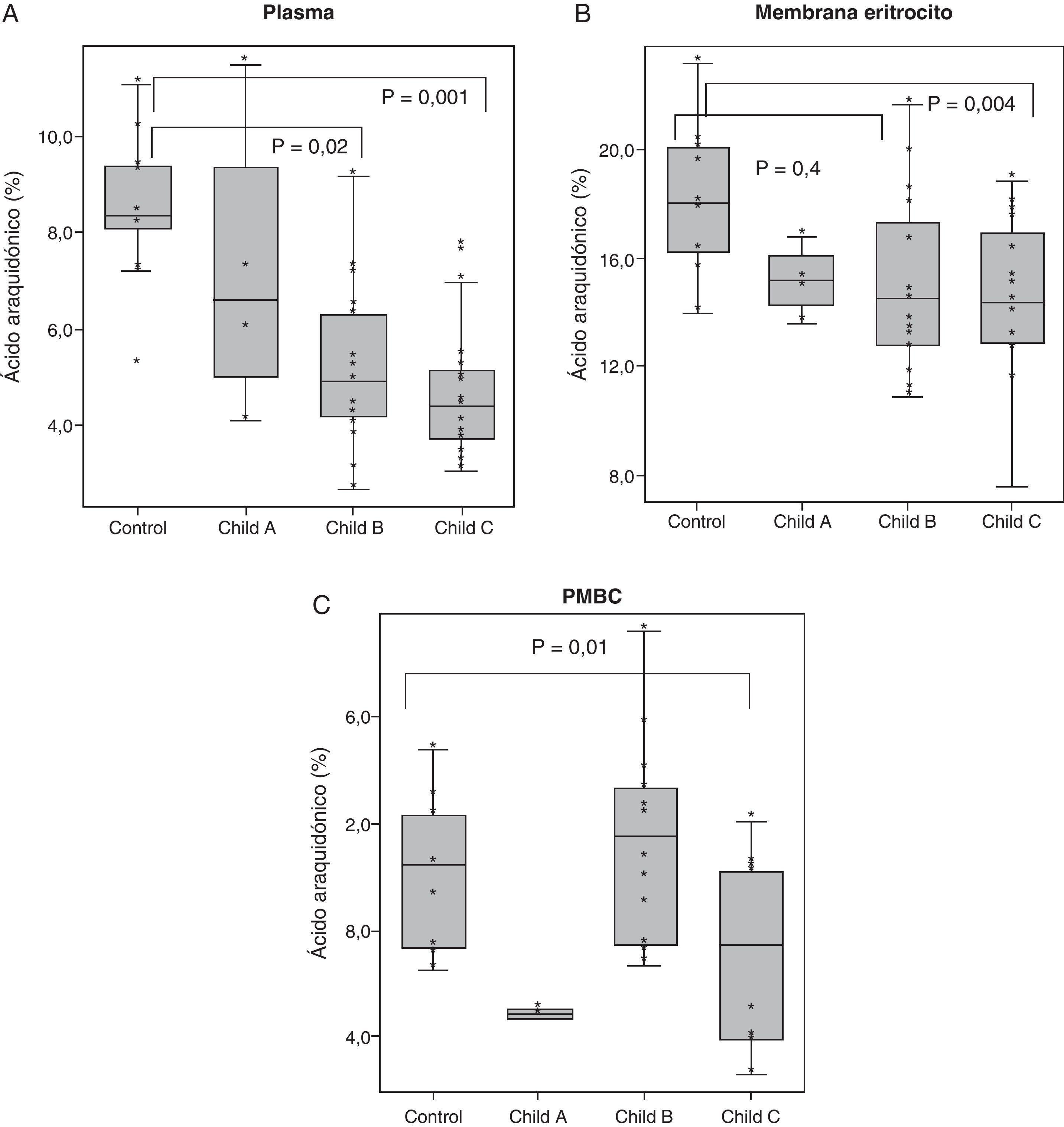
Los resultados correspondientes al AA en plasma, membrana eritrocitaria y PMBC se representan en las gráficas blox-pot en la figura 5. Se muestran los valores de significación (p) correspondientes a las comparaciones bivariadas tras el ANOVA. Si comparamos los resultados en controles con cirróticos Child C, se obtuvo una p=0,001 en plasma, p=0,04 en membrana de eritrocito y una p= 0,01 en PMBC. Se puede observar, por tanto, como el descenso de AA va siendo más acusado en aquellos pacientes con mayor deterioro de la función hepática.
Composición porcentual de AA, en plasma, membrana eritrocitaria y células mononucleadas (PMBC). Se representan los box-plot de la composición porcentual (%) de AA en controles y cirróticos clasificados según la escala Child. Los valores de significación (P) corresponden a las comparaciones bivariadas tras el ANOVA.
Los resultados obtenidos en nuestro estudio ponen de manifiesto descensos en la composición de ácidos grasos (AA, DHA y EPA) en el plasma y además de AA en la membrana eritrocitaria de pacientes con cirrosis descompensada. Estos datos corroboran los resultados obtenidos por Cabré et al.12. Son varias las razones que han sido argumentadas en los últimos años para explicar este descenso. Por un lado, los cirróticos especialmente aquellos de etiología alcohólica, suelen presentar deficiencias nutricionales11. En un estudio en pacientes con hepatopatía crónica se observaron carencias en la dieta que reducían la disponibilidad de ácidos grasos esenciales precursores como AL17. En otros estudios, el descenso de ácidos grasos se relacionaría con problemas de malabsorción de grasas asociados al descenso en la producción de ácidos biliares27-29 o también al déficit en las actividades enzimáticas (elongasa y desaturasa) necesarias para la conversión de AL en AA que en animales cirróticos han resultado deficitarias30. Además, el intento de normalizar el balance de ácidos grasos en enfermos con cirrosis avanzada mediante administración intravenosa de preparados ricos en precursores como AL y ALA no ha obtenido resultados satisfactorios31.
En nuestro estudio, el déficit de AA y ácidos grasos obtenido, no parece deberse a la existencia de un aporte nutricional deficitario ya que se incluyeron pacientes con buen estado nutricional (IMC>18,5 kg/m2) y con cirrosis de diferentes etiologías (tanto etílica como por virus hepatitis B y C) por lo que podemos deducir que la deficiencia nutricional no parece ser la causa del déficit sino que se encuentra asociada a la funcionalidad hepática de estos enfermos. De hecho, nuestros resultados demuestran que el déficit de AA en plasma y en membrana eritrocitaria correlaciona con el deterioro de la función hepática y que esta deficiencia es más acusada en enfermos con mayor deterioro de la misma. En un estudio anterior, en una serie de 101 pacientes cirróticos se demostró que concentraciones de AA disminuidas relacionaba con la supervivencia de los enfermos12.
Los resultados obtenidos en las células inmunitarias muestran una disminución significativa en la composición de AA en las PMBC de los pacientes cirróticos. Puesto que no es descartable que la presencia de un déficit de AA en estas células afecte a la producción de LTB4, la capacidad fagocitaria de las mismas pudiera verse afectada. De hecho, hay estudios que han demostrado que los monocitos de pacientes cirróticos presentan una capacidad fagocitaria disminuida32. Otros estudios, asocian una capacidad de producción de ROS en neutrófilos alterada en los cirróticos, reduciendo su capacidad de respuesta frente a bacterias33. En nuestro estudio no hemos encontrado diferencias significativas en la composición de ácidos grasos en los granulocitos (PMN) estudiados.
Otro resultado a considerar es la alteración en la composición de DHA en las PMBC en los pacientes cirróticos. Se observa una tendencia a que los cirróticos presenten una mayor composición de DHA que los controles pero no sabemos cuál es la causa, aunque parece que pueda influir en la respuesta inmunitaria.
Los omega-3 están encargados de aumentar la producción de mediadores antiinflamatorios (protectinas y resolvinas) que reducen el estrés oxidativo y el daño necroinflamatorio en el hígado34. La suplementación de ácidos grasos en la cirrosis ha renovado su interés35 y podría ser de relevancia, por tanto, valorar el efecto que sobre los pacientes cirróticos y sobre las células del sistema inmunitario pudieran ejercer futuras intervenciones en el aporte de ácidos grasos omega-3 en pacientes con hepatopatía crónica.
Las conclusiones más relevantes de nuestro estudio son:
- 1)
Los cirróticos presentan un descenso significativo en los porcentajes de AA, EPA y DHA en plasma y un descenso significativo de AA en membrana eritrocitaria.
- 2)
El contenido de AA en plasma y en membrana eritrocitaria correlaciona con el deterioro en la función hepática (según Child-Pugh) y no depende de un deficitario aporte nutricional.
- 3)
La composición en AA y DHA está alterada en los PBMC de cirróticos, lo que pudiera tener importancia en la funcionalidad de las células inmunitarias de estos enfermos.
Los autores declaran no tener ningún conflicto de intereses.
Este trabajo corresponde a una comunicación científica presentada y premiada con accésit en el V Congreso Nacional del Laboratorio Clínico celebrado en Málaga del 9 al 11 de noviembre de 2011.