El riesgo de desarrollar neoplasias colónicas en pacientes acromegálicos y su relación directa con los niveles elevados de GH/IGF-1 no están bien establecidos y continúan siendo motivo de controversia en la literatura mundial. El objetivo de este trabajo fue evaluar el riesgo de desarrollar lesiones neoplásicas avanzadas (LNA) (adenomas mayores a 1cm, componente velloso mayor del 75% y/o displasia de alto grado), en pacientes con acromegalia, comparado con un grupo control.
Materiales y métodosEstudio multicéntrico caso-control retrospectivo. Ciento treinta y siete pacientes con acromegalia que realizaron videocolonoscopia (VCC) fueron incluidos inicialmente, aunque solo 69 cumplieron criterios de inclusión. Sesenta y dos controles fueron obtenidos: por cada caso (paciente con acromegalia) 2 «controles» fueron seleccionados aleatorizadamente e igualados por edad y sexo. El riesgo se expresó en odds ratio (OR) y su correspondiente intervalo de confianza (IC) del 95%. La significación estadística fue considerada una p<0,05.
ResultadosDe los 69 pacientes con VCC completa y datos adecuados para su análisis, 28 presentaron VCC positiva con hallazgos de pólipos (40%) y 41 VCC negativa o normal (60%). Dentro del grupo con VCC positiva, 14 presentaron LNA (20%) y solo un paciente presentó diagnóstico de cáncer colorrectal. Para el análisis caso-control se incluyó a 31 pacientes frente al grupo control (n = 62) que cumplieron con los criterios de inclusión. La presencia de pólipos colónicos, adenomas y LNA en los pacientes con acromegalia fue de 19/31 (61,9%), 14/31 (45,16%) y 10/31 (32,25%), y en el grupo control de 18/62 (29,03%), 11/62 (17,74%) y 4/62 (6,45%), respectivamente. El riesgo de adenomas y LNA fue mayor en el grupo de acromegalia en comparación con el grupo control, siendo ambos resultados estadísticamente significativos: adenomas OR 2,54 (IC 1,22-5,25) p=0,005, LNA OR: 7,3 (2,4-25), p=0,00.
ConclusiónLa acromegalia se asocia a un mayor riesgo de lesiones colónicas preneoplásicas. Este hallazgo justifica el cribado con VCC al diagnóstico en pacientes con acromegalia.
The risk of developing cancerous lesions in the colon of acromegaly patients and their direct relationship with elevated growth hormone (GH) and insulin-like growth factor-1 (IGF-1) levels is not well established, and is still controversial in the international literature. The objective of this study was to evaluate the risk of developing advanced neoplastic lesions (ALN: greater than 1cm adenomas, villous component greater than 75% and/or high grade dysplasia) in patients with acromegaly compared to a control group.
Materials and methodsA multicentre, retrospective case-control study was conducted initially on 137 patients with acromegaly (cases) who underwent videocolonoscopy (VCC), although only 69 met inclusion criteria. Sixty-two controls were obtained, and for each case two “controls” were randomly selected and matched by age and gender. Risk was expressed as odds ratio (OR) and its corresponding 95% confidence interval (CI). P values<.05 were considered statistical significantly.
ResultsOf the 69 acromegaly patients with a completed VCC and adequate data for their analysis, 28 had a positive VCC with findings of polyps (40%), and 41 VCC negative with no lesions (60%). Within the group with positive VCC, 14 were ALN (20%) and one a colorectal cancer. In the case-control analysis, 31 cases were to be analysed against the control group (n=62). The presence of colonic polyps, adenomas, and ALN in patients with acromegaly was 19/31 (61.9%), 14/31 (45.16%), and 10/31 (32.25%), respectively, and in the control group, it was 18/62 (29.03%), 11/62 (17.74%), and 4/62 (6.45%), respectively. The risk of adenomas and ALN was higher in the acromegaly group compared to the control group: adenomas OR: 2.54 (95% CI 1.22-5.25) P=.005, ALN OR: 7.3 (2.4-25) P=.00.
ConclusionThis preliminary case control study showed an increased risk of pre-cancerous colprectal lesions in patients with acromegaly, supporting the VCC screening at diagnosis.
La acromegalia es una enfermedad progresiva que, si no se trata o está parcialmente controlada, conduce inexorablemente a complicaciones graves e incapacitantes. La causa más frecuente es un adenoma hipofisario que produce un exceso de hormona de crecimiento (GH) y subsecuentemente del factor de crecimiento similar a la insulina (IGF-1)1-3. Considerada clásicamente como poco frecuente, posee una incidencia anual de 4 casos por millón de habitantes y una prevalencia de 60 casos por millón de habitantes4,5. Sin embargo, las estimaciones más recientes describen una incidencia anual mayor, de 11 casos por millón de habitantes y una prevalencia de aproximadamente 78 casos por millón de habitantes6. El comienzo insidioso de las manifestaciones clínicas puede demorar el diagnóstico 6 a 10 años en promedio7. Los efectos de la exposición prolongada y no controlada a niveles suprafisiológicos de GH/IGF-1 en los diferentes tejidos contribuyen a la morbimortalidad elevada característica de esta enfermedad3,7-9.
Mientras algunos estudios muestran que las principales causas de mortalidad en acromegalia son las complicaciones cardiovasculares y las enfermedades malignas con prevalencia similar7, otros no demuestran mayor incidencia de cáncer en estos pacientes comparados con la población general, desestimando el riesgo de neoplasia y la necesidad de un cribado precoz10.
Si bien algunos trabajos reportan un aumento de la prevalencia de neoplasias colónicas, siendo las segundas en frecuencia luego de las tiroideas11,12, el riesgo de desarrollar neoplasias colónicas malignas «de novo» y su relación con los niveles elevados de GH/IGF-1 no están bien establecidos y continúan siendo motivo de controversia en la literatura mundial10,13.
Las guías internacionales recomiendan la realización de videocolonoscopia (VCC) en pacientes con acromegalia, pero no hay consenso en cuanto al momento de la VCC inicial de cribado y el intervalo de las subsiguientes para el control evolutivo en estos pacientes3,8,9,14-16. Las principales dificultades para lograr consenso es el bajo número de pacientes que reúnen los estudios de prevalencia de enfermedad colónica en acromegalia y la falta de un adecuado grupo control que permita determinar el riesgo real de la misma.
Existen 2 tipos de pólipos colónicos: los pólipos hiperplásicos no considerados como precursores de cáncer y los pólipos adenomatosos que potencialmente pueden transformarse en cáncer a través de la secuencia «adenoma-carcinoma»17-20. Dentro de este grupo, las lesiones neoplásicas avanzadas (LNA), que se definen como adenomas mayores a 1 cm, histología con componente velloso mayor al 75% y/o displasia de alto grado, poseen mayor riesgo de transformación20,21. Si bien hay publicaciones sobre el aumento de prevalencia de pólipos colónicos y cáncer colorrectal en pacientes con acromegalia9,10,12,14,15,22, no hay reportes que evalúen la prevalencia de LNA en la acromegalia.
El objetivo principal de este estudio fue determinar por primera vez de manera diferencial la presencia de LNA en pacientes con acromegalia y compararlos con un grupo control sin exceso de GH/IGF-1, aportando mayor evidencia de enfermedad preneoplásica colónica con riesgo de progresar a carcinoma17,21. Como objetivo secundario, se analizó el impacto de diversos parámetros de riesgo para desarrollar neoplasias colónicas dentro del grupo de pacientes acromegálicos con VCC positiva y negativa.
Materiales y métodosEstudio multicéntrico caso-control retrospectivo. Se analizaron los datos de las historias clínicas de 137 pacientes con acromegalia pertenecientes a los servicios de Endocrinología de 11 hospitales de la ciudad de Buenos Aires. El grupo control fue obtenido de 62 pacientes no acromegálicos del Servicio de Gastroenterología del Hospital Carlos G. Durand.
Los pacientes con acromegalia fueron considerados «casos» y aquellos sin acromegalia «controles». Por cada «caso», se seleccionaron 2 «controles» en forma aleatoria, e igualados por edad y sexo. El diagnóstico de acromegalia fue realizado sobre la base de la sospecha clínica, la confirmación bioquímica a través de niveles elevados de IGF-1 para sexo y edad, y GH sin inhibición a menos de 1mg/ml en el test oral de glucosa (TTOG-GH)9. De los pacientes con acromegalia se obtuvieron datos sobre: antecedentes familiares y personales de adenomas y carcinomas colorrectales, insulinorresistencia y diabetes mellitus, tabaquismo, años de evolución de la enfermedad, niveles de GH e IGF-1 basales (esta última expresada en IGF-1/LSN: límite superior normal del método utilizado) y «status» de la enfermedad al momento de la VCC (curada: niveles de IGF-1 normales sin tratamiento farmacológico en la actualidad, controlada: niveles normales de IGF-1 con tratamiento farmacológico, activa: niveles elevados de IGF-1 a pesar de tratamiento quirúrgico o farmacológico, con o sin síntomas de acromegalia.).
En el grupo control se incluyó a pacientes con VCC solicitada por cribado o por colon irritable.
Fueron criterios de inclusión para acromegálicos y controles:
- –
Edad mayor de 18 años
- –
VCC completa: preparación colónica satisfactoria de acuerdo con una puntuación por escala de Boston mayor o igual a 6 puntos en la cual se alcance intubación hasta ciego y se cumpla con los parámetros de calidad: intubación cecal>95% y un tiempo de duración no menor a 6-7 min23-25. La escala de Boston diferencia el grado de preparación de los diferentes sectores del colon y otorga una escala sobre la presencia o no de material fecal, eliminando subjetividades24,25.
Se consideraron criterios de exclusión para acromegálicos y controles:
- –
Historia personal de enfermedad inflamatoria intestinal, carcinoma colorrectal, poliposis adenomatosa familiar, cáncer colónico hereditario no polipósico.
- –
VCC sin intubación cecal o con preparación inadecuada (puntuación por escala de Boston<6).
Los datos sobre la calidad de la VCC y las características de las lesiones colónicas halladas (localización, morfología e histología) fueron obtenidas en forma retrospectiva sobre la base de datos de las historias clínicas de los diferentes centros de salud participantes.
Se consideró VCC negativa aquella sin presencia de lesiones colónicas y VCC positiva aquella con presencia de cualquier tipo de lesión poliposa. Los adenomas colorrectales fueron clasificados en displasia de bajo o alto grado, según la clasificación de Viena26,27. Los pacientes con múltiples lesiones fueron clasificados por la lesión histológicamente más avanzada.
EstadísticaLos resultados fueron expresados en números absolutos y porcentajes (%). La diferencia entre ambos grupos (casos y controles) fueron calculados utilizando test de la chi al cuadrado. Fue considerada una diferencia estadísticamente significativa una p < 0,05, con un intervalo de confianza (IC) del 95%. El riesgo fue expresado en odds ratio (OR) con IC del 95%.
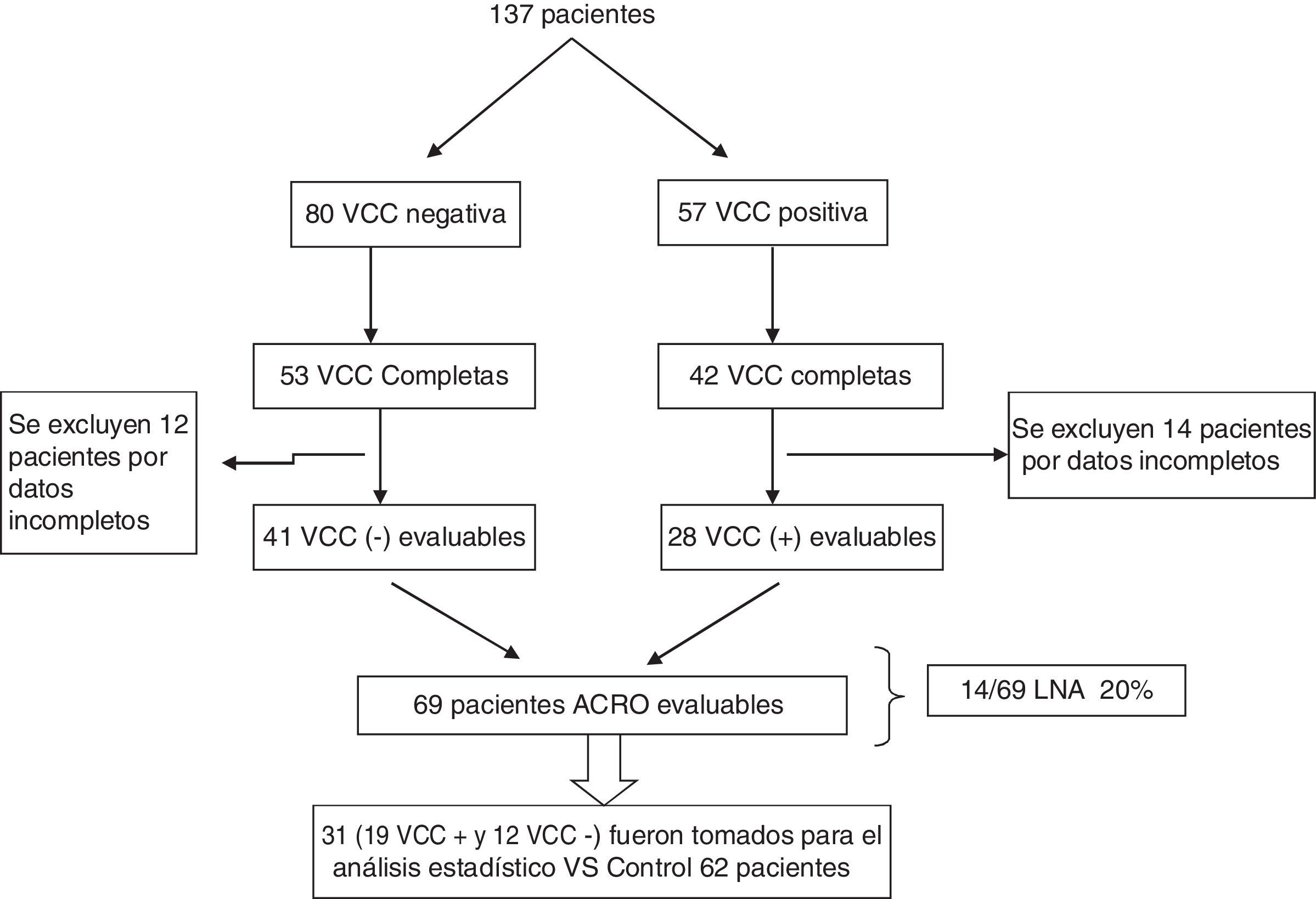
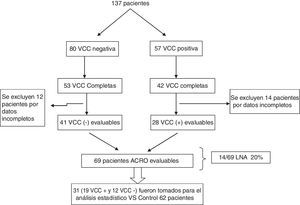
ResultadosInicialmente se analizó a 137 pacientes (mujeres/hombres, edad) con diagnóstico de acromegalia y VCC. Ochenta pacientes presentaron VCC negativa (53/80 VCC completas, edad promedio: 49 años) y 57 VCC positivas (42/57 completas, edad promedio: 52 años). Sesenta y nueve pacientes acromegálicos presentaron VCC completa y datos adecuados para su análisis. De ellos, 28 fueron VCC positiva (40%) y 41 VCC negativa (60%) (fig. 1).
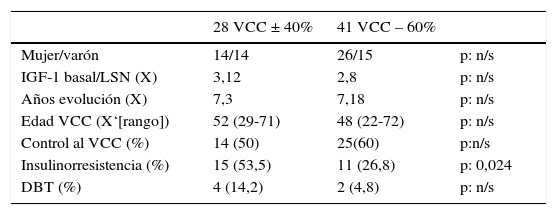
Dentro del grupo con VCC positiva, en 14 se diagnosticó LNA (20%) y en solo un paciente cáncer colorrectal. Al comparar los grupos con VCC positiva y negativa, solo la presencia de insulinorresistencia en el grupo VCC+ (15 pacientes: 53,5%) fue estadísticamente significativa (p: 0,024). El promedio de IGF-1/LSN basal en pacientes con adenomas y sin adenomas fue de 2,84 (rango: 1,17-4,3) y 3,06 (rango: 1,8-7,87), respectivamente (tabla 1). En el momento de realizar la VCC el status de la enfermedad fue: 7 curada (22,58%), 9 activa (29,03%) y 15 controlada (48,39%). La presencia de adenomas en pacientes con más de 15 años de evolución de acromegalia fue de 4/7 (57,14%) y en aquellos con menos de 15 años 10/24 (41,66%), siendo no significativa la diferencia estadística p: 0,469 (tabla 1).
Características de pacientes con acromegalia VCC negativa y positiva
| 28 VCC ± 40% | 41 VCC – 60% | ||
|---|---|---|---|
| Mujer/varón | 14/14 | 26/15 | p: n/s |
| IGF-1 basal/LSN (X) | 3,12 | 2,8 | p: n/s |
| Años evolución (X) | 7,3 | 7,18 | p: n/s |
| Edad VCC (X‘[rango]) | 52 (29-71) | 48 (22-72) | p: n/s |
| Control al VCC (%) | 14 (50) | 25(60) | p:n/s |
| Insulinorresistencia (%) | 15 (53,5) | 11 (26,8) | p: 0,024 |
| DBT (%) | 4 (14,2) | 2 (4,8) | p: n/s |
n/s: no significativo; X: promedio.
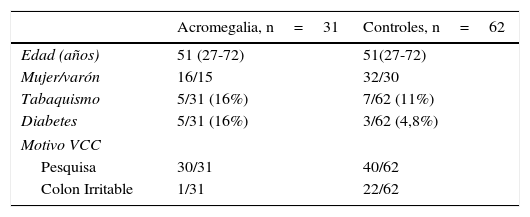
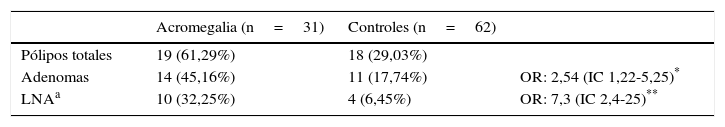
Se tomaron 31/69 pacientes con acromegalia para el análisis estadístico contra 62 controles (fig. 1). En el grupo «casos», la edad promedio fue de 51 años (rango: 27-72), 52% mujeres, y como antecedentes personales 16% tabaquistas y 16% con diabetes (tabla 2). La presencia de pólipos colónicos, adenomas y LNA en este grupo fue de 19/31 (61,9%), 14/31 (45,16%) y 10/31 (32,25%), respectivamente. Del total de pólipos, 5 fueron hiperplásicos y 14 adenomatosos, de los cuales 10 presentaron características de LNA (tabla 3).
En el grupo «control» la edad promedio fue de 51 años (rango: 29-72), el 52% son mujeres y como antecedentes personales el 11% de ellos eran tabaquistas y el 4,5% diabéticos. La presencia de pólipos colónicos, adenomas y LNA en el grupo control fue de 18/62 (29,03%), 11/62 (17,74%) y 4/62 (6,45%), respectivamente. Del total de pólipos, 7 fueron hiperplásicos y 11 adenomatosos, de los cuales 4 presentaron características de LNA (tabla 3).
El riesgo de adenomas y LNA fue mayor en el grupo acromegalia en comparación con el grupo control, siendo ambos resultados estadísticamente significativos: para adenomas un OR 2,54 (IC 1,22-5,25), p: 0,005, para LNA OR: 7,3 (2,4-25), p: 0,00 (tabla 3). Las características de las LNA en acromegalia y controles se detallan en la tabla 4.
Si bien la localización más frecuente de las LNA en ambos grupos fue colon descendente y recto, en el grupo control se observa una tendencia a tener localización preferentemente en esta localización (4/10 [40%] en acromegálicos vs. 3/4 [75%] en controles). En colon transverso se observó 3/10 (30%) en acromegalia y 1/4 (25%) en controles. No se observaron LNA en ascendente y ciego en grupo control.
DiscusiónLos pacientes con acromegalia tienen una prevalencia elevada de lesiones colorrectales y son, luego de las tiroideas, las más frecuentes según las últimas publicaciones sobre el tema14,15,22,28,29. Se han llevado a cabo numerosos estudios para evaluar prevalencia de neoplasias colónicas benignas y malignas en acromegalia, pero continúa siendo un tema de controversia en la literatura mundial la indicación del cribado con VCC en el algoritmo diagnóstico. El carcinoma colorrectal deriva, en la mayoría de los casos, de la transformación de un pólipo adenomatoso, a través de la secuencia llamada «adenoma-carcinoma». Es un proceso de varios pasos de mutaciones y aberraciones genéticas que se iniciaran en las células madres del epitelio y que luego requieren de la alteración del balance entre la proliferación y la apoptosis en la cripta colónica necesarias para el desarrollo tumoral17,18,30,31. Los pólipos hiperplásicos son considerados no neoplásicos y los adenomatosos con bajo grado de displasia no presentan riesgo de progresar a carcinoma. Los pólipos adenomatosos de mayor tamaño y con mayor grado de displasia, principalmente aquellos considerados LNA: tamaño mayor a 1cm, componente velloso mayor del 75% y/o displasia de alto grado constituyen un riesgo mayor para el desarrollo de neoplasias malignas. Se estima en algo más de 5 años la progresión a cáncer en este tipo de pólipos19-21.
Estudios experimentales han demostrado que tanto las células de la mucosa colónica normal como las células tumorales expresan el receptor IGF-1R32,33, e incluso se ha identificado mRNA de IGF-1 en estas células, demostrando su acción proliferativa y antiapoptótica sobre las células tumorales en carcinomas colorrectales33. Se ha demostrado también la relación entre IGF-1 y la proliferación anómala de las células en las criptas colónicas. Estas representan la unidad funcional del epitelio intestinal y poseen una renovación celular rápida a partir de células madre pluripotenciales34,35. En pacientes con acromegalia, la longitud del colon y el sigma es generalmente mayor que en sujetos no acromegálicos. Por otro lado, las células del epitelio en las criptas del sigmoides presentan un patrón de proliferación mayor, un paso preliminar para la formación de adenomas, que se correlaciona con los niveles circulantes de IGF-134-36. Se puede entonces especular que en la acromegalia el exceso de GH/IGF-1 aumenta la proliferación celular en el epitelio colónico y disminuye la apoptosis, mientras que el mayor tamaño del intestino aumenta la cantidad de células madre expuestas, susceptibles a presentar mutaciones aberrantes, lo cual podría predisponer a la acumulación de mutaciones que pueden culminar con el desarrollo de lesiones precancerosas y carcinomas8. Existen suficientes reportes sobre la mayor prevalencia de pólipos colónicos y cáncer colorrectal en pacientes con acromegalia; sin embargo, nunca fueron estudiadas las LNA en estos pacientes9,10,12,14,15,22.
La primera evidencia del aumento de la prevalencia de pólipos premalignos en colon fue aportada por Klein et al. en 1982, mostrando cerca de un 30% de prevalencia de pólipos adenomatosos en un análisis prospectivo de colonoscopias en 17 pacientes con acromegalia y un total de 4 carcinomas en un estudio retrospectivo en 44 acromegálicos37. Si bien estudios posteriores no mostraron un aumento en el desarrollo de neoplasias en colon10,13, algunos reportes sí evidenciaron un aumento en el riesgo, la incidencia y la prevalencia de neoplasias colónicas en pacientes con acromegalia12,14,15,28,38. Tal vez uno de los estudios más representativos es el metaanálisis publicado en 2008 por Rokkas, que incluye 9 estudios con grupo control, con un total de 701 pacientes acromegálicos. Demostró una prevalencia estadísticamente significativa entre acromegálicos vs. controles en pólipos hiperplásicos y adenomas (riesgo relativo [RR] 3,6 y 3,3, respectivamente), y de carcinoma colorrectal, que también fue mayor en los acromegálicos que en los controles, con un 4,6% vs. 1,2%, respectivamente (RR: 4,4)22. En nuestro trabajo se demostró también una mayor prevalencia de pólipos adenomatosos en pacientes acromegálicos vs. controles con RR: 2,54, estadísticamente significativo (p: 0,005). Demostramos también un aumento del riesgo relativo de LNA en acromegalia (RR: 7,3), siendo significativa (p: 0,00) vs. los controles. No encontramos, sin embargo, un aumento significativo de casos de carcinoma colorrectal, a diferencia del metaanálisis de Rokkas, posiblemente por tratarse de un grupo pequeño y de corta evolución. Los niveles de IGF-1 basales, los años de evolución de la acromegalia y el status de la enfermedad en el momento de la VCC no parecerían ser factores que modificaran el riesgo en nuestro trabajo. La presencia de insulinorresistencia en el grupo con neoplasias positivas fue un parámetro de mayor riesgo (p: 0,024), similar a lo reportado en la literatura13,15,39,40.
Continúa siendo controvertida la necesidad de cribado de neoplasias colónicas en pacientes con acromegalia, así como el momento de realización de la misma y el intervalo de las subsiguientes. De acuerdo con las guías del Grupo de consenso de Acromegalia publicadas en 200941 y del consenso para el diagnóstico y el tratamiento de las complicaciones de la acromegalia publicada en 20129, la VCC debería ser solicitada en el momento del diagnóstico de la enfermedad, y de no encontrarse lesiones, pueden ser manejados posteriormente, según las guías para la población general, con VCC cada 10 años, sobre todo en aquellos pacientes con niveles de IGF-1 normales. Para aquellos pacientes con niveles de IGF-1 elevados algunos grupos recomiendan repetir VCC en un intervalo menor y, si hay hallazgos patológicos en la VCC, el seguimiento debería realizarse según las guías de manejo de población general16. En las últimas guías de práctica clínica publicadas en 2014 se sugiere el cribado de neoplasias colónicas en el momento del diagnóstico sin especificar la monitorización posterior de acuerdo con el estado de control de enfermedad o los hallazgos de la VCC3.
Si bien en número de pacientes analizados en este trabajo contra grupo control es pequeño, se demuestra un mayor riesgo de lesiones colónicas preneoplásicas en pacientes con acromegalia. No hay, hasta el momento, trabajos reportados en la literatura que evalúen de manera diferencial los pólipos adenomatosos avanzados o LNA y los hiperplásicos en pacientes con acromegalia. A pesar de estos hallazgos, no podemos concluir que la indicación de VCC de «cribado» en el algoritmo diagnóstico en todo paciente con acromegalia debe estar recomendada. Son necesarios nuevos estudios incorporando un mayor número de pacientes y controles, así como un seguimiento a largo plazo para determinar el riesgo real de desarrollar lesiones colónicas en pacientes con acromegalia, y establecer parámetros clínicos o bioquímicos asociados a este riesgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Instituciones integrantes del departamento de neuroendocrinología, Sociedad Argentina de Endocrinología y Metabolismo (SAEM).