Establecer los efectos de las hormonas sexuales sobre las concentraciones plasmáticas de homocisteína en preeclámpticas y embarazadas normales.
MétodosLos grupos consistieron en 35 preeclámpticas (grupo A) y 35 embarazadas normotensas (grupo B), consideradas como controles. Las muestras de sangre se recolectaron en todas las pacientes antes del parto y en el grupo de estudio (grupo A) inmediatamente después del diagnóstico. Se midieron las concentraciones de testosterona, testosterona libre, sulfato de dehidroepiandrosterona, androstenodiona, estradiol y homocisteína.
ResultadosSe observaron diferencias estadísticamente significativas en la edad gestacional, presencia de proteinuria, peso de los recién nacidos y de la presión arterial sistólica y diastólica (p<0,05). Las concentraciones de testosterona, testosterona libre, sulfato de dehidroepiandrosterona y homocisteína fueron significativamente superiores en el grupo A comparado con los controles (p<0,05). Las concentraciones de estradiol se encontraron disminuidas en el grupo A comparado con los controles (p<0,05). Se encontraron correlaciones positivas fuertes de testosterona, sulfato de dehidroepiandrosterona y testosterona libre y una correlación moderada negativa con las concentraciones de estradiol con las concentraciones plasmáticas de homocisteína (p<0,05).
ConclusionesLas concentraciones plasmáticas de homocisteína son afectadas en forma positiva por testosterona, sulfato de dehidroepiandrosterona y testosterona libre y negativa por el estradiol en pacientes preeclámpticas y embarazadas normotensas.
To establish the effects of sexual hormones on plasma homocysteine concentrations in preeclamptic and normotensive pregnant women.
MethodsThere were two groups: group A consisted of 35 preeclamptic patients and group B of 35 normotensive pregnant women used as controls. Blood samples were collected before labor in both grops and immediately after diagnosis in group A. Concentrations of testosterone, free testosterone, dehidroepiandrosterone sulphate, androstenodione, estradiol and homocysteine were measured.
ResultsThere were statistically significant differences in gestational age, the presence of proteinuria, birthweight and systolic and diastolic blood pressure (p<0.05). Testosterone, free testosterone and dehidroepiandrosterone sulphate were significantly higher in group A than in group B (P<.05). Estradiol concentrations were significant lower in the group A than in group B (P<.05). Strong positive and significant correlations were found between testosterone, dehidroepiandrosterone sulphate and free testosterone and a moderate negative correlation was found between estradiol and plasma homocysteine concentrations (P<.05).
ConclusionsIn preeclamptic and normotensive pregnant women, plasma homocysteine concentrations are positively affected by testosterone, dehidroepiandrosterone sulphate and free testosterone and are negatively affected by estradiol.
El síndrome hipertensivo del embarazo se presenta entre 7-10% de todas las gestantes y constituye una causa importante de morbilidad y mortalidad materna, fetal y neonatal1. Para explicar la etiología de la preeclampsia se han propuesto diversas condiciones patológicas, entre ellas invasión anormal del trofoblasto, intolerancia inmunológica entre la madre y el feto, predisposición genética y/o acumulación de triglicéridos citotóxicos en las células endoteliales2. Si bien parece no existir una explicación única, todas estas condiciones podrían formar parte de una alteración en el funcionamiento placentario y contribuir a la presencia de las manifestaciones clínicas características de este síndrome.
La alteración en el funcionamiento placentario puede afectar a la producción de andrógenos y de estrógenos, los cuales en la placenta son sintetizados a partir del sulfato de dehidroepiandrosterona (DHEA) de origen materno y fetal. El sulfato de DHEA fetal antes de alcanzar la placenta puede ser 16alfa-hidroxilado por el hígado fetal. En la placenta ambos compuestos son desulfatados y convertidos sucesivamente a androstenodiona y 16alfa-hidroxiandrostenodiona, y después a testosterona y 16alfa-hidroxitestosterona, y finalmente a estrógenos. Además, la androstenodiona y la 16alfa-hidroxiandrostenodiona pueden ser directamente convertidas a estrógenos. Estos andrógenos y estrógenos, productos finales del metabolismo placentario, son liberados a la circulación materna y fetal, en donde se unen a la globulina transportadora de hormonas sexuales3. Diversos autores han sugerido que en la preeclampsia las vías esteroidogénicas en la placenta están alteradas. Sin embargo, mientras muchos autores coinciden en que los niveles de estrógenos no difieren entre embarazadas normotensas e hipertensas, los resultados de las mediciones de andrógenos son contradictorios4,5.
La homocisteína es un producto del metabolismo de la metionina y sus concentraciones intracelulares se mantienen bajas debido a una eficiente eliminación por las vías de transmetilación y trans-sulfuración6. Existen indicios que las concentraciones de homocisteína plasmática son afectadas por los esteroides sexuales. Se han encontrado bajas concentraciones de homocisteína durante el embarazo7, un estado caracterizado por la presencia de altos niveles de estrógenos endógenos. Más aún, en mujeres menopáusicas, el tratamiento con 17beta estradiol o estrógenos conjugados produce disminuciones en las concentraciones de más del 10% luego de 6 meses8. Ya previamente se ha reportado el aumento de las concentraciones de homocisteína en pacientes preeclámpticas9. Hasta la fecha se desconoce la desconoce la posible relación entre las hormonas sexuales y las concentraciones de homocisteína en las embarazadas normotensas y las preeclámpticas.
El objetivo de la investigación fue establecer los efectos de las hormonas sexuales sobre las concentraciones plasmáticas de homocisteína en preeclámpticas y embarazadas normales.
MétodosLos grupos consistieron en 35 preeclámpticas (grupo A) y 35 embarazadas normotensas (grupo B), consideradas como controles. La preeclampsia se definió como presión arterial mayor de 140/90mmHg en dos o más ocasiones con 4 h de diferencia entre las mediciones después de la vigésima semana de gestación, con proteinuria de más de dos cruces, en dos ocasiones diferentes con 6 h de diferencia. La presión sanguínea se midió en posición sentada después de 15min de descanso. Ninguna paciente de los casos ni de los controles tenía historia de enfermedad cardiovascular, renal o endocrina, ni diagnóstico de diabetes gestacional.
Solo se incluyó a las pacientes nulíparas. Las muestras de sangre se recolectaron en todas las pacientes antes del parto y en el grupo de estudio inmediatamente después del diagnóstico. El plasma fue separado y almacenado a –70° C hasta el momento de la medición. Los niveles plasmáticos de homocisteína se midieron por el método de quimioluminiscencia. La sensibilidad analítica del ensayo fue de 0,5μmol/l y los coeficientes de variación intra e interensayo fueron del 3,9 y el 5,8%, respectivamente.
La testosterona y testosterona libre se midieron por extracción y radioinmunoensayo y el sulfato de DHEA por radioinmunoensayo. Las concentraciones de estradiol y androstenodiona se midieron utilizando radioinmunoensayo posterior a la extracción con un solvente inorgánico y purificación por cromatografía. Los coeficientes de variación fueron del 8,6% para el sulfato de DHEA, el 10,2% para la androstenodiona, el 6,2% para la testosterona libre, el 9,6% para la testosterona y el 13,7% para el estradiol. Las mediciones cuantitativas de proteinuria en 24 h se realizaron utilizando el método Biuret en un analizador multicanal Synchron LX20®.
Los datos se presentan como valores promedios±desviación estándar. El análisis estadístico entre los dos grupos se realizó con la prueba de la t de Student para datos no relacionados para comparar las características demográficas y las concentraciones plasmáticas de homocisteína y hormonas sexuales. El coeficiente de correlación se determinó usando la prueba de Pearson. Las pruebas con p<0,05 se consideraron estadísticamente significativas.
ResultadosLas características demográficas de las pacientes se muestran en la tabla 1. No se encontraron diferencias en la edad materna y en el promedio de peso materno entre las preeclámpticas y los controles (p>0,05). Se observaron diferencias estadísticamente significativas en la edad gestacional al momento del estudio y valor promedio de proteinuria (p<0,05).
También se encontraron diferencias estadísticamente significativas en el promedio de peso del recién nacido (2.546,86±125,51g en el grupo A comparado con 3.603,46±98,11g en el grupo B; p<0,05).
En la tabla 2 se muestran los promedios de presión arterial sistólica y diastólica en ambos grupos. Se observaron diferencias estadísticamente significativas en los promedios de presión arterial sistólica y diastólica entre los grupos.
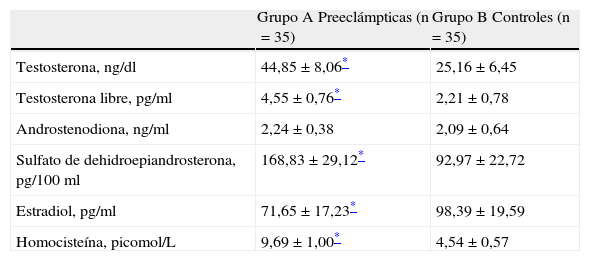
Los valores hormonales se muestran en la tabla 3. Las concentraciones de testosterona, testosterona libre y sulfato de DHEA fueron significativamente superiores en el grupo A comparado con los controles (p<0,05). Las concentraciones de estradiol se encontraron disminuidas en el grupo A comparado con los controles. Las concentraciones de androstenodiona no mostraron diferencias estadísticamente significativas entre los dos grupos en estudio (p=NS). La edad gestacional al momento del parto no modificó las diferencias en las concentraciones de cada hormona entre los dos grupos (p=NS).
Concentraciones de hormonas sexuales y homocisteína en las participantes del estudio
| Grupo A Preeclámpticas (n=35) | Grupo B Controles (n=35) | |
| Testosterona, ng/dl | 44,85±8,06* | 25,16±6,45 |
| Testosterona libre, pg/ml | 4,55±0,76* | 2,21±0,78 |
| Androstenodiona, ng/ml | 2,24±0,38 | 2,09±0,64 |
| Sulfato de dehidroepiandrosterona, pg/100ml | 168,83±29,12* | 92,97±22,72 |
| Estradiol, pg/ml | 71,65±17,23* | 98,39±19,59 |
| Homocisteína, picomol/L | 9,69±1,00* | 4,54±0,57 |
Las concentraciones plasmáticas de homocisteína se muestran también en la tabla 3. Las concentraciones fueron significativamente superiores en las preeclámpticas (9,69±1,00 picomol/l) comparadas con los controles (4,54±0,57 picomol/l; p<0,05). La edad gestacional al momento del parto, el peso del recién nacido y los valores de proteinuria no produjeron modificaciones significativas en las diferencias en las concentraciones de homocisteína entre los dos grupos (p=NS).
Al correlacionar las concentraciones de homocisteína con las concentraciones de hormonas sexuales, se encontraron correlaciones positivas y significativas de testosterona (r=0,789; p<0,05), sulfato de DHEA (r=0,767; p<0,05) y testosterona libre (r=0,763; p<0,05) con las concentraciones de homocisteína. Las concentraciones de estradiol mostraron una correlación negativa y significativa (r=–0,608; p<0,05).
Al correlacionar los valores de presión arterial sistólica con las concentraciones de hormonas sexuales se observó una correlación positiva y significativa con testosterona libre (r=0,416; p<0,05), testosterona (r=0,405; p<0,05) y sulfato de DHEA (r=0,301; p<0,05) y negativa y significativa con estradiol (r=–0,291; p<0,05) con los valores de presión arterial sistólica. Por otra parte, se encontró una correlación positivo y significativa de la testosterona libre (r=0,398; p<0,05), testosterona (r=0,379; p<0,05) y sulfato de DHEA (r=0,291; p<0,05) y negativa y significativa con estradiol (r=–0,209; p<0,05) con la presión arterial diastólica. Con respecto a las valores de proteinuria se observó una correlación positiva con testosterona (r=0,261), testosterona libre (r=0,224) y sulfato de DHEA (r=0,159). Todas estas correlaciones fueron significativas (p<0,05).
DiscusiónLos resultados de este estudio demuestran un aumento en las concentraciones de homocisteína en las pacientes preeclámpticas asociado a una fuerte correlación positiva a la elevación de los andrógenos y negativa con el estradiol. Estos hallazgos pueden tener implicaciones importantes en la etiopatogenia de la preeclampsia. Hallazgos similares a los reportados han sido descritos con el uso de andrógenos en el tratamiento de hombres con hipoandrogenismo y con el uso de testosterona como terapia sustitutiva en hombres mayores10 o como agente contraceptivo en hombres en edad reproductiva11. También existen informes de jóvenes levantadores de pesas, que usan andrógenos desarrollan enfermedad cerebrovascular e infartos del miocardio12.
La preeclampsia está asociada con hiperreactividad vascular y a aumento en la coagulación sanguínea, dos eventos que contribuyen a la presencia de algunas de sus complicaciones. Los andrógenos potencian el funcionamiento del sistema renina-angiotensina, la liberación de eicosanoides, la producción de tromboxano y la adhesividad plaquetaria, y disminuyen la producción de prostaciclina, favoreciendo así la constricción vascular y la coagulación13. Acromite et al.5 reportaron una elevación de las concentraciones de testosterona en preeclámpticas severas en el tercer trimestre. Atamer et al.14 señalan sólo un aumento en las concentraciones de testosterona total en estas pacientes.
La elevación de los andrógenos, aun en la variante clínica más leve de la preeclampsia, puede representar el resultado de una alteración funcional placentaria y contribuir parcialmente a la elevación de la presión arterial observada en estas pacientes. Lo anterior apoya el concepto de Troisi et al.15 quienes describieron que las placentas pequeñas o lesionadas tienen alteración de su función, con disminución de la conversión de andrógenos a estrógenos. Las concentraciones de testosterona total y libre, en esta investigación, fueron mas altas en las preeclámpticas que en los controles sanos, lo cual apoyaría esta hipótesis, esto acentuaría la saturación de la globulina transportadora de hormonas sexuales3,15.
En las mujeres, la hiperandrogenemia actúa como un factor de riesgo cardiovascular. La evidencia epidemiológica demuestra que las mujeres con síndrome de ovarios poliquísticos que tienen concentraciones elevadas de andrógenos desarrollan enfermedad cardiovascular16,17. El motivo de este aumento en el riesgo aun no ha sido explicado. Sin embargo, la asociación directa entre los andrógenos, resistencia a la insulina y alteración de la función endotelial en el síndrome de ovarios poliquísticos que ha sido descrita parece sugerir que las alteraciones metabólicas y hormonales tienen un papel importante en el desarrollo de este18,19. Las concentraciones de testosterona total, testosterona libre y sulfato de DHEA en esta investigación fueron significativamente más altas en las preeclámpticas que en los controles. Este resultado es consistente con la evidencia del aumento de las concentraciones de andrógenos durante el embarazo en pacientes preeclámpticas15,20. En esta investigación, las concentraciones de testosterona total, testosterona libre y sulfato de DHEA se correlacionan con las concentraciones de homocisteína, un factor de riesgo independiente de disfunción endotelial. Hasta la fecha, este es el primer estudio que establece la asociación entre las concentraciones de hormonas sexuales y de homocisteína en preeclámpticas y embarazadas normotensas, y los resultados sugieren que los andrógenos pueden actuar como un factor de riesgo en las preeclámpticas, sin signos clínicos de hiperandrogenemia.
Los esteroides sexuales pueden ser importantes en la regulación del metabolismo de la homocisteína. Las concentraciones de homocisteína parecen relacionarse con el estado estrogénico de la mujer y la fase del ciclo menstrual21. Se ha reportado que la homocisteína esta más baja en pacientes premenopáusicas que menopáusicas22. Otros investigadores, sin embargo, no han reportado la influencia de la menopausia sobre las concentraciones de homocisteína23. También se han reportado concentraciones más altas en hombres que mujeres de edades comparables, incrementarse en transexuales tratados con andrógenos y disminuir en transexuales tratados con estrógenos24.
Los posibles efectos de las alteraciones de las hormonas sexuales en la preeclampsia en el metabolismo de la homocisteína pueden ser secundarios a otros efectos biológicos de estos esteroides. Las deficiencias de vitamina B12 y folato llevan a un marcado incremento de las concentraciones plasmáticas de homocisteína25. Los efectos inducidos por los estrógenos en estas vitaminas deberían llevar a un incremento en las concentraciones de homocisteína.
Las concentraciones de homocisteína están relacionadas con el recambio de proteínas y masa muscular. En dos estudios, las diferencias en las concentraciones totales de creatinina desaparecen después del ajuste por las concentraciones de creatinina plasmática26. Una explicación para esto puede ser que la producción de homocisteína ocurre en conjunción directa con el metabolismo de la creatina. Entre las pacientes en estudio, no se observó ningún caso de insuficiencia renal, una causa conocida de aumento de las concentraciones de homocisteína27, por lo que se puede pensar que los cambios inducidos por las hormonas sexuales sobre las concentraciones de homocisteína en las preeclámpticas pueden ser explicado por los efectos anabólicos/catabólicos de las hormonas. Tres vías metabólicas están disponibles para la depuración de la homocisteína en el riñón: la sintetasa de metionina, la [betaína]-homocisteína metiltransferasa y la cistationina beta-transferasa. En respuesta a la testosterona, la actividad de la sintetasa de metionina renal no se altera28, mientras que la expresión del ARN mensajero de la [betaína]-homocisteína metiltransferasa está disminuida29. Sin embargo, para otros investigadores, la diferencia en la actividad de la [betaína]-homocisteína metiltransferasa no es estadísticamente diferente28.
Una gran cantidad de homocisteína (cerca del 70%) está unida a las proteínas, principalmente a la albúmina, la cual disminuye durante la preeclampsia. Además de los efectos dilucionales y catabólicos7, un aumento en las concentraciones de homocisteína plasmática puede ser el resultado directo de la unión de la homocisteína a la albúmina en las preeclámpticas. Sin embargo, parece poco probable, debido a que la capacidad de unión de la homocisteína a la albúmina es alta y esta última arrastraría la homocisteína a través de la excreción urinaria de proteínas.
Los andrógenos también tienen efectos anabólicos sobre la eritropoyesis. En una pequeña extensión, la síntesis de homocisteína ocurre en los eritrocitos, una fuente potencial de homocisteína30. Sin embargo, no existe relación entre los cambios en la hemoglobina o en el hematocrito con las concentraciones plasmáticas de homocisteína. Los esteroides anabólicos pueden inducir daño renal y la enzima [betaína]-homocisteína metiltransferasa, necesaria para la conversión de homocisteína en metionina, está confinada al hígado25. En las pacientes preeclámpticas existen cambios en los valores de las enzimas hepáticas en respuesta a todos los cambios fisiopatológicos producidos por el síndrome.
Se concluye que, de acuerdo con los hallazgos de esta investigación, que las concentraciones plasmáticas de homocisteína son afectadas en forma positiva por testosterona, sulfato de DHEA y testosterona libre y negativa por el estradiol en pacientes preeclámpticas y embarazadas normotensas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.