Los rafts constituyen nano-dominios estructurales de naturaleza lipoproteica que propician la eficiente transducción de señales y la modulación de procesos fisiológicos asociados a la membrana plasmática. En el sistema nervioso, la alteración de estos dominios se ha asociado con el desarrollo de diversos padecimientos.
DesarrolloEn el presente artículo se revisa el concepto de rafts, los procesos del sistema nervioso en los cuales están involucrados y su papel en distintas afectaciones, entre las que se destacan las enfermedades de Parkinson, Alzheimer y Huntington.
ConclusionesDadas las evidencias de su participación en diversas neuropatologías, la preservación y/o reconstitución de los rafts se vislumbran como una atractiva estrategia terapéutica.
Rafts are function-structural cell membrane nano-domains. They contribute to explain the efficiency of signal transduction at the low physiological membrane concentrations of the signaling partners by their clustering inside specialized signaling domains.
DevelopmentIn this article, we review the current model of the membrane rafts and their physio-pathological relevance in the nervous system, including their role in Parkinson, Alzheimer, and Huntington diseases.
ConclusionsRafts disruption/dysfunction has been shown to relate diverse neurological diseases. Therefore, it has been suggested that preservation of membrane rafts may represent a strategy to prevent or delay neuronal dysfunctions in several diseases.
El modelo actual de la membrana plasmática incluye nano-dominios dinámicos denominados rafts o balsas de membrana. Estas estructuras juegan un papel relevante en diversos procesos de señalización celular al promover la convergencia de sus elementos moleculares participantes. En años recientes, los rafts han recibido una amplia atención debido a la importancia primordial que la transducción de señales tiene en la totalidad de los procesos fisiológicos. En el caso del sistema nervioso, resulta muy interesante examinar su participación tanto en el ámbito fisiológico como bajo situaciones patológicas. En este artículo se revisa el concepto de rafts, su papel en los distintos procesos fisiológicos del sistema nervioso y su relevancia en afectaciones neurológicas como Alzheimer, Parkinson y Huntington.
El concepto de raftsEn su icónico modelo, Singer et al.1 definieron a la membrana plasmática como una bicapa fluida de lípidos que aloja diversos conglomerados proteicos. Resaltaron la distribución homogénea y aleatoria de sus elementos (producto de su libre difusión en el plano de la membrana) y reconocieron la asimetría estructural y funcional entre sus monocapas constitutivas. Desde su publicación, este modelo ha estado sujeto a constante revisión y actualización2-5. Chapman6, por ejemplo, incorporó muy pronto el concepto de la segregación lateral de sus elementos lipídicos en dominios discretos. Concepto que fue retomado por Simons et al.7 al plantear su modelo de dominios lipídicos, a partir de sus observaciones sobre la distribución diferencial de esfingolípidos en la membrana plasmática apical de células epiteliales. Simons et al.8 resaltaron entonces, la participación del colesterol en el establecimiento y la organización de estos dominios, a los que denominaron lipids rafts o balsas lipídicas, y señalaron que estos complejos de glicoesfingolípidos-colesterol se mantienen estrechamente empaquetados y se comportan como unidades estructurales. De esta forma, la membrana plasmática exhibe la coexistencia de al menos dos fases en la extensión de su superficie: líquido ordenado (Lo) y líquido desordenado (Ld). Los rafts corresponden a la fase Lo4,9,10. Con respecto a las proteínas constitutivas de la membrana, Simons et al.8 señalaron que podrían hallarse incluidas en (o ancladas a) los rafts, o bien localizarse fuera de ellos en función de su naturaleza molecular y de sus propiedades termodinámicas. El concepto de balsas lipídicas (lipid rafts) fue posteriormente redefinido en favor del concepto actual de balsas de membrana (membrane rafts), el cual considera no solo su naturaleza lipídica sino también sus componentes proteicos11. Los rafts quedaron así definidos como dominios pequeños (2-200 nm de diámetro), de mayor espesor que la membrana circundante, heterogéneos, enriquecidos en colesterol y esfingolípidos, que compartimentan a una gran variedad de procesos celulares. El modelo vigente de la membrana plasmática contempla la posibilidad de que estos rafts puedan estabilizarse (como consecuencia de la activación de receptores a diversos agonistas) y generar plataformas de mayor tamaño a través de interacciones lípido-lípido, lípido-proteína o proteína-proteína3,4. Se reconocen dos tipos de estos dominios de membrana o rafts: balsas planas y caveolas3. Las primeras se alinean en el plano horizontal de la membrana y su caracterización experimental ha sido muy difícil debido a su pequeño tamaño (2-20 nm de diámetro) y gran dinamismo (vida media del orden de 1 ms). Sin embargo, pueden ser transitoriamente estabilizadas (vida media < 1 min) mediante la activación u oligomerización de proteínas-receptores alojadas en ellas12. Dado lo anterior, una estrategia para su caracterización se ha presentado a través de estudios en membranas modelo donde es posible observar la segregación de dominios (equivalentes a rafts) de mayor tamaño y duración13 (fig. 1). Las caveolas por su parte, corresponden a invaginaciones de la membrana plasmática de mayor dimensión (50-200 nm de diámetro) y mucho menor dinamismo (vida media > minutos), caracterizadas por la presencia de las proteínas cavinas y caveolinas3,8. En este escenario, Kusumi et al. emplearon la poderosa técnica de seguimiento de molécula única y establecieron que tanto las proteínas como los lípidos constitutivos de la membrana plasmática exhiben dos patrones de difusión característicos: uno de corto alcance (o confinado a un compartimento) y otro de largo alcance (o de escape entre compartimentos). A partir del análisis molecular dinámico de los elementos constitutivos de la membrana, estos investigadores propusieron el denominado modelo de corrales de membrana, el cual involucra, de manera relevante, la participación de elementos del citoesqueleto14. Según este nuevo modelo, las proteínas integrales que sobresalen del lado citoplasmático de la membrana plasmática funcionan como postes de andamiaje e interaccionan con los filamentos de actina del citoesqueleto submembranal, lo que determina el confinamiento de pequeñas áreas o corrales (∼40-300 nm de diámetro) en la cara interna de la membrana plasmática. Estos corrales limitan la difusión de las proteínas (integrales o periféricas) y la de los fosfolípidos en ambas monocapas de la membrana. El modelo actual de la membrana plasmática asume que los rafts se alojan dentro de estos corrales2,3,14 y que abarcan entre 1-25% de la superficie total de la membrana, dependiendo del tipo celular al que se refiera14,15. La relevancia funcional, tanto de los corrales como de los rafts, se sustenta en la compartimentación subcelular de procesos a la que dan lugar y propicia su mayor especificidad y eficiencia. En particular, a los rafts se les adjudica un papel importante en la organización espacial y temporal de los distintos elementos moleculares involucrados en la transducción de señales extracelulares, la apoptosis, la infección viral, la adhesión y migración celular, el direccionamiento de proteínas durante los procesos de endocitosis y exocitosis, el citoesqueleto y la transmisión y plasticidad sinápticas3.
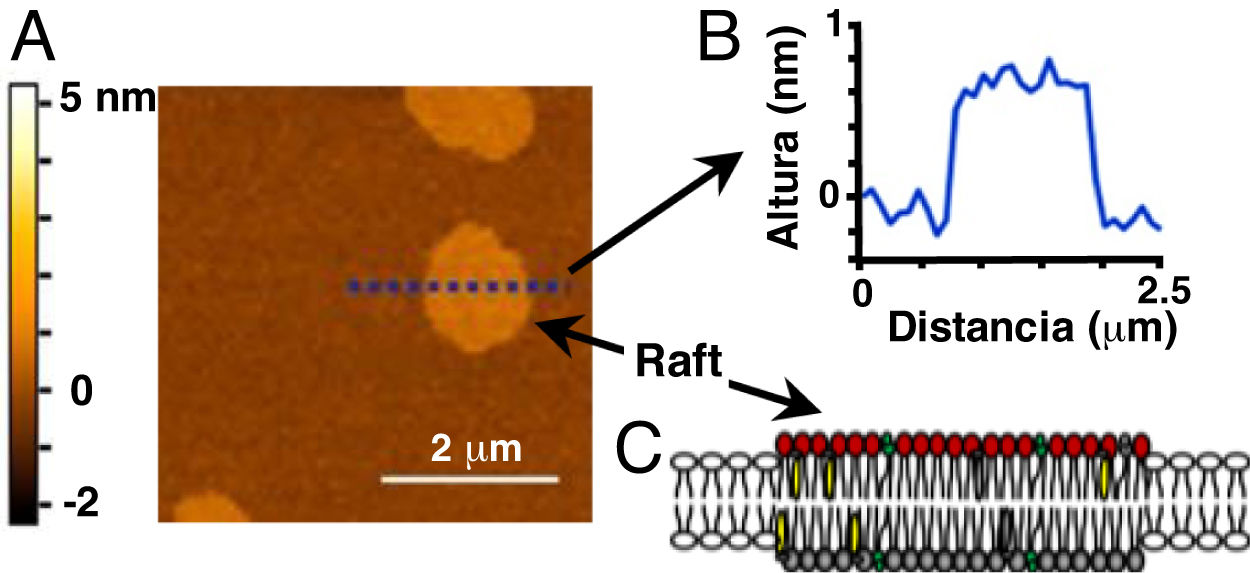
Imagen de dominios tipo rafts obtenida por microscopía de fuerza atómica (MFA). A. Imagen topográfica de una bicapa lipídica modelo (60/20/20 mol% dioleoil fosfatidilcolina/esfingomielina/colesterol) que muestra dominios equivalentes a rafts (sin proteínas). A la izquierda, se indica la escala de colores correspondiente con las alturas de la muestra, en nanómetros (nm). B. Gráfico del análisis de las alturas de la muestra en A a lo largo de la línea punteada. El valor cero (0) de la escala de altura corresponde al nivel de las cabezas de los fosfolípidos de la fase Ld, fuera de los rafts o fase Lo. C. Representación esquemática de un raft en una bicapa lipídica.
Imagen adaptada (con permiso) de: Mensch et al.13. Copyright ©2018, American Chemical Society.
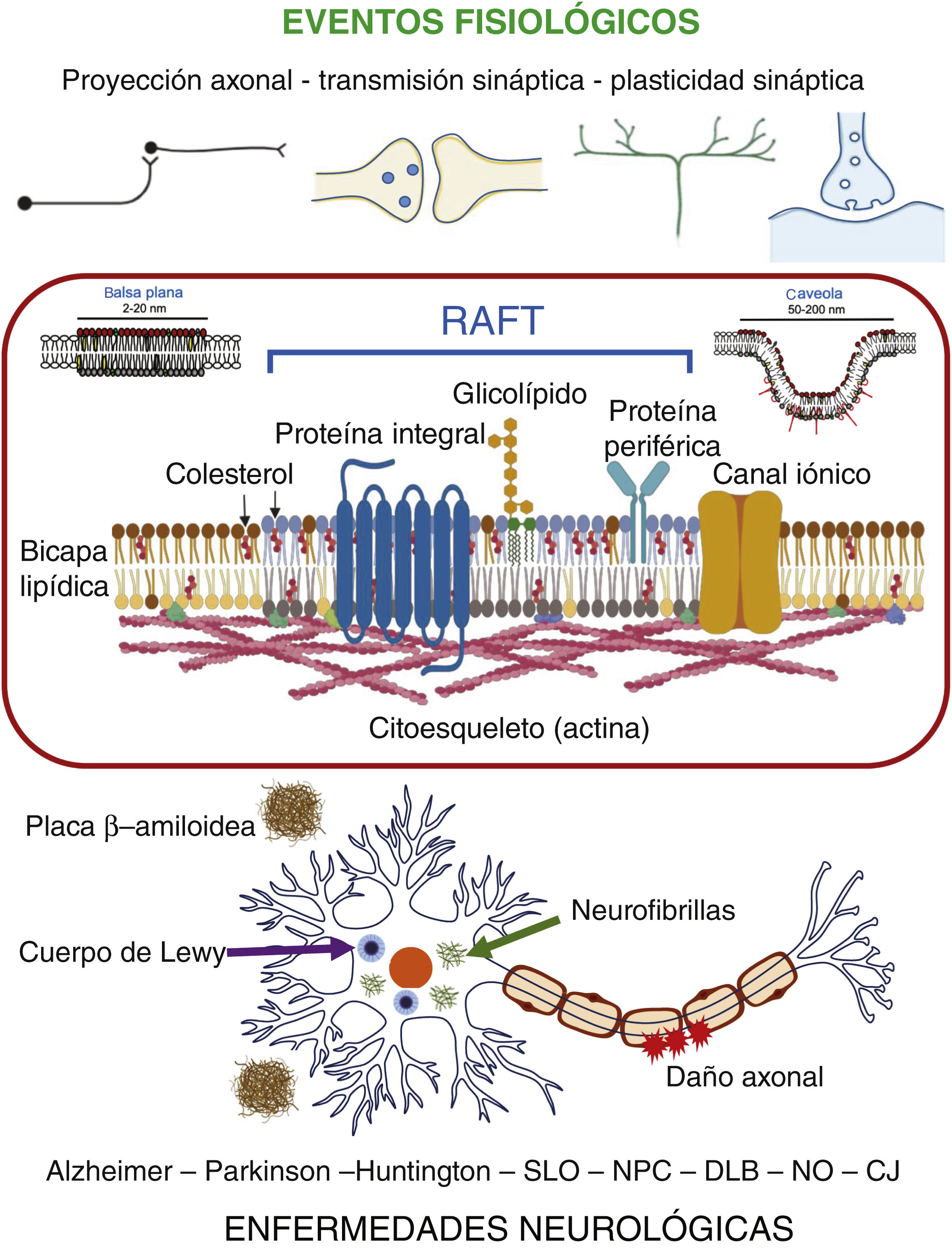
En el sistema nervioso, la presencia de rafts se ha reportado no solo en neuronas sino también en astrocitos, oligodendrocitos y microglía16,17. Cabe mencionar que en muchos reportes relacionados con el sistema nervioso se asume la equivalencia estructural y funcional entre los rafts y los dominios de membrana resistentes a detergentes no-iónicos (DRM), fracción en que se particionan tanto balsas planas como caveolas, lo cual no es estrictamente cierto9. A pesar de esto, la participación de los rafts en los mecanismos de señalización y procesos fisiológicos asociados a la membrana plasmática de las células del sistema nervioso es reconocida ampliamente16,17. Entre tales procesos destacan: el crecimiento y proyección del axón, la neurotransmisión, la plasticidad sináptica, el aprendizaje y la memoria17 (fig. 2).
Participación de rafts en el crecimiento y proyección del axónLos conos de crecimiento del axón son las estructuras sensoriales y móviles que utilizan las neuronas en desarrollo para localizar y reconocer blancos durante el establecimiento de circuitos neuronales. Se reconocen distintas familias de moléculas y de sus receptores implicados en este proceso18. Estudios recientes sugieren que algunos de estos elementos se alojan característicamente en rafts-DRM19,20. El término rafts-DRM aquí utilizado tiene como finalidad hacer énfasis en la naturaleza bioquímica de las preparaciones reportadas. Netrina-1 es una proteína relacionada con la laminina, que atrae o repele a los conos de crecimiento a través de su interacción con sus receptores específicos DCC21. Estos receptores están palmitoilados en uno de sus dominios transmembranales, lo que propicia su asociación con rafts, evento que también es promovido por la unión de su ligando netrina-1. Cabe resaltar que una mutación puntual en su sitio de palmitoilación (sustitución de la cisteína 1121 por valina) atenúa su señalización acoplada a proteínas cinasas activadas por mitógeno (MAPK)22. En este mismo sentido, se reportó que la desestabilización o alteración funcional de los rafts-DRM, mediante el tratamiento con metil-β-ciclodextrina (MBCD; fármaco que preferentemente remueve el colesterol de la membrana plasmática) o la adición exógena del gangliósido GM1 (componente lipídico de rafts), bloquea la activación de la vía MAPK y el direccionamiento de conos de crecimiento inducidos por netrina-119. El factor neurotrófico derivado del cerebro (BDNF) y la semaforina 3A promueven asimismo el direccionamiento de los conos de crecimiento al unirse a sus receptores TrkB y neuropilina-1, respectivamente, a través de vías de señalización que son atenuadas por el tratamiento con MBCD o por la incorporación del gangliósido GM119. Este conjunto de estudios apoya un papel relevante de los rafts en los procesos de crecimiento y proyección del axón.
Importancia de rafts en la transmisión sinápticaLa participación de los rafts en la transmisión sináptica se destaca en dos eventos esenciales: la liberación de los neurotransmisores en las terminales presinápticas y la señalización de sus respectivos receptores posinápticos. El arribo de un potencial de acción a la membrana presináptica provoca de manera secuencial: su despolarización, la apertura de canales de Ca2+ activados por voltaje, el influjo de Ca2+ en la terminal nerviosa, la exocitosis de las vesículas sinápticas y la liberación de los neurotransmisores en la hendidura sináptica. Los neurotransmisores así liberados hacen blanco sobre sus respectivos receptores posinápticos y desencadenan cascadas de señalización. Varios estudios han documentado la importancia del colesterol y de los rafts en este proceso23,24. Se ha reportado, por ejemplo, la presencia en rafts de proteínas involucradas en el proceso de exocitosis, como SNARE (SNAP25, sintaxina 1 y VAMP2), Munc18, sinaptofisina y sinaptotagmina25. Por otra parte, estudios en cultivos de neuronas del hipocampo de ratas mostraron que la aplicación de MBCD o de inhibidores de la síntesis de colesterol (mevastatina o ácido zaragózico) reduce significativamente su tasa de exocitosis25. En terminales presinápticas (sinaptosomas) de rata se reportó, por su parte, que los canales de calcio activados por voltaje CaV2.1 o tipo P/Q (preponderantes en las sinapsis del sistema nervioso central) se localizan en rafts y que la desestabilización funcional de éstos, mediante la aplicación de saponina o MBCD, disminuye el influjo de Ca2+ a través dichos canales26. Otras investigaciones respaldan la relevancia de los rafts-DRM en los procesos de señalización del tipo glutamatérgica, GABAérgica, dopaminérgica, colinérgica, serotoninérgica y purinérgica27–30. En la mayoría de estos casos, los receptores posinápticos para los neurotransmisores, las proteínas asociadas a sus cascadas de señalización y los transportadores que los recapturan se localizan en rafts-DRM y resultan afectados en su funcionamiento cuando éstos son desestabilizados.
Rafts y plasticidad sinápticaLa plasticidad sináptica consiste en un cambio en la eficiencia de la transmisión sináptica e implica modificaciones en el mecanismo de liberación de los neurotransmisores y/o alteraciones en los elementos posinápticos31. La eficiencia de la transmisión sináptica puede modularse a través de sinapsis ya existentes o mediante la generación de otras nuevas. Estas modificaciones, a su vez, pueden incidir sobre el funcionamiento de circuitos o redes neuronales y afectar procesos como el neurodesarrollo, el aprendizaje y la memoria17,31,32. Acorde con su relevancia en la transmisión sináptica, a los rafts también se les reconoce su participación en la plasticidad sináptica30,33. En un estudio realizado en rebanadas de hipocampo de ratas, por ejemplo, se observó que la disminución del colesterol de la membrana plasmática (por la aplicación de MBCD) interfirió con el mecanismo de potenciación a largo plazo (LTP) típicamente observado en esta preparación33,34. En este mismo modelo se mostró que la remoción del colesterol atenúa de manera significativa la respuesta de los receptores posinápticos glutamatérgicos NMDA (N-metil-D-aspartato) y AMPA (ácido α-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico)29. En otro estudio, realizado en ratas sometidas a pruebas de memoria espacial, se determinó que los receptores NMDA en la corteza insular y el hipocampo se relocalizan en rafts-DRM, sin modificar su nivel de expresión27. Otro aspecto interesante se refiere a la acción de los factores neurotróficos o neurotrofinas (NGF, BDNF, neurotrofina-3 y neurotrofina-4) esenciales para la supervivencia, diferenciación neuronal y plasticidad sináptica35. Se sabe que la estimulación neuronal repetitiva promueve la expresión y la actividad de estas neurotrofinas, lo que a su vez se traduce en procesos de neurotransmisión y plasticidad sináptica más eficientes a través de un mecanismo que es regulado por la localización de sus receptores en rafts-DRM36,37. En cultivos de neuronas de la corteza cerebral y del hipocampo de ratas se ha reportado que la aplicación de BDNF promueve la síntesis e incorporación del colesterol en los rafts, así como la expresión de la proteína caveolina-2 y de las proteínas presinápticas sinaptofisina, SNAP-25 y sintaxina38. Todos estos efectos son mediados por la activación y relocalización de los receptores para BDNF del tipo TrkB y p75 en rafts-DRM39. Cabría esperar entonces que la alteración en la síntesis del colesterol y/o de las proteínas constitutivas de los rafts, promovida por el BDNF, modifique su composición y organización, y afecte a los procesos de plasticidad sináptica en los que participan. Finalmente, también se ha reportado la localización en rafts de otros tipos de receptores con actividad de cinasas de tirosina (receptores para neurorregulinas del tipo ErbB) asociados con los mecanismos de plasticidad sináptica.
Participación de rafts en aprendizaje y memoriaGeneralmente, se acepta que los procesos de aprendizaje y memoria se basan en los mecanismos de plasticidad sináptica que, como previamente se ha mencionado, se relacionan con rafts30,33. El proceso de generación de memoria espacial en ratas, por ejemplo, implica la relocalización de receptores NMDA en rafts-DRM a través de un mecanismo que depende de la proteína de andamiaje PSD-9527. Otro ejemplo interesante lo constituyen el crecimiento y la arborización de dendritas en neuronas corticales de cultivos primarios de hipocampo de ratones, promovidos por la sobreexpresión de caveolina-1 y por la concomitante localización de la proteína PSD-95 y de los receptores NMDA y TrkB en rafts-DRM40. En otra investigación, en la cual se mantuvieron ratas adultas con una dieta rica en colesterol durante dos a cuatro meses, se observó un mejoramiento en sus capacidades de aprendizaje espacial con relación al grupo de ratas mantenidas con dieta regular41. En un estudio adicional, sin embargo, el tratamiento durante tres meses con estatinas (fármacos inhibidores de la síntesis de colesterol) promovió un mejor desempeño de ratones en pruebas de aprendizaje y memoria42. Estos resultados, aparentemente contradictorios, podrían explicarse por el requerimiento de un nivel óptimo de colesterol para la estabilidad de los rafts y del desarrollo de estos procesos, como se ha demostrado en otros casos43. Finalmente, en experimentos en rebanadas de hipocampo de rata tratadas por dos a cuatro horas con estatinas se facilitó el fenómeno de LTP, sin modificar el nivel basal de la transmisión sináptica34, lo que sugiere un efecto específico sobre los mecanismos de plasticidad sináptica. A partir de estos estudios, se puede concluir que la modificación en la concentración de colesterol afecta la constitución de los rafts y los procesos asociados a ellos (plasticidad sináptica, aprendizaje y memoria).
Participación de rafts en enfermedades neurológicasEn años recientes se ha documentado que la alteración en la composición y organización de los rafts-DRM propicia la desregulación de vías de señalización y circuitos neuronales, lo que a su vez se ha asociado con diversas enfermedades neurológicas, entre las que se destacan las enfermedades de Alzheimer, Parkinson y Huntington17,32 (fig. 2).
La enfermedad de AlzheimerLa enfermedad de Alzheimer es el padecimiento neurodegenerativo más común y causa principal de la demencia progresiva durante la vejez. Se caracteriza por la presencia intracelular de husos de neurofibrillas de la proteína tau y por la acumulación extracelular del péptido β-amiloideo (Aβ), derivado del procesamiento de la proteína precursora amiloidea (APP) por las enzimas β- y γ-secretasas44. Recientemente, también ha cobrado relevancia la neurotoxicidad de los oligómeros de la proteína Aβ 45-47. La proteína precursora amiloidea se localiza en rafts-DRM y, en consecuencia, la síntesis, acumulación y posterior agregación del péptido Aβ se dan preferentemente en estos dominios48-52. Más aún, todo el conjunto de enzimas implicadas en la generación de la APP se localiza en los mismos50,51. Estas evidencias apoyan la hipótesis de que los cambios en la estructura y composición de las balsas de membrana podrían asociarse con la manifestación de la enfermedad de Alzheimer. En este sentido, estudios epidemiológicos muestran una reducción en la prevalencia de la enfermedad de Alzheimer en individuos sujetos a tratamiento crónico con estatinas, las cuales atraviesan la barrera hematoencefálica53. Por otra parte, el análisis post mortem de la corteza temporal de sujetos con esta enfermedad mostró una disminución de rafts-DRM54, mientras que en la región del hipocampo se detectó una reducción en el contenido de colesterol de los mismos55, con respecto a sujetos sin este padecimiento. Otros grupos han reportado también alteraciones en la composición de los rafts-DRM en muestras de la corteza frontal de sujetos con esta enfermedad56. En modelos de ratón se ha observado que la aplicación crónica de inhibidores de la síntesis de colesterol reduce el grado de agregación de la proteína Aβ 57. Por otra parte, en un modelo de vesículas unilamelares, se mostró que el gangliósido GM1 regula la interacción de los monómeros de la proteína Aβ, así como sus procesos de oligomerización y formación de fibras, a través de un mecanismo dependiente del nivel de colesterol58,59. Estos resultados apoyan la propuesta de que la enfermedad de Alzheimer debe considerarse un trastorno de la membrana plasmática, y que los cambios en la composición y estructura de los rafts representan un blanco potencial para su tratamiento46,48,53,60.
La enfermedad de ParkinsonEn pacientes con enfermedad de Parkinson, el cociente fosfolípidos/colesterol en el cerebro está incrementado61. Aunque a la fecha no se ha establecido una relación directa entre esta condición y la neurodegeneración nigro-estriatal característica de este padecimiento62, sí se ha planteado la posibilidad de que las alteraciones en la composición lipídica y, por lo tanto, en las propiedades biofísicas de la membrana plasmática estén relacionadas con esta enfermedad63,64. Dichas modificaciones podrían incidir sobre la funcionalidad de proteínas como α-sinucleína, parkina, PINK1 y DJ-1, reconocidas como marcadores moleculares de la enfermedad de Parkinson62,65-68. En el caso de α-sinucleína se ha observado que su interacción con gangliósidos y colesterol promueve su internalización y posterior efecto sobre la membrana plasmática de células de microglía, mantenidas en cultivo69. En un estudio de microscopía de fuerza atómica se observó que la presencia de α-sinucleína impide la formación de rafts en un modelo de membrana artificial70. En otro estudio, que combinó microscopía de fuerza atómica y técnicas de dispersión de neutrones, se reportó que la presencia del gangliósido GM1 favorece la unión de la α-sinucleína a un modelo de bicapa lipídica71. Por su parte, el análisis post mortem de la corteza frontal de individuos con la enfermedad de Parkinson reveló alteraciones significativas en la composición de los rafts-DRM, que incluían una mayor proporción de ácidos grasos saturados y una significativa reducción en el nivel de cerebrósidos con respecto a la de individuos sanos61. Se ha reportado también una menor expresión de distintos gangliósidos (GD1a, GD1b y GT1b) y otros componentes lipídicos (fosfatidiletalonamina, fosfatidilcolina, fosfatidilinositol y cerebrósidos) en la sustancia nigro-estriatal de pacientes masculinos con esta enfermedad72. Aun cuando los estudios referidos sustentan la relevancia de los rafts-DRM en la enfermedad de Parkinson, resulta necesario fortalecer esta hipótesis sin desestimar la discusión ya mencionada sobre la asumida equivalencia entre rafts y DRM.
La enfermedad de HuntingtonLa enfermedad de Huntington es una enfermedad neurodegenerativa progresiva que se caracteriza por alteraciones motoras, cognitivas y de conducta73. Se origina por la incorporación anómala de residuos de glutamina en el extremo N-terminal de la proteína huntingtina. En ratones modelo esta enfermedad se asocia con una disminución en la síntesis de colesterol en la corteza cerebral y el estriado y con muerte neuronal74. En el núcleo estriado de humanos afectados por esta enfermedad se detectó (post mortem) una reducción significativa en la concentración de gangliósidos75, mientras que en muestras también de estriado humano y de ratones modelo se reportó la expresión atenuada de los genes que codifican para las enzimas glicosiltransferasas implicadas, precisamente, en la síntesis de gangliósidos76. Otro grupo reportó, también en ratones modelo, la acumulación de la proteína huntingtina mutada en los rafts-DRM77. Finalmente, la adición de colesterol exógeno a neuronas cultivadas del estriado de ratones modelo disminuyó su tasa de mortalidad74, mientras que la infusión intracerebral del gangliósido GM1, en este mismo modelo, mejoró su disfunción motora y atenuó su grado de neurodegeneración78. Lo anterior sugiere que un incremento en la biosíntesis y/o una mayor disponibilidad de colesterol y/o gangliósidos podría paliar los aspectos asociados a la enfermedad de Huntington.
Sin embargo, otros estudios también en ratones modelo, han reportado la acumulación de colesterol y de la proteína huntingtina mutada en rafts-DRM77,79. Más aún, en células que expresaban la huntingtina mutada se observó que además de esta proteína también caveolina-180, el gangliósido GM1 y los receptores para NMDA se localizan preferentemente en rafts-DRM. Interesantemente, el tratamiento de estas células con MBCD o simvastatina disminuyó la presencia de rafts-DRM y atenuó la excitotoxicidad mediada por NMDA80. Acorde con lo anterior, la administración de fármacos que contrarrestan la acumulación de colesterol (simvastatina) podría ser benéfica en el tratamiento de la enfermedad de Huntington. En este mismo sentido, la colesterol 24-hidroxilasa (CYP46A1), enzima encargada de catalizar la conversión de colesterol en 24-hidroxicolesterol en el sistema nervioso central, se encuentra disminuida en el putamen de pacientes con la enfermedad de Huntington y en el estriado de ratones modelo81. Notablemente, la restitución de la enzima CYP46A1 en el estriado de los ratones modelo mitigó sus déficits motores, aumentó el tamaño promedio de sus neuronas espinosas medianas y restauró su homeostasis del colesterol81. Estos resultados identifican a la enzima CYP46A1 como un objetivo terapéutico en la enfermedad de Huntington.
Es claro que se requieren más estudios para resolver esta aparente contradicción en la participación del colesterol y del gangliósido GM1 en la enfermedad de Huntington, así como para establecer los principios moleculares y funcionales que rigen el delicado balance entre estabilidad-inestabilidad y funcionalidad-disfunción de los rafts y sus correspondientes implicaciones en este padecimiento.
Síndrome de Smith–Lemli–Opitz (SLO)El síndrome de Smith-Lemli-Opitz se caracteriza por malformaciones durante el desarrollo, mielinización incompleta y retraso mental82. En esta afectación el contenido de colesterol en los rafts-DRM está disminuido significativamente debido a la carencia de la enzima 3β-hidroxiesteroidea Δ7-reductasa83,84. En consecuencia, distintos estudios indican que una mayor presencia de 7-dehidrocolesterol promueve cambios en la organización y en la dinámica de la membrana plasmática que podrían estar asociados a las manifestaciones de este síndrome85,86.
Enfermedad de Niemann–Pick tipo C (NPC)La enfermedad de Niemann–Pick tipo C afecta principalmente a personas adultas. Provoca demencia progresiva, manifestaciones psiquiátricas y anormalidades en el sistema nervioso central (aspectos clínicos compartidos con la enfermedad de Alzheimer). Es causada por la mutación de las proteínas NPC1 y NPC2 y se caracteriza por la acumulación de colesterol en vesículas endolisosomales87. Esta condición afecta procesos vitales de la célula, incluyendo eventos de fusión vesicular y autofagia. Se ha reportado que neuronas cultivadas del estriado de ratones en los cuales se noqueó la expresión de las proteínas NPC no responden a la aplicación de BNDF, aun cuando expresen el receptor TrkB para esta neurotrofina88. Estos estudios sugieren que en ausencia de proteínas NPC funcionales el colesterol permanece secuestrado en endolisosomas, su contenido en la membrana plasmática (y el retículo endoplásmico) disminuye y que esta condición afecta a los sistemas de señalización alojados en los rafts (activación de receptores TrkB por BNDF)89.
Demencia con Cuerpos de Lewy (DLB)Esta enfermedad neurodegenerativa se manifiesta por síntomas neuropsiquiátricos, deterioro cognitivo, demencia y síntomas parkinsonianos moderados. Se caracteriza por la conglomeración de moléculas de α-sinucleína en los denominados cuerpos de Lewy, los cuales se alojan en estructuras del sistema nervioso central como el tallo cerebral, el sistema límbico y la corteza cerebral90. En pacientes con DLB se ha reportado (post mortem) que los rafts-DRM en células de la corteza frontal presentan niveles significativamente más bajos de colesterol y más altos de ésteres de esteroles, que en los de los sujetos sin esta enfermedad64. Lo anterior se acompaña de una concentración significativamente alta de lisofosfatidilcolina, la cual es indetectable en extractos lipídicos de cerebros de sujetos normales. Estas especies lipídicas son generadas, en parte, por la oxidación catalizada por radicales libres de los ácidos grasos de fosfatidilcolinas poliinsaturadas, y su presencia indica daño oxidativo de los fosfolípidos de membrana. El resultado es un incremento significativo en la relación fosfolípidos/colesterol. Estos cambios afectan la distribución de proteínas asociadas a rafts-DRM, como el canal aniónico VDAC1 y la proteína prion (PrPc), que son desplazadas de dichos dominios, mientras que se incrementa en ellos la presencia de la proteína precursora amiloidea63.
Neuromielitis ópticaLa neuromielitis óptica es una enfermedad inflamatoria desmielinizante del sistema nervioso central, originada por la unión del anticuerpo NMO-IgG a la proteína acuaporina-4 (AQP4) en astrocitos, lo que desencadena un proceso de citotoxicidad91. AQP4 es una proteína transmembranal que se localiza principalmente en rafts-DRM. En células OS3 (una línea celular de astrocitos de ratón) la aplicación de MBCD o simvastatina provoca la relocalización de AQP4 en regiones fuera de los rafts-DRM, lo que disminuye la citotoxicidad promovida por el NMO-IgG obtenido de pacientes con esta enfermedad92.
Enfermedad de Creutzfeldt JakobLas proteínas prion (PrP) son los agentes causantes de las encefalopatías espongiformes transmisibles, como la enfermedad de Creutzfeldt Jakob93. Esta enfermedad degenerativa es debida a un cambio conformacional de la PrPc que da lugar a su forma infecciosa PrPSc94. Al parecer los rafts juegan un papel crítico en esta conversión, ya que el tratamiento con estatinas o filipina de células cerebrales de hámster, células ScN2a de neuroblastoma o células CHO que expresan PrPc elimina la presencia de PrPc en los rafts-DRM y previene la formación de la PrPSc95.
ConclusionesLos rafts o balsas de membrana representan dominios estructurales de naturaleza lipoproteica que propician la eficiente modulación de procesos fisiológicos asociados a la membrana plasmática. Los principios que subyacen a la dinámica de ensamble-disociación-señalización de estos complejos moleculares en los diferentes escenarios y contextos celulares, actualmente son materia de intenso estudio. En el sistema nervioso se ha determinado que la alteración de estos dominios promueve el desarrollo de diversas enfermedades neurológicas (fig. 2). Resulta pues atractiva la propuesta de estrategias terapéuticas contra estas enfermedades desde una perspectiva basada en la relevancia fisiopatológica de los rafts.
FinanciaciónEste trabajo fue parcialmente apoyado por el Consejo Nacional de Ciencia y Tecnología (CONACyT) de México, a través de los convenios IFC-2016-1955 (U.M., S.S-A., A.A.R-M.) y CB-284443 (A.A.R-M.) y por la Universidad Autónoma de San Luis Potosí a través de los convenios C19-FAI-05-59.59 (U.M.) y C18-FRC-08-03.03 (A.A.R-M.). Estas fuentes de financiamiento no participaron en el diseño, desarrollo, análisis, escritura o en la decisión de envío de este trabajo para su publicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.