El progresivo envejecimiento de la población en las últimas décadas ha provocado un aumento en la frecuencia de aparición de las muchas complicaciones que se asocian al cáncer. Entre ellas destacan las neurológicas, que aparecen en un 10-30% de los pacientes con neoplasias sistémicas. La meningitis neoplásica aparece en un 4-15% de los pacientes con tumores sólidos y se asocia a un mal pronóstico. El objetivo de este trabajo es describir las características clínicas, licuorales, de imagen y pronósticas en una serie de meningitis neoplásica.
Fuentes y desarrrolloSe realizó una revisión retrospectiva de todos los pacientes ingresados en el Hospital Universitario de Gran Canaria Dr. Negrín con sospecha de meningitis neoplásica entre los años 1990 y 2008. Se seleccionaron 37 pacientes, con un rango de edad entre los 15 y los 75 años. De los 33 casos en los que se identificó un tumor primario, 27 (81,8%) estaban asociados a tumores sólidos (24,2% de mama y 24,2% de pulmón). La diplopia fue la manifestación de disfunción de nervios craneales más frecuente, observándose en 12 casos (32,4%). La supervivencia media tras el diagnóstico fue de 87,9 días (12,6 semanas). La citología del líquido cefalorraquídeo fue positiva en 12/26 casos (46,4%).
ConclusiónLa meningitis neoplásica es una complicación grave de los tumores tanto sólidos como hematológicos. Es necesario mantener un alto nivel de sospecha que permita establecer un diagnóstico precoz, puesto que la supervivencia media en los pacientes con meningitis neoplásica es baja.
The increase in the ageing population in the last decades has led to an increased frequency of cancer-associated complications. Among these, neurological disorders stand out, as they appear in 10-30% of patients with systemic neoplasia. Neoplastic meningitis accounts for 4-15% of patients with solid tumours and it has a poor prognosis. The objective of this paper is to describe the clinical, imaging and prognostic characteristics as well as cerebrospinal fluid findings in a series of neoplastic meningitis.
Background and developmentWe performed a retrospective review of all patients admitted to the Hospital Universitario of Gran Canaria Dr. Negrín with clinical suspicion of neoplastic meningitis between 1990 and 2008.
We selected 37 patients with an average age ranging from 15 to 75 years old. A total of 81.8% of the cases in which a primary tumour was found were associated with solid tumours (24.2% were located in the breast, and 24.2% in the lung). The most frequent sign of cranial nerve dysfunction was dyplopia, which was observed in 32.4% of the cases. The average survival rate after diagnosis was 87.9 days (12.6 weeks). The cerebrospinal fluid cytology was positive in 46.4% of the cases.
ConclusionNeoplastic meningitis is a severe complication of both solid and haematological tumours. We stress the importance of maintaining a high level of suspicion to achieve early diagnosis, since the average survival probability for neoplastic meningitis patients is low.
El progresivo envejecimiento de la población en las últimas décadas ha provocado un incremento muy importante de la incidencia de los diferentes tipos de cáncer en nuestra sociedad1-3. Paralelamente se ha producido una mejora en los tratamientos de los mismos, alargando la supervivencia tras el diagnóstico4. Esto ha llevado a un aumento en la frecuencia de aparición de las muchas complicaciones que se asocian a esta enfermedad. Entre las complicaciones de los pacientes con cáncer destacan las neurológicas, que aparecen hasta en un 10-30% de los casos5,6.
La meningitis neoplásica (MN) consiste en la infiltración de las meninges por parte de células tumorales, con diseminación de las mismas a través del líquido cefalorraquídeo (LCR)7,8. Fue descrita por primera vez por Eberth en 18709. Se trata de una complicación relativamente frecuente de los cánceres sistémicos, apareciendo en un 3-15% de los pacientes con tumores sólidos (meningitis carcinomatosa) y en un 5-15% de los pacientes con tumores hematológicos (meningitis linfomatosa y meningitis leucémica)10-17.
El objetivo de este trabajo es describir las características clínicas, licuorales, de imagen y pronósticas en una serie de MN.
Material y métodosSe realizó una revisión retrospectiva de todos los pacientes ingresados en el Hospital Universitario de Gran Canaria Dr. Negrín con sospecha de MN entre los años 1990 y 2008. Este hospital es de tercer nivel y cubre un área sanitaria aproximada de 450.000 habitantes.
A todos los pacientes ingresados en la Sección de Neurología se les realiza un informe de alta que queda almacenado en una base de datos informatizada (FILEMAKER PRO versión 5.5®). Se seleccionaron y revisaron todos los ingresos durante el periodo de estudio, incluyendo todos los pacientes que ingresaron por una sospecha de MN, según los criterios establecidos por los autores del trabajo (ver más adelante). Los pacientes ingresados en otros servicios se localizaron a través del Departamento de Codificación del hospital. Se realizó una búsqueda según los términos “meningitis neoplásica”, “meningitis carcinomatosa”, “carcinomatosis meníngea”, “carcinomatosis leptomeníngea”, “meningitis linfomatosa” y “meningitis leucémica”.
Todos los pacientes seleccionados inicialmente fueron revisados por dos de los autores del trabajo. En todos los casos seleccionados se revisaron los datos epidemiológicos (edad y sexo), clínicos (presencia o no de fiebre, cefalea, rigidez de nuca, náuseas o vómitos, afectación de pares craneales, afectación del nivel de conciencia u otra clínica focal y/o crisis comiciales), oncológicos (presencia o no de tumor primario conocido y localización del mismo), valores de laboratorio (hemograma, bioquímica básica y velocidad de sedimentación globular), parámetros del LCR (citobioquímica, análisis microbiológicos y citología) y resultados de las técnicas de neuroimagen (tomografía computerizada [TC] y resonancia magnética [RM] craneal en todos los casos). En todos los casos revisados se buscó específicamente el diagnóstico mediante cultivo, serología o reacción en cadena de la polimerasa, tanto en sangre como en LCR, de bacterias aerobias, anaerobias, mycobacterias, Treponema pallidum y virus neurotropos (virus de la inmunodeficiencia humana, virus de Epstein-Barr, citomegalovirus, virus del herpes simple y virus varicela-zóster); en los casos en los que se hubiera realizado se recogió el resultado de las técnicas de detección de hongos. En todos los casos se revisó la evolución de la enfermedad.
El diagnóstico de meningitis carcinomatosa se basó en los datos clínicos, licuorales y de neuroimagen. Se estableció el diagnóstico de meningitis neoplásica en los siguientes casos: 1) presencia de células neoplásicas en el LCR; 2) celularidad en el LCR >10 leucocitos, con negatividad de los estudios microbiológicos y hallazgos en la RM o TC craneales compatibles con una meningitis neoplásica; 3) celularidad en el LCR >10 leucocitos, con glucorraquia disminuida (<50% de la glucosa plasmática) y/o hiperproteinorraquia (proteínas en LCR> 45mg/dl), siempre que los estudios microbiológicos citados previamente fueran negativos, y se asociara a historia previa de neoplasia maligna o diagnóstico de la misma durante el ingreso o el seguimiento.
Los hallazgos diagnósticos en RM o TC craneales que se consideraron compatibles con una MN incluían: 1) el realce leptomeníngeo difuso; 2) el engrosamiento meníngeo; 3) los depósitos nodulares múltiples en el espacio subaracnoideo, la superficie cerebelosa o la superficie cortical; y 4) las masas tumorales, con o sin hidrocefalia.
ResultadosSe seleccionaron 37 pacientes, 20 hombres (54,1%) y 17 mujeres (45,9%), con edades comprendidas entre los 15 y los 75 años. La edad media fue de 50,5 años (44,8 años en hombres y 56,9 años en mujeres).
El tumor primario era conocido previamente al diagnóstico de MN en 26 casos (70,3%); en 7 casos (16,2%) se llegó al diagnóstico del tumor primario tras el diagnóstico de MN, 5 de ellos tras el análisis del LCR, 1 tras biopsia cortical y otro tras necropsia. En 4 casos (10,8%) no se llegó al diagnóstico del tumor primario. De estos 4 casos, 1 presentó una citología positiva y 1 tenía lesiones hepáticas compatibles con metástasis de primario desconocido.
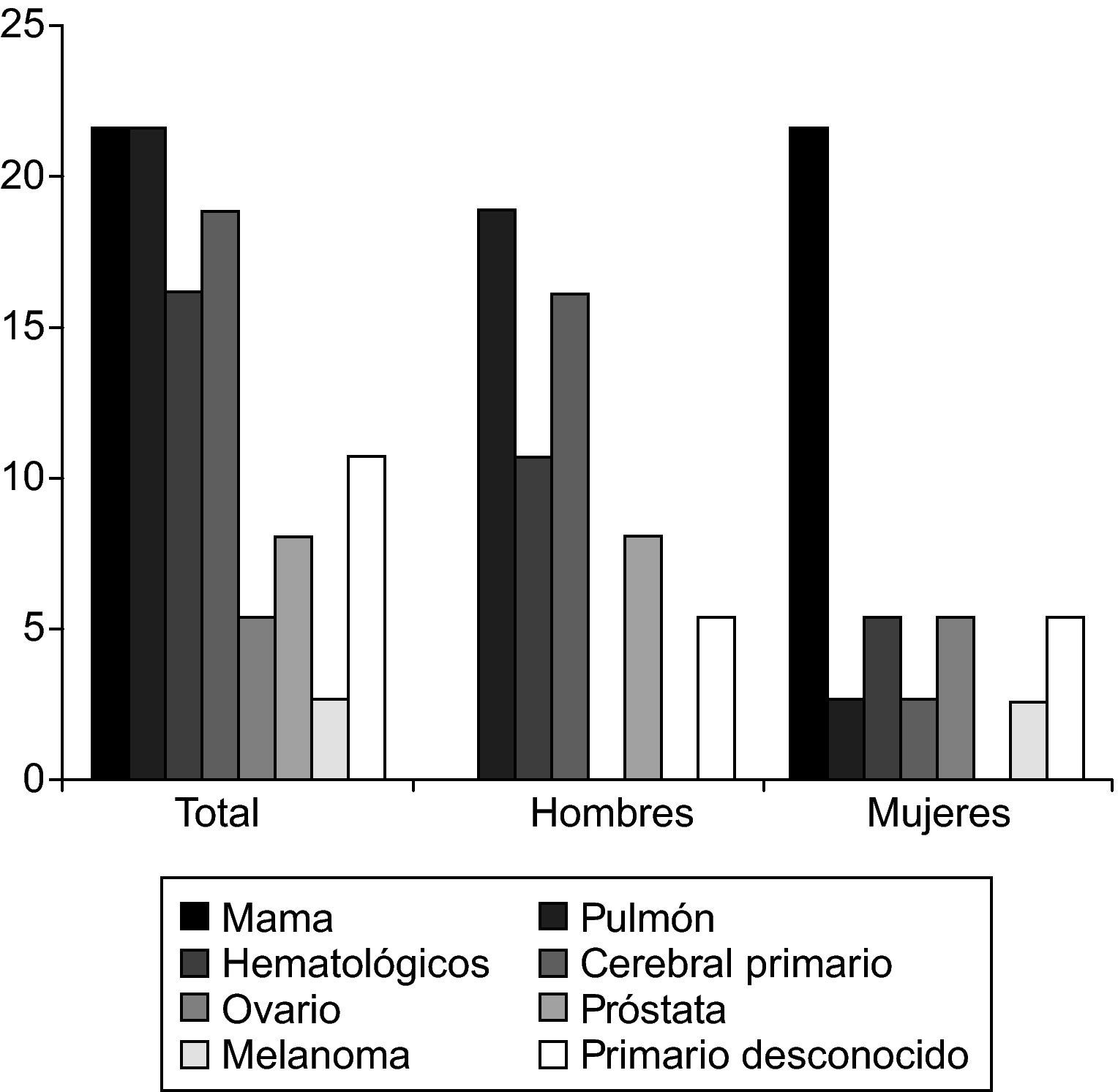
Entre los 33 casos con tumor primario filiado, 27 (81,8%) eran tumores sólidos. De ellos, 8 (24,2%) correspondían a cáncer de mama; 8 (24,2%) a cáncer de pulmón; 5 (15,2%) a tumores cerebrales primarios, incluyendo un gliosarcoma, un astrocitoma de alto grado, un tumor neuroepitelial embrionario, un tumor de glándula pineal y otro de estirpe no definida; 3 (9,1%) a adenocarcinoma de próstata; 2 casos (6,1%) a cáncer ovárico; y 1 (3%) a melanoma. Los 6 casos restantes (18,9%) correspondían a tumores de estirpe hematológica: 4 a linfoma no hodgkiniano (12,1%), 1 (3%) a una leucemia linfoide aguda pre B y 1 (3%) a un linfoma meníngeo primario. La frecuencia relativa de los distintos tumores se muestra en la figura 1.
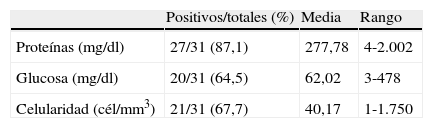
Las características del LCR se analizaron en 31 de los casos. Sus resultados pueden observarse en la tabla 1. En 29 casos (93,5%) se observó una alteración en al menos un parámetro del LCR (proteinorraquia > 45mg/dl, pleocitosis > 10 cél/mm3, o glucorraquia < 60-80mg/dl o < 60% de la glucemia plasmática); en los 2 casos restantes (6,5%) todos los parámetros citobioquímicos del LCR fueron normales, llegándose al diagnóstico de MN mediante citología positiva para malignidad en uno de ellos, y diagnóstico por imagen compatible con MN en el otro caso. Se obtuvieron resultados citológicos en 28 casos. La citología del LCR resultó positiva para células malignas en 9 de los casos (32,1%) en la primera punción lumbar, en 3 (10,7%) en la segunda y en 1 (3,5%) en la tercera o sucesivas. En total, se obtuvo una citología positiva en LCR en 13 casos (46,4%).
En los 6 pacientes en que no se analizó el LCR, se llegó al diagnóstico de MN ante un cuadro con presentación clínica típica, y alteraciones en RM/TC compatibles con MN.
Se realizó TC craneal en 30 casos (81%) obteniéndose hallazgos compatibles con MN en 7 de ellos (23%), y alteraciones no sugestivas de MN en 5 (16,7%). No se encontraron alteraciones de ningún tipo en 18 casos (60%). Se realizó RM del neuroeje en 28 casos (75,7%). De estos, 21 (75%) mostraron alteraciones compatibles con MN, 3 (10,7%) alteraciones de otra índole y 4 (14,3%) estudios dentro de la normalidad. En cuanto a las alteraciones halladas en RM, 13 casos (46,4%) presentaban infiltración leptomeníngea difusa, 4 casos (143%) realce focal, 2 casos (7,1%) mostraban masas tumorales y 3 casos (10,7%) presentaban depósitos nodulares subaracnoideos o interventriculares, con hidrocefalia asociada en 2 de ellos.
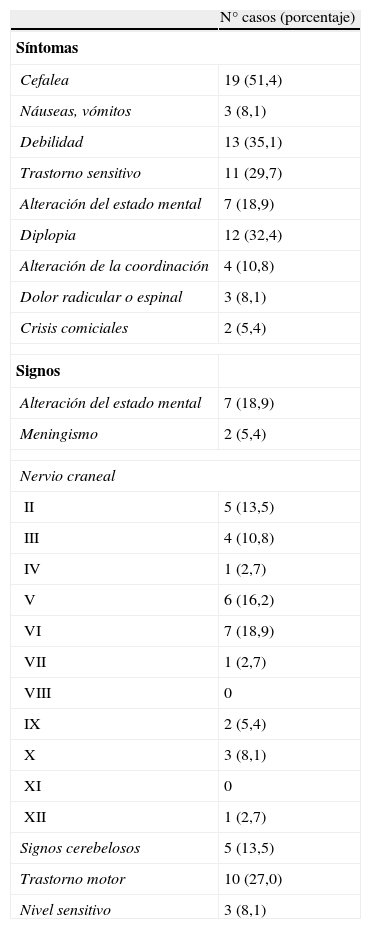
Los síntomas y signos neurológicos de presentación están resumidos en la tabla 2. En 18 casos (48,7%) la clínica de presentación estaba localizada a un único nivel del neuroeje (médula, fosa posterior o supratentorial) e incluían los 3 territorios en 4 casos (10,8%). La cefalea era el síntoma de presentación en 19 pacientes (51,4%), con características y localización variables. Presentaban fiebre 4 casos (10,8%). Las alteraciones del estado mental incluían tanto alteraciones del nivel de conciencia (desde somnolencia a coma) como del contenido de la misma (delirio, deterioro cognitivo). Se observaron alteraciones de este tipo en 7 de los casos analizados (18,9%).
Signos y síntomas de presentación de la meningitis neoplásica
| N° casos (porcentaje) | |
| Síntomas | |
| Cefalea | 19 (51,4) |
| Náuseas, vómitos | 3 (8,1) |
| Debilidad | 13 (35,1) |
| Trastorno sensitivo | 11 (29,7) |
| Alteración del estado mental | 7 (18,9) |
| Diplopia | 12 (32,4) |
| Alteración de la coordinación | 4 (10,8) |
| Dolor radicular o espinal | 3 (8,1) |
| Crisis comiciales | 2 (5,4) |
| Signos | |
| Alteración del estado mental | 7 (18,9) |
| Meningismo | 2 (5,4) |
| Nervio craneal | |
| II | 5 (13,5) |
| III | 4 (10,8) |
| IV | 1 (2,7) |
| V | 6 (16,2) |
| VI | 7 (18,9) |
| VII | 1 (2,7) |
| VIII | 0 |
| IX | 2 (5,4) |
| X | 3 (8,1) |
| XI | 0 |
| XII | 1 (2,7) |
| Signos cerebelosos | 5 (13,5) |
| Trastorno motor | 10 (27,0) |
| Nivel sensitivo | 3 (8,1) |
II incluye tanto la disminución de la agudeza visual como la presencia de edema de papila.
Trastorno motor incluye hemiparesia, paraparesia o tetraparesia.
Trastorno sensitivo incluye clínica sensitiva facial.
Se observaron datos de afectación neurológica focal en 22 casos (59,5%), 16 de ellos con afectación de nervios craneales (43,2%), tanto de forma aislada (3 casos) como asociada a otros signos focales.
En cuanto a la evolución, se obtuvieron datos fiables en 25 de los 37 casos estudiados. Todos ellos fallecidos entre la fecha del diagnóstico de MN (3 casos -12%-) y los 12 meses posteriores. Siete casos (28%) fueron exitus en el primer mes tras el diagnóstico de MN, dos de ellos en la primera semana de evolución. Los restantes casos se distribuyeron de forma equitativa entre los 2 siguientes trimestres y el segundo semestre desde el diagnóstico (3 casos -12%- por periodo). En 6 casos no se pudo definir el momento de la muerte. Los 4 casos en los que no se encontró tumor primario fallecieron en el primer mes tras el diagnóstico. El paciente que presentó un LCR sin anomalías citobioquímicas ni citológicas falleció a los 6 meses del diagnóstico. La supervivencia media fue de 87,9 días (12,6 semanas).
DiscusiónLa MN aparece en un 3-15% de todos los pacientes oncológicos10-17. Este porcentaje se eleva hasta un 19% en algunas series de autopsias18. En general, se presenta en estadios avanzados de la enfermedad neoplásica, aunque no es exclusiva de estas fases12,19-21. Su aparición conlleva un importante incremento tanto de morbilidad como mortalidad.
Los tumores primarios que se asocian con mayor frecuencia a los casos diagnosticados de MN son los carcinomas de mama, pulmón y el melanoma, con una frecuencia relativa de 27-50%, 22-36% y 12% respectivamente12,13,17. En nuestra serie, se obtuvieron datos similares en los dos primeros tumores (21,6% en cada caso). Sin embargo, sólo obtuvimos un 3% de casos asociados al melanoma, lo que podría estar relacionado con la baja incidencia del melanoma en nuestra comunidad, que se encuentra entra las menores de Europa22. En nuestro estudio, el tercer tipo tumoral en frecuencia estaba formado por el conjunto de neoplasias de estirpe hematológica, constituyendo un 16,2% de los casos incluidos. Un 13,5% de los pacientes presentaban un tumor cerebral primario concomitante, un resultado similar al de otros estudios (10-32%)23. En las series publicadas, los carcinomas de primario desconocido constituyen el 1-7% de todos los casos de MN12. En nuestra serie este porcentaje se eleva hasta el 10,8%, constituyendo el quinto tipo en frecuencia. Esta diferencia quizás se deba a un estudio insuficiente en estos casos dada la corta supervivencia media de los pacientes tras el diagnóstico de MN. Así pues, para diagnosticar una MN hay que mantener un alto nivel de sospecha, pues mientras una historia de cáncer previo apoya el diagnóstico, en un 29,8% de los casos de nuestra serie el tumor primario no se conocía antes de la clínica neurológica.
La aparición de clínica neurológica multifocal es característica en la MN11-15,17,20,24-28. El síntoma más frecuente en nuestra serie es la cefalea (51,4%). El análisis de los casos con cefalea no ha permitido encontrar características que puedan asumirse como típicas en la MN, aunque el diseño del estudio, basado en la revisión retrospectiva de los casos, no era el adecuado para este propósito. Las alteraciones del estado mental y las crisis comiciales se observaron en el 18,9% y el 5,4% de nuestros casos respectivamente, unas frecuencias menores a las descritas en la literatura. En el caso de las alteraciones del estado mental, estas diferencias pueden estar relacionadas con el tipo de estudio, puesto que algunos de estos pacientes no fueron valorados durante su ingreso por un neurólogo, y la recogida de datos ha sido retrospectiva, por lo que alteraciones sutiles del estado mental pueden haber pasado desapercibidas. En el caso de las crisis comiciales no hemos encontrado ningún factor que justificara la menor frecuencia de aparición en nuestra serie. La afectación de los pares craneales es frecuente en los casos de MN; en nuestra serie nos ha llamado la atención la menor frecuencia de afectación tanto del nervio óptico como del nervio facial, aunque consideramos que estas variaciones han de entenderse en el contexto de un estudio en el que la recogida de datos se ha realizado de forma retrospectiva, con la más que probable pérdida de datos focales sutiles. Un 48,7% de nuestros casos se manifestó con datos de afectación de un único nivel. Este porcentaje es similar al encontrado en otros estudios previos, en los que se llega a observar hasta en el 53%20. Por todo ello, es importante mantener la sospecha de una MN ante un cuadro neurológico subagudo o crónico, incluso cuando se halle limitado a un solo nivel del neuroeje.
El diagnóstico de MN ha aumentando en los últimos años, probablemente debido a la supervivencia prolongada de los pacientes con enfermedad metastásica y a las mejoras en los procedimientos diagnósticos. El test diagnóstico más importante es el examen del LCR, obtenido generalmente por medio de la punción lumbar11-13,15,18,24-26,29. En nuestra serie, solo el 2,7% mostraba normalidad en los cuatro parámetros de LCR recogidos (celularidad, proteinorraquia, glucorraquia y citología). Las alteraciones detectadas con mayor frecuencia fueron la hiperproteinorraquia (87,1%) y la pleocitosis (67,7%). Estos resultados se asemejan a los descritos en estudios previos con porcentajes entre 79-91% y 72-79%, respectivamente12,14,17,20,24,25. La citología de LCR positiva para células malignas es el método estándar para el diagnóstico de MN. Sin embargo, su sensibilidad no es demasiado elevada, con unos porcentajes de positividad entre el 45% para el primer análisis, y el 80% con una segunda determinación12,18. Se recomienda que el volumen de LCR extraído esté en torno a 8-10 cc, ya que esto aumenta la sensibilidad de la prueba con respecto al análisis de volúmenes menores de LCR12,14. En nuestra serie, la rentabilidad del estudio citológico ha sido baja, con un porcentaje de positividad de un 46,4% a pesar de extracciones repetidas de LCR, lo que puede estar relacionado con el análisis de volúmenes de LCR escasos. De forma general se considera que la realización de más de 2 punciones lumbares no incrementa significativamente su sensibilidad12, siempre que el volumen de LCR extraído sea el adecuado.
La RM con gadolinio puede establecer o apoyar el diagnóstico en algunos pacientes con una presentación clínica típica en los que la citología resulta negativa26,30,31. En nuestro trabajo, la TC craneal mostró hallazgos compatibles con el diagnóstico de MN en el 23% de los casos en que se realizó. Este porcentaje se vio incrementado hasta el 75% con la realización de RM del neuroeje. Esta prueba complementaria resultó considerablemente importante para el diagnóstico de MN en el 64,8% de los casos que presentaban citología negativa, y aún más en el 2,7% que no presentaba alteración alguna en los parámetros del LCR.
No nos hemos detenido en analizar otros métodos diagnósticos de MN, como son los marcadores bioquímicos del LCR30, ya que su uso aún no está establecido de forma regular en nuestro hospital.
La supervivencia media de los pacientes con MN no tratada es de 4 a 6 semanas, alcanzando con el tratamiento adecuado hasta 4-6 meses en algunos casos12,32-36. En nuestra serie, la supervivencia media fue de 87,9 días (12,6 semanas), según los resultados obtenidos de los 25 casos en los que se pudo recoger la evolución. En el resto de los casos no se tienen datos exactos, ya sea por falta de rigurosidad en la recogida de datos en las historias clínicas, o por ausencia de información tras la derivación de algunos pacientes a otros centros. Hemos de tener en cuenta que nuestro hospital es centro de referencia de aproximadamente la mitad de la población de la provincia de Las Palmas, con inclusión tanto del área norte de la isla de Gran Canaria, como de la isla de Lanzarote. Una vez establecido el diagnóstico inicial, estos pacientes eran trasladados de nuevo a sus centros correspondientes, lo que llevó a la pérdida de los datos referentes al seguimiento posterior de los mismos.
Reconocemos las limitaciones de un trabajo de estas características, donde tanto la selección de pacientes como la recogida de datos se han realizado de forma retrospectiva. Por un lado, es probable que se haya infravalorado la incidencia de la MN, puesto que puede haber habido pacientes que hayan ingresado en el hospital en estadios terminales de su enfermedad de base y en los que no se haya realizado un esfuerzo diagnóstico intenso para determinar las complicaciones asociadas. Por otra parte, no hemos tomado únicamente los enfermos valorados por la Sección de Neurología, por lo que resulta posible que haya habido casos que han ingresado con complicaciones de su enfermedad de base y en los que no se haya llegado a un diagnóstico etiológico. Por otra parte, la recogida de datos también ha sido retrospectiva, por lo que se pueden haber perdido datos sutiles de afectación neurológica focal. Además, no todos los casos tenían estudio del LCR, por lo que no podemos establecer valores definitivos de positividad de los parámetros del mismo. Aunque los resultados obtenidos no aportan novedades sustanciales a los aspectos ya conocidos de la MN, sí creemos que un trabajo de estas características nos sirve para refrendar algunas generalidades sobre el comportamiento de las mismas. Creemos recomendable la realización de trabajos prospectivos bien diseñados que ayuden a establecer posibles factores pronósticos que permitan seleccionar aquellos pacientes que pudieran beneficiarse de tratamientos específicos.
En resumen, el diagnóstico de MN requiere de un alto nivel de sospecha, pues aunque generalmente aparece en la enfermedad neoplásica avanzada, puede ser el síntoma de presentación de un tumor no conocido. Hemos de sospecharla ante cuadros neurológicos subagudos o crónicos con afectación multifocal, sin olvidar los casos en que la clínica está más localizada. Igualmente, aunque la citología para células malignas del LCR es el único método diagnóstico de certeza, la combinación de una clínica típica con estudios de neuroimagen compatibles es adecuada por sí sola para establecer el diagnóstico de MN.
Clásicamente se ha establecido la importancia del diagnóstico precoz en estos pacientes, ya que la administración del tratamiento adecuado puede mejorar o estabilizar los síntomas de la misma, y proporcionar beneficios en la supervivencia, no tanto en los casos con enfermedad metastásica conocida, como en aquellos sin antecedentes de neoplasia. En nuestra serie no hemos obtenido datos suficientes que establezcan los beneficios de un diagnóstico temprano, puesto que el diseño del estudio no fue el apropiado para este propósito; sin embargo, y citando una afirmación común entre los clínicos, “la ausencia de evidencia no significa evidencia de la ausencia”, por lo que creemos que los esfuerzos futuros deben orientarse hacia la mejora en el diagnóstico precoz y el tratamiento de una patología que, actualmente, tiene un pronóstico sombrío.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de este trabajo ha sido presentado en la LX Reunión Anual de la Sociedad Española de Neurología.