Los tinnitus y las alucinaciones verbales o musicales (AVM) pueden deberse a lesiones neurológicas de naturaleza y topografía diversa.
MétodoSe han rastreado estos síntomas en 1.000 pacientes de una consulta de neurología cognitiva, anotando datos epidemiológicos y de neuroimagen.
ResultadosRefirieron tinnitus el 6,9% y AVM el 0,9%. Hubo predominio femenino no significativo en el grupo con paracusias. La edad media fue menor en los pacientes con tinnitus y mayor en los que tenían AVM. La hipoacusia mostró mayor prevalencia en los enfermos con paracusias (significativo con AVM). No hubo diferencias en la prevalencia de trastorno psicótico u obsesivo-compulsivo, o de leucoaraiosis. El tratamiento con ácido acetilsalicílico mostró mayor frecuencia en el grupo con AVM, y otros analgésicos no opioides y benzodiacepinas en los pacientes con tinnitus. La presunta causa de las AVM fue demencia con cuerpos de Lewy (n=2, uno con enfermedad vascular), enfermedad de Alzheimer (n=2, uno con enfermedad vascular), enfermedad vascular cerebral pura (n=3), lesión cerebral traumática (n=1) y lesión quirúrgica en el tronco encefálico (n=1). En los 9 casos había un elemento facilitador de la aparición de paracusias, como hipoacusia (n=6) o medicación de riesgo (n=9), además de polifarmacia (n=9).
ConclusionesLos pacientes con tinnitus tomaban con frecuencia benzodiacepinas y analgésicos no opioides, y en los que tenían AVM había mayor prevalencia de hipoacusia y de tratamiento con ácido acetilsalicílico. Las causas de AVM fueron demencia con cuerpos de Lewy, enfermedad de Alzheimer y lesiones focales en mesencéfalo, protuberancia, lóbulo temporal izquierdo o claustro izquierdo.
Different types and localisations of neurological lesions can produce tinnitus and verbal or musical hallucinations (VMH).
MethodThese symptoms were screened for in 1,000 outpatients at a cognitive neurology clinic, and epidemiological and neuroimaging data were recorded.
ResultsTinnitus was present in 6.9% of the total and VMH in 0.9%. The paracusia group was predominantly female but the difference was not statistically significant. Patients with tinnitus were younger and those with VMH were older than the rest of the sample (mean ages). Hearing loss was more prevalent in the paracusia group (difference was significant in VMH subgroup). There were no intergroup differences in the prevalence of psychotic and obsessive-compulsive disorders, or of leukoaraiosis. Treatment with acetylsalicylic acid was more frequent in the VMH group, whereas other non-opioid analgesics and benzodiazepines were more commonly prescribed to patients with tinnitus. The suspected cause of VMH was dementia with Lewy bodies (n=2, one with vascular disease), Alzheimer disease (n=2, one with vascular disease), isolated cerebrovascular disease (n=3), traumatic brain injury (n=1), and surgical brainstem lesion (n=1). All VMH cases displayed an underlying factor that might prompt this symptom, eg, hearing loss (n=6), a predisposing drug (n=9), and polypharmacy (n=9).
ConclusionsTreatment with benzodiazepines and non-opioid analgesics was more frequent in the tinnitus group, whereas the VMH group showed a higher prevalence of hearing loss and treatment with acetylsalicylic acid. The causes of VMH were dementia with Lewy bodies, Alzheimer disease, and focal lesions in the mesencephalon, pons, left temporal lobe, or left claustrum.
Una percepción auditiva simple, sin un estímulo externo que la produzca, se llama tinnitus (palabra latina que significa tintineo) o acúfeno. Comprende un amplio espectro de sonidos (silbido, siseo, chillido, zumbido, campaneo, chisporroteo, burbujeo, martilleo, tamborileo, resuello, trueno, un tono musical, vibración metálica; ruido de olas, de lluvia, de la válvula de una olla a presión, de árboles agitados, de un molinillo o trituradora, de un río, de una cascada, de una hoguera, de un tren; sonido de animales específicos, de un motor, de un timbre, del viento, etc.) y la causa es variada1 (tabla 1).
Causas de tinnitus
| Aumento espontáneo transitorio de la actividad neuronal auditiva |
| Compresión de la membrana timpánica (por cerumen, pelo o líquido) |
| Compresión del viii nervio craneal |
| Contracciones del estapedio por reinervación anómala tras una parálisis de Bell |
| Dehiscencia en el canal semicircular |
| Emisiones otoacústicas |
| Enfermedad autoinmune del oído interno |
| Estrés y cansancio intensos |
| Fístula perilinfática |
| Herpes zoster ótico (síndrome de Ramsay Hunt) |
| Hipoacusia (de conducción o neurosensorial, aguda o crónica) |
| Idiopático |
| Lesión cerebral que involucra circuitos relacionados con información auditiva |
| Lesión focal en el tronco encefálico |
| Mioclonías palatales |
| Otosclerosis |
| Postinfeccioso |
| Relación con fármacos (incluyendo síndromes por supresión)a |
| Síndrome de Ménière |
| Somatosonido debido a hipersístole cardíaca por anemia, hipertiroidismo o estenosis aórtica; disección, estenosis o displasia fibromuscular carotídea, fístula arteriovenosa dural o carotidocavernosa, dehiscencia del bulbo yugular o tumor del glomus yugular; hipertensión intracraneal benigna |
| Trastorno somático en la cabeza y región cervical superior (síndrome de Costen, lesión por latigazo, etc.) |
| Traumatismo acústico agudo |
| Traumatismo craneal |
| Trompa de Eustaquio patulosa |
| Tumores del ángulo pontocerebeloso |
| Vértigo posicional incapacitante |
Si la percepción espuria es más compleja, de contenido verbal, musical o mixto, hablamos de alucinaciones auditivas complejas (AAC), verbales o musicales. Cuando hay autoconsciencia de la inexistencia del estímulo en el entorno, también se conocen como alucinosis (en este caso, auditivas). Si la hipoacusia es el único factor causal aparente, se pueden referir como «síndrome de Charles Bonnet auditivo»2,3, y si son predominantemente musicales, «síndrome del oído musical»4.
Existe una gran variedad etiológica de las AAC (tabla 2), y también suceden en personas sanas5–7. Es frecuente que intervenga un factor predisponente y otro desencadenante. Por ejemplo, las alucinaciones desencadenadas por medicamentos son más probables en personas con hipoacusia; en algunos enfermos con una lesión cerebral, las alucinaciones se manifiestan cuando aparece actividad bioeléctrica paroxística; en un paciente con calcificación talamoestriada, aparecieron AAC al surgir hipocalcemia e hiperfosfatemia por hipoparatiroidismo, y desaparecieron al corregir estas alteraciones8. La reducción de neuronas colinérgicas que se produce en la edad avanzada también ejerce como factor predisponente, y al combinarse con deficiencia visual o auditiva, se pueden generar alucinaciones visuales o/y auditivas (síndrome de Charles Bonnet), que podrían mejorar con un anticolinesterásico9.
Causas publicadas de alucinaciones auditivas complejas
| Trastornos con hipoacusia como manifestación principal | OtosclerosisM, implante coclearM, presbiacusiaM, lesión en la porción pontomesencefálica de la vía auditivaM |
| Trastornos psiquiátricos primarios | EsquizofreniaM, trastorno bipolar, trastorno obsesivo-compulsivoM, depresiónM, anorexia nerviosa, trastorno de conversión |
| Trastornos con lesión focal aparente en el sistema nervioso central | Lesión vascular (infartoM, hemorragia intraparenquimatosaM, hemorragia subaracnoideaM, malformación vascularM, trombosis de seno venoso cerebral), neoplasia (meningiomaM, gliomaM, metástasisM, lipoma), radioterapiaM, epilepsiaaM (sobre todo cuando el área epileptógena se halla en el lóbulo temporal derecho) y tratamiento electroconvulsivoM, lobectomía por epilepsiaM, abscesoM, encefalitis víricaM, encefalitis límbica autoinmune, romboencefalitis por ListeriaM, esclerosis múltiple, ataques de migraña (con o sin aura)M, calcificación en los núcleos basalesM, esquisencefalia |
| Trastornos neurológicos sin focalidad aparente en la vía auditiva | Alucinosis postraumatismo cranealM, encefalopatía de HashimotoM, enfermedad de LymeM, encefalitis por virus o por cisticercos, neurosífilis; alfasincleinopatías (atrofia multisistémica, demencia con cuerpos de Lewy y enfermedad de ParkinsonM), enfermedad de AlzheimerM |
| Efecto de sustancias | Alucinosis alcohólicaM, otras sustanciasb |
| IdiopáticasM |
M: hay casos publicados con alucinaciones musicales.
AmantadinaM, antidepresivos tricíclicosM, antipalúdicos (quinina, cloroquina, mefloquina), baclofeno (la supresión brusca), benzodiacepinasM (y su supresión), bifosfonatos, cocaína, corticoidesM, bromocriptinaM, digoxina, dipiridamolM, gentamicinaM, inhibidores selectivos de la recaptación de serotonina, ketamina, marihuana, mirtazapinaM, opioidesM, pentoxifilinaM, psicoestimulantes (cocaína, anfetaminas, metilfenidato), pramipexolM, prazosina, propranololM, ranitidina, salicilatosM, topiramato, trimetoprim-sulfametoxazol, voriconazolM.
En este trabajo se han rastreado tinnitus y AAC en una muestra de pacientes neurológicos. Se analizan factores predisponentes, aspectos de la neuroimagen y los posibles mecanismos fisiopatológicos subyacentes.
Pacientes y métodoEn un fichero de 1.000 pacientes de una consulta de neurología cognitiva se rastreó la presencia de tinnitus y AAC. Se realizó un análisis descriptivo de edad y sexo y se indagó la posible asociación con supuestos factores de riesgo, como hipoacusia y leucoaraiosis cerebral. Además, se revisó la medicación por si apareciese asociación con algún fármaco. En cuanto a las alteraciones de la sustancia blanca en la neuroimagen, se consideraron «positivos» los casos con puntuación≥2 en la escala de Blennow (tomografía computarizada) o≥4 en la de Fazekas (resonancia magnética)10.
En los pacientes con AAC se analizó la posible relación del diagnóstico y de la topografía de las lesiones encefálicas focales, cuando se detectaron, con estas paracusias.
Los resultados se expresan en media±desviación estándar o en frecuencia absoluta (porcentaje). Para verificar la asociación entre variables se han utilizado las pruebas de chi-cuadrado, exacta de Fisher y t de Student. Se consideraron significativos los valores de p menores de 0,05.
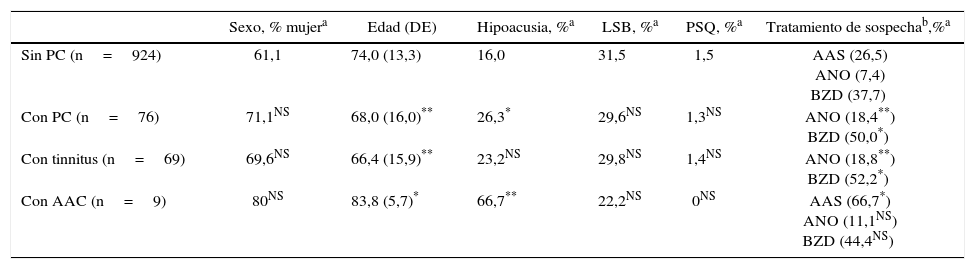
ResultadosDe los 1.000 pacientes, 69 manifestaron tinnitus y 9 AAC (2 de ellos también tinnitus). El sexo, la edad y la presencia de presuntos factores de riesgo se expresan en la tabla 3. Se analizó en toda la muestra la frecuencia de los fármacos con presencia no esporádica en el subgrupo con paracusias (antiagregantes plaquetarios –el ácido acetilsalicílico [AAS] se reexaminó aparte–, analgésicos opioides y no opioides, antiinflamatorios no esteroideos, benzodiacepinas, inhibidores selectivos de la recaptación de serotonina, inhibidores de la recaptación de serotonina y noradrenalina, neurolépticos, betabloqueadores (el propranolol se analizó aparte), bloqueadores de receptores AT1 de angiotensina ii, antagonistas del calcio, diuréticos de asa, estatinas e inhibidores de la bomba de protones). Sobre los pacientes con AAC, en la tabla 4 se relatan otros datos.
Sexo, edad y posibles factores de riesgo asociados en el grupo de pacientes analizado (n=1.000)
| Sexo, % mujera | Edad (DE) | Hipoacusia, %a | LSB, %a | PSQ, %a | Tratamiento de sospechab,%a | |
|---|---|---|---|---|---|---|
| Sin PC (n=924) | 61,1 | 74,0 (13,3) | 16,0 | 31,5 | 1,5 | AAS (26,5) ANO (7,4) BZD (37,7) |
| Con PC (n=76) | 71,1NS | 68,0 (16,0)** | 26,3* | 29,6NS | 1,3NS | ANO (18,4**) BZD (50,0*) |
| Con tinnitus (n=69) | 69,6NS | 66,4 (15,9)** | 23,2NS | 29,8NS | 1,4NS | ANO (18,8**) BZD (52,2*) |
| Con AAC (n=9) | 80NS | 83,8 (5,7)* | 66,7** | 22,2NS | 0NS | AAS (66,7*) ANO (11,1NS) BZD (44,4NS) |
AAC: alucinaciones auditivas complejas; AAS: ácido acetilsalicílico; ANO: analgésicos no opioides; BZD: benzodiacepinas; DE: desviación estándar; LSB: leucoaraiosis moderada o intensa, o lesiones lacunares múltiples en la sustancia blanca cerebral; NS: diferencia frente al grupo de pacientes sin la alteración de la fila de datos (señalada en la columna de la izquierda) no significativa; PC: paracusias; PSQ: pacientes con esquizofrenia, trastorno bipolar o trastorno obsesivo-compulsivo.
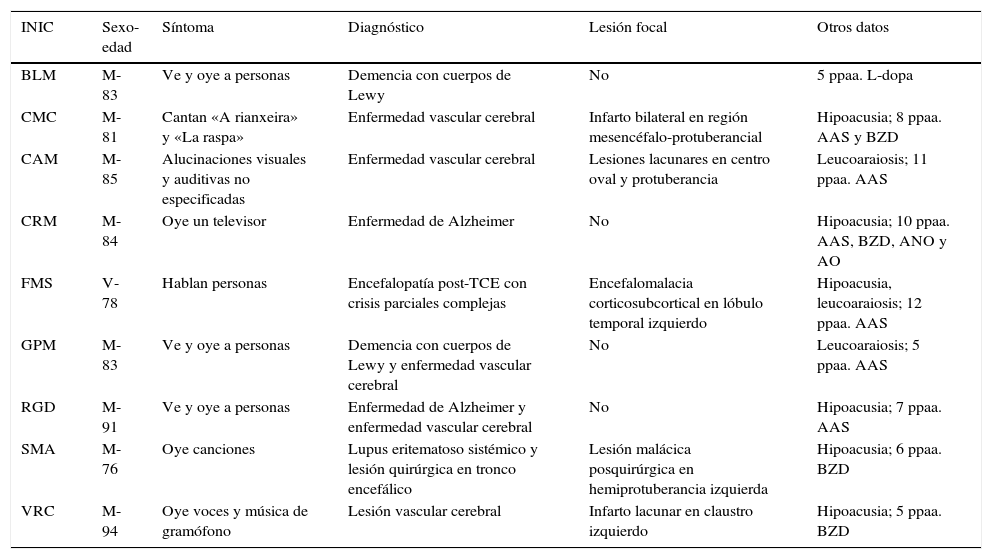
Datos relativos a los pacientes con alucinaciones auditivas complejas
| INIC | Sexo-edad | Síntoma | Diagnóstico | Lesión focal | Otros datos |
|---|---|---|---|---|---|
| BLM | M-83 | Ve y oye a personas | Demencia con cuerpos de Lewy | No | 5 ppaa. L-dopa |
| CMC | M-81 | Cantan «A rianxeira» y «La raspa» | Enfermedad vascular cerebral | Infarto bilateral en región mesencéfalo-protuberancial | Hipoacusia; 8 ppaa. AAS y BZD |
| CAM | M-85 | Alucinaciones visuales y auditivas no especificadas | Enfermedad vascular cerebral | Lesiones lacunares en centro oval y protuberancia | Leucoaraiosis; 11 ppaa. AAS |
| CRM | M-84 | Oye un televisor | Enfermedad de Alzheimer | No | Hipoacusia; 10 ppaa. AAS, BZD, ANO y AO |
| FMS | V-78 | Hablan personas | Encefalopatía post-TCE con crisis parciales complejas | Encefalomalacia corticosubcortical en lóbulo temporal izquierdo | Hipoacusia, leucoaraiosis; 12 ppaa. AAS |
| GPM | M-83 | Ve y oye a personas | Demencia con cuerpos de Lewy y enfermedad vascular cerebral | No | Leucoaraiosis; 5 ppaa. AAS |
| RGD | M-91 | Ve y oye a personas | Enfermedad de Alzheimer y enfermedad vascular cerebral | No | Hipoacusia; 7 ppaa. AAS |
| SMA | M-76 | Oye canciones | Lupus eritematoso sistémico y lesión quirúrgica en tronco encefálico | Lesión malácica posquirúrgica en hemiprotuberancia izquierda | Hipoacusia; 6 ppaa. BZD |
| VRC | M-94 | Oye voces y música de gramófono | Lesión vascular cerebral | Infarto lacunar en claustro izquierdo | Hipoacusia; 5 ppaa. BZD |
AAS: ácido acetilsalicílico; ANO: analgésicos no opioides; AO: analgésicos opioides; BZD: benzodiacepinas; INIC: iniciales del paciente; M: mujer; ppaa: principios activos; V: varón.
En la revisión de 1.000 expedientes de pacientes neurológicos aparecen paracusias en el 7,6% (6,9% tinnitus y 0,9% AAC). Se estima que más del 80% de la población adulta ha experimentado tinnitus alguna vez, aunque la prevalencia del que es persistente y molesto varía del 4,4 al 27,9%11–13. En la consulta de neurología, el tinnitus se relata por los pacientes que lo sienten como algo desagradable y con sospecha de relación con el motivo de la consulta. Por otra parte, en 2 series de personas sin trastorno psicótico, la prevalencia de AAC fue de 0,7 y 0,8%14,15. Así pues, la frecuencia de tinnitus y AAC en este trabajo se halla en el rango de los datos publicados.
En las publicaciones sobre tinnitus no se aprecian diferencias de género11–13, mientras que las AAC son más frecuentes en las mujeres, ya sean verbales16 o musicales3,17. En el trabajo se observa un predominio de mujeres en los pacientes con paracusias, más acusado si tienen AAC (tabla 3), pero sin alcanzar diferencia significativa frente a las personas sin paracusia, en las que también predomina el género femenino.
La prevalencia de los acúfenos se incrementa con la edad hasta los 70 años, y después se estabiliza o reduce12,13. Las alucinaciones verbales son más frecuentes en la edad media7,14, y en una recopilación de 132 casos con alucinaciones musicales, la media de edad fue de 61,5 años3. En este trabajo se encontró una menor edad en el grupo de pacientes con tinnitus (respecto a los que no los tienen) y un mayor edad en el grupo con AAC (tabla 3). Como la prevalencia de los trastornos cognitivos se incrementa al avanzar la edad, se comprende la alta edad media de la muestra total (73,6±13,6 años, mediana 77). Esto es congruente con el hallazgo de menor edad en el subgrupo con tinnitus (66,4±15,9), ya que en los enfermos de mayor edad no se incrementa su incidencia y sí la del deterioro cognitivo. Sin embargo, parece contradictorio que los pacientes con AAC tengan mayor edad, cuando las estadísticas de la bibliografía indican lo contrario. Una explicación es que la mayoría de los estudios epidemiológicos procede de población general, en la que la etiología de las AAC incluye a las personas con esquizofrenia y otras enfermedades con mayor prevalencia en edad joven o media, como la epilepsia, la esclerosis múltiple o la alucinosis alcohólica (tabla 2). En los 9 pacientes con AAC de la presente muestra, los diagnósticos (como enfermedad vascular cerebral o enfermedad degenerativa demenciante –tabla 4–) pueden intervenir simultáneamente en la etiología de las alucinaciones y del deterioro de la cognición, y son más frecuentes en la edad avanzada.
La hipoacusia es un factor de riesgo para tener paracusias2,3,11,18,19, y aquí aparece con mayor frecuencia en las personas que las tienen (significativamente en el subgrupo con AAC) (tabla 3). En gran parte de los casos de AAC publicados concurren un factor desencadenante y otro(s) predisponente(s), y la hipoacusia es uno de los predisponentes frecuentes, especialmente en las AAC musicales1–3,18,19. En este trabajo se detecta hipoacusia en el 66,6% de los pacientes con AAC (tabla 4).
En estudios realizados mayoritariamente en enfermos con esquizofrenia se ha observado que alteraciones en la sustancia blanca que alteran la conectividad entre determinadas áreas del cerebro (sobre todo la frontotemporal izquierda) dan lugar a alucinaciones auditivas20,21. Por tanto, cabe pensar que las lesiones leucoarióticas extensas o lacunares múltiples pueden predisponer a la aparición de AAC. En este trabajo se observan en el 31,3% de los casos, sin diferencia significativa respecto a tener o no paracusias (tabla 3). Es posible que una potencial asociación de esa alteración con las paracusias haya quedado atenuada en estos pacientes de neurología cognitiva, por ser la propia leucoaraiosis una causa frecuente de las manifestaciones cognitivoconductuales22,23.
Las AAC son frecuentes en enfermos con esquizofrenia (≅ 70%)5, trastorno bipolar (11-67%)5,24 o trastorno obsesivo-compulsivo25. Pueden ser verbales o musicales26,27. En la muestra, ninguno de los 15 pacientes con alguno de esos diagnósticos refirió AAC. Cuando estas personas acuden a una consulta de neurología, no se considera necesario evaluar esos síntomas, controlados en psiquiatría, salvo que hayan experimentado un cambio en asociación con los síntomas neurológicos.
Se conoce la asociación de determinados fármacos con tinnitus o AAC (tablas 1 y 2). En este trabajo se observó una mayor frecuencia de AAS en los pacientes con AAC (66,7 frente a 26,5% en las personas sin AAC), analgésicos no opioides en los casos con acúfenos (18,8 vs. 7,4% en el grupo sin tinnitus) y benzodiacepinas en ambos grupos con paracusias (52,2% con tinnitus vs. 37,6%; 44,4% con AAC vs. 38,5%) (tabla 3). El AAS, a dosis alta o tomado prolongadamente, induce destrucción por apoptosis de neuronas cocleares, lo cual produce hipoacusia y tinnitus, muchas veces reversible28. En el grupo analizado, la frecuencia de AAS fue mayor en el grupo sin tinnitus. Es posible que el carácter transitorio del síntoma y el hecho de que los enfermos tomaran una dosis baja (100mg/día), en muchos casos desde poco tiempo antes, expliquen que no se hallara una mayor frecuencia en los pacientes con tinnitus. Sin embargo, sí hay una mayor frecuencia en los pacientes con AAC. Seis de las 9 personas con AAC tomaban AAS como antiagregante plaquetario. Si comparamos la frecuencia de antiagregantes plaquetarios en los grupos con AAC (66,7%) y sin AAC (40,1%), la diferencia no es significativa. Cabe pensar que las consecuencias de la enfermedad vascular sobre el cerebro guardan relación con la génesis de las AAC, y no el tratamiento con AAS, pero Allen menciona en una publicación 18 casos de AAC musicales o tinnitus atribuibles al AAS29. En todo caso, los 9 pacientes de la muestra no son suficientes para hacer inferencias certeras sobre relación de causalidad.
Trece de los 69 pacientes con acúfenos (18,8%) tomaban regularmente analgésicos no opioides (el AAS, en todos los casos a dosis antiagregante, y los antiinflamatorios no esteroideos se consideraron aparte), y de ellos, 10 tomaban paracetamol. Entre los pacientes sin tinnitus, tomaba estos analgésicos el 7,4% (diferencia con p=0,001). El hallazgo podría derivar del hecho, poco conocido, de que el paracetamol tiene efectos ototóxicos y puede producir tinnitus e hipoacusia30.
Entre los síntomas que puede producir la supresión de benzodiacepinas se hallan los acúfenos31. Además, representan una opción terapéutica contra este síntoma, con un grado de eficacia desconocido32. Por otra parte, se han descrito AAC desencadenadas por benzodiacepinas, que, a su vez, se hallan entre los posibles tratamientos33,34. En algunos pacientes de este trabajo, las benzodiacepinas se prescribieron antes del comienzo de las paracusias, y en otros, después, para tratar ansiedad o disforia, a veces provocada o incrementada por la paracusia. No sabemos si en algún caso ejercieron un efecto causal, pero no se registraron casos en los que el síntoma comenzase poco después de iniciar este tratamiento.
De los 9 casos con AAC, 4 tienen una enfermedad degenerativa (2, demencia con cuerpos de Lewy, y otros 2, enfermedad de Alzheimer), 5 tienen enfermedad vascular cerebral (en 2 de ellos asociada a enfermedad degenerativa) y los 2 restantes tienen una lesión encefálica focal, traumática o posquirúrgica (tabla 4). En la demencia con cuerpos de Lewy existe propensión a desarrollar alucinaciones visuales, y en ocasiones otros síntomas psicóticos, entre ellos las alucinaciones auditivas, que figuran como criterio de apoyo al diagnóstico35. En la enfermedad de Alzheimer son menos frecuentes, pero suceden en el 12% de los casos (mediana)36, posiblemente en uno de sus fenotipos37,38, en el que se ha observado asociación con el alelo C102 del gen codificante del receptor 5HT2A39. En todo caso, las AAC son más probables en las alfasinucleinopatías y en la enfermedad de Alzheimer que en los demás tipos de demencia degenerativa, y quizá por ese motivo no encontramos otras enfermedades degenerativas en los 9 pacientes con AAC.
Las lesiones focales no degenerativas, cuando afectan a circuitos que intervienen en la gestión de información auditiva, son susceptibles de producir alucinaciones de este ámbito sensorial. Pueden ser tumorales, infecciosas, traumáticas, quirúrgicas, etc., destacando en frecuencia las de origen vascular40. Así pues, resulta lógico que 5 de los 9 casos con AAC tuvieran enfermedad vascular cerebral, y 3 de ellos tenían alguna lesión focal que podría ser responsable de este síntoma. Los otros 2 casos tenían además una enfermedad degenerativa (tabla 4).
La topografía de las lesiones asociadas a paracusias es variada, porque la vía auditiva es larga y tiene muchos circuitos moduladores. En primer lugar, la información captada en el órgano de Corti se dirige al núcleo coclear. Desde ahí, tras hacer escala algunas fibras en los núcleos del complejo olivar superior, la vía asciende por el lemnisco lateral (la mayor parte por el contralateral). En este trayecto, algunos axones se detienen en el núcleo del lemnisco lateral y el tubérculo cuadrigémino inferior, continuando hacia el núcleo geniculado medial del tálamo, desde donde parten proyecciones hacia la primera circunvolución temporal y, posteriormente, a las áreas asociativas. En cuanto al aspecto modulador, en el fragmento periférico encontramos un haz olivococlear, que protege del daño por ruido excesivo y facilita la atención focalizada. Una alteración en el tramo periférico aferente produce hipoacusia ipsolateral de determinadas bandas de frecuencia y, por un fenómeno de plasticidad homeostática, induce una hiperactividad reactiva en neuronas indemnes del núcleo coclear, que se transmite al cerebro y puede producir tinnitus (unilateral)41. Además, en el núcleo coclear dorsal convergen aferencias somatosensitivas de la cabeza y la región cervical superior, información necesaria para localizar el sonido en relación con la posición de la cabeza. Tanto la reducción de aferencias de la vía auditiva periférica como la llegada de una estimulación somatosensitiva excesiva de cabeza o cuello pueden ser motivo de tinnitus (a veces con audición normal)1,41. Si las alteraciones son ligeras, los acúfenos aparecen cuando se perturban simultáneamente ambos elementos. También existe un tinnitus sin hipoacusia por hiperfunción de las células ciliadas externas de la cóclea, por producir excesivas «emisiones otoacústicas», que exceden la capacidad compensadora de la vía olivococlear42. Esta causa interviene en menos del 10% de los tinnitus, generalmente asociada a otra de mayor influencia. En definitiva, la hipoacusia facilita los tinnitus, pero no es una condición necesaria ni suficiente. En la muestra observada, tenía hipoacusia la cuarta parte de los pacientes con tinnitus (tabla 3).
En el trayecto encefálico se detectan varios haces moduladores. De la corteza auditiva parten fibras hacia el núcleo geniculado medial, al tubérculo cuadrigémino inferior y a otros núcleos del tálamo. Otras neuronas llegan al núcleo coclear desde el tubérculo cuadrigénimo inferior y el núcleo del lemnisco lateral. La formación reticular ejerce un control bidireccional entre el núcleo coclear y el tálamo. Esos circuitos están a su vez influidos por otras regiones (corteza prefrontal y parietal, cíngulo, ínsula, parahipocampo, amígdala, núcleos basales y cerebelo)2,43,44. Una hipofunción de la vía auditiva o de la formación reticular ascendente produce una «disritmia talamocortical»45,46, de modo que la desaferentación induce, como compensación, hiperactividad en algunas áreas corticales. Si el fenómeno actúa intensamente, puede provocar la liberación de información auditiva almacenada en circuitos mnésicos. Si no hay desaferentación, la paracusia podría no estar mediada por disritmia talamocortical, sino por deficiencia de los sistemas descendentes moduladores. En muchos casos actúan ambos mecanismos. Las paracusias por alteración rostral al núcleo coclear pueden ser simples o complejas, bilaterales (más frecuentes) o unilaterales.
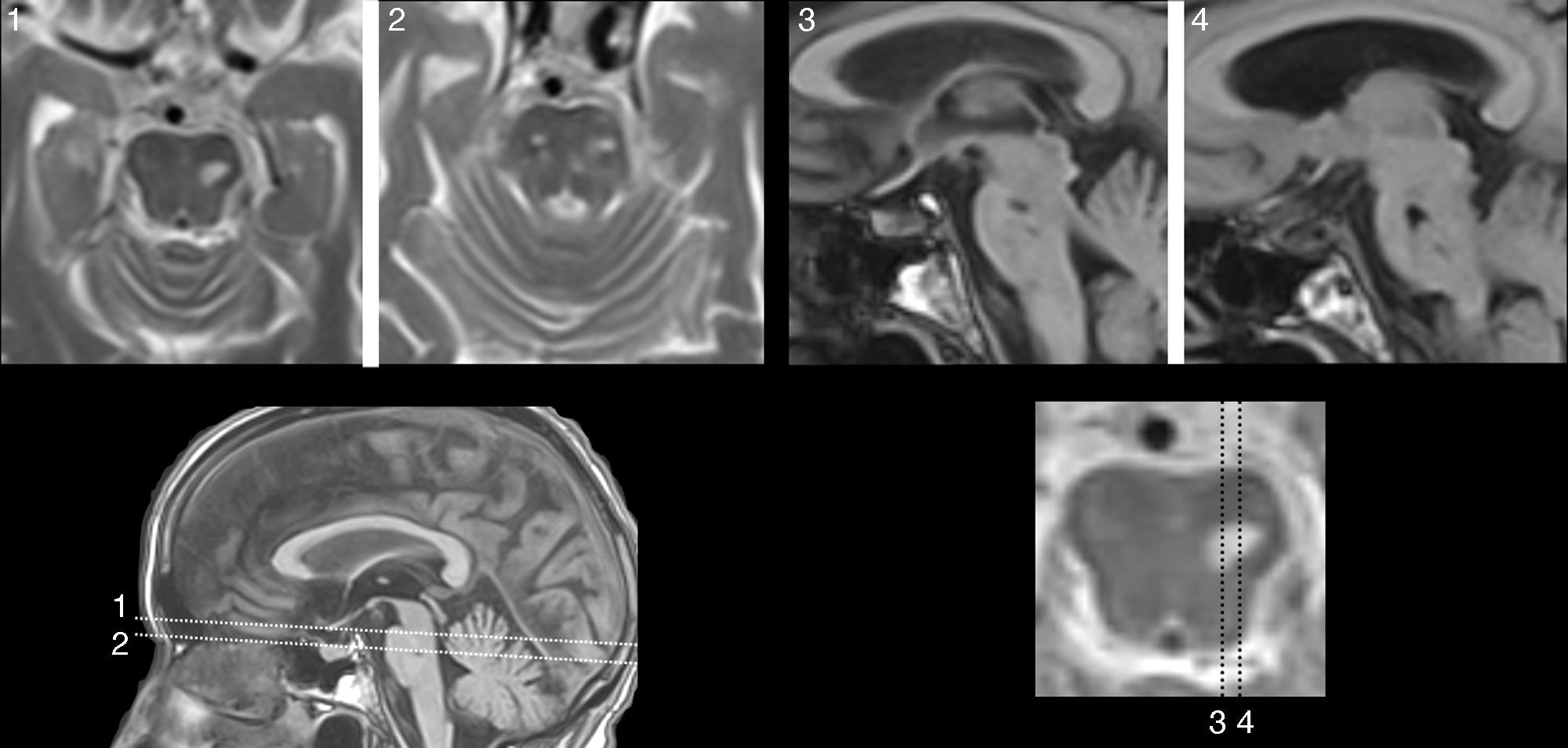
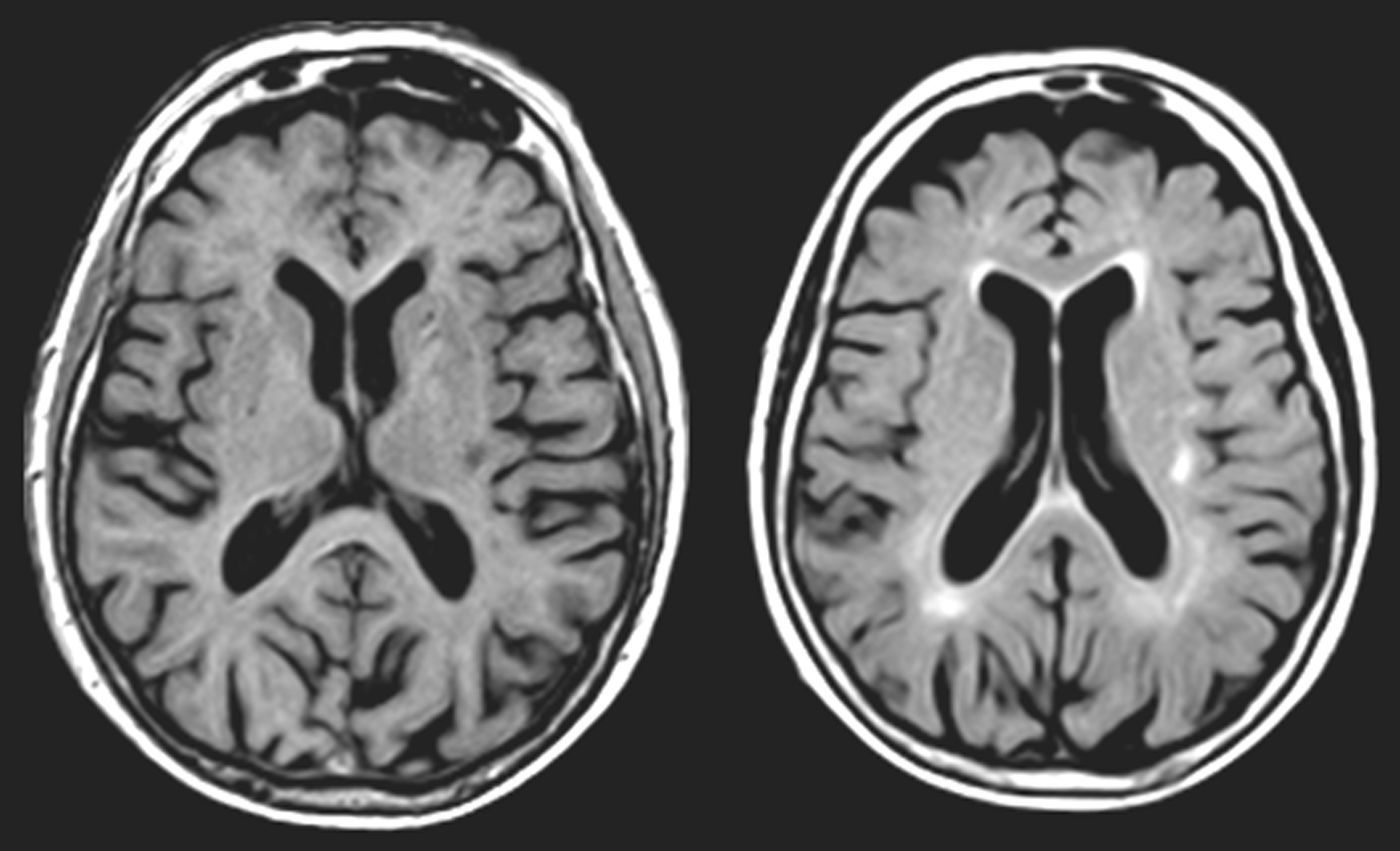
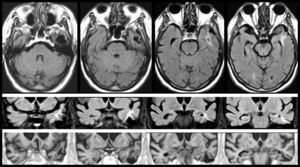
Las lesiones que provocan AAC pueden asentar en cualquier parte de la vía auditiva (generalmente rostral al núcleo coclear), o en zonas adyacentes (afectando fibras moduladoras), e incluso en otra región relacionada con las anteriores, por un mecanismo de diasquisis47–50. Múltiples publicaciones describen AAC por lesiones en el trayecto del tegmento pontomesencefálico al tálamo, en el propio tálamo y en el espacio por donde circulan las radiaciones del tálamo a la corteza temporal. En otros casos, la lesión se sitúa en la región temporal superior o adyacente a ella, izquierda o derecha, con efecto excitante. Raramente, las lesiones se hallan en otras partes del conectoma cerebral relacionadas funcionalmente con las anteriores (lóbulo frontal51,52, parietal53, hipocampo54, cerebelo55). Cinco de los 9 pacientes con AAC tienen una lesión focal potencialmente causal (tabla 4). En 3 casos, la lesión se sitúa en el tegmento protuberancial o mesencefálico. Existen muchas publicaciones con AAC, verbales y musicales, debidas a una lesión ubicada en esta región. Guardan cierta semejanza con las «alucinosis pedunculares», en las que destacan las manifestaciones visuales, aunque también pueden tener un componente táctil o auditivo46. En la figura 1 se observa la neuroimagen de una paciente con lesión en esta localización, que oye fragmentos de las mismas canciones desde hace años.
Mujer de 81 años con hipoacusia, diabetes y dislipidemia, que desde los 78 años tiene alucinaciones auditivas complejas verbales y musicales. En la exploración se aprecia parálisis de la mirada hacia arriba. Las imágenes de resonancia muestran una lesión situada en la parte anterior del lemnisco lateral, en la confluencia pontomesencefálica izquierda (1 y 2: secuencias TSE-T2; 3 y 4: secuencias SE-T1).
Otros 2 casos (iniciales VAA y SMA) ilustran diferencias fisiopatológicas de las paracusias. VAA tiene un neurinoma del acústico que le produce hipoacusia y tinnitus unilateral. SMA fue intervenida de un neurinoma similar al anterior, apreciándose una alteración de señal posquirúrgica en la resonancia magnética, en la región pontina adyacente; desde entonces siente AAC. En VAA, además de una hiperactividad de fibras sanas reactiva a la hipoacusia, podría haber un fenómeno de transmisión por contacto entre fibras comprimidas adyacentes1. En SMA se involucran haces moduladores del sistema nervioso central que, en secuencia retrógrada, conectan con las áreas corticales asociativas.
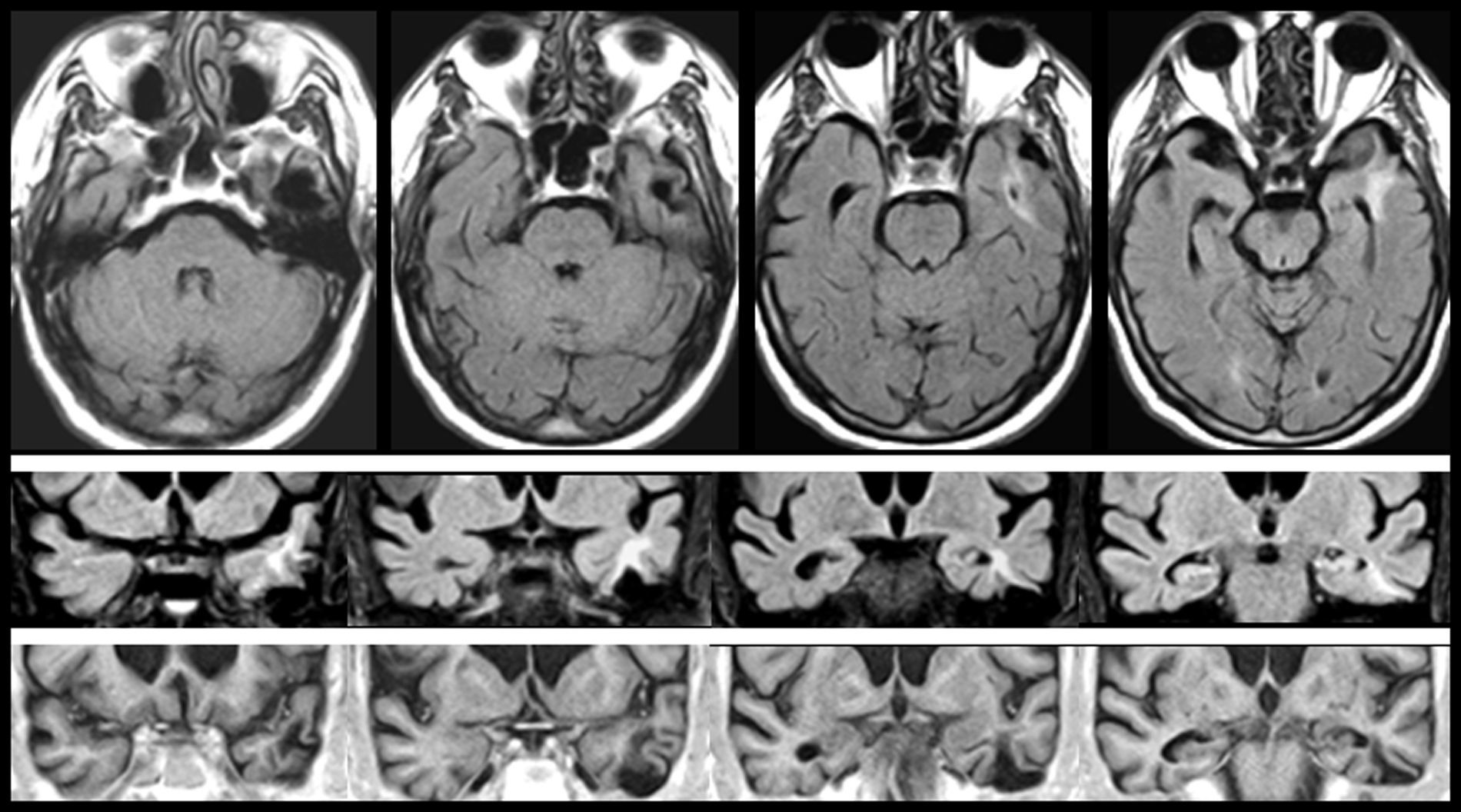
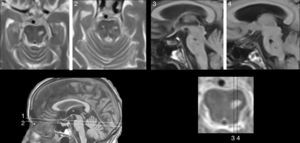
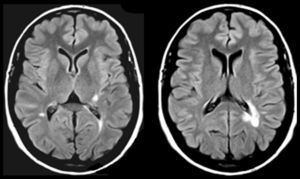
En FMS (tabla 4), la actividad bioeléctrica paroxística de una zona de encefalomalacia cortical temporal con lesión gliótica circundante (fig. 2) causa crisis parciales con AAC. La actividad epiléptica en el entorno de la circunvolución temporal superior es una causa conocida de AAC56.
Resonancia magnética de un varón de 78 años con hipertensión arterial y presbiacusia, que tuvo un traumatismo con coma a los 53 años. A los 76 comenzó con episodios paroxísticos recurrentes con estado delirante y alucinatorio (visual y auditivo). Zona de encefalomalacia temporal izquierda con componente gliótico (filas superiores: FLAIR; fila inferior: T1-IR).
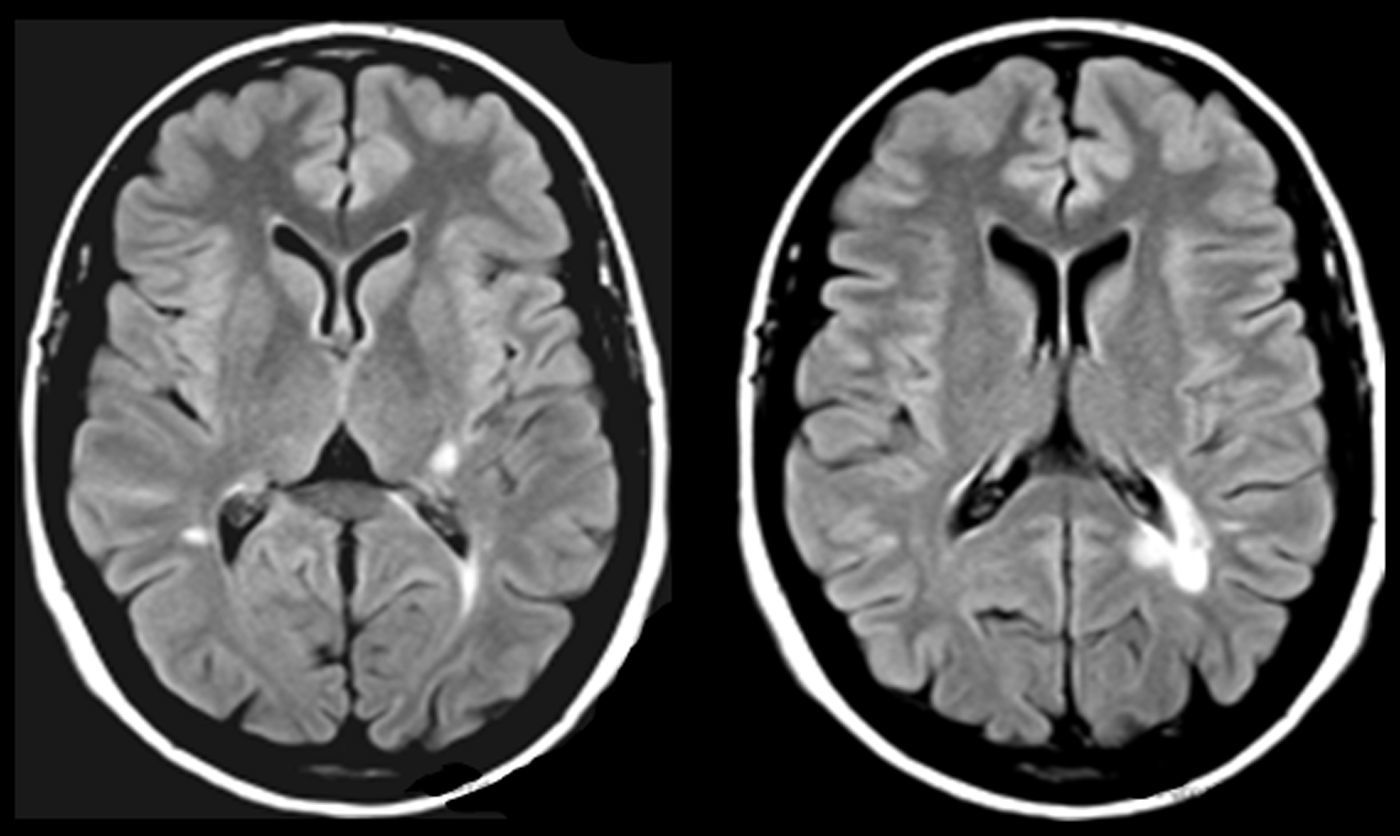
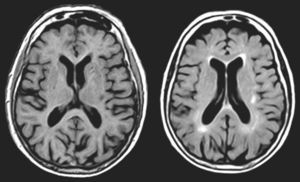
En AVM (fig. 3), la lesión lacunar se halla en el trayecto que siguen las proyecciones que circulan del pulvinar y cuerpo geniculado medial a la corteza temporal. En VRC (tabla 4, fig. 4), una lesión lacunar en la parte posterior del claustro izquierdo, adyacente a la ínsula, le produce AAC musicales. Un metaanálisis señala que entre las áreas cerebrales que se activan durante las AAC se hallan las ínsulas y el claustro izquierdo44, que conectan con áreas corticales auditivas57 e intervienen en el procesamiento de la información auditiva57,58.
Imágenes de resonancia magnética (secuencias de T1 en la izquierda y de FLAIR en la derecha). Mujer de 94 años con hipertensión arterial. Hipoacusia bilateral y acúfenos desde hace 2 años y alucinaciones verbales y musicales desde hace 9 meses, biaurales, de contenido repetitivo, sin influencia en la conducta o el estado anímico.
En los 9 casos con AAC se registraron más de una de las causas conocidas (tabla 2). Frecuentemente, es necesario que un segundo o tercer factor causal desborde la capacidad adaptativa del cerebro. Además de la enfermedad causal (sinucleinopatía, enfermedad de Alzheimer o lesión focal en área de riesgo para producir paracusia), los 9 pacientes tienen hipoacusia o toman algún fármaco presuntamente predisponente (tabla 4). La polifarmacia, registrada en todos los casos, podría ser un factor más de riesgo, aunque sería necesario observar este aspecto en muestras más amplias para afianzar la asociación.
Las paracusias forman parte de la constelación de síntomas derivados de trastornos neurológicos muy variados, y con frecuencia pasan desapercibidas si no se pregunta sobre ello. La semiología tendría una gran riqueza si se aplicara siempre una exploración amplia (con audiometría, reflejos auditivos, pruebas de audición dicótica, potenciales evocados de tronco encefálico, etc.)17,59,60, pero las condiciones de trabajo de la práctica clínica habitual obligan a seleccionar los procedimientos de diagnóstico imprescindibles para encontrar la causa y poder instaurar un tratamiento. En todo caso, siempre que el paciente aqueje AAC, o bien tinnitus sin una causa periférica bien definida (sobre todo si es pulsátil o se acompaña de signos neurológicos focales), es necesario obtener neuroimagen cefálica.
FinanciaciónEl trabajo no ha sido presentado en ninguna reunión científica ni ha sido financiado.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses relacionado con el contenido del artículo.