Estimar el filtrado glomerular (FG) en sujetos obesos es un desafío. Analizamos el rendimiento de las fórmulas de estimación en esta población.
Material y métodosEstudio de corte transversal que incluyó a 100 sujetos con diversos grados de obesidad, evaluados entre 2008 y 2015. Se midió el FG con iotalamato (patrón de referencia) y se estimó con fórmulas basadas en creatinina sérica: Cockroft Gault, MDRD, CKD-EPI, MCQ y CKD-MCQ (promedio de estas). Se creó un score de performance global (S-P-Global) con puntajes, para unificar todos los criterios de análisis.
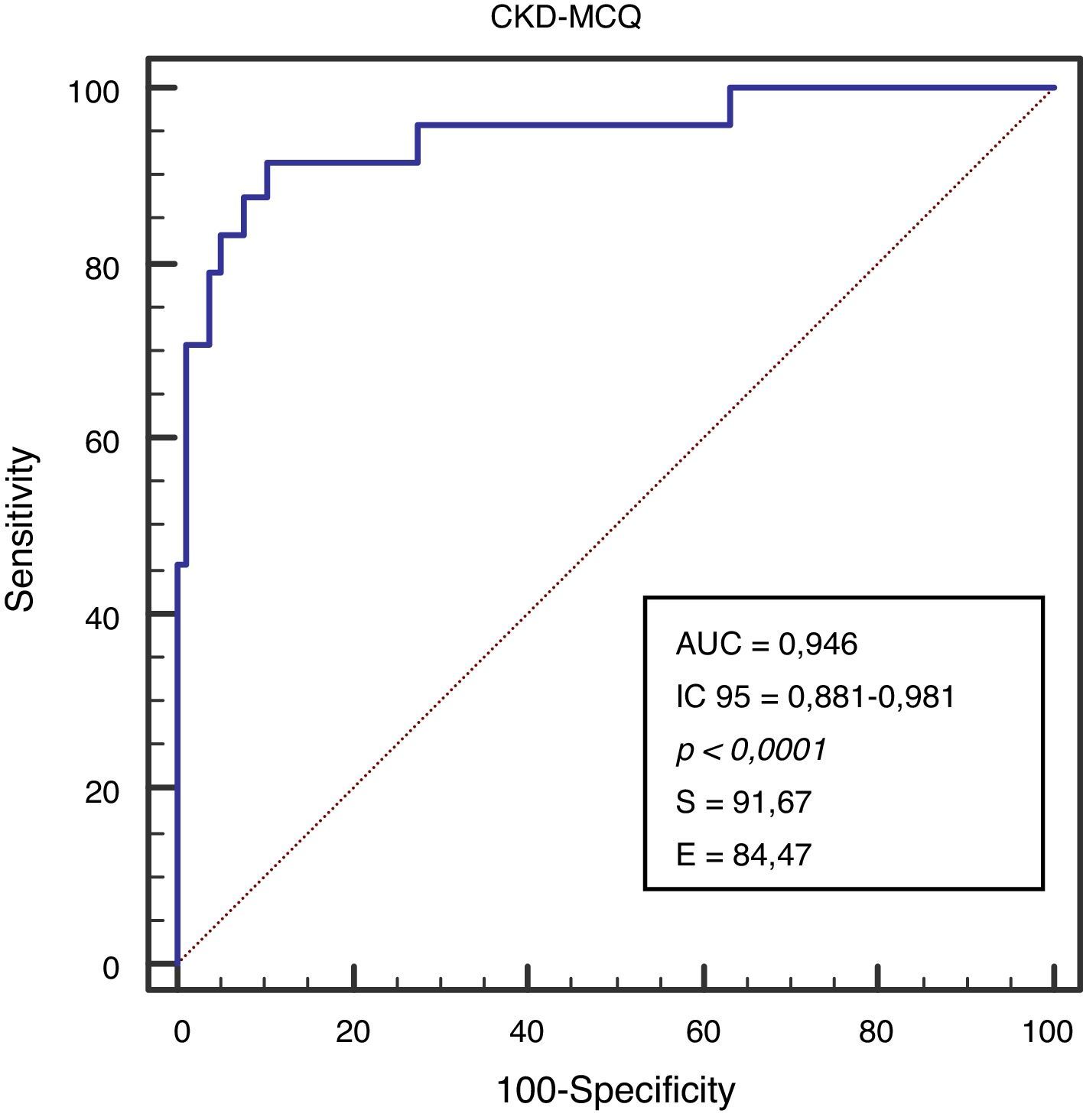
ResultadosEn obesidad grado i (n=53) la fórmula de mejor rendimiento fue CKD-MCQ (sesgo 1,6 ± 17,4ml/min×1,73 m2; correlación [r]=0,87; área bajo la curva [AUC]=0,978; sensibilidad [S]=100% y especificidad [E]=87,8%). En obesidad grado ii (n=25) las de menor sesgo fueron MCQ y CKD-MCQ (1,8 ± 22.3 y –4,4 ± 21,9ml/min×1,7 3m2), esta última con mayor r (r=0,89) e igual AUC, S, y E (AUC=0,976; S=85,7%; E=100%). En obesidad grado iii (n=22), MDRD fue la de menor sesgo (–0,2 ± 31,1ml/min×1,73 m2) y CKD-MCQ la de mayor r y AUC (r=0,66; AUC=0,929); con igual S y E (S=80%; E=94.1%) que MDRD.
CKD-MCQ fue la única ecuación en la que no se hallaron diferencias significativas con el patrón de referencia, en ninguno de los grados de obesidad; y en el S-P-Global fue la que mayor puntaje obtuvo (39/48).
ConclusiónLa fórmula de mayor rendimiento global para estimar el FG en sujetos con diversos grados de obesidad fue CKD-MCQ.
Estimating glomerular filtration rate (GFR) in obese subjects is a challenge. An analysis is made of the performance of equations to estimate GFR in this population.
Material and methodsThis cross-sectional study included 100 obese subjects evaluated between 2008 and 2015. The GFR was measured with urinary iothalamate clearance (reference standard) and estimated using creatinine-based formulas: Cockroft Gault, MDRD, CKD-EPI, MCQ,and CKD-MCQ (mean of these). A Global Performance Score (G-P-Score) was created to unify all the analysis criteria.
ResultsCKD-MCQ equation had the best performance in obesity grade I (n=53) [bias=1.6+/- 17.4ml / min x 1.73 m2; Correlation (r)=0.87; Area under the curve (AUC)=0.978; Sensitivity (S)=100%; Specificity (E)=87.8%]. MCQ and CKD-MCQ had the lowest bias in obesity grade II (n=25) (bias=1.8+/- 22.3 and -4.4+/- 21.9ml / min x 1.73m2), and CKD-MCQ the highest r (r=0.89), with the same AUC, S, and E (AUC=0.976, S=85.7%, E=100%). MDRD equation had the lowest bias in obesity grade III (n=22) (bias=-0.2+/- 31.1ml/min x 1.73 m2), and CKD-MCQ had the highest r and AUC (r=0.66, AUC=0.929), with the same S and E (S=80%, E=94.1%) than MDRD.
CKD-MCQ was the only equation without significant differences compared to the reference standard in any of the obesity levels. The highest score was obtained in the G-P-Score (39/48).
ConclusionCKD-MCQ had the better overall performance for estimating GFR in subjects with different degrees of obesity.
La obesidad es un grave problema de salud pública en la actualidad, su prevalencia se incrementa año tras año en todo el mundo y Latinoamérica no parece ser la excepción1,2. Es bien conocida la relación entre obesidad y diabetes tipo 2, hipertensión, dislipidemia, enfermedad coronaria, accidente cerebrovascular y algunos tipos de cáncer3. Algunos autores sugieren que la obesidad además, aumenta el riesgo de inicio y progresión de enfermedad renal crónica (ERC)4,5, no solo por la relación con sus factores de riesgo tradicionales ya conocidos, sino también por un efecto directo sobre la estructura renal4,6,7.
Es muy importante conocer con precisión el filtrado glomerular (FG) en los pacientes con obesidad por diferentes motivos: detectar precozmente el daño renal en una población de riesgo, clasificarlos en los diferentes estadios de ERC, ajustar la dosis de los medicamentos que se excretan por vía renal y evitar la progresión de la enfermedad.
El método más preciso para medir el FG es mediante el aclaramiento de inulina8. La medición del FG con iotalamato arroja resultados similares y es también considerado como patrón oro (gold standard)9. Estos métodos muchas veces resultan complejos, poco prácticos, caros y de poca disponibilidad.
En la práctica clínica se utilizan habitualmente marcadores endógenos como la creatinina sérica (CrS) para estimar el FG a través de diferentes fórmulas. La estimación del FG a partir de la CrS en población obesa constituye un desafío. Los niveles de CrS dependen en gran medida de la masa muscular, en los pacientes con obesidad existe una desproporción entre la masa magra y grasa, y por este motivo los valores de CrS suelen ser erráticos para estimar el FG en estos individuos. Las fórmulas usadas habitualmente en la práctica clínica no están calibradas para ser utilizadas en esta población. Además, estas han sido desarrolladas en poblaciones con etnias diferentes a la raza típica de América Latina (mezcla entre nativos, españoles e italianos).
No existen muchos estudios en el mundo de validación de las fórmulas de estimación del FG en sujetos obesos. En el 2007, en Francia, Rigalleau et al.10 mostraron que en sujetos diabéticos, en los que también se incluyeron obesos, la ecuación cuadrática de la Clínica de Mayo (MCQ) tenía mejor rendimiento que las otras fórmulas para estimar el FG. Luego en el 2014, también en Francia, Lemoine et al.11 mostraron un buen rendimiento de la ecuación Chronic Kidney Disease and Epidemiology (CKD-EPI) para estimar el FG en obesos. Este fue el motivo por el cual, en nuestro estudio, se creó una nueva estimación que combina ambas fórmulas, con el objetivo intentar mejorar el rendimiento de cada una por separado.
Según nuestro conocimiento no existe en la actualidad ninguna publicación que valide estas fórmulas en población obesa latinoamericana.
El objetivo de este trabajo fue estudiar el rendimiento de diferentes fórmulas de estimación del FG en pacientes con diversos grados de obesidad, originarios de Argentina.
Material y métodosSe realizó un estudio de corte transversal, analítico y observacional.
Se incluyó de manera consecutiva a todos los individuos mayores de 18 años, con diagnóstico de obesidad (índice de masa corporal [IMC]>30 kg/m2), a quienes se les determinó el FG con iotalamato por diferentes motivos, en el Hospital Privado Universitario de Córdoba entre septiembre del 2008 y octubre del 2015. Se excluyó a los pacientes que la semana previa o posterior al estudio no presentaban determinaciones de CrS.
Se registraron sexo, edad, raza, IMC (kg/m2), antecedentes de hipertensión arterial, diabetes mellitus, ingesta habitual de inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina II. Se determinaron los valores de CrS (mg/dl) y FG medido con iotalamato (ml/min×1,73 m2).
Los pacientes fueron estratificados según el IMC (IMC=peso en kilogramos/altura en m2) siguiendo la clasificación de obesidad de la Organización mundial de la Salud en grado i (GI; IMC entre 30 y 34,9 kg/m2), grado ii (GII; IMC entre 35 y 39,9 kg/m2) y grado iii (GIII; IMC de 40 kg/m2 o más)12.
La tasa de FG se midió mediante la depuración renal de iotalamato no radiomarcado, determinado por cromatografía líquida de alta performance (HPLC). El instrumento utilizado fue HPLC Gilson® con detector UV/Visible Modelo 189 con columna Phenomenex® de C18. En todos los casos, el procedimiento se llevó a cabo siguiendo un manual protocolizado de operaciones. Las muestras de plasma se recogieron con heparina como agente anticoagulante y las muestras de orina en recipientes estériles. Los resultados se expresan ajustados a 1,73 m2 de superficie corporal.
La determinación de CrS se realizó utilizando el método cinético de Jaffe (Roche Diagnostics, Sussex, Reino Unido), trazable al método de referencia IDMS, en un autoanalizador Modular P. La calibración de la determinación se realizó con un calibrador liofilizado comercial para sistemas automatizados. Todas las determinaciones utilizadas participaron en los programas de control de calidad internos y externos (RIQAS, Reino Unido) y superaron las especificaciones de calidad de análisis recomendados (error total aceptable). Los valores de CrS se expresan en mg/dl.
La tasa de FG estimado se calculó a partir del valor de CrS, con las siguientes fórmulas, todas se expresan en ml/min×1,73 m2:
- –
Cockcroft y Gault (CG)13=(140 – edad [años]×peso (kg)/72×CrS [mg/dl]×0,85 si es mujer). Ajustada por el área de superficie corporal (CG_SC) con la fórmula de Dubois-Dubois14=0,007184×peso (kg)0,425×altura (cm)0,725.
- –
Modification of Diet in Renal Disease (MDRD) simplificada para 4 variables y ajustado a la estandarización Isotope Dilution Mass Spectrometry (MDRD-4 IDMS)15,16=(175×CrS [mg/dl]0,154×edad [años]–0,203×0,742 si es mujer×1,210 si es de raza negra).
- –
Chronic Kidney Disease and Epidemiology (CKD-EPI)17=k1× (CrS [mg/dl]/k2]–k3×0,993edad [años]), donde k1=141 para hombres de raza blanca y 143 para mujeres de raza blanca (no había pacientes de raza negra); k2=0,7 para mujeres y 0,9 para hombres; k3=1,209, 1,209, 0,411, y 0,329 para hombres con CrS>0,9mg/dl, mujeres con CrS>0,7mg/dl, hombres con CrS≤0,9mg/dl, y mujeres con CrS≤=0,7mg/dl, respectivamente.
- –
Mayo Clinic Quadratic equation (MCQ)18=exp (1.911+5.249/CrS [mg/dl] – 2.114/CrS [mg/dl] – 0,00686× edad (años) – 0,205 si es mujer).
- –
Por último, se creó un nuevo estimador, construido a partir del promedio de las predicciones de CKD-EPI y MCQ (CKD-MCQ)=(CKD-EPI+MCQ)/2.
Al ser un trabajo de investigación retrospectivo y observacional, no se pudo obtener un consentimiento informado escrito de cada sujeto. El trabajo de investigación fue aprobado por el CIEIS (Comité Institucional de Ética de Investigación en Salud) de nuestra institución. Protocolo HP-4-264.
Análisis estadísticoSe evaluó el rendimiento de cada fórmula en relación con el aclaramiento con iotalamato (valor de referencia) mediante los valores de medias, desviación estándar, correlaciones (r=coeficiente de correlación de Pearson) y sesgo (diferencia entre el FG estimado y medido). Para comparar las predicciones de las ecuaciones y el FG medido se utilizó el test t apareado.
Se analizó el rendimiento de cada fórmula para discriminar FG menor de 60ml/min a través del área bajo la curva (AUC), sensibilidad (S) y especificidad (E).
Con el objetivo de unificar los criterios de rendimiento, se creó un sistema de puntajes al que llamamos score de performance global. Consiste en la adjudicación de mayor puntaje a la fórmula con menor sesgo, mayor correlación, AUC, S y E, en cada uno de los grupos. A la fórmula de menor sesgo en obesidad grado i se le adjudica el mayor puntaje y a la de mayor sesgo, el menor, así con todas las variables analizadas, en todos los grupos. Cuando varias fórmulas coincidían exactamente en el mismo valor (p. e., igual sesgo o correlación) comparten el mismo puesto en el ranking y se le adjudica el mismo puntaje.
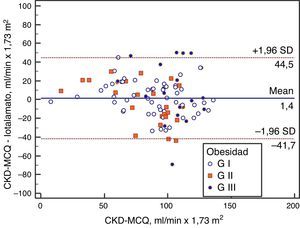
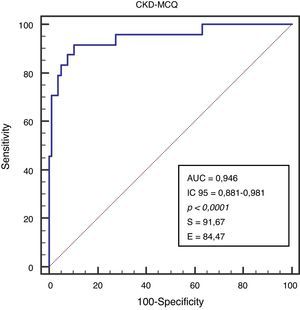
Se graficaron la concordancia (Bland Altman), la correlación (regresión lineal) y el AUC (curva ROC) de la fórmula con mayor rendimiento.
Para analizar las variables categóricas se utilizaron las frecuencias absolutas (n) y relativas (%), y para las variables continuas, medias (M) y desviación estándar (DE).
Para comparar variables continuas se utilizó el test de la t de Student o el test de Mann-Whitney, según correspondiera. Para las variables categóricas se utilizaron LA χ2 y el test exacto de Fisher. Para comparar más de 2 grupos se utilizó el test ANOVA.
El cálculo del AUC se realizó con el método de Hanley and Mac Neil.
Todos los test fueron a 2 colas y se consideró estadísticamente significativo un valor de p menor de 0,05.
El análisis estadístico se realizó con el programa MedCalc 15.11.4 (MedCalc Software, Ostend, Bélgica) y Stata 14 (StataCorp. LP., College Station, TX, EE. UU.).
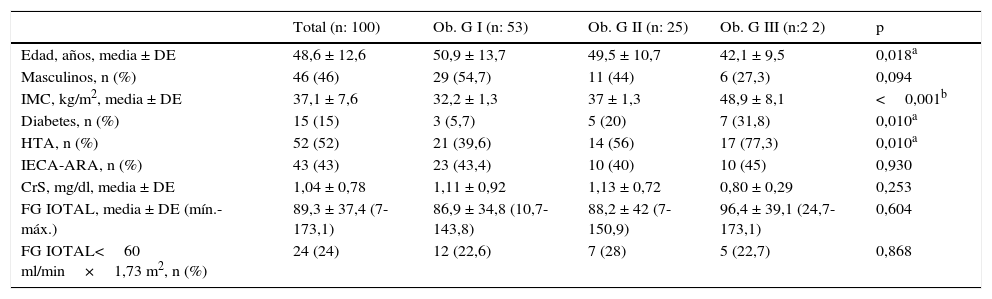
ResultadosSe incluyó en el estudio a 100 pacientes (46 hombres), con diversos grados de obesidad, con un IMC promedio de 37,1 ± 7,6 kg/m2 y con diferentes estadios de ERC. El promedio ± DE (mín.-máx.) del FG medido por iotalamato fue de 89,3 ± 37,4 (7-173) ml/min×1,73 m2. Se excluyó a 4 pacientes que no presentaban determinaciones de CrS cercanas a la medición del FG. Las características basales del total de participantes y sus grupos se muestran en la tabla 1. Todos los participantes eran de raza blanca. Los pacientes con obesidad G III eran de menor edad, que los de G I (42,1 ± 9,5 vs. 50,9 ± 13,7 respectivamente; p=0,018). Existen diferencias significativas entre los 3 grupos respecto al porcentaje de diabetes (G I 5,7%, G II 20% y G III 31,8%; p=0,010) e hipertensión (G I 39,6%, G II 56%, G III 77,3%; p=0,010). No existen diferencias respecto al valor promedio de CrS ni del FG medido por iotalamato.
Características de los pacientes según el grado de obesidad
| Total (n: 100) | Ob. G I (n: 53) | Ob. G II (n: 25) | Ob. G III (n:2 2) | p | |
|---|---|---|---|---|---|
| Edad, años, media ± DE | 48,6 ± 12,6 | 50,9 ± 13,7 | 49,5 ± 10,7 | 42,1 ± 9,5 | 0,018a |
| Masculinos, n (%) | 46 (46) | 29 (54,7) | 11 (44) | 6 (27,3) | 0,094 |
| IMC, kg/m2, media ± DE | 37,1 ± 7,6 | 32,2 ± 1,3 | 37 ± 1,3 | 48,9 ± 8,1 | <0,001b |
| Diabetes, n (%) | 15 (15) | 3 (5,7) | 5 (20) | 7 (31,8) | 0,010a |
| HTA, n (%) | 52 (52) | 21 (39,6) | 14 (56) | 17 (77,3) | 0,010a |
| IECA-ARA, n (%) | 43 (43) | 23 (43,4) | 10 (40) | 10 (45) | 0,930 |
| CrS, mg/dl, media ± DE | 1,04 ± 0,78 | 1,11 ± 0,92 | 1,13 ± 0,72 | 0,80 ± 0,29 | 0,253 |
| FG IOTAL, media ± DE (mín.-máx.) | 89,3 ± 37,4 (7-173,1) | 86,9 ± 34,8 (10,7-143,8) | 88,2 ± 42 (7-150,9) | 96,4 ± 39,1 (24,7-173,1) | 0,604 |
| FG IOTAL<60 ml/min×1,73 m2, n (%) | 24 (24) | 12 (22,6) | 7 (28) | 5 (22,7) | 0,868 |
ARA: antagonistas de los receptores de angiotensina II; CrS: creatinina sérica; DE: desviación estándar; FG IOTAL: filtrado glomerular medido por iotalamato, en ml/min×1,73 m2; HTA: hipertensión arterial; IECA: inhibidores de la enzima convertidora de angiotensina; IMC: índice de masa corporal; M: media; Ob. GI, II, III=obesidad grado 1, 2 y 3.
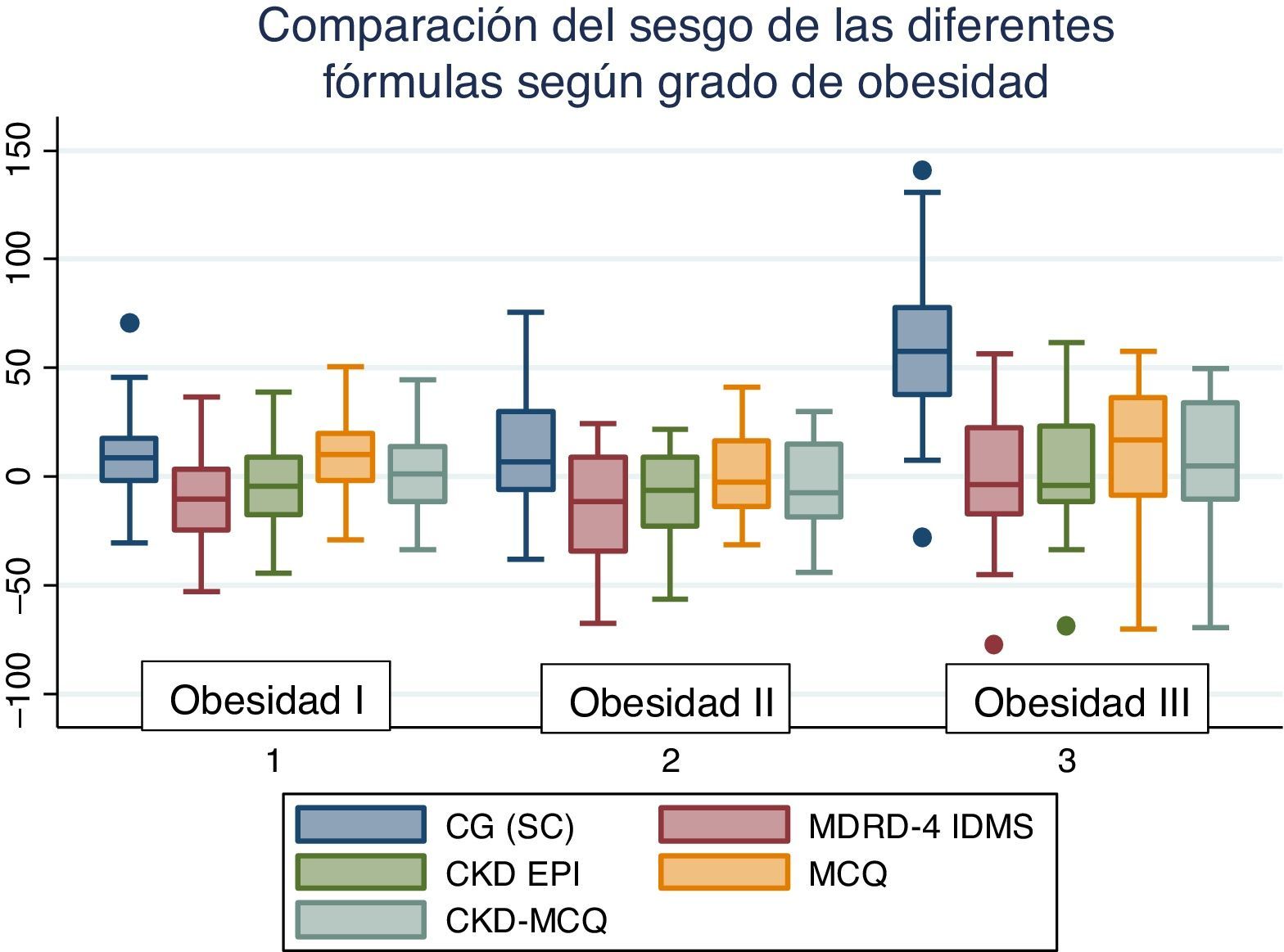
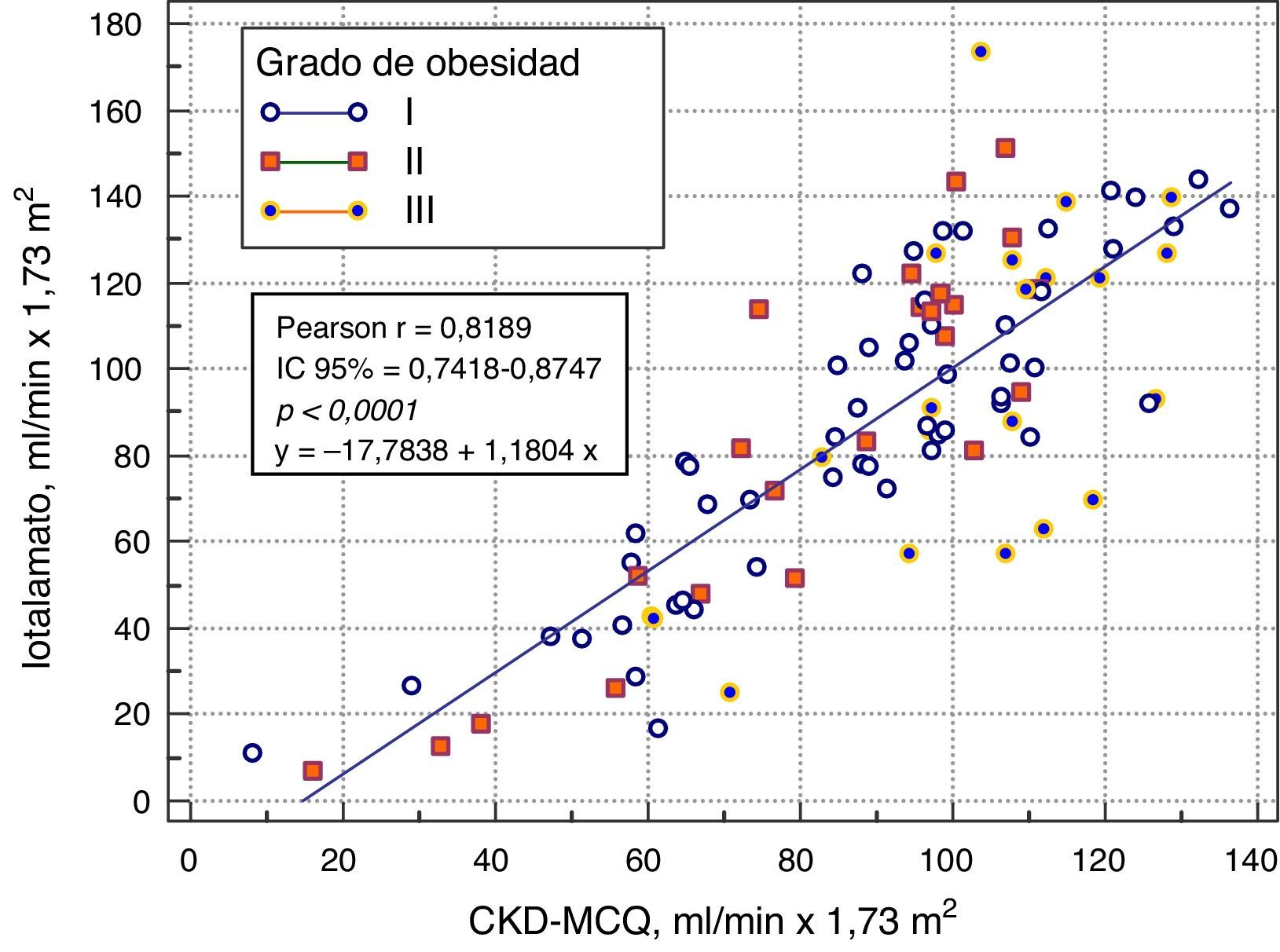
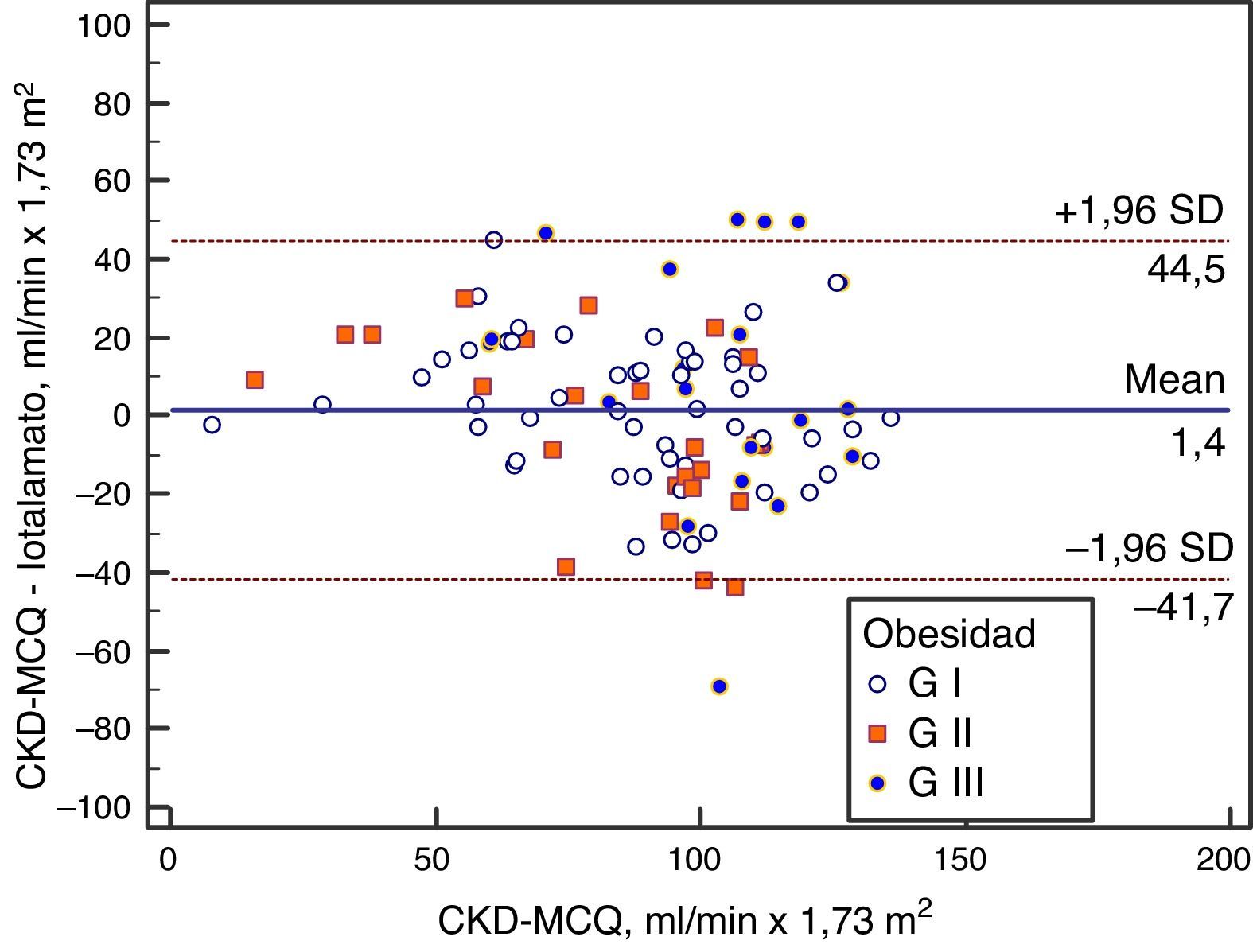
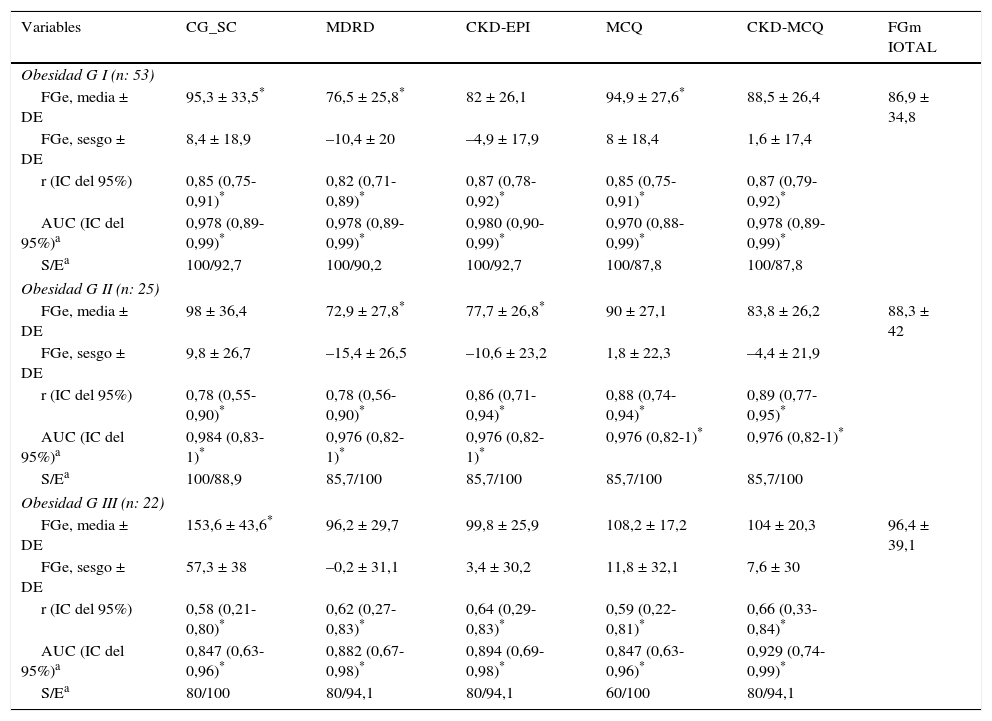
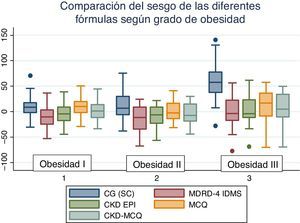
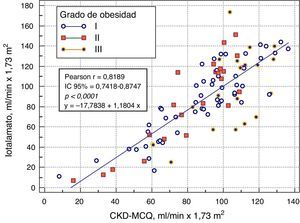
El rendimiento de las fórmulas de estimación del FG, en los diferentes grados de obesidad, se muestra en la tabla 2. En los pacientes con obesidad G I (n = 53), el FG medido por iotalamato fue de 86,9 ± 34,8ml/min×1,73 m2. La fórmula de mejor predicción fue CKD-MCQ (promedio=88,5 ± 26,4ml/min×1,73 m2, sesgo 1,6 ± 17,4ml/min×1,73 m2, r=0,87, AUC=0,978, S=100% y E=87,8%). Las fórmulas con menor rendimiento fueron CG_SC (95,3 ± 33,5ml/min×1,73 m2), MDRD (76,5 ± 25,8ml/min×1,73m2) y MCQ (94,9 ± 27,6ml/min×1,73 m2), con diferencias significativas respecto al patrón de referencia. En los pacientes con obesidad G II (n = 25), el FG promedio medido por iotalamato fue de 88,3 ± 42ml/min×1,73 m2. Las ecuaciones de mejor rendimiento fueron MCQ (90 ± 27,1ml/min×1,73 m2) y CKD-MCQ (83,8 ± 26,2ml/min×1,73 m2), esta última con mayor r (r=0,89) e igual AUC (AUC=0,976), S (S=85,7%) y E (E=100%). Las estimaciones de MDRD (72,9 ± 27,8ml/min×1,73 m2) y CKD-EPI (77,7 ± 26,8ml/min×1,73 m2) fueron diferentes del patrón de referencia. En la obesidad G III (n = 22), el FG promedio medido por iotalamato fue de 96,4 ± 39,1ml/min×1,73 m2. MDRD (96,2 ×29,7ml/min×1,73 m2) fue la ecuación de menor sesgo (–0,2 ± 31,1ml/min×1,73m2) y CKD-MCQ (104 ± 20,3ml/min×1,73 m2) la de mayor r (r=0,66) y AUC (AUC=0,929). En este grupo se puede observar una reducción importante de la correlación en todas las estimaciones. La figura 1 muestra cómo disminuyen su rendimiento a medida que se incrementa el grado de obesidad, con un aumento de la dispersión del sesgo, y con algunas predicciones muy erráticas (valores atípicos). La única fórmula en la que no se halló diferencias significativas con el patrón de referencia, en ninguno de los 3 grados de obesidad, fue CKD-MCQ (tabla 2).
Rendimiento de fórmulas para estimar el filtrado glomerular en diferentes grados de obesidad, comparado con FGm IOTAL
| Variables | CG_SC | MDRD | CKD-EPI | MCQ | CKD-MCQ | FGm IOTAL |
|---|---|---|---|---|---|---|
| Obesidad G I (n: 53) | ||||||
| FGe, media ± DE | 95,3 ± 33,5* | 76,5 ± 25,8* | 82 ± 26,1 | 94,9 ± 27,6* | 88,5 ± 26,4 | 86,9 ± 34,8 |
| FGe, sesgo ± DE | 8,4 ± 18,9 | –10,4 ± 20 | –4,9 ± 17,9 | 8 ± 18,4 | 1,6 ± 17,4 | |
| r (IC del 95%) | 0,85 (0,75-0,91)* | 0,82 (0,71-0,89)* | 0,87 (0,78-0,92)* | 0,85 (0,75-0,91)* | 0,87 (0,79-0,92)* | |
| AUC (IC del 95%)a | 0,978 (0,89-0,99)* | 0,978 (0,89-0,99)* | 0,980 (0,90-0,99)* | 0,970 (0,88-0,99)* | 0,978 (0,89-0,99)* | |
| S/Ea | 100/92,7 | 100/90,2 | 100/92,7 | 100/87,8 | 100/87,8 | |
| Obesidad G II (n: 25) | ||||||
| FGe, media ± DE | 98 ± 36,4 | 72,9 ± 27,8* | 77,7 ± 26,8* | 90 ± 27,1 | 83,8 ± 26,2 | 88,3 ± 42 |
| FGe, sesgo ± DE | 9,8 ± 26,7 | –15,4 ± 26,5 | –10,6 ± 23,2 | 1,8 ± 22,3 | –4,4 ± 21,9 | |
| r (IC del 95%) | 0,78 (0,55-0,90)* | 0,78 (0,56-0,90)* | 0,86 (0,71-0,94)* | 0,88 (0,74-0,94)* | 0,89 (0,77-0,95)* | |
| AUC (IC del 95%)a | 0,984 (0,83-1)* | 0,976 (0,82-1)* | 0,976 (0,82-1)* | 0,976 (0,82-1)* | 0,976 (0,82-1)* | |
| S/Ea | 100/88,9 | 85,7/100 | 85,7/100 | 85,7/100 | 85,7/100 | |
| Obesidad G III (n: 22) | ||||||
| FGe, media ± DE | 153,6 ± 43,6* | 96,2 ± 29,7 | 99,8 ± 25,9 | 108,2 ± 17,2 | 104 ± 20,3 | 96,4 ± 39,1 |
| FGe, sesgo ± DE | 57,3 ± 38 | –0,2 ± 31,1 | 3,4 ± 30,2 | 11,8 ± 32,1 | 7,6 ± 30 | |
| r (IC del 95%) | 0,58 (0,21-0,80)* | 0,62 (0,27-0,83)* | 0,64 (0,29-0,83)* | 0,59 (0,22-0,81)* | 0,66 (0,33-0,84)* | |
| AUC (IC del 95%)a | 0,847 (0,63-0,96)* | 0,882 (0,67-0,98)* | 0,894 (0,69-0,98)* | 0,847 (0,63-0,96)* | 0,929 (0,74-0,99)* | |
| S/Ea | 80/100 | 80/94,1 | 80/94,1 | 60/100 | 80/94,1 | |
FGe: filtrado glomerular estimado, en ml/min×1,73 m2; FGm IOTAL: filtrado glomerular medido por iotalamato, en ml/min.
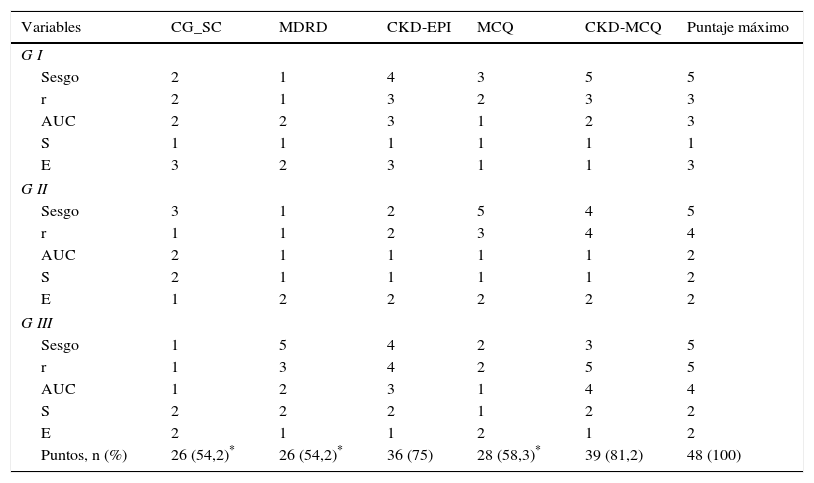
En el score de performance global, la fórmula con mayor puntaje obtenido fue CKD-MCQ (39 de los 48 puntos posibles), seguida por CKD-EPI (36 de 48); el resto de las fórmulas obtuvo puntajes significativamente menores (tabla 3).
Score de performance global de las diferentes fórmulas
| Variables | CG_SC | MDRD | CKD-EPI | MCQ | CKD-MCQ | Puntaje máximo |
|---|---|---|---|---|---|---|
| G I | ||||||
| Sesgo | 2 | 1 | 4 | 3 | 5 | 5 |
| r | 2 | 1 | 3 | 2 | 3 | 3 |
| AUC | 2 | 2 | 3 | 1 | 2 | 3 |
| S | 1 | 1 | 1 | 1 | 1 | 1 |
| E | 3 | 2 | 3 | 1 | 1 | 3 |
| G II | ||||||
| Sesgo | 3 | 1 | 2 | 5 | 4 | 5 |
| r | 1 | 1 | 2 | 3 | 4 | 4 |
| AUC | 2 | 1 | 1 | 1 | 1 | 2 |
| S | 2 | 1 | 1 | 1 | 1 | 2 |
| E | 1 | 2 | 2 | 2 | 2 | 2 |
| G III | ||||||
| Sesgo | 1 | 5 | 4 | 2 | 3 | 5 |
| r | 1 | 3 | 4 | 2 | 5 | 5 |
| AUC | 1 | 2 | 3 | 1 | 4 | 4 |
| S | 2 | 2 | 2 | 1 | 2 | 2 |
| E | 2 | 1 | 1 | 2 | 1 | 2 |
| Puntos, n (%) | 26 (54,2)* | 26 (54,2)* | 36 (75) | 28 (58,3)* | 39 (81,2) | 48 (100) |
AUC: área bajo la curva; r: correlación; S: sensibilidad; E: especificidad.
Se grafica la correlación a través de su regresión lineal (fig. 2), concordancia con Bland Altman (fig. 3), y el AUC, la S y la E para detectar un FG menor de 60ml/min×1,73 m2, con una curva ROC (fig. 4), de la fórmula CKD-MCQ, para todos los individuos del estudio.
Existen pocas publicaciones en el mundo que estudien el rendimiento de las fórmulas para predecir el FG en pacientes obesos. Rigalleau et al.10, en Francia, analizaron la predicción del FG estimado por CG, MDRD y MCQ, comparado con FG medido por 51Cr-EDTA, en 200 sujetos diabéticos, de los cuales 50 eran obesos. Observaron que MCQ mejora la predicción del FG en estos pacientes, pero no se realizó un análisis específico en los individuos obesos. Lemoine et al.11, también en Francia, evaluaron en 209 pacientes obesos el sesgo, la precisión y la exactitud de CKD-EPI para predecir el FG medido por iohexol o inulina. El rendimiento de las predicciones fue bueno, sobretodo en FG menores a 60ml/min×1,73 m2. En este trabajo no se analizaron el AUC, la S y la E, ni tampoco se utilizaron otras fórmulas además de CKD-EPI. Nuestro grupo previamente estudió el rendimiento del FG estimado por MDRD y CKD-EPI comparando con el FG medido por iotalamato, en 85 adultos sudamericanos candidatos a ser donantes renales. CKD-EPI obtuvo mejores resultados, aunque el porcentaje de pacientes obesos era escaso19.
Nuestro estudio adquiere importancia ya que es el primer trabajo que analiza el rendimiento de las fórmulas para estimar el FG, en pacientes con diversos grados de obesidad de un país latinoamericano.
Consideramos que la creación de un score de puntaje para evaluar el rendimiento de las fórmulas es de gran utilidad, ya que unifica todos los criterios de validación y utiliza un parámetro de performance general, aunque este score no ha sido validado previamente.
El mayor puntaje del score de performance global fue para CKD-MCQ, seguida por CKD-EPI, con diferencias significativas con el resto de las fórmulas. La única fórmula que no evidenció diferencias significativas en la predicción de FG, en ninguno de los 3 grupos, fue CKD-MCQ. A medida que aumenta el grado de obesidad, las fórmulas van perdiendo capacidad de predicción. Creemos de utilidad la aplicación de esta nueva fórmula (CKD-MCQ), que no es más que el promedio de CKD-EPI y MCQ, ya que mejora el rendimiento de cada una por separado.
ConclusiónLa fórmula de mayor rendimiento global para estimar el FG en pacientes con diversos grados de obesidad fue la combinación CKD-MCQ. En la obesidad G III todas las fórmulas redujeron su rendimiento. Recomendamos la utilización de CKD-MCQ, sobre las otras fórmulas, en sujetos con obesidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónFundación Nefrológica de Córdoba (gastos de publicación).
Conflicto de interesesNinguno para declarar.
Fundación Nefrológica de Córdoba.