El dolor oncológico es un problema complejo y de gran importancia en la práctica clínica diaria. Aunque el cáncer suele ser indoloro en las primeras fases de su desarrollo, la prevalencia de dolor crónico maligno es del 30-50% en pacientes oncológicos que están en tratamiento activo y del 70-90% en los pacientes con enfermedad avanzada. La prevalencia real del dolor irruptivo oncológico no está clara y es muy variable en función de los estudios, con un abanico que abarca del 19 al 93%. La disnea es un síntoma muy frecuente y común a muchas enfermedades, lo que traduce su origen multisistémico, y se puede presentar tanto en patología respiratoria como en enfermedades no respiratorias. Está presente hasta en el 78% de los pacientes con cáncer de pulmón. Se presentan 2 casos clínicos en los que se utilizó fentanilo intranasal con pectina, tanto para el manejo del dolor irruptivo oncológico como para las crisis de disnea, obteniendo en ambos casos un gran alivio sintomático.
Cancer pain is a complex and highly important problem in daily clinical practice. Although cancer is usually painless in the early phases of its development, the prevalence of chronic pain is 30%-50% in cancer patients undergoing active treatment and 79%-90% in patients with advanced disease. The true prevalence of breakthrough cancer pain is unclear and varies widely across studies, ranging from 19% to 93%. Dyspnea is a highly frequent symptom that is common to many diseases, indicating its multisystemic origin. This symptom can occur in respiratory and non-respiratory diseases. Dyspnea is present in up to 78% of patients with lung cancer. We describe two clinical cases in which fentanyl pectin nasal spray was used in the management of both breakthrough cancer pain and dyspnea exacerbations, providing strong symptomatic relief in both patients.
Varón de 53 años, sin antecedentes personales de interés salvo intolerancia a la glucosa, fumador de 10-20 cigarros al día desde los 20 años e intervenido quirúrgicamente por ginecomastia derecha a los 30 años. Trabajador durante más de 20 años en una fábrica de productos químicos industriales.
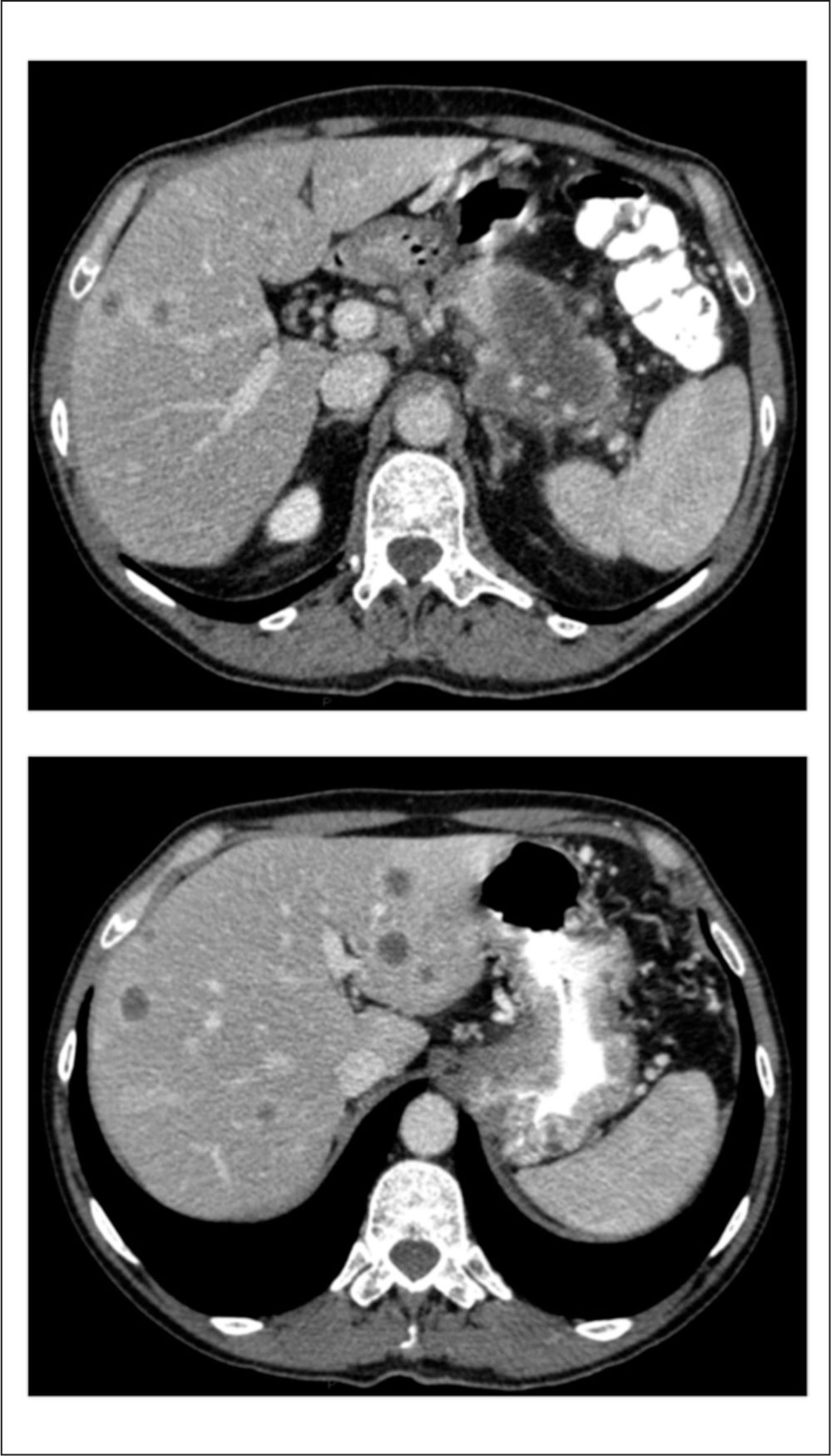
A raíz de un cuadro de dolor epigástrico irradiado a hipocondrio izquierdo (HCI) de 3 meses de evolución junto con astenia, hiporexia y pérdida de al menos 5 kg de peso fue diagnosticado en diciembre de 2011 de un adenocarcinoma de páncreas estadio IV (metástasis hepáticas y ganglionares) (fig. 1).
En ese momento presenta como sintomatología cardinal dolor nociceptivo (somático-visceral) moderado (escala visual analógica [EVA]=6) a nivel epigástrico irradiado a HCI y espalda, a pesar del tratamiento con ibuprofeno 600mg cada 8h, paracetamol 1 g cada 8h (alterno con el ibuprofeno) y tramadol 50mg cada 8h. Sin otros síntomas asociados, con una escala ECOG (Eastern Cooperative Oncology Group) de 1. Si bien el dolor basal no está controlado (EVA=6), el paciente describe 3 episodios de empeoramiento en la intensidad del dolor, con una EVA=8, principalmente tras la ingesta de comida.
Se ajusta la analgesia en la consulta de oncología suspendiendo tramadol e iniciando oxicodona/naloxona 10/5mg cada 12h (con oxicodona de liberación inmediata 5mg de rescate hasta cada 4h). Se prescribe metoclopramida profiláctica durante las primeras 48-72h y macrogol en caso de estreñimiento, y se programa el inicio de la primera línea de quimioterapia paliativa esquema FOLFOXIRI (oxaliplatino, irinotecán y 5-fluorouracilo).
En la revaluación a la semana, el paciente presenta un dolor basal con una EVA de 4, con necesidad de 3-4 rescates/día de oxicodona de liberación inmediata, con 3 crisis de dolor irruptivo (DI) tras la ingesta de alimentos (incidental) de 30-45min de duración, con una EVA=8. Se ajusta el tratamiento aumentando la dosis de oxicodona/naloxona a 20/10mg cada 12h y se inicia titulación con fentanilo intranasal con pectina (FINP) de 100μg hasta cada 4h para el DIO, explicando al paciente que en caso de no obtener alivio del dolor tras 20min desde su aplicación se puede administrar una dosis extra en la fosa nasal contralateral.
En la revaluación semanal, el paciente tiene controlado el dolor basal (EVA=2) y mantiene las 3 crisis de DI tras la ingesta, con EVA=7, si bien con una dosis eficaz de FINP tras la titulación de 200μg se reduce a una EVA de 2 a los 15-20min. Presenta, como único efecto secundario añadido al estreñimiento leve del opioide de base (controlado 1 sobre de macrogol al día), somnolencia leve durante 30-40min.
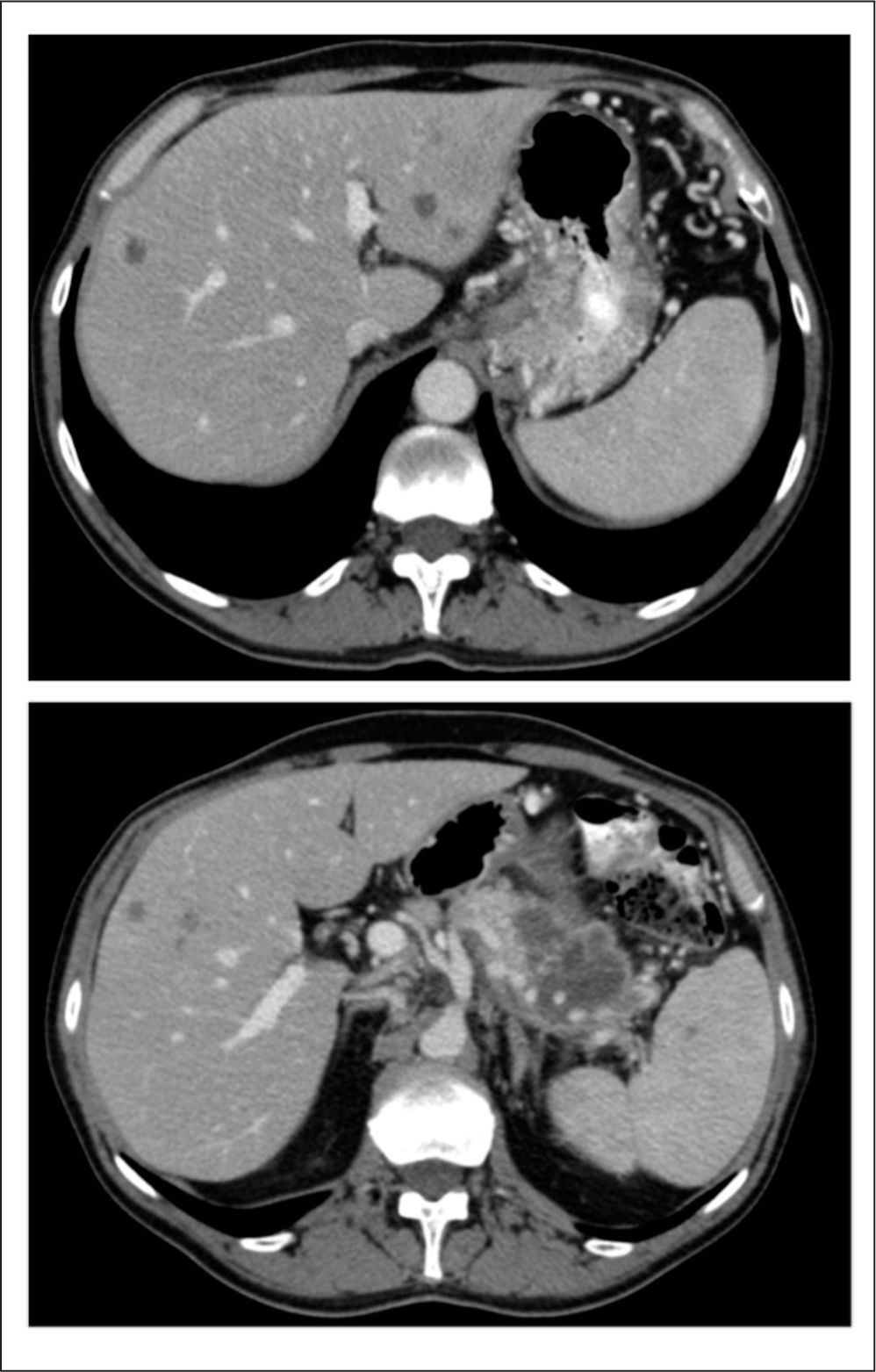
En la tomografía computarizada (TC) tras el tercer ciclo de quimioterapia se obtiene una estabilización de la enfermedad (reducción tumoral de todas las lesiones, pero<30%) (fig. 2), con franca mejoría clínica, suspendiendo bruscamente el paciente (por su cuenta) la medicación analgésica sin presentar ningún efecto secundario relevante (salvo diarrea grado 1) y sin rebrote del dolor. En ese momento, el paciente presenta un ECOG de 1 y realiza una vida prácticamente normal.
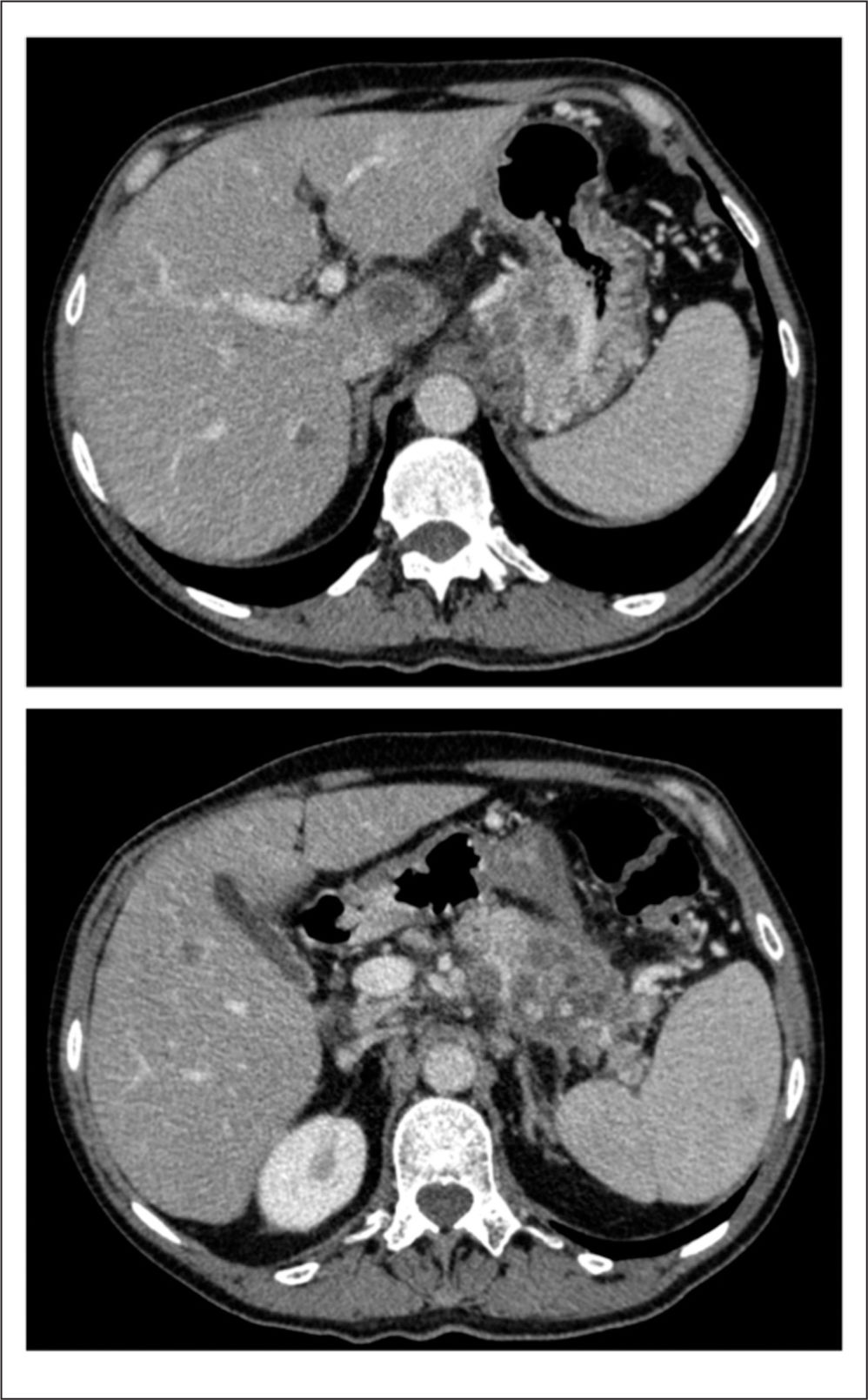
Ante la estabilidad radiológica de la enfermedad con claro beneficio clínico, se completa el tratamiento de quimioterapia hasta los 6 ciclos, si bien comienza unas 72h antes del sexto ciclo con dolor «en cinturón», con una EVA basal=3-4 junto con aumento de la astenia. Ante la elevada sospecha clínica de progresión tumoral se realiza una TC que lo confirma (fig. 3).
En ese momento, el paciente presenta un dolor en epigastrio irradiado en cinturón y a la espalda, con una EVA basal de 5, junto con 2-3 crisis diarias de DI, principalmente tras la ingesta de alimento, con una EVA=10 (infiltración gástrica) y febrícula vespertina. El paciente mantiene hasta el momento un ECOG de 1. Por dicho motivo se programa un tratamiento de quimioterapia paliativa de segunda línea, esquema gemcitabina + capecitabina, y se ajusta el tratamiento de soporte reiniciando oxicodona/naloxona 10/5mg cada 12h, FINP de 100-200μg hasta cada 4h (dosis eficaz tras titulación de 200μg) y naproxeno de 500mg cada 12h (fiebre tumoral).
Tras aumentar progresivamente en las 2 semanas posteriores la oxicodona/naloxona hasta dosis de 40/20mg cada 12h y manteniendo la dosis de FINP de 200μg (3-4 veces al día), el paciente presenta una EVA basal de 2 y una EVA de las crisis de DI de 9, que se reduce a 3 a los 15min de la instilación intranasal de 200μg de fentanilo. La febrícula remite y el ECOG continúa en 1, con diarrea, mucositis, astenia y anemia grado 1 como única toxicidad de la quimioterapia.
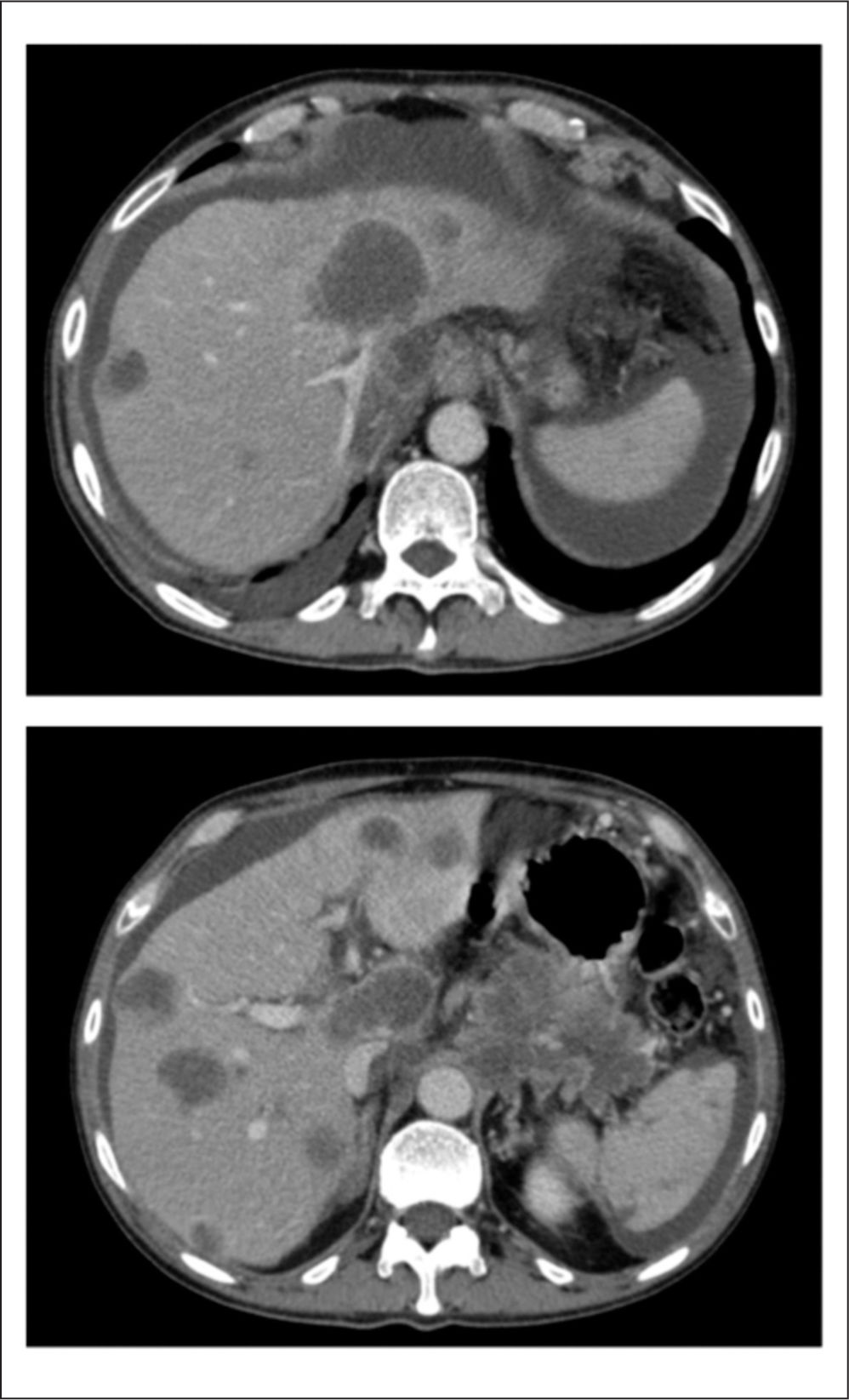
Sin embargo, tras el segundo ciclo (a las 6 semanas de iniciar la segunda línea), el paciente sufre un claro empeoramiento sintomático con astenia severa, deterioro del ECOG a 3 y un empeoramiento brusco del perfil hepático, junto con vómitos persistentes compatibles con oclusión duodenal, que se confirma radiológicamente (fig. 4). En ese momento se realiza una rotación opioide ante el empeoramiento del dolor por intolerancia oral (últimas tomas de opioide oral no eficaces por la emesis), con una EVA=6, iniciando un parche de fentanilo transdérmico de 75μg cada 72h (EVA posterior de 4), siendo necesario aumentar la dosis de FINP de 200 a 400μg, con EVA tras su administración de 3 (previo 9), con mejoría del cuadro oclusivo tras sueroterapia, reposo digestivo y corticoides intravenosos a dosis altas, y es posible el alta domiciliaria con buen manejo sintomático durante 7 días. Posteriormente ingresa por bajo nivel de conciencia e insuficiencia hepática grave; en este momento se inicia sedación terminal. El paciente fallece a las 72h del ingreso con los síntomas controlados.
DiscusiónEl dolor oncológico es un problema complejo y de gran importancia en la práctica clínica diaria. Aunque el cáncer suele ser indoloro en las primeras fases de su desarrollo, la prevalencia de dolor crónico maligno es del 30-50% en pacientes oncológicos que están en tratamiento activo y del 70-90% en los pacientes con enfermedad avanzada. En función de la localización y estadio de la enfermedad, la prevalencia del dolor será distinta: es muy alta en tumores óseos, broncogénicos, pancreáticos o gástricos y baja en linfomas/leucemias. Además, el 41% expresa 3 o más dolores, el 68% 2 o más dolores diferentes y solo un 19% expresa dolor único1. Es por ello un síntoma de enorme importancia, que requiere un manejo multidimensional, con un alto porcentaje de tratamientos inadecuados2.
La prevalencia real del DI oncológico (DIO) no está clara, es muy variable en función de los estudios, con un abanico que abarca del 19 al 93%3. El estudio EPIC analiza la incidencia de dolor en más de 5.000 pacientes oncológicos de 12 países, y el DI presenta una incidencia del 63%, del que solo el 33% llegó a recibir tratamiento con opioides potentes2.
Como ilustra el caso clínico, no es lo mismo el dolor crónico que el irruptivo, y es necesario realizar una titulación con opioides de liberación rápida hasta llegar a la dosis analgésica óptima; sin embargo coexisten episodios de dolor intenso, de corta duración (< 1h en nuestro paciente) y muy intenso (EVA > 7) en los que el diagnóstico y un tratamiento analgésico eficaz y rápido son la clave del éxito analgésico. El tratamiento con fentanilo transmucoso (FT) es una de las elecciones más eficaces, sobre todo en los casos de DI idiopático, en los que no existe un claro desencadenante del dolor (por lo que no es posible predecirlos). A este respecto, el FINP ha demostrado ser uno de los FT más rápidos en actuar, ha mostrado un inicio de acción desde los 5min de su administración4, a lo que hay que sumar que no se «pierde tiempo» en su administración, a diferencia de otros FT. Podría ser discutible la necesidad de una gran rapidez de acción en nuestro paciente en los episodios de DI incidentales (tras la ingesta), si bien en los episodios de DI idiopáticos que presenta en la etapa final de la enfermedad, esta característica es fundamental para garantizar el éxito terapéutico.
El dolor oncológico es variable y cambiante con el tiempo (normalmente acorde con la evolución de la enfermedad oncológica), de ahí la importancia de una periódica y rigurosa revaluación, para ir adecuando el tratamiento analgésico a las diferentes fases de la enfermedad. Nuestro paciente presenta momentos de la enfermedad en los que es posible la ausencia de medicación analgésica, mientras que al final del proceso son necesarias dosis altas de opioide de liberación retardada e inmediata.
No menos importante que la eficacia analgésica es una baja tasa de efectos adversos. Como refleja el caso clínico, el único síntoma ocasionado por la utilización de FINP fue la somnolencia leve durante 30-40min. Este excelente perfil de seguridad es el reflejo de los datos de toxicidad que presenta el fármaco en los estudios pivotales realizados, con<1% de efectos adversos nasales graves5. A nivel sistémico, los efectos adversos más frecuentes son mareo, vómitos, somnolencia, náuseas y estreñimiento. Debido a que los pacientes en tratamiento con FT están, por definición, en tratamiento con opioides de base para el dolor crónico, los efectos sistémicos están enmascarados, sin ser perceptible en la mayoría de los casos el empeoramiento de estos salvo quizás la somnolencia, como ocurre en nuestro paciente, si bien suele ser leve y limitada en el tiempo.
Un reflejo de la rapidez, eficacia y buen perfil de toxicidad del FINP son los datos del estudio CP045, en el que el 90% de los pacientes no requirió incrementar la dosis del fármaco, en el 94%, de más de 42.000 episodios tratados, no se requirió medicación adicional de rescate y más del 90% de los pacientes manifestó estar satisfecho o muy satisfecho con el tratamiento5. Gracias al tratamiento con FINP, nuestro paciente fue capaz de controlar el DI durante la evolución de la enfermedad, con dosis eficaz que osciló entre 200 y 400μg, consiguiendo una EVA tras el tratamiento en torno a 2-3 y permitiendo al paciente realizar una vida independiente hasta sus últimos días.
Una ventaja añadida de la vía intranasal es la posibilidad de administrar la medicación en los casos en los que la vía oral está comprometida. Esta situación no es infrecuente en pacientes oncológicos a lo largo de la evolución de la enfermedad:
- •
Xerostomía: presente en más del 70% de los pacientes oncológicos6,7, lo que puede limitar la absorción de fármacos sublinguales o transmucosales orales que precisan de una cantidad mínima de saliva.
- •
Disfagia: presente en más del 30% de los pacientes oncológicos7,8, lo que limita la utilización de medicamentos orales como la morfina o la oxicodona de liberación rápida.
- •
Candidiasis oral: presente en el 70% de los pacientes terminales8.
- •
Mucositis: entre el 5 y > 40% de los pacientes oncológicos, en función del esquema de quimioterapia recibido, presenta mucositis en diferente grado9. Si bien en los casos de afectación leve, la administración de medicación oral/transmucosal puede no ser un impedimento, en casos moderados/graves puede limitar su acción por imposibilitar una correcta administración del fármaco. La vía transmucosal nasal es una alternativa eficaz y segura en estos casos.
- •
Obstrucción digestiva/diarrea/estreñimiento: complicaciones frecuentes en los pacientes oncológicos que limitan/imposibilitan la utilización de la vía oral.
Nuestro paciente presentó mucositis (si bien en grado leve) secundaria al tratamiento citostático, y en las fases finales obstrucción gástrica con imposibilidad de utilizar la vía oral, problema solventado con la administración de fentanilo transdérmico y transmucosal nasal, que permitió mantener un adecuado control analgésico durante toda la evolución de la enfermedad, sin ser necesaria la administración de palomilla subcutánea y un manejo ambulatorio hasta 72h antes de su fallecimiento.
Más de la mitad de los pacientes oncológicos utilizan un número elevado de fármacos (polimedicación)10,11, lo que aumenta de forma considerable las interacciones farmacológicas, la posibilidad de cometer errores en su administración y un deterioro en sus capacidades físicas y psíquicas11. Disminuir el número de comprimidos podría contribuir beneficiosamente en la adherencia terapéutica, otra de las ventajas de utilizar la vía intranasal. Nuestro paciente llegó a utilizar, en determinadas fases de su enfermedad, hasta 10 fármacos.
Por último, destacar una característica propia del dolor oncológico, el potencial efecto analgésico de los tratamientos antitumorales como la quimioterapia, la terapia dirigida, la radioterapia, la hormonoterapia, etc., ya que la principal causa del dolor oncológico es el tumor primario y sus metástasis. Son innumerables los ejemplos en los que el tratamiento antitumoral ocasiona un efecto analgésico12,13, que es uno de los pilares fundamentales en el manejo del dolor oncológico. En nuestro paciente es posible suprimir el tratamiento analgésico de tercer escalón tras 3 ciclos de quimioterapia.
ConclusionesEl caso clínico presentado es un caso típico de dolor basal nociceptivo visceral controlado con opioides mayores, que presenta crisis de DI mixtas (idiopáticas e incidentales) controladas con FINP, permitiendo al paciente continuar realizando una vida «normal» con un ECOG de 1 hasta 2 semanas previas a su fallecimiento.
Una de las claves fundamentales para conseguir controlar adecuadamente el dolor en pacientes oncológicos es conocer la existencia del DI para poder diagnosticarlo y tratarlo:
- •
Características específicas (inicio rápido, gran intensidad, corta duración, etc.).
- •
Fármacos especialmente dirigidos contra el DIO.
- •
Alta incidencia en los pacientes oncológicos (50-90%).
Una de las principales causas por las que el DIO no se maneja correctamente es el desconocimiento sobre su existencia; por ello, los fármacos más utilizados para su manejo son los opioides de acción rápida utilizados en la titulación del dolor basal (podrían ser útiles en determinados tipos de DIO incidentales y de larga duración) en vez de los opioides de acción inmediata (FT).
En nuestro paciente, el FT utilizado es el FINP, que ha demostrado ser:
- •
Eficaz.
- •
Rápido en actuar.
- •
Seguro, tanto a nivel sistémico (somnolencia leve) como nasal.
- •
Apto en vía oral comprometida: oclusión.
- •
Apto en paciente polimedicado.
Paciente varón de 77 años, con antecedentes personales de hipertensión arterial controlada con 1 fármaco, ex fumador desde el año 2000, con un índice paquete año acumulado de 100, enfermedad pulmonar obstructiva crónica (EPOC) con limitación crónica al flujo aéreo moderada-grave, úlcera gástrica y un episodio de diverticulitis con hemorragia digestiva baja en el año 2000.
Tras cuadro de tos con expectoración hemoptoica y pérdida de 3 kg de peso en 1 mes, el paciente es diagnosticado, en el año 2008, de un carcinoma broncogénico de células escamosas de origen pulmonar estadio clinicorradiológico IIIB, T2N3M0 (masa en lóbulo inferior derecho, adenopatías mediastínicas paratraqueales derechas e izquierdas y sin afectación a distancia). Entre diciembre de 2008 y abril de 2009 el paciente recibe tratamiento con quimioterapia según esquema paclitaxel 200mg/m2 + carboplatino 6 AUC y radioterapia en pauta secuencial sobre masa y mediastino afectado, con respuesta radiológica completa y buena tolerancia al tratamiento, sin efectos secundarios reseñables, presentando ECOG de 0 y realizando una vida completamente normal. El paciente realiza revisiones sin evidencia de progresión de enfermedad hasta noviembre de 2012, fecha en la que se aprecia en la TC un derrame pleural derecho con atelectasia del lóbulo inferior derecho secundaria. En ese momento, el paciente presentaba buen estado general, refiriendo una disnea grado 2 según la escala modificada de la Medical Research Council (mMRC). Además se le realiza una toracocentesis diagnóstica, y se obtiene un líquido serohemorrágico con criterios de exudado de predominio linfocitario con citología negativa para malignidad. Por sospecha de progresión de enfermedad (por la presencia de líquido pleural serohemorrágico y sobre la base de los hallazgos radiológicos), a pesar de la negatividad de la citología, se asume progresión de enfermedad con un intervalo libre de progresión de 38 meses y se propone al paciente la administración de quimioterapia de segunda línea según esquema docetaxel 75mg/m2. Se administra un primer y único ciclo en noviembre de 2012, ya que el paciente ingresa por un episodio de neutropenia febril, negándose a recibir más tratamiento quimioterápico para su enfermedad de base. Se decide, por decisión del paciente, realizar tratamiento exclusivamente sintomático a partir de entonces.
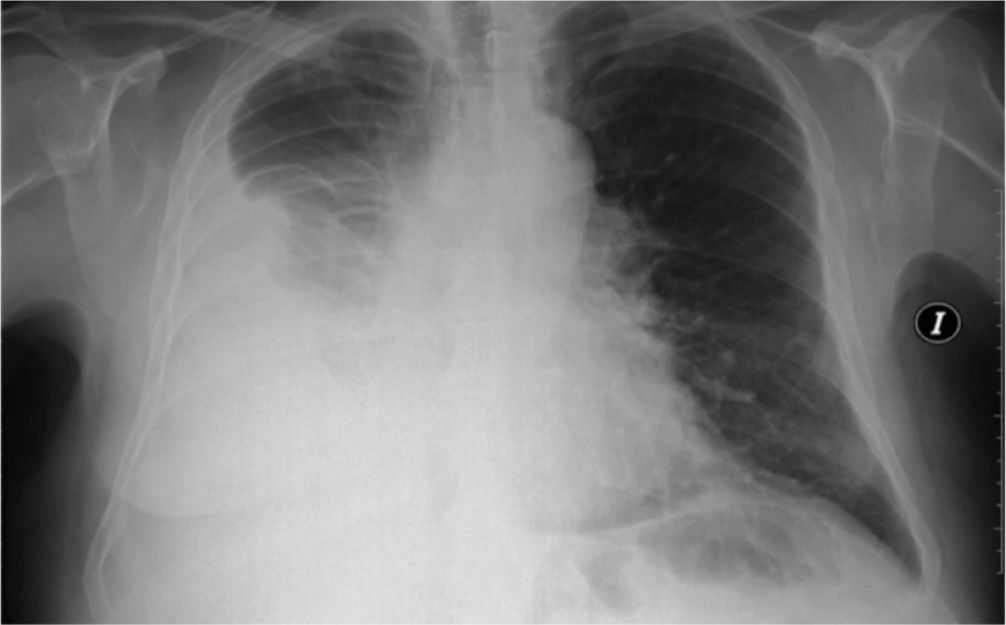
En enero de 2014 acude a consulta refiriendo un cuadro de disnea progresiva grado 3 de la MRC acompañado de dolor en hemitórax derecho de características pleuríticas sin tos, expectoración ni fiebre. A la exploración física, el paciente se encuentra taquipneico en reposo, con una frecuencia respiratoria de 23 respiraciones porminuto y mantiene una saturación de oxígeno (SatO2) basal del 94%. En la auscultación pulmonar destaca una disminución del murmullo vesicular en base pulmonar derecha, y en las pruebas complementarias realizadas se objetiva una hipoxemia arterial en la gasometría arterial respirando aire ambiente (pH 7,45 mmHg, PaO2 65 mmHg, PaCO2 36 mmHg, HCO3 22, SatO2 94%) y un derrame pleural derecho que ocupaba dos tercios del hemitórax derecho en la radiografía de tórax (fig. 5). Se le realiza de nuevo una toracocentesis diagnóstica, con los mismos resultados, y con citología nuevamente negativa para malignidad. Dado el compromiso clínico del paciente se decide colocación de un drenaje torácico en quinto espacio intercostal derecho, con salida de 1.800ml de líquido sanguinolento, con alivio sintomático. En la radiografía de tórax de control se visualiza ausencia de reexpansión completa pulmonar, pese a lo cual se realiza pleurodesis con 4 g de talco diluidos en 50ml de suero salino a través del drenaje. En ese momento, el paciente presenta un dolor pleurítico derecho con una intensidad de 7 (EVA de 7), a pesar de tratamiento con Enantyum® 25mg cada 8h y Nolotil® 575mg cada 8h (alterno con Enantyum®), por lo que se ajusta analgesia con fentanilo transdérmico a dosis de 25μg cada 72h, y es posible el alta con buen control, tanto del dolor (EVA basal a la semana de 3) como de la disnea, y sin efectos secundarios por el opioide de base.
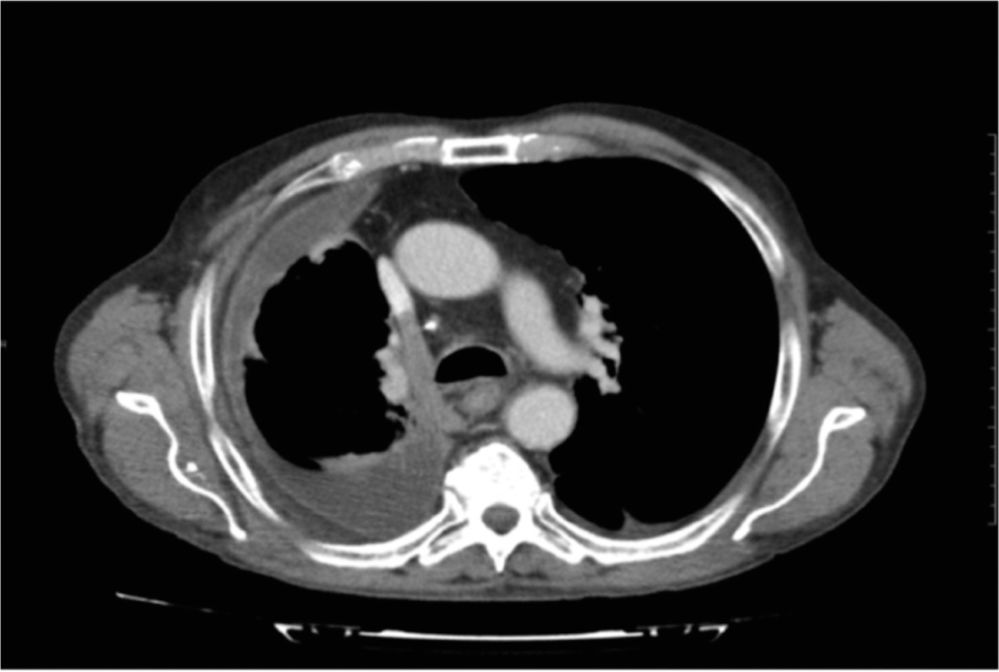
En revisión rutinaria en consulta ambulante, el paciente refiere deterioro de su clase funcional, con disnea clase 4 de la MRC; además presenta «crisis de asfixia», tanto en reposo como con los esfuerzos (con el aseo, al caminar, etc.), con buen control del dolor torácico. Además se cuantifica la disnea según la escala de Borg (escala clínica que valora la disnea durante el ejercicio), con una puntuación de 7 para la disnea «de base»; además refiere al menos 4 «crisis de ahogo» al día, con una intensidad de 9 según la misma escala. Dado que el síntoma cardinal del paciente en este momento es la disnea, se ajusta terapia broncodilatadora con budesonida/formoterol, 320/9, 2 inhalaciones cada 12h y tiotropio 18 μ, 1 cápsula inhalada cada 24h, pese a lo cual no refiere mejoría de esta. No presenta insuficiencia respiratoria en la gasometría de control y en la TC de tórax de control no se aprecian datos de progresión tumoral; únicamente destaca derrame pleural derecho con engrosamiento pleural difuso con colapso pulmonar derecho, pero sin incremento con respecto a la TC previa (fig. 6). Ante la estabilidad radiológica, pero dado el empeoramiento clínico de la disnea, se decide iniciar tratamiento con fentanilo intranasal a dosis de 100μg (1 instilación) en caso de disnea, pudiendo repetir la dosis, 200μg (1 instilación en cada fosa nasal), en caso de persistir «ahogo», debiendo esperar al menos 4h entre los episodios.
A la semana de iniciar el tratamiento, el paciente experimenta mejoría de su disnea basal (7 a 4 en la escala de Borg), así como en número de episodios de asfixia (una media de 2-3 al día) e intensidad de estos (9 a 5). Además, no refiere efectos secundarios reseñables ni clínicos (no somnolencia ni cefalea), ni depresión respiratoria, con una gasometría arterial basal normal (pH 7,38, PaCO2 40 mmHg, PaO2 63 mmHg). La dosis de fentanilo eficaz para controlar la disnea fue de 100μg cada 8h. En ese momento, el paciente presenta un ECOG de 1 y realiza una vida casi normal (le permite salir del domicilio por su disnea).
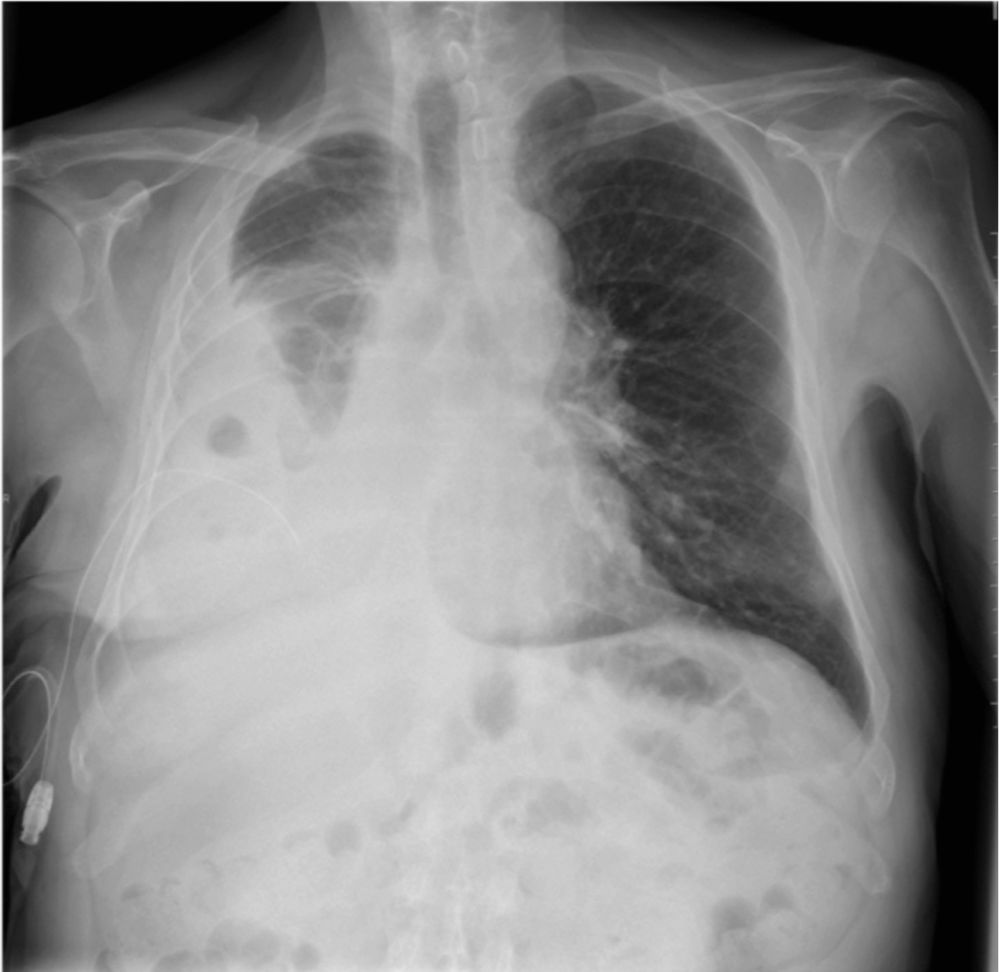
Con dicha dosis, el paciente mantiene buen control de la disnea hasta agosto-septiembre de 2014, fecha en que refiere de nuevo empeoramiento de su clínica respiratoria, con una disnea basal de 8, con más de 4 crisis de «disnea irruptiva» al día con una intensidad de 10. Se incrementa dosis de fentanilo a 200μg nasal cada 8h, con escasa/leve mejoría de la clínica. Ante sospecha de progresión se le realiza una radiografía de tórax, en la que se aprecia empeoramiento del derrame pleural derecho. Tras extraer 800ml de líquido mediante una toracocentesis evacuadora, el paciente experimenta mejoría clínica y puede disminuir la dosis de fentanilo intranasal a 100μg cada 8h de forma temporal. El paciente acude en 3 ocasiones a consulta por empeoramiento de la disnea (grados 7-8) secundario a aumento del derrame pleural, que requiere toracocentesis evacuadoras periódicas (al menos 3 en el último mes y medio) e incremento de la dosis de fentanilo inhalado (200μg, 2 instilaciones cada 8h). Por ello se opta por colocar un catéter tunelizado a finales de noviembre de 2014, sin complicaciones, drenándose el paciente en su domicilio unos 200ml con una frecuencia de 1-2 veces por semana (fig. 7). Tras la colocación del catéter, el paciente mantiene una dosis de fentanilo intranasal de 200μg 2 veces al día y refiere una disnea «basal» de 3, con escasos episodios de disnea «irruptiva», grados 4-5 según la escala Borg. A destacar, además, que presenta un ECOG de 1 pudiendo realizar una vida casi normal hasta la fecha.
DiscusiónLa disnea se define como la sensación subjetiva de falta de aire, ahogo o dificultad para respirar14,15. No es equivalente a insuficiencia respiratoria, este es un concepto exclusivamente gasométrico (definido como una PaO2<60 mmHg en reposo, a nivel del mar y respirando aire ambiental, acompañado o no de hipercapnia, PaCO2 > 45 mmHg). Como tal síntoma es subjetivo, cada sujeto lo siente y lo expresa a su modo, y está influenciado por factores fisiológicos, psicológicos y medioambientales.
La disnea es un síntoma muy frecuente y común a muchas enfermedades, lo que traduce su origen multisistémico, y se puede presentar tanto en patología respiratoria como en enfermedades no respiratorias. Es uno de los síntomas más prevalentes en enfermedades crónicas, de hecho se presenta en el 90-95% de los pacientes con EPOC, en el 78% de los pacientes con cáncer de pulmón, en el 60-88% de los pacientes con insuficiencia cardíaca crónica y cerca del 100% de los pacientes con enfermedades neuromusculares a lo largo de la historia de su enfermedad16,17.
En el caso de las enfermedades respiratorias (ya sean obstructivas, restrictivas o mixtas) son muchas las que en sus etapas finales cursan con un cuadro de deterioro funcional progresivo con episodios intercalados de exacerbaciones, que requieren con frecuencia hospitalización, y cuyo síntoma principal es la disnea; el paradigma es la EPOC y, con menos frecuencia, el resto de patologías (neumopatías intersticiales difusas extensas, enfermedades neuromusculares progresivas, como la distrofia muscular de Duchenne, enfermedad de la motoneurona/esclerosis lateral amiotrófica, etc.). La disnea en la EPOC constituye el síntoma cardinal y más invalidante que condiciona la calidad de vida de los pacientes, generalmente se presenta en estadios avanzados, cuando hay un daño pulmonar importante y su aparición con el esfuerzo suele ser el primer síntoma por el cual consultan los pacientes18–20. En el caso del paciente oncológico, y más concretamente el paciente con un carcinoma broncogénico, la disnea es también un síntoma muy frecuente, ya sea por causas directas relacionadas con el tumor (neumonitis obstructiva o atelectasia, linfangitis carcinomatosa, émbolos tumorales, parálisis unilateral diafragmática, neumotórax, derrame pleural o derrame pericárdico con taponamiento) como por causas indirectas debidas a los efectos secundarios del tratamiento recibido (neumonitis posradioterapia, poscirugía —lobectomía o neumonectomía—, toxicidad pulmonar inducida por fármacos citostáticos o por fármacos inhibidores de la tirosincinasa orales, cardiotoxicidad inducida por quimioterapia, etc.). Solo la mitad de los pacientes con enfermedad respiratoria terminal se beneficia de tratamiento convencional (broncodilatadores, oxígeno, etc.) y se deben buscar alternativas de tratamiento farmacológico que alivien su sintomatología.
La forma de presentación de la disnea no es igual en todos los pacientes, ya que puede ocurrir en reposo, con el ejercicio, puede ser continua, intermitente o aparecer en forma de «crisis». Existe algún estudio observacional que describe las características de la disnea en pacientes con cáncer, pero no hay consenso sobre el manejo y la efectividad del tratamiento en ellos21.
Desde un punto de vista fisiopatológico, no existe un mecanismo único que explique la disnea, pero, por lo general, es el resultado de una anormalidad en 3 grandes sistemas: aumento de los requerimientos ventilatorios (como en el caso de la fiebre o la anemia), existencia de debilidad muscular o alteraciones en el impulso ventilatorio. Además, las diferentes enfermedades que pueden producir disnea según su mecanismo patogénico se engloban en enfermedades típicamente obstructivas (EPOC, hiperreactividad bronquial, secreciones, masas), enfermedades restrictivas (enfermedades intersticiales, fibrosis, derrame pleural, obesidad), las que cursan con alteraciones en la relación ventilación/perfusión (anemia, hipertensión pulmonar, insuficiencia cardíaca, embolia pulmonar) y las que producen debilidad muscular (enfermedades neuromusculares). El sistema nervioso central (SNC) juega, asimismo, un papel muy importante en la percepción de la disnea y en su modulación, mediante la activación de receptores que envían un impulso aferente al SNC y este, a su vez, un impulso eferente sobre los músculos implicados en la respiración. En este sentido, los opioides endógenos o endorfinas pueden atenuar la sensación de disnea actuando en el SNC22,23. Además, en el modo en que la disnea afecta al paciente influyen también factores de orden psicológico, como la personalidad, el estado emocional e incluso la presencia de ansiedad o depresión, frecuentes en los enfermos respiratorios terminales24.
Un mal control de la ansiedad aumenta la disnea y esta, a su vez, contribuye a incrementar la ansiedad, creándose así un círculo vicioso.
La subjetividad de este síntoma hace difícil su medición, por lo que es preciso cuantificarlo utilizando sistemas validados que permiten, además, un seguimiento más objetivo de este síntoma y evaluar la efectividad de las medidas terapéuticas empleadas. En este sentido hay diferentes instrumentos, que van desde la escala analógica visual hasta escalas numéricas como la escala mMRC25 o la escala modificada de Borg26. La mMRC cuantifica la disnea durante las actividades de la vida diaria con 4 rangos, de 0 a 4, donde la puntuación más alta expresa una mayor limitación funcional. No obstante, su sencillez comporta cierta rigidez temporal, de modo que resulta difícil obtener cambios tras una intervención terapéutica. La escala de Borg modificada, sin embargo, se utiliza más que la anterior, siendo de gran utilidad durante las pruebas de esfuerzo, y consta de 12 niveles numéricos de disnea (entre 0 y 12 puntos) con descriptores verbales para cada uno de ellos (tabla 1). Además hay otros índices o escalas, como el índice de la disnea basal de Mahler, la escala de disnea de la New York Heart Association, o cuestionarios de calidad de vida que miden de forma más amplia diversas dimensiones de la enfermedad, pero más limitadas en la práctica clínica habitual.
Escalas de medición de disnea.
| MRC | Escala de Borg (modificada) |
|---|---|
| 0: no sensación de falta de aire al correr en llano o subir escaleras | 0: nada de nada |
| 1: sensación de falta de aire al correr en llano o subir escaleras | 0,5: muy, muy ligera |
| 2: anda más despacio que las personas de su edad en llano por la falta de aire o tiene que parar cuando anda a su propio paso en llano | 1: muy ligera 2: ligera |
| 3: para a respirar después de andar unos 100 m o tras pocosminutos en llano | 3: moderada |
| 4: la falta de aire le impide salir de casa o se presenta al vestirse o desnudarse | 4: algo intensa |
| 5: intensa | |
| 6: entre 5 y 7 | |
| 7: muy intensa | |
| 8: entre 7 y 9 | |
| 9: muy, muy intensa (casi máxima) | |
| 10: máxima |
Al considerar las estrategias para el manejo de la disnea debemos tener en cuenta que las intervenciones van dirigidas a tratar, en primer lugar, la causa de base (diuréticos en caso de ICC, broncodilatadores en el caso de EPOC u oxígeno suplementario en caso de insuficiencia respiratoria). La disnea es el objetivo principal del tratamiento en ausencia de otra causa potencialmente reversible. Los opioides son una herramienta muy importante para el tratamiento de la disnea en el paciente terminal. Actúan disminuyendo la frecuencia respiratoria, modulan la respuesta ventilatoria en respuesta a la hipoxia y a la hipercapnia, con una mayor tolerancia del centro respiratorio a los valores de CO2. Además parece que tienen efecto vasodilatador en el lecho vascular pulmonar en modelos animales. El papel beneficioso de los opioides para el manejo de la disnea en EPOC ha sido reconocido en varios estudios; el utilizado con mayor frecuencia es la morfina, tanto por vía oral como parenteral y nebulizada. Hay 2 ensayos clínicos importantes que establecen las bases para la recomendación de opioides en el paciente con disnea, así como para su titulación, ya sea sin o con opioide de base27,28. Además, Currow et al29, en un estudio fase II demuestran por primera vez que pequeñas dosis de opioides producen mejoría en el manejo de la disnea, que además se mantiene a largo plazo. Este hecho es importante, ya que nos plantea que la terapia con opioides debe utilizarse no solo en situaciones de final de la vida, sino también para pacientes estables con EPOC, cuando la disnea es grave y persistente a pesar del tratamiento broncodilatador máximo. Otros opioides diferentes a la morfina se han investigado en un número limitado de casos. Tal es el caso de la hidromorfona oral o nebulizada y el fentanilo inhalado, cuyo beneficio se ha demostrado en series de casos limitadas con buenos resultados. Es sabido que la administración nasal tiene ventajas, como la fácil administración, el rápido inicio de acción y el buen control, tanto del dolor como de la disnea30.
El principal temor en el manejo de los opioides es la depresión respiratoria. Diferentes estudios han demostrado que este temor es infundado; de hecho, el uso de opioides a una dosis adecuada puede producir alivio sintomático de la disnea con disminución de la frecuencia respiratoria sin cambios significativos en los parámetros respiratorios (SatO2 y valores de PaCO2). Además, estas conclusiones han sido reafirmadas en otras revisiones, de tal manera que las guías del American College of Chest Physicians para el manejo de la disnea en pacientes con enfermedad cardiológica o respiratoria avanzada recomiendan el uso y titulación de opioides para el alivio sintomático de la disnea31,32.
El caso que nos ocupa trata de un paciente con una enfermedad obstructiva de base (EPOC con limitación crónica al flujo aéreo moderada-grave), que posteriormente desarrolla un carcinoma broncogénico tratado con quimiorradioterapia radical, con una larga supervivencia a pesar de tratarse de un estadio localmente avanzado en el momento del diagnóstico. Conforme avanza la enfermedad tumoral, el paciente desarrolla un derrame pleural derecho (presumiblemente paraneoplásico), que ocasiona un empeoramiento de su disnea basal, la cual, en mayor o menor grado, será el síntoma cardinal durante toda su evolución. La existencia de escalas de medición de disnea resulta útil para evaluar cuantitativamente la disnea en nuestro paciente (disnea basal grado 4 en reposo según la escala mMRC o grado 7 según la escala de Borg con el ejercicio), así como para poder evaluar la respuesta a una terapia específica. En este caso, la disnea es de origen multifactorial (patrón obstructivo por su EPOC de base y patrón restrictivo por el derrame pleural derecho asociado), con escasa mejoría a pesar de tratamiento broncodilatador máximo y toracocentesis seriadas. El uso de fentanilo intranasal supone una herramienta terapéutica añadida cuando el tratamiento médico no es capaz de aliviar la sintomatología, tanto en la disnea que el paciente define como «basal» de reposo como en los momentos de «crisis» o durante el ejercicio. Tal y como ilustra el caso, el fentanilo intranasal es bien tolerado y a una dosis máxima de 200μg 3 veces al día no presentó efectos secundarios importantes, ya que el paciente no refirió excesiva somnolencia ni se apreció elevación de las cifras de PaCO2 en ninguna de las gasometrías realizadas. Por lo general, la dosis utilizada de fentanilo intranasal para el control de la disnea es inferior a la requerida para el manejo del DIO, según nuestra experiencia y las diferentes series publicadas. Este es un ejemplo de paciente en el que la disnea es el síntoma cardinal, y el hecho de haber utilizado de forma temprana los opioides nos permite incrementar la dosis sin un riesgo importante de depresión respiratoria u otros efectos adversos al final de la enfermedad.
ConclusionesEn la actualidad existe una falta de consenso sobre el uso de opioides en la disnea en el paciente refractario, pese a lo cual las diferentes sociedades respiratorias recomiendan el uso de morfina, ya que muchos pacientes se benefician de esta terapia sin efectos secundarios reseñables.
El caso clínico actual es una demostración de la eficacia de un opioide transmucosal, citrato de fentanilo intranasal con pectina, en el manejo de la disnea (de origen multifactorial), tanto de base como con ejercicio, que presenta el paciente a lo largo de su enfermedad. Es un tratamiento complementario al resto de medidas farmacológicas (broncodilatadores de acción larga y corta) y no farmacológicas (toracocentesis evacuadoras), que contribuye al alivio de la disnea con un perfil de seguridad bueno a nivel sistémico (no somnolencia ni hipercapnia). En el caso de nuestro paciente, en el manejo de la disnea el fármaco ha demostrado ser seguro, eficaz y cómodo en su administración por su rapidez de acción.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.