La enfermedad arterial periférica de las extremidades inferiores (EAP) conlleva una mayor morbimortalidad en pacientes con diabetes mellitus tipo 2 (DM2); este trabajo evalúa la prevalencia en dichos pacientes y su asociación con variables socio-demográficas y clínicas.
Material y métodosEstudio descriptivo transversal con muestreo consecutivo de pacientes con DM2, entre 50-80 años, en Atención Primaria. La presencia de EAP fue diagnosticada mediante un índice tobillo-brazo (ITB) ≤ 0,9. Variables independientes: socio-demográficas, clínicas y de laboratorio. Para determinar qué factores se asociaban a ITB bajo se hizo un análisis bivariado y regresión logística múltiple.
ResultadosMuestra de 251 pacientes, de los que el 52,6% eran mujeres; la edad media ± desviación estándar fue de 68,5 ± 8,5 años. Presentaron ITB bajo el 18,3% (intervalo de confianza del 95% [IC del 95%], 13,3-23,3%); 6 sujetos (2,4%) estaban diagnosticados previamente de EAP. Tras el análisis multivariante, los factores que se vieron asociados con un ITB bajo fueron la edad (OR=1,07; IC del 95%, 1,02-1,12) y la presencia de retinopatía (OR=2,69; IC del 95%, 1,06-6,81).
ConclusionesHay un bajo porcentaje de pacientes diagnosticados de EAP, a pesar de su elevada prevalencia en pacientes con DM2 seguidos en Atención Primaria, especialmente aquellos de mayor edad y con retinopatía, por lo que hay que insistir en la recomendación de realizar sistemáticamente el ITB en esta población de riesgo.
Peripheral artery disease in the lower limbs (PAD) is a prevalent condition that entails high morbidity in diabetic patients; this study assesses PAD in these patients and its socio-demographic and clinic associated variables.
Material and methodsDescriptive study in a systematic sample of diabetic patients (DM2) aged 50-80 years, in Primary Care settings. The dependent variable was the presence of PAD diagnosed by ankle-brachial index (ABI) ≤ 0.9; independent variables: socio-demographic, clinical and laboratory. Statistics: bivariate and multiple logistic regression analyses were performed to determine the variables associated with low ABI.
ResultsA sample of 251 patients, 52.6% women; mean age: 68.5 ±8.5. A low ABI was detected in 18.3% (95% Confidence Interval (95% CI):13.3-23.3%), with 6 subjets (2.4%) previously diagnosed as suffering PAD. Age (OR=1.07; 95% CI: 1.02-1.12) and retinopathy (OR=2.69; 95% CI: 1.06-6.81) were associated (multiple logistic regression analysis) with ABI.
ConclusionsThe percentage of patients diagnosed with PAD is very low, although PAD prevalence is high among DM2 patients attending Primary Care clinics, especially in older patients and those with retinopathy. We emphasize the recommendation of performing the ABI test in this population at risk.
Las estimaciones dadas, en el 2012, por la Organización Mundial de la Salud convierten la diabetes mellitus (DM) en una epidemia mundial, en relación con el gran aumento del sobrepeso, la obesidad y la inactividad física1.
La enfermedad arterial periférica de las extremidades inferiores (EAP) tiene a la DM como principal factor de riesgo2 y su diagnóstico indica la presencia de una arteriosclerosis sistémica que comporta un riesgo cardiovascular adicional en estos pacientes y nos lleva a realizar un tratamiento intensivo de los factores de riesgo cardiovascular (FRCV)2-4; en el estudio UKPDS, el riesgo de aparición aumentaba un 28% por cada 1% de incremento de la hemoglobina glucosilada (HbA1c)5. Por consiguiente, y debido a que la prevalencia de la EAP aumenta progresivamente con la edad, es razonable suponer que su presencia y la del «pie isquémico» podrían convertirse en una de las más frecuentes complicaciones de la DM en un próximo futuro6.
Su detección se ve dificultada, ya que a menudo es asintomática2,3; por tanto, aunque la exploración clínica aporte una importante información, es necesario emplear pruebas no invasivas en Atención Primaria (AP) para establecer el diagnóstico de EAP y esto se puede lograr con el cálculo del índice tobillo-brazo (ITB), una prueba no invasiva, rápida, barata, que no solo puede detectarla sino también cuantificar su gravedad, con una sensibilidad y una especificidad estimadas de un 79% y un 96%, respectivamente7,8. Diferentes sociedades científicas recomiendan medir el ITB en todos los pacientes con DM tipo 2 (DM2) mayores de 50 años y en aquellos que presenten clínica de EAP o tengan otros FRCV3,9.
El objetivo del presente trabajo es conocer la prevalencia de la EAP en pacientes con DM2 en el ámbito de la AP y su relación con variables socio-demográficas y clínicas mediante el cálculo del ITB.
Material y métodosSe llevó a cabo un estudio observacional transversal. La población de estudio estaba constituida por todos los pacientes con DM2 adscritos a 3 de los 6 cupos médicos del centro de salud de la localidad de Fernán-Núñez (provincia de Córdoba) y cuyas edades estaban comprendidas entre los 50 y los 80 años. Se consideraron los siguientes criterios de exclusión: pacientes con DM tipo 1, ITB elevado o incompresible, imposibilidad de desplazamiento al centro de salud por sus medios, o presentar lesiones en extremidades que contraindicaran la técnica del ITB.
Basándonos en estudios previos10,11, estimamos un tamaño de muestra de 237 sujetos, para una prevalencia esperada de ITB bajo del 20%, una precisión del 5% y un nivel de confianza del 95%. Asumiendo una tasa de no respuesta del 10%, el tamaño muestral mínimo requerido sería de 261 pacientes. El muestreo fue consecutivo, es decir, se fue incluyendo a todos los pacientes que acudieron a las consultas y que reunía los criterios de selección, hasta alcanzar el tamaño muestral predeterminado.
Todos los pacientes que aceptaron participar fueron incluidos tras ser informados de la naturaleza, los riesgos y las ventajas del estudio, y firmar un documento de consentimiento; el estudio fue aprobado por la Comisión de ética e investigación del Distrito Sanitario Área Sur de Córdoba.
Las fuentes de recogida de datos fueron la anamnesis por entrevista clínica (estado civil, nivel de estudios, antecedentes familiares, tiempo de evolución y tabaquismo), la historia clínica digital, la exploración física y el análisis de laboratorio. Los criterios diagnósticos tenidos en cuenta para el estudio aparecen en la tabla 1. Las variables independientes estudiadas se recogen en el resto de las tablas presentes en este artículo.
Los criterios diagnósticos
| DM2 | Individuos incluidos en el Proceso Asistencial de DM de la Consejería de Salud de la Junta de Andalucía |
| Hipertensión arterial | Diagnóstico bien documentado o con tratamiento hipotensor, con independencia de las cifras tensionales |
| Enfermedad arterial periférica | Diagnóstico bien documentado en la historia clínica |
| Cardiopatía isquémica | Episodio bien documentado de angina de pecho, infarto agudo de miocardio o intervención quirúrgica coronaria |
| Enfermedad cerebrovascular | Episodio bien documentado de accidente cerebrovascular isquémico o de estenosis de los troncos supraaórticos ≥ 50% |
| Neuropatía | Diagnóstico bien documentado o estudio mediante exploración física y monofilamento |
| Síndrome metabólico | Criterios del National Cholesterol Education Program en su documento Adult Teatment Panel III |
| Dislipidemia | Colesterol total ≥ 200mg/dl y/o triglicéridos ≥ 200mg/dl, cLDL ≥ 160mg/dl, cHDL<40mg/dl en hombres y < 50mg/dl en mujeres; igualmente, con independencia de los niveles de lípidos, si el paciente tomaba fármacos hipolipidemiante o tenía previamente este diagnóstico registrado |
| Nefropatía | Diagnóstico bien documentado. Insuficiencia renal ante una tasa de filtrado glomerular mediante la fórmula MDRD < 60ml/min/1,73m2. Albuminuria cuando el cociente albúmina/creatinina fue > 30mg/g o la concentración de albúmina en la muestra de orina minutada superaba los 20μg/min |
| Retinopatía | Diagnóstico confirmado por el oftalmólogo |
| Obesidad abdominal | Diámetro de la cintura > 102cm en hombres o>88cm en mujeres |
| ObesidadIMC (peso/talla al cuadrado) | Se clasificó como obeso al paciente con IMC>30; sobrepeso entre 25 y 29,9; normopeso entre 18,5 y 24,9 y bajo peso < 18,5 |
| Fumador | Consumo de uno o más cigarrillos diariamente, o quienes refirieran abandono de la adicción de menos de 6 meses antes de ser incluido en este estudio |
Diagnóstico bien documentado: diagnóstico recogido en la historia clínica digital.
A todos se les realizó un estudio analítico con valores hematocitométricos y bioquímicos de rutina, el perfil lipídico (colesterol total, cHDL, cLDL y triglicéridos), HbA1c, glucemia basal, ácido úrico, proteína C reactiva, homocisteína y microalbuminuria.
Se consideraron como valores normales de las pruebas bioquímicas los aportados por nuestro laboratorio de referencia, excepto en HbA1c, cuyo dintel asumido fue el de < 7%12.
Para la determinación del ITB se utilizó un eco-Doppler portátil bidireccional con sonda de 8MHz (Huntleigh® Dopplex D900/D920) y un esfigmomanómetro digital calibrado. Se midió la presión arterial sistólica en las arterias tibial posterior y pedia de ambos miembros inferiores, y en las braquiales de los superiores. Se calculó el ITB mediante la aplicación que para tal efecto está disponible en la plataforma Diraya del Servicio Andaluz de Salud. El valor del miembro con menor ITB fue el que se consideró como el resultado final de la prueba. Los puntos de corte utilizados fueron ≤ 0,9 para ITB bajo y ≥1,4 o incompresible para ITB alto13.
Se aplicó estadística descriptiva con cada una de las variables y se calcularon los intervalos de confianza del 95% (IC del 95%) de los principales estimadores del estudio. Se hizo un análisis bivariado para comprobar la relación de las variables independientes y la presencia de ITB, para lo que se emplearon las pruebas de la ji al cuadrado, la prueba de la t de Student o ANOVA (previa comprobación de normalidad), y la U de Mann-Whitney, en su caso (contrastes bilaterales, valor de p ≤ 0,05). Se hizo un análisis de regresión logística múltiple en donde las variables independientes consideradas se introdujeron en el modelo mediante la técnica «enter». Las variables cualitativas con más de 2 categorías fueron tratadas como dummy. La bondad de su ajuste fue comprobada mediante el test de Hosmer-Lemeshow. Para el análisis se utilizaron los programas EPIDAT 3.1 y SPSS 17.0.
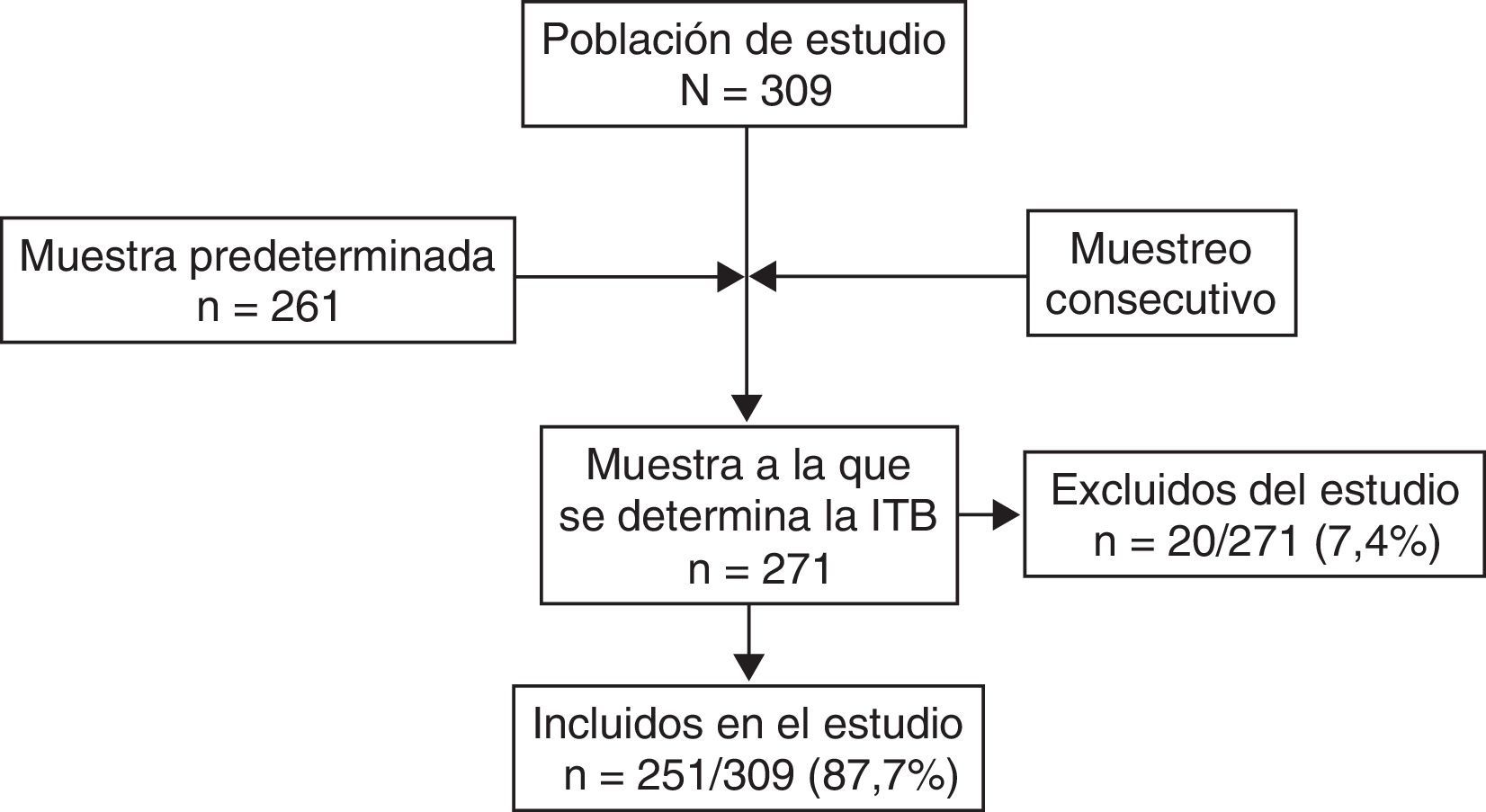
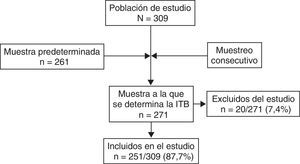
ResultadosLa medición del ITB se llevó a cabo en 271 pacientes con DM2 (fig. 1), de los 309 potencialmente reclutables (tasa de respuesta del 87,7%); de aquellos, se excluyó a 20 pacientes (7,4%) por presentar un ITB alto o incompresible. Por tanto, la muestra definitiva fue de 251 pacientes DM2, de los que el 52,6% eran mujeres, y la media de edad ± desviación estándar fue de 68,5±8,5 años; con una duración media de la DM2 de 9,3 años±7,2 (mediana: 8). Presentaron un ITB bajo 46 pacientes (18,3%; IC del 95%, 13,3-23,3%); 6 sujetos (2,4%) estaban diagnosticados previamente de EAP.
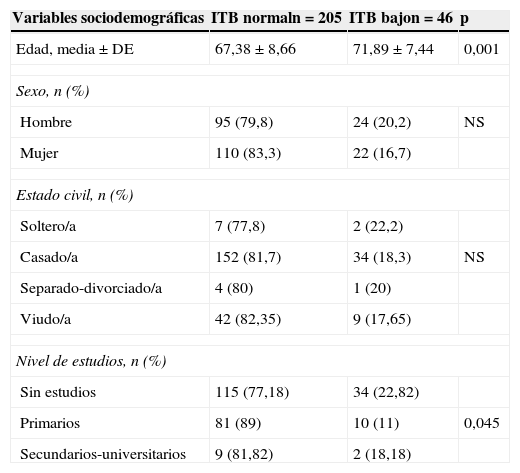
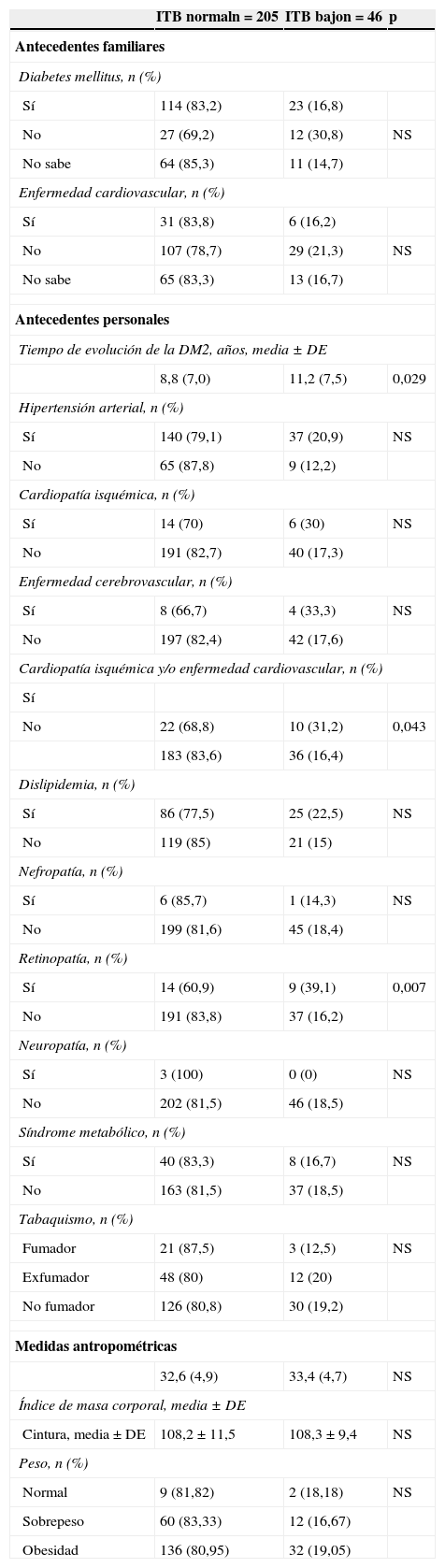
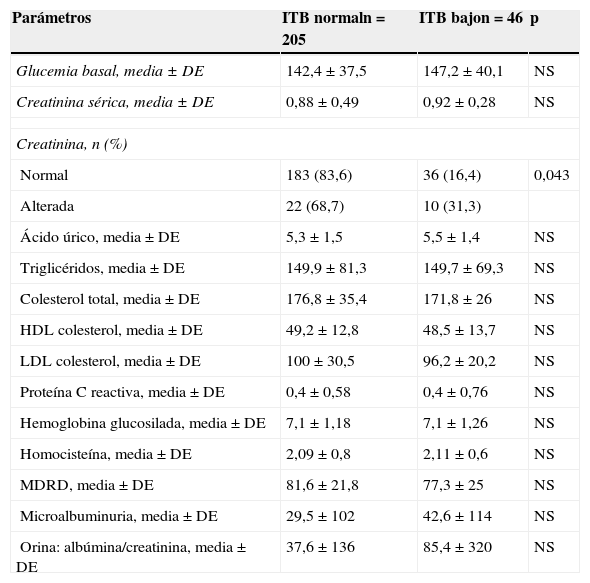
Los resultados de la prevalencia de ITB bajo en función de las características sociodemográficas de la muestra se recogen en la tabla 2, mientras que las de los antecedentes familiares y personales, y las medidas antropométricas se reflejan en la tabla 3. La tabla 4 muestra la relación entre un ITB bajo y los parámetros bioquímicos y la tabla 5 su relación con los tratamientos vigentes. La EAP se halló asociada con la edad (p<0,001), el nivel de estudios (p=0,043), el tiempo medio de evolución de la DM2 (en los pacientes con ITB normal: 8,8±7,0 años, y entre los que tenían un ITB bajo: 11,2±7,5 años; p=0,029), antecedentes de retinopatía (p=0,007), de cardiopatía isquémica y/o enfermedad cerebrovascular (p=0,043) y creatinina en sangre elevada (p=0,043).
Características sociodemográficas de los pacientes según el ITB
| Variables sociodemográficas | ITB normaln=205 | ITB bajon=46 | p |
|---|---|---|---|
| Edad, media ± DE | 67,38 ± 8,66 | 71,89 ± 7,44 | 0,001 |
| Sexo, n (%) | |||
| Hombre | 95 (79,8) | 24 (20,2) | NS |
| Mujer | 110 (83,3) | 22 (16,7) | |
| Estado civil, n (%) | |||
| Soltero/a | 7 (77,8) | 2 (22,2) | |
| Casado/a | 152 (81,7) | 34 (18,3) | NS |
| Separado-divorciado/a | 4 (80) | 1 (20) | |
| Viudo/a | 42 (82,35) | 9 (17,65) | |
| Nivel de estudios, n (%) | |||
| Sin estudios | 115 (77,18) | 34 (22,82) | |
| Primarios | 81 (89) | 10 (11) | 0,045 |
| Secundarios-universitarios | 9 (81,82) | 2 (18,18) | |
DE: desviación estándar; ITB: índice tobillo-brazo; NS: no significativa.
Antecedentes familiares, personales y medidas antropométricas de los pacientes según el ITB
| ITB normaln=205 | ITB bajon=46 | p | |
|---|---|---|---|
| Antecedentes familiares | |||
| Diabetes mellitus, n (%) | |||
| Sí | 114 (83,2) | 23 (16,8) | |
| No | 27 (69,2) | 12 (30,8) | NS |
| No sabe | 64 (85,3) | 11 (14,7) | |
| Enfermedad cardiovascular, n (%) | |||
| Sí | 31 (83,8) | 6 (16,2) | |
| No | 107 (78,7) | 29 (21,3) | NS |
| No sabe | 65 (83,3) | 13 (16,7) | |
| Antecedentes personales | |||
| Tiempo de evolución de la DM2, años, media ± DE | |||
| 8,8 (7,0) | 11,2 (7,5) | 0,029 | |
| Hipertensión arterial, n (%) | |||
| Sí | 140 (79,1) | 37 (20,9) | NS |
| No | 65 (87,8) | 9 (12,2) | |
| Cardiopatía isquémica, n (%) | |||
| Sí | 14 (70) | 6 (30) | NS |
| No | 191 (82,7) | 40 (17,3) | |
| Enfermedad cerebrovascular, n (%) | |||
| Sí | 8 (66,7) | 4 (33,3) | NS |
| No | 197 (82,4) | 42 (17,6) | |
| Cardiopatía isquémica y/o enfermedad cardiovascular, n (%) | |||
| Sí | |||
| No | 22 (68,8) | 10 (31,2) | 0,043 |
| 183 (83,6) | 36 (16,4) | ||
| Dislipidemia, n (%) | |||
| Sí | 86 (77,5) | 25 (22,5) | NS |
| No | 119 (85) | 21 (15) | |
| Nefropatía, n (%) | |||
| Sí | 6 (85,7) | 1 (14,3) | NS |
| No | 199 (81,6) | 45 (18,4) | |
| Retinopatía, n (%) | |||
| Sí | 14 (60,9) | 9 (39,1) | 0,007 |
| No | 191 (83,8) | 37 (16,2) | |
| Neuropatía, n (%) | |||
| Sí | 3 (100) | 0 (0) | NS |
| No | 202 (81,5) | 46 (18,5) | |
| Síndrome metabólico, n (%) | |||
| Sí | 40 (83,3) | 8 (16,7) | NS |
| No | 163 (81,5) | 37 (18,5) | |
| Tabaquismo, n (%) | |||
| Fumador | 21 (87,5) | 3 (12,5) | NS |
| Exfumador | 48 (80) | 12 (20) | |
| No fumador | 126 (80,8) | 30 (19,2) | |
| Medidas antropométricas | |||
| 32,6 (4,9) | 33,4 (4,7) | NS | |
| Índice de masa corporal, media ± DE | |||
| Cintura, media ± DE | 108,2 ± 11,5 | 108,3 ± 9,4 | NS |
| Peso, n (%) | |||
| Normal | 9 (81,82) | 2 (18,18) | NS |
| Sobrepeso | 60 (83,33) | 12 (16,67) | |
| Obesidad | 136 (80,95) | 32 (19,05) | |
DE: desviación estándar; DM2: diabetes mellitus tipo 2; ITB: índice tobillo-brazo; NS: no significativa.
Determinaciones de laboratorio según el ITB
| Parámetros | ITB normaln=205 | ITB bajon=46 | p |
|---|---|---|---|
| Glucemia basal, media ± DE | 142,4 ± 37,5 | 147,2 ± 40,1 | NS |
| Creatinina sérica, media ± DE | 0,88 ± 0,49 | 0,92 ± 0,28 | NS |
| Creatinina, n (%) | |||
| Normal | 183 (83,6) | 36 (16,4) | 0,043 |
| Alterada | 22 (68,7) | 10 (31,3) | |
| Ácido úrico, media ± DE | 5,3 ± 1,5 | 5,5 ± 1,4 | NS |
| Triglicéridos, media ± DE | 149,9 ± 81,3 | 149,7 ± 69,3 | NS |
| Colesterol total, media ± DE | 176,8 ± 35,4 | 171,8 ± 26 | NS |
| HDL colesterol, media ± DE | 49,2 ± 12,8 | 48,5 ± 13,7 | NS |
| LDL colesterol, media ± DE | 100 ± 30,5 | 96,2 ± 20,2 | NS |
| Proteína C reactiva, media ± DE | 0,4 ± 0,58 | 0,4 ± 0,76 | NS |
| Hemoglobina glucosilada, media ± DE | 7,1 ± 1,18 | 7,1 ± 1,26 | NS |
| Homocisteína, media ± DE | 2,09 ± 0,8 | 2,11 ± 0,6 | NS |
| MDRD, media ± DE | 81,6 ± 21,8 | 77,3 ± 25 | NS |
| Microalbuminuria, media ± DE | 29,5 ± 102 | 42,6 ± 114 | NS |
| Orina: albúmina/creatinina, media ± DE | 37,6 ± 136 | 85,4 ± 320 | NS |
DE: desviación estándar; HDL: high density lipoprotein; ITB: índice tobillo-brazo; LDL: low density lipoprotein; MDRD: modification of diet in renal disease; NS: no significativa.
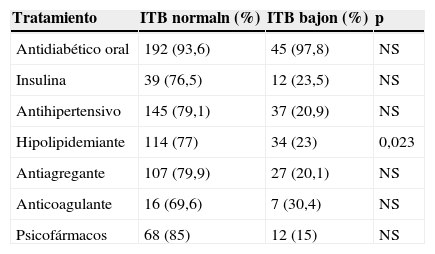
Tratamientos farmacológicos de los pacientes según el ITB
| Tratamiento | ITB normaln (%) | ITB bajon (%) | p |
|---|---|---|---|
| Antidiabético oral | 192 (93,6) | 45 (97,8) | NS |
| Insulina | 39 (76,5) | 12 (23,5) | NS |
| Antihipertensivo | 145 (79,1) | 37 (20,9) | NS |
| Hipolipidemiante | 114 (77) | 34 (23) | 0,023 |
| Antiagregante | 107 (79,9) | 27 (20,1) | NS |
| Anticoagulante | 16 (69,6) | 7 (30,4) | NS |
| Psicofármacos | 68 (85) | 12 (15) | NS |
ITB: índice tobillo-brazo; NS: no significativa.
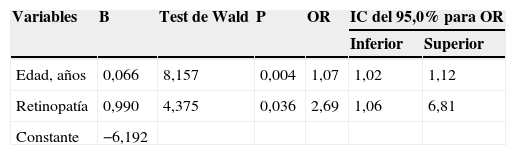
Los factores que se vieron asociados finalmente con un ITB bajo mediante análisis multivariado (tabla 6) fueron: la edad (OR=1,07; IC del 95%, 1,02-1,12) y la presencia de retinopatía (OR=2,69; IC del 95%, 1,06-6,81).
Variables asociadas a un ITB bajo mediante análisis multivariado
| Variables | B | Test de Wald | P | OR | IC del 95,0% para OR | |
|---|---|---|---|---|---|---|
| Inferior | Superior | |||||
| Edad, años | 0,066 | 8,157 | 0,004 | 1,07 | 1,02 | 1,12 |
| Retinopatía | 0,990 | 4,375 | 0,036 | 2,69 | 1,06 | 6,81 |
| Constante | −6,192 | |||||
Variables independientes contempladas en el modelo máximo: edad, sexo, estado civil, nivel de estudios, antecedentes familiares de DM2, presencia de DM, HTA, CI, ECV, dislipidemia, retinopatía, nefropatía, neuropatía, síndrome metabólico, tabaquismo, tratamientos con ADO, insulina o antihipertensivos, IMC, cintura, niveles de glucemia, creatinina, ácido úrico, triglicéridos, colesterol total, LDL, HDL, HBA1, microalbuminuria, cociente albúmina-creatinina, homocisteína. Variable dependiente: ITB bajo.
Test de Ómnibus: 12,849; p=0,002; test de bondad de ajuste de Hosmer-Lemeshow: 4,345; p=0,825.
IC del 95%: intervalo de confianza del 95%; ITB: índice tobillo-brazo; OR: odds ratio.
La prevalencia de EAP en pacientes DM2, diagnosticada por un ITB bajo, obtenida en el presente trabajo (18,32%) está en torno a la media reportada por otros estudios de nuestro país, realizados con el mismo tipo de pacientes y método diagnóstico; oscila desde un 11,3%10 hasta un 29%11, fluctuación debida a apreciables diferencias en cuanto a la edad, sexo y tiempo de evolución de la diabetes. Los porcentajes pueden ser marcadamente más elevados cuando el ITB se ha realizado en consultas especializadas, con resultados superiores al 37%14,15.
De nuestros pacientes, solo 6 (2,4%) estaban diagnosticados previamente de EAP, porcentaje inferior al publicado en 1998 por Bundó et al.16, que fue del 6,9%; un trabajo del 2014, realizado en nuestro país, muestra que de 443 historias clínicas de pacientes con DM, solo al 10,1% se le realizó el ITB17; en otro estudio llevado a cabo en todo Estados Unidos, también en AP2, se refleja que casi el 70% de los facultativos nunca usan el ITB en su práctica habitual; esto manifiesta la poca relevancia que se da a esta macroangiopatía y justifica su elevado infradiagnóstico.
En numerosos trabajos la edad aparece como el marcador de riesgo más significativo de desarrollar EAP; en nuestro estudio, también se observa y lo mismo ocurre en relación con los años de evolución de la DM210,18-21. Mostaza et al.21 obtuvieron un incremento del 31% en la prevalencia de ITB bajo por cada 5 años más de edad y que el riesgo de presentarlo era un 76% mayor cuando la duración de la DM2 excedía los 10 años. No hemos obtenido diferencias por el género y, a este respecto, hay resultados discrepantes, ya que para unos autores4,19,20 es similar y para otros es significativamente más prevalente en los varones con DM210. La asociación observada en nuestro trabajo entre ITB bajo y un bajo nivel de estudios está en consonancia con la relación entre la prevalencia de la DM2 conocida en España y el nivel de estudios de la población, así como con la estrecha vinculación de los factores socioeconómicos, principalmente el nivel educativo, con el desarrollo de los FRCV22,23. Nuestra muestra recoge un porcentaje de pacientes sin estudios muy elevado (59%) y los niveles educativos bajos se correspondían con aquellos de más edad, por lo que es una variable cuyos efectos no pueden considerarse independientemente de esta; no obstante, este fenómeno fue controlado mediante análisis multivariado.
Entre los pacientes con DM2, el papel que desempeñan los FRCV tradicionales en el desarrollo de EAP varía de unos a otros estudios. En el nuestro no se halló relación estadística con el consumo de tabaco, coincidiendo con otros autores10; sin embargo, está claramente establecido que el hábito tabáquico es el factor de riesgo modificable más importante para el desarrollo y exacerbación de EAP3,4; aquí, igualmente, el factor etario puede estar influyendo en estos resultados, ya que nuestros pacientes fumadores tenían un promedio de edad de 59,8 años frente a los 70 años de los que no fuman (p<0,001); así mismo pueden estar influyendo el tamaño muestral y el carácter transversal y no longitudinal del estudio, lo que impide saber qué factores de riesgo y desde cuándo preceden a la aparición de la EAP.
No hemos obtenido diferencias significativas en relación con el perfil lipídico; estos resultados se dan también en numerosos estudios21,24,25; en nuestro caso, creemos que el hecho de que un gran número de pacientes (58,9%) estén tratados con hipolipidemiante interfiere con la posibilidad de establecer una asociación; esta tampoco aparece cuando tenemos en cuenta el diagnóstico previo de cualquier tipo de dislipidemia; sin embargo, sí la establecemos cuando contemplamos únicamente el hecho de si están o no con dicho tratamiento. Esta posible discrepancia puede deberse a un sesgo por ausencia de datos de los diagnósticos de dislipidemia, cosa que no ocurre con los tratamientos, que sí quedan registrados en el historial farmacológico digital del paciente en prácticamente la totalidad de los casos.
Tampoco hemos hallado asociación con la hipertensión arterial o estar en tratamiento antihipertensivo, aunque esta enfermedad se ha visto relacionada frecuentemente con un ITB bajo26; probablemente el hecho de su alta prevalencia (72% de nuestros pacientes) impida que podamos considerarlo como un factor relevante. Los mismos resultados y razonamientos podemos exponer en relación con el síndrome metabólico20,21,27.
Son numerosos los trabajos que documentan una asociación positiva entre un inadecuado control glucémico y EAP20,28. Nosotros no hemos encontrado diferencias según el nivel de control de la DM2 ni tampoco con el hecho de estar o no en tratamiento con insulina, como posible marcador de un estado evolutivo más avanzado de la enfermedad; estos resultados, probablemente se deban también al carácter transversal del estudio.
Cuando hemos analizado la cardiopatía isquémica y la enfermedad cerebrovascular conjuntamente, obtuvimos significación estadística (p=0,043) que no se mantenía al estudiarlas por separado. En un metaanálisis del 200529, que incluía 7 estudios con un total de 28.679 sujetos de la población general, se estimó una especificidad de ITB bajo para coronariopatía, enfermedad cerebrovascular y mortalidad cardiovascular del 92,7, el 92,2 y el 87,9%, respectivamente.
En relación con las complicaciones microvasculares de la DM2, hemos hallado asociación únicamente con la retinopatía, lo que ya había sido puesto de manifiesto en otros trabajos26,30, en los que además hallan relación con la neuropatía; en el estudio de Mostaza et al.21, esta asociación desaparecía cuando el ajuste se hacía por la edad y la duración de la diabetes. Entre los parámetros de función renal estudiados, únicamente se encontró relación con un ITB bajo la creatinina elevada en sangre. Wu et al.31 obtuvieron una fuerte asociación entre una función renal anormal (GFR < 60 ml−1 min 1,73 m−2) y EAP (ITB < 0,9 o > 1,4) en los individuos con diabetes (OR=2,3), y solo en ellos el cociente albúmina/creatinina en orina (ratio ≥ 30 mg/g−1) sí se asociaba independientemente a la EAP (OR=1,87). La creatinina plasmática quizás haya que valorarla separadamente del resto de los parámetros renales, ya que está afectada por distintas fuentes de variabilidad biológica, múltiples interferencias analíticas e importantes problemas de estandarización32; por todo esto, cabe plantear la posible existencia de un problema de fiabilidad.
Este estudio presenta algunas limitaciones o posibles sesgos que conviene considerar para valorar cómo afectaron a los resultados. Dado el alto porcentaje finalmente incluidos en el estudio (81,2%) de los potencialmente reclutables, creemos que no se ha producido un sesgo de selección que afecte a la representatividad de la población de estudio; no obstante, el hecho de que el ámbito poblacional estudiado se haya ceñido a los pacientes con DM2 registrados en un centro de salud rural hace que la extrapolación de los resultados a la población diana se vea limitada. Por otro lado, con la utilización de la historia clínica como fuente de información, se corre el riesgo de sesgos de información por ausencia de datos; con el fin de evitarlo, completamos los datos a recoger con los aportados por los pacientes a través de la entrevista clínica. Finalmente, y a la hora de hallar asociaciones entre factores de riesgo y EAP, es preciso asumir las limitaciones propias de los estudios de carácter transversal.
ConclusiónSe constata el hecho de que la EAP se encuentra aún muy infradiagnosticada en el ámbito de la AP, a pesar de la elevada prevalencia de ITB bajo en pacientes DM2, especialmente entre los de más edad, nivel socioeducativo inferior, mayor tiempo de evolución de la DM2 y presencia de arteriosclerosis en otros territorios vasculares. Su cribado sistemático en esta población llevaría a identificar a más individuos de alto riesgo candidatos a un control más intenso de sus FRCV y a una búsqueda activa de enfermedad vascular en otros territorios, lo que es especialmente relevante en relación con la enfermedad coronaria, que en estos pacientes es frecuentemente oligosintomática; también permitiría mejorar su calidad de vida y reducir la discapacidad4. Por todo esto, recomendamos el uso de esta sencilla exploración en las consultas de AP, ya que no requiere equipamiento o habilidades especiales, es bien aceptada por los pacientes, aplicable a sujetos de cualquier edad y sin riesgos para estos. Los estudios a realizar deberían centrarse en comprobar y cuantificar el efecto causal y/o predictor de determinados factores, utilizando para ello diseños longitudinales, ya sean retrospectivos (casos y controles) o prospectivos (estudios de cohortes).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal facultativo y de enfermería que ha participado en la medición del ITB: M.J. Ramírez Campos, I. Alcaide Aguilar, A. Carmona López, M. Hidalgo Rodríguez, M.C. Mañas González, R. Martos García, A. Molina Moreno, F. Moral Moreno, A. Osuna Guerrero y J.M. Urraco Ruda.