Los criterios para introducir modificaciones en el calendario de vacunación dependen de la enfermedad (carga, frecuencia, morbimortalidad, potencial de eliminación), de la vacuna (inmunogenicidad, eficacia, efectividad, eficiencia, compatibilidad, seguridad y garantía de suministro) y de la sociedad (impacto sobre la población y el sistema sanitario, percepción de la enfermedad por la población).
En España existen 19 calendarios diferentes que no se justifica desde un punto de vista sanitario, epidemiológico, social o económico.
La Asociación Española de Pediatría recomienda vacunar: frente rotavirus a partir de las sexta semana, frente a papilomavirus en niñas preadolescentes, universalizar la vacuna antineumocócica, administrar una segunda dosis de varicela a los 3-4 años, cambiar indicaciones de la vacuna de la tos ferina y vacunar de gripe y hepatitis A en situaciones de riesgo.
Repasaremos más detenidamente las vacunas que han sido recientemente introducidas: rotavirus, neumococo, papiloma y mentaremos los principales cambios en las ya existentes.
The criteria for modifying the immunization schedule depends on the disease (load, frequency, morbidity and mortality, killing potential) of the vaccine (immunogenicity, efficacy, effectiveness, efficiency, compatibility, safety and assurance of supply) and society (impact on the population and the health system, perception of disease in the population).
In Spain there are 19 different vaccine schedules that are not justified from a health, epidemiological, social or economic perspective.
The Spanish Association of Paediatrics recommends: vaccinating against rotavirus from the sixth week, against papillomavirus in preadolescent girls, achieving universal pneumococcal protection, administering a second dose of varicella at 3-4 years, changing the indications of the pertussis vaccine and flu vaccine and hepatitis A risk.
We will review further the vaccines that have recently been introduced: rotavirus, pneumococcus and papillomavirus and mention the major changes in existing ones.
Los calendarios vacunales son las secuencias cronológicas de vacunas que se administran sistemáticamente en un área geográfica; su fin es obtener una inmunización adecuada en la población frente a las enfermedades para las que se dispone de una vacuna eficaz.
Un calendario vacunal debe ser eficaz, seguro, sencillo, aceptado, unificado y actualizado.
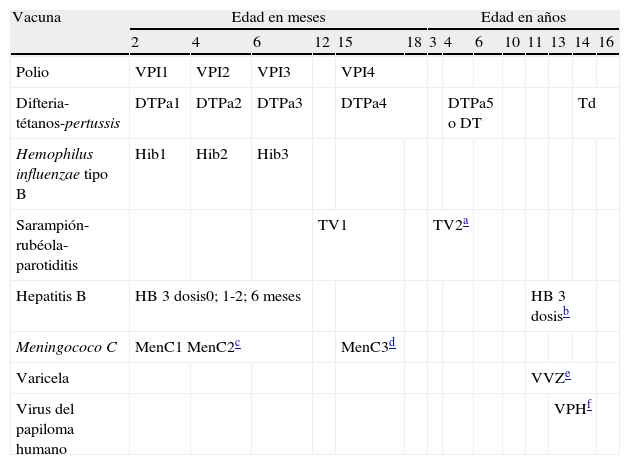
Las vacunas sistemáticas son las que se administran de forma rutinaria a todos los niños de acuerdo al calendario vacunal que se encuentre vigente. Las vacunas sistemáticas en toda España desde el nacimiento son las recogidas en la tabla 11.
Consejo interterritorial del sistema nacional de salud calendario de vacunaciones recomendado (2007)
| Vacuna | Edad en meses | Edad en años | ||||||||||||
| 2 | 4 | 6 | 12 | 15 | 18 | 3 | 4 | 6 | 10 | 11 | 13 | 14 | 16 | |
| Polio | VPI1 | VPI2 | VPI3 | VPI4 | ||||||||||
| Difteria-tétanos-pertussis | DTPa1 | DTPa2 | DTPa3 | DTPa4 | DTPa5 o DT | Td | ||||||||
| Hemophilus influenzae tipo B | Hib1 | Hib2 | Hib3 | |||||||||||
| Sarampión-rubéola-parotiditis | TV1 | TV2a | ||||||||||||
| Hepatitis B | HB 3 dosis0; 1-2; 6 meses | HB 3 dosisb | ||||||||||||
| Meningococo C | MenC1 MenC2c | MenC3d | ||||||||||||
| Varicela | VVZe | |||||||||||||
| Virus del papiloma humano | VPHf | |||||||||||||
Aprobado por el Consejo Interterritorial el 10 de octubre de 2007.
En la tabla 2 se reseñan las diferencias más significativas entre los distintos calendarios vacunales regionales, para consultar específicamente cada calendario remitimos al Comité Asesor de Vacunas2.
Diferencias reseñables entre los calendarios vacunales de las distintas comunidades autónomas españolas
| Difteria-tétanos-tos ferina | Ceuta, Melilla, Madrid dTpa a los 14 años, Td en el resto del territorioValencia dTpa a los 6 añosMadrid 5adosis dTpa a los 4 años |
| Triple vírica | País Vasco, Cataluña, Melilla y Madrid 1.adosis a los 12 meses. Resto 15 mesesSegún comunidad 2.adosis a los 3, 4 ó 6 años |
| Hepatitis B | Comunidades con vacuna hexavalente y 1.adosis al nacer, en total se ponen 4 dosisHay comunidades con 1.adosis al nacer, 2.aal mes y 3.aa los 6 meses. Otras con vacunación a los 2-4-6 meses |
| Se están generalizando las vacunas hexavalentes pero en algunas comunidades se coadministra pentavalente y HB | |
| Varicela | Madrid, Navarra, Ceuta y Melilla 2.° año de vida. Resto entre los 10-12 añosNavarra 2 dosis |
| Hepatitis A | Cataluña 12 años, Ceuta 2 años y Melilla 18 meses; vacunación universal |
| Tuberculosis, BCG | País Vasco, al nacimiento |
| Neumococo conjugada | Madrid |
La Asociación Española de Pediatría (AEP) aconseja, frente a la propuesta del Consejo Interterritorial del Sistema Nacional de Salud, además:
- •
Vacunar sistemáticamente:
- ∘
De neumococo.
- ∘
Tdpa en vez de Td en los adolescentes.
- ∘
- •
Sería recomendable incluir:
- ∘
Rotavirus en lactantes.
- ∘
Administrar 2 dosis de varicela (a los 12-15 meses la primera dosis y la segunda a los 3-4 años).
- ∘
- •
En grupos de riesgo debería vacunarse de:
- ∘
Anualmente de gripe.
- ∘
Poner 2 dosis de HA.
- ∘
Es la principal causa de diarrea infantil grave en todo el mundo, se asocia a un mayor riesgo de deshidratación que la producida por otros microorganismos, sobre todo entre los 6-24 meses de edad, en los países en desarrollo es entre los 2-5 meses. Muestra una alta incidencia de infecciones repetidas en los 2 primeros años de vida, va disminuyendo la gravedad del cuadro con el mayor número de reinfecciones. Afecta prácticamente a todos antes de los 5 años, el 50% deben ser asintomáticos pero contagiosos. En Europa, anualmente, se estima que causa 231 muertes de 3,6 millones de episodios, 87.000 hospitalizaciones y unas 700.000 visitas médicas; el 6-11% de las hospitalizaciones en menores de 5 años son por gastroenteritis aguda y un 40% de ellas son por rotavirus3. El coste total social (incluyendo gastos directos médicos, directos no médicos e indirectos) por episodio es de 166-473 € en el ámbito de la atención primaria; de 334-770 € en el servicio de urgencias; y de 1.525-2.101 € en el hospital4.
El único reservorio es el humano. La transmisión es feco-oral. En las manos sobrevive 4 h, en objetos hasta días. El período de incubación es de 24 a 72 h, con máxima eliminación a los 2-5 días tras el inicio de la diarrea que persiste hasta 10 días (más si es grave)5.
Actualmente se conocen 7 grupos A-G de rotavirus, según la proteína VP6 de la cápside media; las proteínas VP7 y VP4 de la cubierta externa que generan respuesta inmunitaria específica protectora; VP7 designa al serotipo G; VP4 determina la especificidad de tipo P (hay 15 tipos de G y al menos 26 tipos de P). El A es el principal responsable de enfermedad en humanos (90%). Las asociaciones predominantes son G1, 3 y 4 con P[8], G2 con P[4] y G9 con P[8] y P[6]. El B ha sido reconocido en epidemias en adultos, el C se ha detectado en casos de diarrea aguda esporádica infantil5. La distribución mundial de los serotipos es variable y en una misma zona varía de una estación a otra. Dentro del serogrupo A los más prevalentes son el G1, G2, G3, G4 y G96. En España, de 1996 a 2006 en niños hospitalizados menores de 5 años, el principal fue el G1 (En el 2005 fue el G9)7.
La vacunación es la única estrategia con posibilidad de impacto en la prevención de la enfermedad. En el desarrollo e investigación de vacunas se ha dirigido hacia el serogrupo A. Todas las vacunas autorizadas y en estudio son de virus vivos atenuados para administración oral.
La primera vacuna autorizada, en Estados Unidos, fue en 1998 RotaShield®, con 3 cepas procedentes del reordenamiento genético entre rotavirus del mono Rhesus y humanos; un año después se suspendió por un aumento en el riesgo de invaginación intestinal (el 90% de los casos se produjo cuando la primera dosis de vacuna se administró pasados los 3 meses de edad). Se han seguido diferentes estrategias para el desarrollo de vacunas, usar virus de animales, atenuar los de los seres humanos y actualmente se estudian los rotavirus de neonatos asintomáticos5.
La vacuna que actualmente se puede encontrar en España (marzo de 2011)a es una vacuna pentavalente resortante de rotavirus bovino-humano, comercializada como RotaTeq®11. La cepa donante es la cepa de rotavirus bovino WC3 y contiene 5 cepas que expresan en superficie VP7 de los rotavirus humanos de los serotipos G1, G2, G3 y G4 y la proteína VP4 del rotavirus humano correspondiente al genotipo P[8]. Es una vacuna que sería, en términos generales, de administración universal en 3 dosis por vía oral. La primera dosis se administrará entre las 6 y las 12 semanas de vida, la segunda y la tercera separadas de 4 a 10 semanas, edad máxima tercera dosis de 26 semanas. Se puede coadministrar con otras vacunas incluidas en el calendario o con cualquier intervalo con ellas. No hay cambios en prematuros mayores de 25 semanas. Los estudios pivotales han sido en 68.038 lactantes de Estados Unidos, Finlandia, Alemania, Bélgica y Sucia; de nivel medio-alto; en estos estudios la invaginación intestinal y otros efectos secundarios fueron similares a los que se administró placebo (algo más de fiebre, vómitos, diarrea e infecciones respiratorias)11. Disminuye la hospitalización por rotavirus en un 96% y la gastroenteritis grave en el 98%.
La OMS recomienda la introducción de la vacuna en todos los programas nacionales, especialmente donde la diarrea suponga más del 10% de la mortalidad en menores de 5 años. Bélgica, Luxemburgo, Finlandia y Austria tienen incluida la vacunación en calendarios con distintas financiaciones.
Están contraindicadas en historia previa de invaginación, inmunodeficiencia (incluido el VIH asintomático) y debe tenerse precaución con contactos estrechos con inmunodeprimidos y embarazadas, además de las generales o enfermedad relacionadas con hidratos de carbono.
Hay en estudio otras vacunas: tetravalentes bovinas-humanas (en Estados Unidos), con cepas neonatales, menos virulentas (en India, Australia). Se ha planteado la encapsulación de partículas víricas, el uso de la vía intranasal, las partículas sin ARN o con ADN plasmídico que codifique proteínas víricas específicas5.
NeumococoSe conocen 92 serotipos de neumococos potencialmente causantes de enfermedad precedida de una colonización nasofaríngea asintomática de más o menos duración12. El único reservorio conocido es el hombre. La edad de mayor colonización, por tanto de mayor contagiosidad, y mayor grado de enfermedad es del mes a los 5 años de edad. Aunque prácticamente todos los niños en algún momento tienen neumococos en su nasofaringe, muy pocos desarrollan la enfermedad. La carga de enfermedad es mucho mayor en los países en vías de desarrollo (100-500 casos/100.000 menores de 5 años, frente a 8-75 en países desarrollados, anualmente). Los serotipos varían poco de una región a otra13 pero sí varía el tipo de colonización con la edad14. En adultos el 60-87% de los casos de bacteriemia se asocian a neumonía; en los menores de 3 años lo más frecuente es la bacteriemia oculta sin foco. La forma más letal es la meningitis. Las infecciones virales facilitan la adhesión de los neumococos a la nasofaringe. Hay más colonización en relación con el mayor hacinamiento, la asistencia a guardería, el tabaquismo o la etnia; también hay más prevalencia si se han tomado antibióticos. Asimismo existe variabilidad en el tiempo. Donde mayores resistencias a antibióticos adquieren los neumococos es en la nasofaringe del niño sano (por los antibióticos y por la transmisión de material genético entre cepas). Las cepas más invasivas (1, 5 o 7F) son difíciles de encontrar en la nasofaringe y también, por ello, son más sensibles a los antibióticos14. Los serotipos menos invasivos y portados durante mayor tiempo suelen infectar a pacientes con mayor comorbilidad, con enfermedad más grave y mayor mortalidad.
Los serotipos incluidos en la vacuna conjugada heptavalente (VNC7) eran los más frecuentes en portadores sanos antes de la era vacunal.
Se ha propuesto clasificarlos15 en los que producen enfermedad invasiva por neumococo (ENI) y están muy relacionados «clonalmente® (1, 4, 7F y 9V) y los que la causan pero son genéticamente más variados (6A, 6B, 14 y 19F).
Algunos neumococos parecen tener «predisposición» a producir una ENI concreta o afectar a un grupo etario14: el serotipo 1, neumonía con empiema en mayor de 2 años; los 6, 10 y 23, meningitis; en menores de 5 años son especialmente incidentes los serotipos 1, 3, 5, 7F y 19A (más a raíz de la introducción de VNC7 que no los incluía); el 19A es el más frecuente en menores de 2 años y multirresistente; el 3 produce neumonías necrosantes, y el 5, epidemias locales. En ancianos, sin mucha diferencia geográfica, la mayor incidencia es con 6B, 8, 14 y 23F.
Los que mayor resistencias han tenido han sido 6A, 6B, 9V, 14, 19A, 19F y 23F16; el más llamativo es en el 19A. En España con datos del Laboratorio de Referencia de Neumococos del Instituto de Salud Carlos III, en 1979 la resistencia era de un 6%, se llegó a un máximo del 45% en 1995-1997 que empieza a declinar con un uso más racional de antibióticos y es mayor a partir de 2002 coincidiendo con la introducción de la vacuna, hasta el 22,3% en 2008. Estudios de este mismo centro muestran cómo ha disminuido el porcentaje de cepas resistentes a la penicilina: 6B, 9V, 19F y 23F, mientras el serotipo 14 sigue estable; además han aumentado otros serotipos no incluidos en VNC7, 19A y 24F.
Antes de la llegada de la VNC7 se estimaba que en España cubriría un 74% de los ENI17. Los serotipos que se encontraban eran 14, 19F, 6B, 23F, 6A, 19A, 18C y 9V; en niños de 2 a 5 años 1, 6B, 19F, 23F, 6A y 9V. Un estudio18 encontró en 1999 que el 36% de los niños españoles estudiados eran portadores, el 44,5% de ellos no tipificables, un 27,3% lo eran de cepas incluidas en VNC7. En España los serotipos que actualmente producen la mayoría de las ENI en niños son: 19A, 1, 6A, 7F, 5, 3, 24F, 15 de los vacunales persiste el 14.
La vacunación generalizada con vacuna neumocócica conjugada heptavalente, VNC7, Prevenar® (disponible desde 2001) ha demostrado efectividad para disminuir las ENI. Además, confiere inmunidad de grupo. Gracias a esto la carga total de ENI es sensiblemente inferior que en la era prevacunal. Han disminuido los portadores sanos menores de 5 años de los serotipos incluidos en la vacuna.
Han aumentado los ingresos por neumonía con empiema, como en otros muchos países desde la introducción de la vacuna; solo un 11% fueron por serotipos incluidos en VNC7. El mayor incremento ha sido con el 19A y el 5. El ascenso del 1 y 19A viene ocurriendo desde antes de introducir la vacuna y el 3 se ha mantenido estable.
Se han autorizado 2 nuevas vacunas conjugadas neumocócicas19 VNC10 (Synflorix®) y VNC13 (Prevenar 13®); esta última es por la que actualmente está incluida en el calendario vacunal de Madrid20. Incluyen serotipos que apenas colonizan nasofaringe, por tanto no producirán aumento de la inmunidad de grupo (no eliminará portadores como hizo VNP7 y provocó disminución de carga de enfermedad en ancianos).
La vacunación con vacunas conjugadas no obvia la administración de VNP23 (vacuna neumocócica de 23 polisacáridos) que sigue estando indicada en niños de riesgo mayores de 24 meses, se administrará, al menos, 8 semanas después de la última conjugada.
La técnica de conjugación parece soportar la inclusión de mayor número de serotipos, por ellos se investigan vacunas con dianas diferentes a los polisacáridos capsulares. Parece que la vacuna ideal sea la que evite la colonización (tabla 3).
Composición de las vacunas antineumocócicas
| Vacuna | Antígenos que contiene la vacuna |
| VNC7 | 4,6B, 9V, 14, 18C, 19F, 23F |
| VNC10 | 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F |
| VNC13 | 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 3, 4, 6A, 7F, 19A |
| VNP23 | 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F |
Son virus ubicuos, epiteliotropos y específicos de seres humanos. Causan la enfermedad de transmisión sexual más frecuente. Se conocen 200 genotipos, 40 de ellos infectivos, 15 con riesgo oncogénico: el 16 y 18 causan el 70% de los carcinomas escamosos y 85% de los adenocarcinomas cervicales, el VPH45 causa el 10,5% de los adenocarcinomas, seguidos del 31 y 33. Los VPH6 y 11 causan el 90% de los condilomas acuminados21.
La prevalencia de infección por VPH en España es de las más bajas (3-17%), con una incidencia anual de cáncer de cérvix de 8 al 13 por 100.000 mujeres. Los genotipos detectados son el VPH16 y VPH18 y una tasa de fallecimientos alrededor de 750/año.
La infección está confinada a la célula epitelial, no hay viremia y no desencadena la inmunidad adaptativa, porque no se accede a los ganglios linfáticos para activar linfocitos Th. En el 50% de las mujeres infectadas no se detectan anticuerpos y por tanto no hay protección frente a reinfección aunque sea el mismo genotipo. La protección local adquirida es por IgG específicos y no IgA. En más del 80% de las mujeres se aclara espontáneamente la infección22,23.
Las vacunas disponibles son intramusculares con lo que inducen respuesta inmunitaria más potente que la infección natural porque el antígeno vacunal (L1) es captado por la célula presentadora del músculo y llevado al ganglio linfático, efecto potenciado por el adyuvante24.
Hay 2 vacunas disponibles:
- •
Gardasil®, tetravalente (VPH16, 18, 6, 11). Aprobada por la EMEA (Agencia Europea del Medicamento) en 2006. Fabricada con la inserción de los genes seleccionados en el genoma de una levadura. Como adyuvante contiene hidrofosfato, sulfato de aluminio amorfo. Está indicada para prevenir el carcinoma cervical, las lesiones vulvares de alto grado y las verrugas genitales, basadas en la eficacia en mujeres de 16-26 años e inmunogenicidad en niños y adolescentes de 9-15 años. La primovacunación son 3 dosis: a los 0, 2 y 6 meses. No interfieren anticonceptivos hormonales. Es compatible con vacuna frente a hepatitis B (HB), Tdap y meningococo C (MenC). Es por la que ha optado el ministerio de Salud y Consumo.
- •
Cervarix®, bivalente (VPH16, 18). Aprobada por la EMEA 2007. Usan plásmido que las introducen en un insecto que lo lleva como vector a su huésped natural. Su adyuvante es el AS04, reconocido por los TLR4, que genera IgG1 y linfocitos B de memoria. Indicada en la prevención de la neoplasia cervical basada en datos de eficacia en mujeres de 15-25 años e inmunigenicidad en niñas y mujeres de 10-25 años. Primovacunación con tres dosis: a los 0, 1 y 6 meses.
Las proteínas una vez sintetizadas, extraídas y purificadas tienen la particularidad de autoensamblarse dando lugar a las VLP (partículas similares al virus), pero sin su ADN.
Las fichas técnicas no explicitan un tope máximo de edad para la vacunación. No ha sido evaluada en varones.
En la valoración clínica la OMS ha aceptado como marcadores subrogados la infección persistente por VPH y el carcinoma in situ (CIN) II/III (por imposibilidad metodológica y ética de usar el cáncer).
Tos ferinaNo se dispone de vacunas monovalentes frente a tosferina ni frente a difteria. Se dispone de:
- •
Vacuna monovalente con toxoide tetánico.
- •
Vacuna bivalente con toxoide diftérico tipo infantil (DT) o tipo adulto (dT)
- •
Trivalentes: difteria, tétanos, tos ferina (DTP o triple bacteriana), de células enteras (DTPe) o acelular (DTPa y dTpa según el toxoide diftérico sea tipo infantil o adulto con componente antigénico reducido o no de Bordetella pertussis).
- •
Tetravalentes: DTPe o DTPa con vacunas Haemophilus influenzae tipo B (Hib), HB o VPI (polio inyectable).
- •
Pentavalentes: DTPa con Hib, HB o VPI.
- •
Hexavalente: DTPa con Hib, HB y VPI.
La vacuna DTPa podría sustituirse a partir de los 5 años por Tdpa en dosis de refuerzo. La AEP continúa recomendando la vacuna DTPa para la 5.ª dosis, al tiempo que considera que si se vacuna con Tdpa como 5.ª dosis debería ir acompañada de una 6.ª dosis de la misma vacuna en la adolescencia. Debido a que la inmunidad de la vacuna antitos ferina es de corta duración hay más notificaciones de tos ferina en adultos jóvenes (clínica de tos irritativa prolongada) y son reservorio para lactantes susceptibles. Podría ser adecuado cambiar en los calendarios sistemáticos la Td de adolescentes por Tdpa, especialmente los que por su trabajo tienen contacto con lactantes.
En España, desde 2009, se recomienda para completar el calendario una dosis frente al tétanos y la difteria entre los 13 y 16 años y la administración de una única dosis de recuerdo en torno a los 60 años. En heridas tetanogénicas o no vacunados no hay cambios sustanciales25.
Otras apreciaciones sobre las demás vacunas sistemáticas en España- •
Varicela. El Comité de Expertos Asesor de Vacunas de la Comunidad de Madrid en 2008 determinó: vacunar contra la varicela a los niños de 15 meses que pudieran haberla padecido antes de cumplir un año de edad26.
- •
Haemophilus influenzae tipo B. Desde la introducción de la vacuna, en 1998, se ha podido constatar la práctica desaparición de enfermedad invasiva por este germen en todo Occidente.
- •
Gripe y hepatitis A. Sería recomendable vacunar en situaciones de riesgo, como primer paso para una futura recomendación universal.
- •
Poliomielitis. En 2004 se cambió la vacunación oral por la intramuscular. Cuando en una región se erradica la circulación del virus salvaje, el riesgo de presentar la enfermedad por un virus importado es menor que el riesgo de presentarla por los virus atenuados de la vacuna, ya que los virus vacunales pueden permanecer años en las heces de los inmunodeprimidos y muy largos períodos de tiempo en aguas residuales. Para considerar erradicada la enfermedad no debe haber circulantes ni virus salvajes, ni atenuados.
- •
Meningococo C. La vacunación fue introducida en el año 2000 con la pauta de 3 dosis en los primeros 6 meses de vida, también se realizó una campaña de catch-up en los menores de 6 años en casi todas las comunidades, que se fue ampliando a los menores de 20 años. En el 2006 se cambia la pauta por la pérdida de eficacia de la vacuna en los que recibieron las dosis antes del año. En el momento actual se recomienda la vacunación a la cohorte no vacunada, nacida a partir de 1985, con una dosis.
- •
Hepatitis B. Está incluida en el calendario español desde los años 1990 sin que haya habido cambios reseñables en la última década. Salvo indicaciones en período neonatal, comentado en anterior artículo.
- •
Triple vírica. Se considera que los nacidos antes de 1956 son inmunes. Si hay sospecha, en mayor de 15 meses, de no haber presentado enfermedad o de vacunación incompleta sería recomendable vacunar (2 dosis separadas un mes) o completar la vacunación.
La descentralización sanitaria ha acarreado una incompresible e injustificable falta de unificación del calendario vacunal que va a recibir un niño en España según la comunidad autónoma donde nazca o donde se mude.
La universalización de la vacunación frente a rotavirus es la única estrategia con posibilidad de impacto en la prevención de la enfermedad. La ENI, en un porcentaje no despreciable, es una enfermedad grave; la VNC7ha dejado de ser coste-efectiva y hay actualmente mejores alternativas. El impacto de la vacunación contra papilomavirus en la reducción de la morbimortalidad se verá en décadas. Si se cambiase la vacunación de Td en adolescentes por Tdpa habría una menor incidencia de tos ferina, tan grave en lactantes y tan molesta en los adultos. Se puede mejorar la carga de enfermedad producida por varicela, gripe y HA revisando las actuales indicaciones de vacunación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota disponibilidad (abril 2.011) en nuestro medio de vacunas frente a rotavirus: en 2006, la EMA registró 2 vacunas, Rotarix® y Rotateq®. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) autorizó su comercialización en España en 2006. En marzo de 2010 se detectó en Rotarix® fragmentos de ADN de circovirus porcino tipo 1 y el tipo 2 en Rotateq®. En junio de 2010 el ministerio de Sanidad y Consumo8 notifica la falta de evidencia de que estos hallazgos sean un problema para los humanos y que Rotateq® no representa ningún problema de seguridad pero recomiendan no iniciar vacunación (no se menciona Rotarix®). En la nota también se especifica que el beneficio/riesgo puede ser distinto en otros países y referencia otra nota de la Food and Drug Administration (FDA)9. Días después se emite nota de consenso de múltiples sociedades científicas10 recomendando que tan pronto como sea posible se reinicie la vacunación.