El objetivo del presente artículo de revisión consiste en contextualizar los factores que intervienen en la resistencia farmacológica de los tumores del sistema nervioso central, más específicamente aquellos involucrados con el meduloblastoma y la resistencia que este genera contra el fármaco ciclofosfamida. Uno de los aspectos centrales es la hipoxia, la cual se vincula a la evasión de la apoptosis, un sello distintivo (hallmark) del cáncer —término del artículo de referencia escrito por los investigadores Hanahan y Weinberg (2011). La actividad proteica de algunos de las aldehídos deshidrogenasas y de los citocromos P450 es la que nos ha permitido comprender el entorno metabólico de los tumores sólidos y, por ende, cómo se genera el fenómeno de resistencia al fármaco. Se evidencia el empleo potencial de la isoforma aldehído deshidrogenasa 1A1 como un marcador tumoral avalado por estudios que se describen en el presente artículo.
The purpose of this review article is to set the factors involved in central nervous system tumors drug resistance in a context, more specifically those involving medulloblastoma and the resistance it generates against the drug cyclophosphamide. One central aspect is hypoxia, which is linked to apoptosis evasion, which is a “hallmark” of cancer – a term used in the reference paper written by researchers Hanahan & Weinberg (2011). Protein activity of some aldehyde dehydrogenases and cytochromes P450 are the elements that have allowed for the metabolic environment of solid tumors to be understood and, hence, the way the phenomenon of drug resistance is generated. The potential use of the aldehyde dehydrogenase 1A1 isoform as a tumor marker is demonstrated, endorsed by studies described in the body of this article.
La hipoxia y el cáncer han estado siempre vinculados. Los tumores se desarrollan en regiones hipóxicas donde los mecanismos de respuesta a las carencias de oxígeno son fundamentales en la progresión de la actividad tumoral1. Los niveles elevados de hipoxia son características típicas de los tumores sólidos, y las respuestas a la hipoxia contribuyen al fenotipo maligno2.
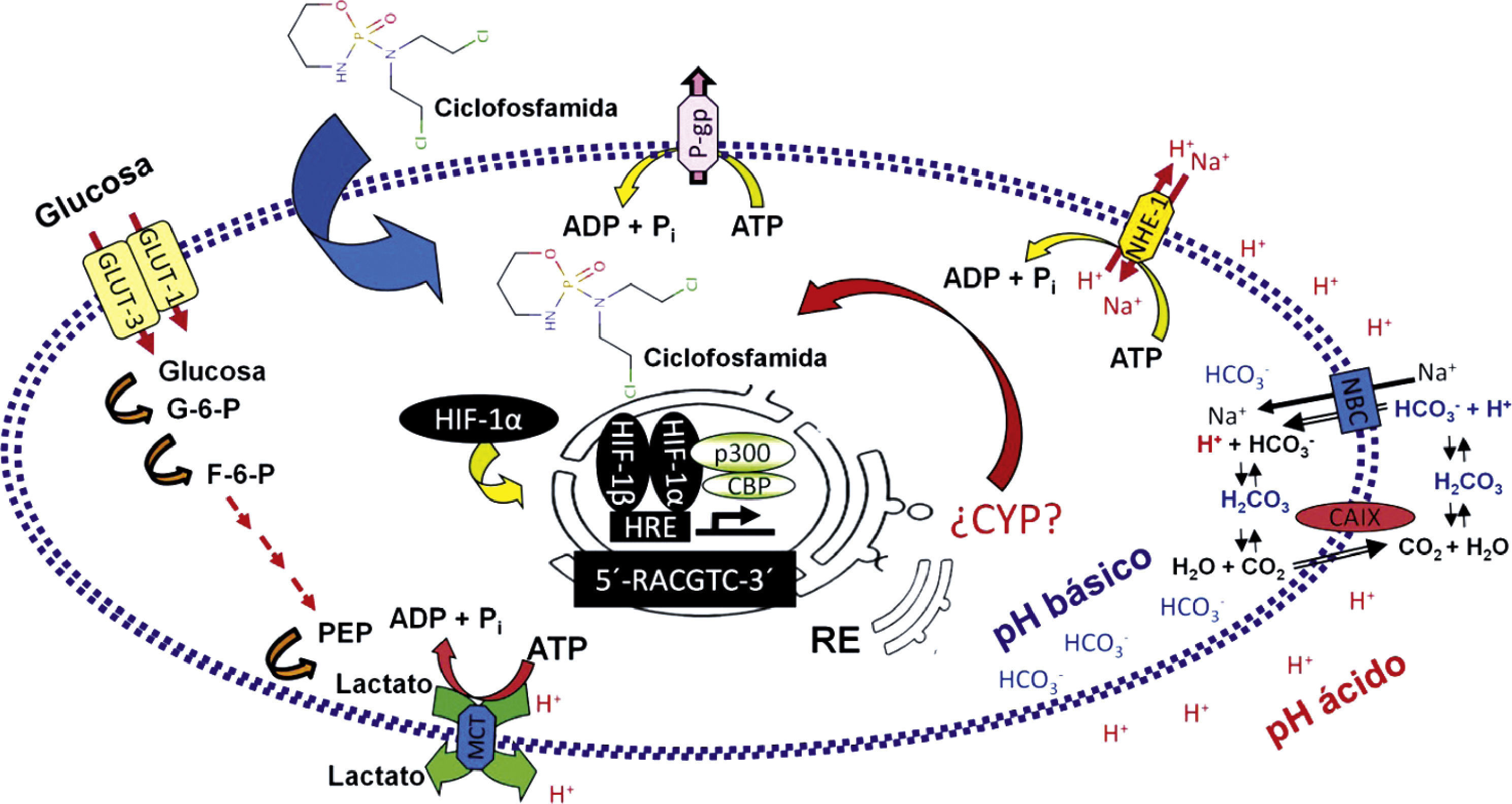
Asimismo, se ha documentado que los tumores presentan una tasa elevada de glucólisis, incluso cuando la concentración de oxígeno es favorable para la fosforilación oxidativa. El ritmo acelerado de incorporación de la glucosa en los tumores puede apreciarse empleando la tomografía de emisión de positrones después de la inoculación a los pacientes de glucosa radioactiva no metabolizable [fluor-18] 2-desoxi-2-fluoro-d-glucosa y la detección de su acumulación en tumores sólidos, lo cual, a su vez, es un factor predictivo de tumores agresivos3–5. En la figura 1 se ilustra el ambiente extra- e intracelular de la célula tumoral.
Factores de resistencia a fármacos antineoplásicos regulados por hipoxia. El factor por inducción de hipoxia —en particular su subunidad factor por inducción de hipoxia 1a— presente en el citosol, se estabiliza y es traslocado inmediatamente al núcleo, donde se heterodimeriza con otras proteínas y activa la maquinaria transcripcional para regular la expresión de diversos genes. Varios de estos codifican proteínas que son consideradas de resistencia farmacológica o participan en procesos que generan resistencia. Por ejemplo, la glucólisis puede conducir a incrementos en la síntesis y liberación de lactato. Asimismo, la hipoxia incrementa la expresión de proteínas relacionadas con la regulación del pH extracelular, como la anhidrasa carbónica y el antiporte de sodio-hidrógeno 1, lo cual es relevante para la resistencia, puesto que el pH puede limitar la entrada de ciertos fármacos a las células tumorales. De manera similar, proteínas importantes en la extrusión de fármacos en células tumorales, como la glucoproteína P, se encuentran sobreexpresadas. Un grupo de enzimas reconocidas entre las principales metabolizadoras de fármacos, los citocromos P450, también son consideradas mediadoras de resistencia farmacológica en varios tumores. Sin embargo, a la fecha no existen datos suficientes que demuestren que la hipoxia también modula la expresión de dichas enzimas.
ADP: adenosina difosfato; ATP: adenosina trifosfato; CAIX: anhidrasa carbónica; CBP: proteína de unión a CREB; CO2: dióxido de carbono; F-6-P: fructosa-6-fosfato; GLUT1: transportador de glucosa 1; GLUT3: transportador de glucosa 3; G-6-P: glucosa-6-fosfato; H+: hidrogenión; HIF-1a: factor por inducción de hipoxia 1a; H2CO3: ácido carbónico; H2O: agua; HCO3-– anión bicarbonato; HRE: elemento de respuesta a hormonas; MCT: transportadores de monocarboxilato; Na+: ion de sodio; NBC: cotransportador Na+/HCO3- NHE-1: antiporte de sodio-hidrógeno; p300: proteína de unión E1A p300; PEP: ácido fosfoenolpirúvico; Pi: fosfato inorgánico; P-gp: glucoproteína P; RE: retículo endoplasmático.
Adaptado por Valencia-Cervantes a partir de Brahimi-Horn y Pouysségur, 2009.
En este tenor, el presente artículo de revisión pretende retomar aspectos fundamentales de los elementos que se ven involucrados en la resistencia de algunos tumores del sistema nervioso central (SNC), aunque con un énfasis en el meduloblastoma que aqueja a pacientes pediátricos.
Asimismo, se revisará el papel de la aldehído deshidrogenasa (ALDH) más específicamente de la isoforma 1A1, de la cual, en trabajos de investigación recientes, se ha evidenciado su importancia a través de su expresión proteica como marcador de desarrollo del SNC en sus inicios, pero que sigue manteniendo un protagonismo similar, ahora como marcador tumoral y en algunos casos como determinante pronóstico.
Se espera que en un futuro no muy distante, los antecedentes aquí presentados funjan como una base de la cual se pueda partir y así, no solo aclarar los enigmas que rodean a los mecanismos fisiopatológicos de los cánceres del SNC, sino que también esto se pueda reflejar en alternativas de solución para mejores terapéuticas que eleven la calidad de vida de los pacientes en quienes el cáncer la ha mermado de manera creciente a su paso.
2MeduloblastomaEl meduloblastoma es uno de los tumores pediátricos más comunes. A pesar de que los tratamientos con diferentes modalidades mejoran la supervivencia, un tercio de los -pacientes con este tumor fallecen, además de que el tratamiento produce efectos a largo plazo. Con el descubrimiento de la desregulación presente en las vías de señalización celular, la cual se vincula directamente con el desarrollo del meduloblastoma, en la actualidad se emplean nuevas terapéuticas para abatirla a nivel molecular6.
3CiclofosfamidaCiclofosfamida es un agente alquilante de mostaza nitrogenada del grupo de las oxazoforinas. La ciclofosfamida es utilizada para el tratamiento de numerosos procesos malignos y ciertas enfermedades autoinmunitarias7,8. Los objetivos de la terapia consisten en controlar el proceso patológico subyacente a la brevedad posible y discontinuar o reemplazar la ciclofosfamida con medicamentos alternativos menos tóxicos tan pronto como sea posible a fin de minimizar la morbilidad asociada. Se requieren constantes y frecuentes evaluaciones de laboratorio para monitorear la función renal, evitar complicaciones en la vejiga inducidas por el fármaco y detectar toxicidad de la médula ósea.
Ciclofosfamida se utiliza principalmente en combinación con otros agentes quimioterapéuticos en el tratamiento de los linfomas, algunas formas de cáncer de cerebro, leucemia y algunos tumores sólidos. Es un fármaco quimioterapéutico que actúa promoviendo la inducción de la muerte de ciertas células T.
Nicolini et al. (2004) demostraron que las acciones biológicas de ciclofosfamida son dependientes de la dosis. A dosis altas, se asocia a niveles elevados de citotoxicidad e inmunosupresión, en tanto que a dosis bajas y continuas exhibe propiedades inmunoestimulantes y angiogénicas9. Nelius et al. (2009) realizaron un estudio de 17 pacientes con cáncer de próstata hormonorrefractario resistente a docetaxel, en el cual demostraron una disminución de los niveles de APE (antí-geno prostático específico) en 9 de los 17 pacientes. La mediana de supervivencia fue de 24 meses en el grupo entero y de 60 meses en aquellos que mostraron una respuesta APE. El estudio concluyó que ciclofosfamida a dosis bajas “puede ser una alternativa viable” de tratamiento para el cáncer de próstata hormonorrefractario resistente a docetaxel y “es un candidato interesante para terapia de combinación, por ejemplo, inmunoterapia, inhibidores de la tirosina cinasa y agentes antiangiogénicos”10.
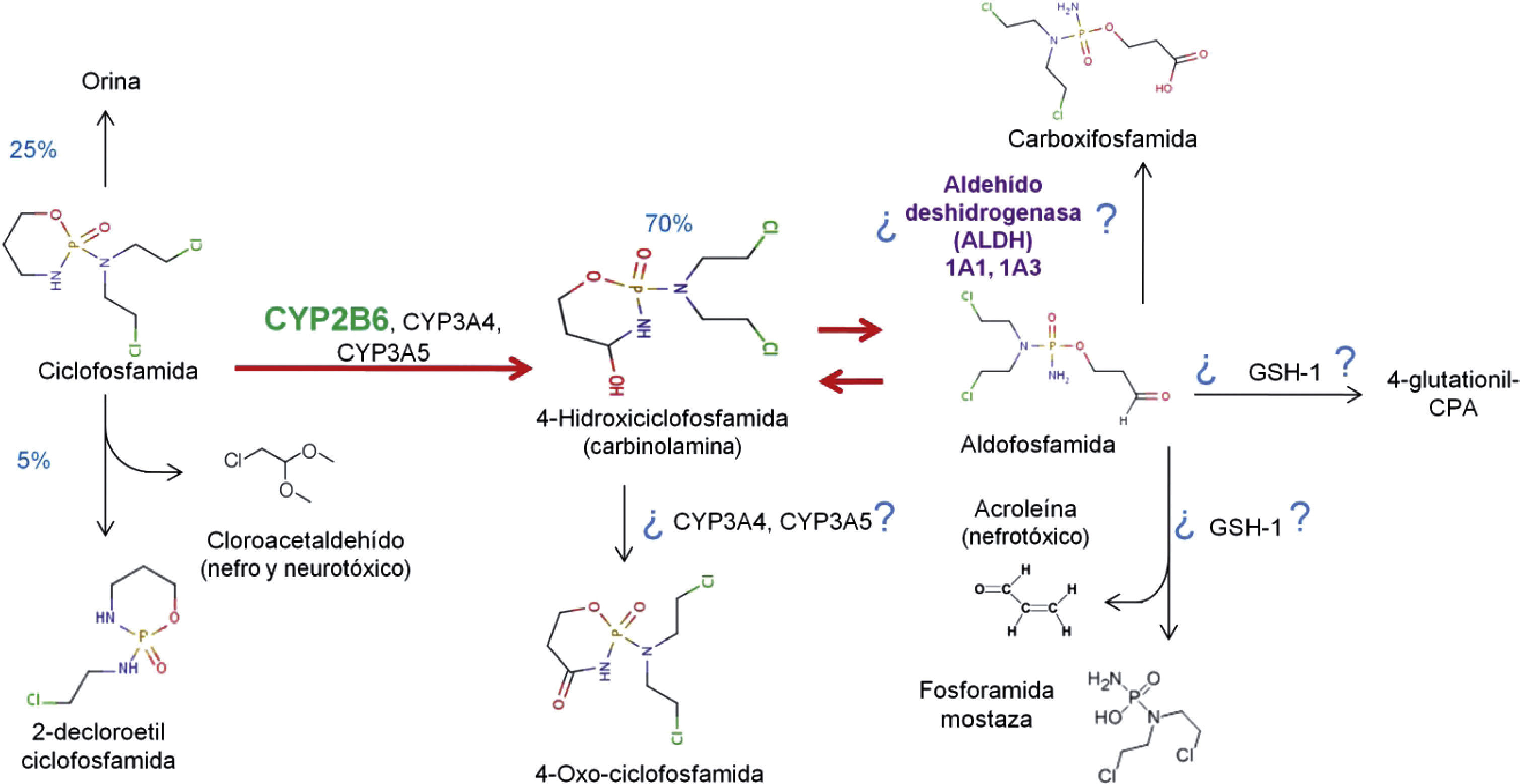
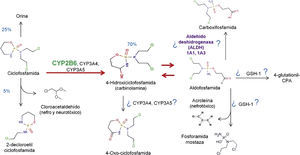
4FarmacologíaCiclofosfamida oral es absorbida rápidamente y convertida por enzimas oxidasa de función mixta (sistema del citocromo P450) en metabolitos activos en el hígado (fig. 2)11. El principal metabolito activo es 4-hidroxiciclofosfamida, la cual existe en equilibrio con su tautómero, -aldofosfamida12,13. La mayor parte de la aldofosfamida es oxidada subsecuentemente por la enzima ALDH para generar carboxiciclofosfamida. Una pequeña proporción de aldofosfamida se difunde libremente en las células, donde se separa en 2 compuestos, fosforamida mostaza y acroleína14. Los metabolitos activos de ciclofosfamida se unen con gran afinidad a las proteínas y se distribuyen hacia todos los tejidos, se presume que atraviesan la barrera placentaria y se sabe que están presentes en la leche materna15.
CYP2B6 y el metabolismo de ciclofosfamida. Los porcentajes en azul indican los desechos o el porcentaje de generación del metabolito en cuestión. Se ha sugerido en la figura que algunos citocromos P450, así como el glutatión 1 y las ALDH 1A1 y 1A3 pudieran intervenir en la generación de metabolitos por la presencia de los mismos en estudios de expresión proteica.
4-glutationil-CPA: 4-glutationil-ciclofosfamida.
Adaptado por Tamayo-Chuc a partir de McDonald et al., 2003; McCune et al., 2006 y Emadi A et al., 2009.
Los metabolitos de ciclofosfamida son excretados sin cambios principalmente en la orina, y la posología del fármaco debe ajustarse adecuadamente en condiciones de disfunción renal16. Los fármacos que alteran la actividad enzimática microsomal hepática (por ejemplo, alcohol, barbitúricos, rifampicina o fenitoína) pueden derivar en una aceleración del metabolismo de ciclofosfamida en sus metabo-litos activos e incrementar los efectos tanto farmacológicos como tóxicos del fármaco. En contraste, los medicamentos que inhiben las enzimas microsomales hepáticas (por ejemplo, los corticosteroides, los antidepresivos tricíclicos o alopurinol) ocasionan una conversión lenta de ciclofosfamida en sus metabolitos y, por lo tanto, condicionan efectos terapéuticos y tóxicos reducidos17.
Ciclofosfamida reduce la actividad de la pseudocolinesterasa plasmática y puede derivar en bloqueo neuromuscular prolongado cuando se administra simultáneamente con succinilcolina18,19.
Finalmente, como agente alquilante, añade un grupo alquilo (Cn+H2n+1) al ADN. Une el grupo alquilo a la base guanina del ADN en el átomo de nitrógeno número 7 del anillo de imidazol. Esto interfiere con la replicación del ADN mediante la formación de reticulaciones (enlaces transversales [cross-links] de ADN) tanto en el mismo filamento (reticulación intrastrand) como en el filamento opuesto (reticu-lación interstrand).
5Mecanismo de acciónEl efecto principal de ciclofosfamida es mediado por su metabolito de fosforamida mostaza. Este metabolito solo se forma en células con bajos niveles de ALDH. La fosforamida mostaza forma reticulaciones de ADN entre, y por dentro de ambas hebras y dentro de las hebras de ADN en la posición guanina N-7 (conocidas como enlace transversal [crosslinkage] interfilamentoso e intrafilamentoso, respectivamente). Esto es irreversible y deriva en apoptosis celular20.
Ciclofosfamida presenta niveles relativamente bajos de toxicidad quimioterapéutica típica cuando la ALDH se encuentra presente en concentraciones relativamente altas en las células madre de la médula ósea, el hígado y el epitelio intestinal. Las enzimas ALDH protegen estos tejidos proliferantemente activos contra los efectos tóxicos de fosforamida mostaza y acroleína convirtiendo la aldofosfamida en carboxifosfamida, lo cual impide la formación de metabolitos tóxicos y acroleína21. Ciclofosfamida induce efectos inmunomoduladores beneficiosos en la inmunoterapia adaptativa. Los mecanismos sugeridos incluyen22:
- 1.
Eliminación de las células T-reguladoras (células T CD4+CD25+) en hospedadores sin tratamiento previo y portadores de tumores.
- 2.
Inducción de factores de crecimiento de células T, como interferón (IFN) tipo I.
- 3.
Injerto mejorado de células T-efectoras tumor-reactivas, eventualmente transferidas por la creación de un nicho inmunológico espacial.
En consecuencia, el preacondicionamiento con ciclofosfamida de hospedadores destinatarios (de células T de donante) ha sido empleado para mejorar la inmunidad en hospedadores sin tratamiento previo y mejorar los regímenes de inmunoterapia adoptiva basada en células T, así como en estrategias de vacunación activa y para inducir la inmunidad antitumoral objetiva.
6Citocromo P450Los citocromos P450 (CYP) pertenecen a una súper familia de proteínas que contienen un cofactor heme y, por lo tanto, son hemoproteínas. Los CYP emplean una variedad de pequeñas moléculas como sustratos y en las reacciones enzimáticas. En términos generales, las enzimas oxidasa terminales en las cadenas de transferencia de electrones son clasificadas ampliamente como sistemas que contienen P450. El término se deriva del pico espectrofotométrico a la longitud de onda máxima de absorción de la enzima (450 nm) cuando se encuentra en el estado reducido y formando un complejo con monóxido de carbono. Su presencia se ha identificado en todos los reinos de la vida —en animales, plantas, hongos, protistas, bacterias, archaea— e incluso en los virus se han identificado las enzimas CYP23. Sin embargo, las enzimas no se han encontrado en Escherichia coli24,25. Se conocen más de 18,000 diferentes proteínas CYP26. La mayoría de los CYP requiere de una proteína asociada para ceder uno o más electrones a fin de reducir el hierro (y eventualmente el oxígeno molecular)27.
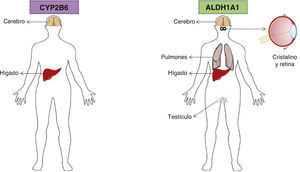
7CYP2B6El citocromo P450 2B6 es una enzima que en los seres humanos es codificada por el gen CYP2B6. CYP2B6 es miembro del grupo de enzimas del citocromo P450. Constituye entre el 2 y el 10% del contenido total de CYP hepático y también se expresa en el cerebro28,29. Junto con CYP2A6, está involucrado en el metabolismo de la nicotina, entre otras muchas sustancias. Las proteínas del citocromo P450 son monoxigenasas que catalizan diversas reacciones involucradas en el metabolismo de los fármacos y la síntesis del colesterol, los esteroides y otros lípidos. Esta proteína se localiza en el retículo endoplasmático y su expresión es inducida por fenobarbital. Se sabe que la enzima metaboliza algunos xenobióticos como los fármacos antineoplásicos, ciclofosfamida e ifosfamida28.
8Aldehído deshidrogenasasLas proteínas aldehído deshidrogenasas se encuentran presentes en todas las regiones subcelulares, incluido el citosol, el retículo endoplasmático, las mitocondrias y el núcleo, con presencia de algunas incluso en más de una ubicación. Las isoenzimas de la ALDH encontradas en organelos diferentes al citosol son portadoras de secuencias que hacen posible su traslocación a regiones subcelulares específicas. Después de la traslocación o la importación, las secuencias mitocondriales pueden ser eliminadas (haciendo que las proteínas maduras sean más cortas), en tanto que las señales nucleares y microsomiales permanecen intactas. La mayoría de las proteínas ALDH presentan una amplia distribución tisular y exhiben especificidad por diferentes sustratos30.
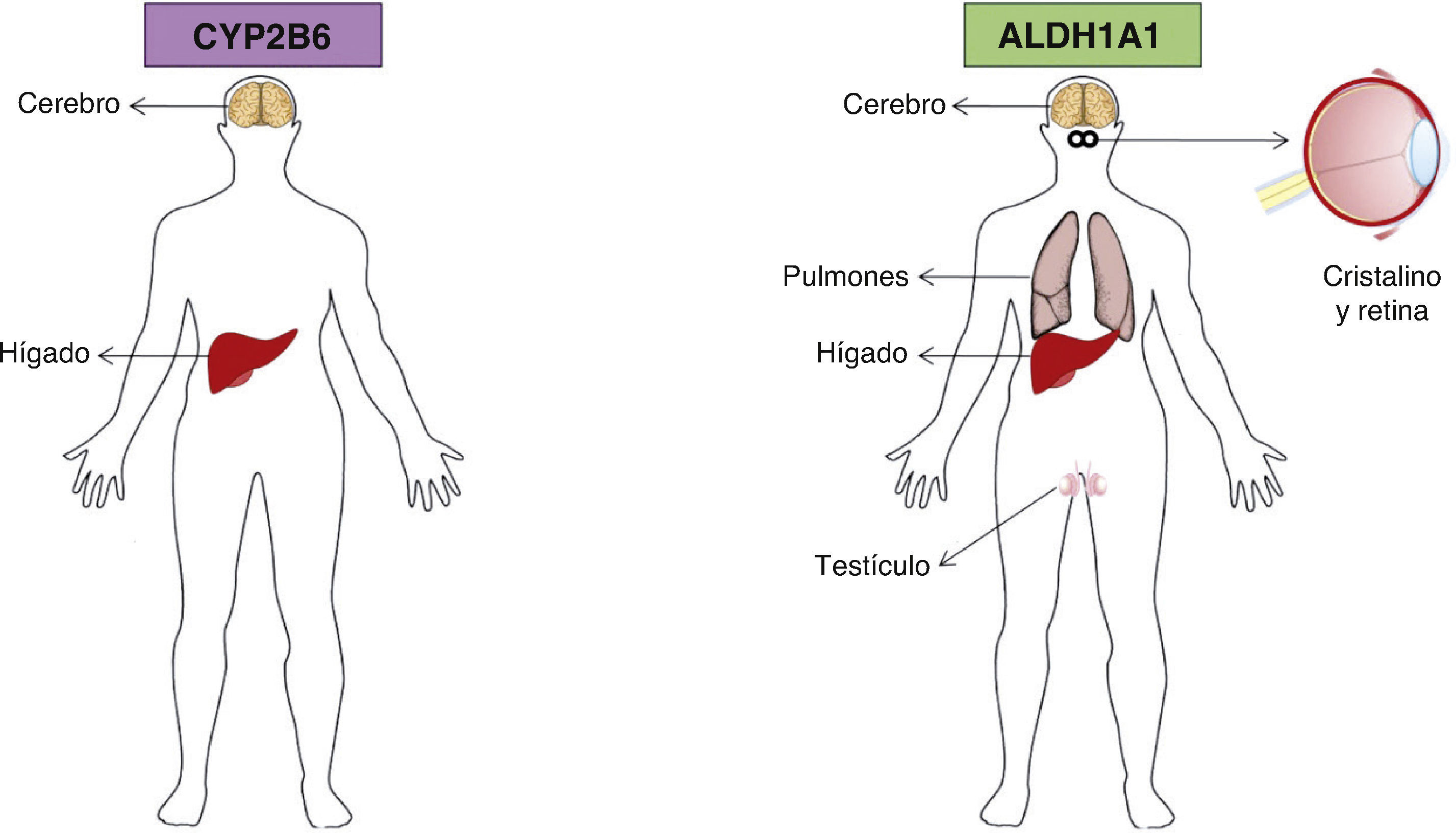
9Aldehído deshidrogenasa 1A1El gen de la aldehído deshidrogenasa 1A1 (ALDH1A1) codifica un homotetrámero que se distribuye ubicuamente en los epitelios adultos de varios órganos, entre ellos el cerebro, el testículo, el riñón, el cristalino del ojo, la retina, el hígado y los pulmones (fig. 3). La ALDH1A1 es 1 de 3 isoenzimas citosólicas altamente conservadas que catalizan la oxidación del metabolito del retinol, retinal (retinaldehído), en ácido retinoico31.
Adam et al. (2012) analizaron su expresión en el SNC tanto maduro como en desarrollo, así como en 93 casos de glioblastomas primarios. Sorprendentemente, la ALDH1A1 estuvo ausente en los nichos de las células madre en las diferentes etapas de desarrollo del SNC. No obstante, la ALDH1A1 se expresó acusadamente en astrocitos maduros, coexpresando tanto proteína ácida fibrilar glial como proteína S10032.
10Experimentación con ALDH1A1 en tumores cerebralesLa ALDH1A1ha sido empleada como marcador pronóstico en una gran cantidad de tumores cerebrales33. Asimismo, se ha estudiado su papel en la resistencia a los fármacos antineoplásicos. A continuación se describen los estudios más relevantes34:
Zhang M., et al. (2010) examinaron la función de ALDH1A1 como una enzima neutralizante de los efectos tóxicos de 4-hidroxinonenal, que es un producto de la peroxidación lipídica estudiado en forma intensiva. En dichas pruebas, para las cuales se empleó como modelo experimental el neuroblastoma, la sobreexpresión de ALDH1A1 redujo la producción de aductos proteicos de 4-hidroxinonenal. Lo anterior induce a pensar en aplicaciones terapéuticas para enfermedades neurodegenerativas por medio de la neutralización de los efectos tóxicos de 4-hidroxinonenal35.
A diferencia del estudio anterior, Liu et al. (2012) evaluaron la expresión inmunohistoquímica de ALDH1 en astrocitomas de diversos grados patológicos. Al cotejarse comparativamente con muestras de tejidos normales, se observó expresión de la proteína exclusivamente en los tejidos patológicos, independientemente de otras variables (sexo, edad, tamaño del tumor). A mayor expresión, se registraron índices más bajos de supervivencia global y supervivencia libre de progresión36.
Schäfer et al. (2012) analizaron in vitro la asociación entre ALDH1A1 y la resistencia del glioblastoma multiforme —un tumor astrocitario— a temozolomida como monoterapia o en combinación con 4-dietilaminobenzaldehído, o con horquillas cortas de ARN reductoras de la expresión de ALDH1A1. La mediana de supervivencia fue de 21 meses en los pacientes con bajos niveles de expresión de ALDH1A1 y de 9.8 meses en aquellos con expresión elevada37.
ALDH1A1 posee, además de su valor predictivo, una peculiaridad como blanco terapéutico en el glioblastoma multiforme humano a través de su inhibición. El estudio concluyó que dicha enzima desempeña un papel fundamental en la resistencia generada contra temozolomida, el cual fue demostrado ampliamente en pruebas in vitro. Sin embargo, se sugirió complementar estas observaciones con resultados in vivo para comparar los métodos experimentales, así como también abrir la investigación a fin de encontrar un inhibidor específico de ALDH1A137.
Recientemente, Bouvier et al. (2013) realizaron estudios con tumores fibrosos solitarios y hemangiopericitomas de las meninges comparándolos con meningiomas y sarcomas sinoviales (estos 2 últimos, sarcomas de partes blandas). El método empleado fue la cuantificación de la expresión por medio de inmunoensayos con anticuerpos anti-ALDH. Se demostró que la expresión a nivel del ARNm de ALDH1A1 fue superior en los tumores fibrosos solitarios/hemangiopericitomas de las meninges en comparación con los sarcomas de partes blandas38.
Aunado a lo anterior, ALDH1A1 fue calificada en este estudio como un marcador inmunohistoquímico eficaz para el diagnóstico de los tumores fibrosos solitarios (sensibilidad=84%, especificidad=98.8%) y los hemangiopericitomas de las meninges (sensibilidad=84.5%, especificidad=98.7%). Asimismo, se remarca la cualidad diagnóstica complementaria que la enzima posee con CD34. Es importante destacar que el anticuerpo empleado en este modelo experimental podría no ser del todo específico a la isoforma ALDH1A1, aunque los autores concuerdan con Schäfer et al. (2012) sobre la pertinencia de su inhibición como estrategia terapéutica38.
11Meduloblastoma y mecanismos de resistenciaComo mayor antecedente experimental de la resistencia farmacológica del meduloblastoma a ciclofosfamida, se tienen las investigaciones de Friedman et al. (1992). Empleando una línea celular de meduloblastoma humano denominada Daoy 4-HCR, la cual es 6 veces más resistente al metabolito 4-hidroperoxiciclofosfamida que la línea Daoy ordinaria (esta es solo 2 veces resistente), el equipo de investigación midió la expresión de ALDH —sin especificar isoforma alguna—, la actividad de la glutatión-S-transferasa y el contenido de glutatión39.
La citotoxicidad de fenilcetociclofosfamida, que es un análogo del fármaco no metabolizable por ALDH, permitió vincular el papel de ALDH con la resistencia farmacológica a 4-hidroperoxiciclofosfamida. Los resultados de las mediciones de la actividad de ALDH mostraron un incremento significativo (P<0.05) pero pequeño en la línea celular cotejada en comparación con la línea celular Daoy original39.
Analizando en conjunto las enzimas cuantificadas, los investigadores caracterizaron mecanismos de resistencia con 3 patrones distintos: el primer patrón, niveles elevados de ALDH; el segundo, niveles elevados de glutatión; y un tercer patrón que no se definió en ese momento. El estudio incitó en su tiempo a seguir investigando los múltiples mecanismos de resistencia a fin de poder caracterizarlos más ampliamente39.
12DiscusiónEn el presente artículo de revisión nos hemos adentrado en la línea de investigación de los tumores del SNC y, más específicamente en el meduloblastoma, con la finalidad de retroalimentar documentalmente el papel decisivo de la isoforma enzimática ALDH1A1. También se destaca el papel del citocromo P450 2B6, el cual se ve involucrado en menor grado en el metabolismo de ciclofosfamida e ifosfamida.
El tratamiento del meduloblastoma se mantiene como un reto difícil. La mayoría de los pacientes con este tipo de tumor fallecen por una enfermedad progresiva tras el fracaso de la intervención quirúrgica y radioterapéutica. Sin embargo, la experiencia clínica sugiere que una proporción significativa de dichos pacientes también desarrolla el tumor progresivamente. Por lo tanto, la identificación de los mecanismos de resistencia farmacológica y el desarrollo de estrategias para confrontar este obstáculo serán los objetivos primordiales del día de mañana.
No se debe olvidar la justificación más importante, la cual consiste en tratar de estudiar los mecanismos directos de resistencia farmacológica a fin de encontrar alternativas terapéuticas más eficaces para los pacientes, objetivo principal de la investigación biomédica actual y futura.
13ConclusiónLa ALDH1A1ha demostrado un papel pronóstico en los tumores del SNC y su expresión se ha vinculado con la resistencia a la terapéutica. Muchas investigaciones han demostrado que puede ser fundamental para valorar el pronóstico de ciertos tumores malignos del SNC.
Como punto de partida, los resultados de Friedman et al. (1992) demostraron en modelos experimentales que las células de meduloblastoma humano contienen niveles elevados de glutatión-S-transferasa y que es posible sensibilizarlas a 4-hidroperoxiciclofosfamida con L-butionina-S, R-sulfoximina, un hallazgo que sugiere una estrategia para mejorar la efectividad del fármaco en esta enfermedad. Sin embargo, al menos 2 mecanismos adicionales de resistencia (ALDH elevada y un mecanismo previamente no definido) también parecen desempeñar un papel fundamental en la resistencia a 4-hidroperoxiciclofosfamida en algunas líneas celulares. No hay nada concluyente con respecto a un mecanismo lineal de resistencia, de modo que se requerirán nuevos estudios que revitalicen la importancia de la investigación al respecto.
14FinanciamientoLos autores no recibieron ningún patrocinio para la realización del presente artículo.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.