Varón de 69años de edad con antecedentes de resección transuretral de próstata por hiperplasia benigna y manipulación dental en el plazo de 4meses atrás. Acudió a Urgencias del hospital Royo Villanova (HRV) por presentar fiebre de 38°C de 4días de duración junto con tos no productiva y astenia. Su médico de cabecera le había recetado amoxicilina-clavulánico y paracetamol, sin mejoría. En la auscultación cardiaca los tonos eran arrítmicos y se apreciaba un soplo sistólico y diastólico rudo en foco aórtico. La auscultación pulmonar era normal. El electrocardiograma mostró una fibrilación auricular a 152latidos/min y en la radiografía de tórax existía un pequeño derrame pleural bilateral. Otros datos analíticos fueron: gasometría arterial: pH, 7,50; pO2: 79mmHg; pCO2: 31mm Hg; HCO3−: 24,2mmol/l; satO2: 96%; hemoglobina: 12,1g/dl; hematocrito: 36,5%; leucocitos: 10.100/mm3 (neutrófilos, 73%); plaquetas: 239.000/mm3.
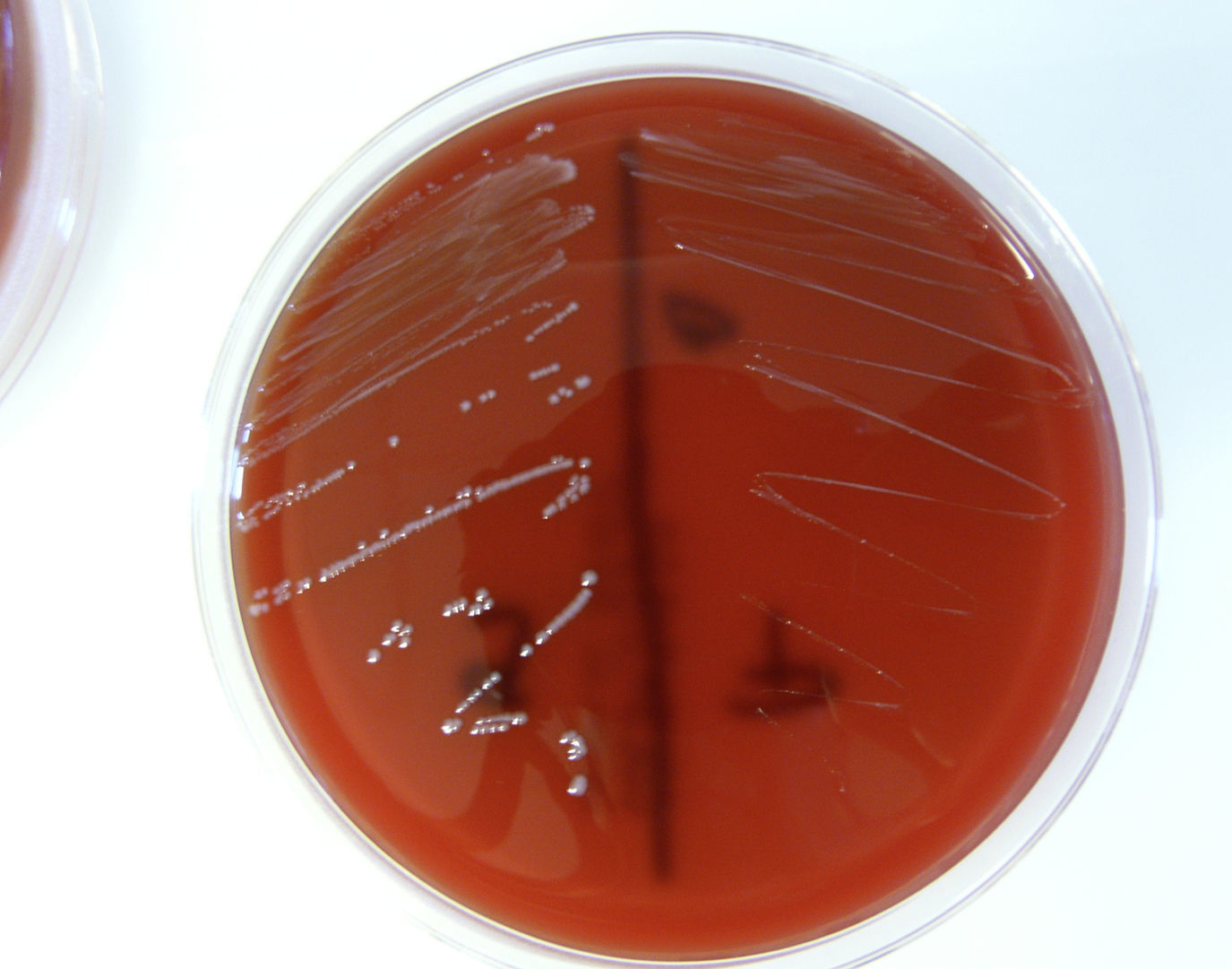
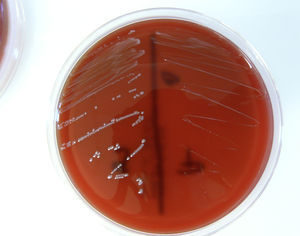
Se diagnosticó en Urgencias una infección respiratoria con derrame pleural, se extrajeron hemocultivos y se inició tratamiento con levofloxacino. Una vez ingresado el paciente en Medicina Interna, se realizó un ecocardiograma transtorácico que mostró una aurícula izquierda dilatada (53mm), un ventrículo izquierdo dilatado sin hipertrofia, con buena contractilidad y fracción de eyección del 56%, y una válvula aórtica trivalva con una imagen de vegetación a nivel del velo no coronario que provocaba una insuficiencia aórtica severa. Se inició tratamiento empírico de endocarditis infecciosa (EI) con cloxacilina, ampicilina y gentamicina y se pautaron nuevos hemocultivos. Al día siguiente se realizó un ecocardiograma transesofágico que confirmó la presencia de una vegetación de 4×8mm en la localización descrita. En los primeros hemocultivos se informó de la existencia de 2morfotipos de Enterococcus faecalis (fig. 1) y se suprimió la cloxacilina.
El paciente se mantuvo con fiebre menor de 38°C y buen estado general hasta que, a los 4días, presentó un edema agudo de pulmón e ingresó en la UCI. La evolución fue favorable y al día siguiente fue sometido con éxito a cirugía de sustitución valvular en otro centro hospitalario (Hospital Miguel Servet [HMS]), con buena evolución posterior.
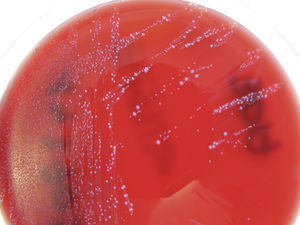
Mientras tanto, en el laboratorio de Microbiología (HRV) se informaron los segundos hemocultivos, que seguían siendo positivos, pero con predominio de unas colonias diminutas que correspondieron finalmente a E. faecalis (fig. 2) e identificados como tales mediante métodos microbiológicos convencionales (paneles Combo 32 [Microscan, Siemens] y API 20 Strep [BioMérieux]). La tercera tanda de hemocultivos fue negativa. Por otra parte, la válvula extraída durante el acto quirúrgico se remitió al laboratorio de Microbiología del HMS, donde se aisló asimismo E. faecalis con 2morfotipos, identificados en este caso mediante MALDI-TOF (Bruker). Para confirmar que ambos aislados estaban relacionados, fueron remitidos para tipificación mediante electroforesis en campo pulsado (PFGE) a la Universidad de la Rioja, donde se confirmó la identidad clonal.
En cuanto a la sensibilidad realizada en los 2hospitales (HRV y HMS) (microdilución: paneles comercializados Strhae [Izasa] y Combo 32, Microscan, Siemens) y difusión en agar (E-test [BioMérieux], interpretación CLSI), los aislados eran sensibles a ampicilina y sinérgicos a la asociación con gentamicina (<500μg), pero presentaron una ligera diferencia al comparar ambas variantes (una dilución) en los E-test de penicilina (2 y 4μg/ml, respectivamente) y levofloxacino (1 y 2μg/ml), diferencia que fue mayor en el caso de gentamicina (morfotipo grande = 2 μg/ml y variantes de colonia pequeña =12μg/ml).
A la vista de lo observado, estábamos ante un caso verdaderamente infrecuente, tanto por aislarse 2morfotipos de E. faecalis en una endocarditis, como por asentar esta en una válvula nativa.
Los morfotipos denominados «variantes de colonia pequeña» (VCP, o small colony variants [SCV en sus siglas en inglés]) se han descrito tanto en bacterias gramnegativas (Escherichia coli, Pseudomonas aeruginosa, Salmonella enterica, Burkholderia cepacia) como en grampositivas, especialmente en estafilococos (Staphyloccus aureus y S. epidermidis)1, pero es un hecho excepcional en enterococos.
En S. aureus, las VCP se han reconocido como patógenos emergentes2 y representan una subpoblación que puede surgir naturalmente —o bien seleccionarse tras tratamientos antimicrobianos3— caracterizada por su crecimiento lento y definida como colonias no hemolíticas y no pigmentadas de un tamaño unas 10veces menor a las cepas parentales, de ahí su nombre1. Su pequeño tamaño es a menudo debido a la auxotrofia para la hemina y/o la menadiona, 2compuestos que participan en la cadena de transporte de electrones4. Por otro lado, la capacidad de persistir intracelularmente les confiere además ventajas en la supervivencia que van más allá del conocido aumento de la resistencia a los antimicrobianos, especialmente a la gentamicina3,5.
Con respecto a la sensibilidad de nuestros morfotipos, coincide con las observaciones descritas en el trabajo de Wellinghausen et al.6. También en este la mayor diferencia entre ambas variantes se encontró en la gentamicina (4 y 12μg/ml respectivamente), seguido por variaciones de tan solo una dilución en betalactámicos (penicilina, ampicilina e imipenem), y siendo idéntica con vancomicina y rifampicina
El significado de las VCP como agentes causales de infecciones crónicas, recurrentes y resistentes a los antibióticos se ha demostrado en estudios prospectivos, particularmente en pacientes con osteomielitis crónica o fibrosis quística, y se han aislado sobre todo en pacientes con infecciones persistentes de piel, abscesos profundos e infecciones asociadas a cuerpos extraños2. En cuanto a las EI, hay muy poca información disponible acerca de la participación de las VCP7,8, y todavía menos en el caso de una etiología enterocócica6,9. En el único artículo publicado de estas características, Wellinghausen et al.6 presentan un caso de endocarditis sobre válvula protésica aórtica causada por VCP de Enterococcus faecalis, y las caracterizan en comparación con el fenotipo normal clonalmente relacionado con respecto a las alteraciones microscópicas y ultraestructura, dinámica de crecimiento, fisiología y vías metabólicas. Las VCP de enterococos morfológicamente consistían en células heterogéneas, de diferentes tamaños y con formas aberrantes, evidenciándose también células vacías, «fantasma». Además, mostraron una incompleta separación celular, con paredes celulares gruesas y excesiva producción de una sustancia intercelular. Esta sustancia de agregación parece constituir un factor de virulencia que facilita la adherencia celular, la internalización en células de mamíferos y la supervivencia intracelular en macrófagos humanos6. Los autores encuentran que las alteraciones estructurales y metabólicas observadas podrían facilitar la supervivencia de estas VCP de enterococos especialmente en condiciones de microaerobiosis, ambiente que se logra presumiblemente in vivo durante una endocarditis.
En cuanto a la implicación clínica de estas variantes, además de aumentar la sospecha diagnóstica de estar ante una infección crónica o persistente, hay que tener en cuenta la aumentada resistencia a los antimicrobianos, que puede interferir especialmente en el tratamiento combinado con aminoglucósidos. Huelga insistir en la importancia del diagnóstico precoz de la EI, y en este caso, como en los escasos otros publicados, hubo de llegarse a la sustitución quirúrgica de la válvula, por lo cual se desconoce el impacto que la falta de sensibilidad de estas variantes pudiera tener en un hipotético manejo basado en la terapia antibiótica exclusivamente.
A la Dra. Carmen Torres y a Elena Gómez-Sanz, del Departamento de Bioquímica y Biología Molecular de la Universidad de La Rioja, por haber realizado la electroforesis en campo pulsado (PFGE) que confirmó la identidad clonal de las 2 variantes de Enterococus faecalis.