Los niveles de resistina sérica se han asociado con obesidad, grasa visceral y resistencia a la insulina. Su relación con la masa muscular ha sido menos evaluada.
ObjetivosEvaluar la relación entre la masa muscular determinada por bioimpedancia eléctrica y los niveles de resistina circulante en mujeres con obesidad mayores de 60 años.
MétodosRealizamos un estudio transversal en 313 mujeres con obesidad. Se registraron datos antropométricos (peso, talla, índice de masa corporal y circunferencia de la cintura), parámetros BIA (masa grasa total, masa libre de grasa, índice de masa libre de grasa, masa muscular esquelética e índice de masa muscular esquelética [iMME]), presión arterial y analítica.
ResultadosLos pacientes fueron divididos en dos grupos diferentes según el valor medio de iMME (11,93kg/m2): iMME bajo frente a iMME alto. En el grupo de iMME bajo, los niveles de resistina fueron más altos que los niveles de resistina del grupo de iMME alto (valor delta: 2,8+0,3 ng/dl:p=0,01). Los niveles de resistina sérica se correlacionan inversamente con masa libre de grasa, índice de masa libre de grasa, masa muscular esquelética e iMME. Esta adipoquina muestra una correlación positiva con los niveles de insulina, HOMA-IR y PCR. En el modelo con iMME como variable dependiente, los niveles de resistina explicaron el 12% de la variabilidad de la masa muscular (Beta -0,38, IC95% -0,91- -0,11).
ConclusionesLos niveles séricos de resistina se asocian con baja masa muscular esquelética en mujeres con obesidad mayores de 60 años.
Serum resistin levels have been associated with obesity, visceral fat, and insulin resistance. Its relationship with muscle mass has been less evaluated.
ObjectivesTo evaluate the relationship between muscle mass determined by electrical bioimpedance and circulating resistin levels in obese women over 60 years of age.
MethodsWe conducted a cross-sectional study in 313 obese women. Anthropometric data (weight, height, body mass index [BMI] and waist circumference), BIA parameters (total fat mass, fat-free mass, fat-free mass index), skeletal muscle mass and skeletal muscle mass index (SMI), blood pressure and laboratory tests were recorded.
ResultsPatients were divided into two different groups according to the mean value of SMI (11.93kg/m2): low SMI versus high SMI. In the low SMI group, the resistin levels were higher than the resistin levels in the high SMI group (delta value: 2.8+0.3 ng/dl:p=0.01). Serum resistin levels are inversely correlated with fat-free mass, fat-free mass index, skeletal muscle mass, and SMI. This adipokine shows a positive correlation with insulin, HOMA-IR and PCR levels. In the model with SMI as the dependent variable, resistin levels explained 12% of the variability in muscle mass (Beta -0.38, 95% CI -0.91- -0.11).
ConclusionsSerum resistin levels are associated with low skeletal muscle mass in obese women over 60 years of age.
La sarcopenia es una enfermedad muscular generalizada que consiste en la pérdida progresiva de masa muscular, fuerza muscular y/o función física1. Esta entidad puede producir a medida que avanza la edad una reducción de la calidad de vida y aumentar el riesgo de caídas, fracturas y mortalidad2. Además, algunos estudios han detectado que la sarcopenia también se asocia con la resistencia a la insulina y la diabetes mellitus tipo 23. Por lo tanto, un estado crónico de inflamación puede contribuir a la etiología de la sarcopenia y a la disfunción del tejido muscular, produciendo a su vez esta situación un círculo vicioso de inflamación y deterioro muscular4.
No obstante, la evaluación de la masa muscular es difícil en los pacientes con obesidad. El uso clínico de las medidas de composición corporal es fundamental para una evaluación adecuada, especialmente en la evaluación del compartimento muscular. En este contexto, la evaluación nutricional ya no puede basarse en la determinación de medidas antropométricas clásicas. El concepto de evaluación nutricional morfofuncional postula que la evaluación nutricional debe realizarse utilizando técnicas que determinen la evaluación de la antropometría y composición corporal que incluyen técnicas como el análisis de impedancia bioeléctrica5. Teniendo en cuenta todo lo mencionado anteriormente, no se dispone de evidencia concluyente para dilucidar el papel mediador que tienen el sistema endocrino a través de las adipoquinas como la resistina, la masa grasa y el estado inflamatorio en la evolución y aparición de la sarcopenia. En este contexto, los niveles de resistina sérica están asociados con un aumento de la obesidad, la grasa visceral6 y la diabetes tipo 27, mientras que otros trabajos no han logrado demostrar estas asociaciones8. También se ha descrito una influencia del género en los niveles de resistina sérica9. Por otra parte, la resistina podría ser capaz tanto de alterar los miotúbulos –mediante la activación de la vía clásica NF-kβ10– como de inhibir la diferenciación miogénica de los mioblastos11. En pacientes con enfermedad pulmonar obstructiva crónica, se ha demostrado una relación inversa entre los niveles de resistina circulante y la masa muscular12. Hasta la fecha no existen trabajos que hayan evaluado la relación de los niveles circulantes de resistina con la masa muscular, a pesar de que la sarcopenia en la obesidad es una entidad cada vez más frecuente13.
El objetivo de este estudio fue evaluar la relación entre la masa muscular determinada por bioimpedancia eléctrica y los niveles de resistina circulante en mujeres con obesidad mayores de 60 años.
Pacientes y métodosPoblación a estudioEste estudio transversal se llevó a cabo desde enero de 2020 hasta diciembre de 2022. Los participantes fueron seleccionados mediante muestreo no probabilístico consecutivo. Se invitó a participar a un total de 313 mujeres, mayores de 60 años con obesidad. Todos los participantes dieron su consentimiento informado por escrito, y el protocolo cumplió con la Declaración de Helsinki. Fue aprobado por el Comité de Ética, con código de registro 06/2021.
Los criterios de inclusión para el presente estudio fueron los siguientes; obesidad evaluada como índice de masa corporal (IMC)> 30kg/m2 y edad superior a 60 años. Los criterios de exclusión fueron la presencia de cualquier de las siguientes situaciones (p. ej., enfermedad renal crónica con filtrado glomerular <60ml/min, enfermedad hepática crónica con Child C, insuficiencia cardíaca con fracción de eyección <50%, cualquier tipo de tumor maligno con o sin tratamiento coadyuvante y antecedentes de alcoholismo), uso de medicamentos que potencialmente influyeron en el peso o parámetros metabólicos (como por ejemplo; orlistat, estatinas, fibratos y medicamentos para tratar la diabetes mellitus o el diagnóstico de diabetes mellitus), incapacidad para caminar o estar postrado en cama.
Los parámetros evaluados en el presente estudio incluyeron; datos antropométricos (peso, talla, IMC y circunferencia de la cintura, parámetros de bioimpedancia [masa grasa total, masa libre de grasa –MLG–], índice masa libre de grasa [iMLG], masa muscular esquelética [MME] e índice de masa muscular esquelética [iMME]), presión arterial y parámetros bioquímicos. Durante la visita basal, se obtuvieron 10ml de sangre venosa después de un ayuno nocturno de 10 h y se repartieron en alícuotas en tubos recubiertos con ácido etilendiaminotetraacético EDTA. Todos los pacientes reclutados recibieron instrucciones para registrar su ingesta dietética diaria y su actividad física.
Parámetros antropométricos, presión arterial y parámetros de estilo de vidaLa estatura, el peso y la circunferencia de la cintura se determinaron con los sujetos en ayunas de 10 h y con ropa ligera. La circunferencia de la cintura se midió con una precisión de 0,1cm justo por encima del ilion con una cinta flexible (Omrom, LA, CA, EE. UU.). La estatura corporal (cm) se midió con un tallímetro estándar (Omrom, LA, CA, EE. UU.) y el peso corporal se determinó con un peso digital (Omrom, LA, CA, EE. UU.). El IMC se obtuvo con la ecuación; peso en kg dividido por la altura en metros al cuadrado.
La masa grasa total y la masa libre de grasa se obtuvieron mediante análisis de impedancia bioeléctrica con una precisión de 50g14 (EFG BIA 101 Anniversary, Akern, It). La masa libre de grasa (MLG) y la masa muscular esquelética (MME) se obtuvieron directamente por impedancia. Se calculó el índice de masa libre de grasa (iMLG) dividiendo el MLG absoluto por la altura al cuadrado (MLG [kg]/altura [m2]) y el iMME se obtuvo dividiendo el MME por la altura al cuadrado también. Los sujetos se dividieron en dos grupos por el valor medio de iMME (11,93kg/m2).
Las presiones arteriales sistólica y diastólica se midieron tres veces consecutivas en el brazo derecho después de 10 min de descanso, y el promedio de las 3 medidas se calculó con un esfigmomanómetro (Omrom, LA, CA, EE. UU.).
Todos los pacientes reclutados recibieron instrucciones para registrar su ingesta dietética diaria durante tres días no consecutivos (dos días diarios y un día de fin de semana). Los registros dietéticos se analizaron utilizando un software específico (Dietosource ®, Ge, Swi), incluyendo tablas nacionales de composición de alimentos como referencia15. Cada sujeto con un cuestionario autoadministrado registró la actividad física.
Procedimientos bioquímicos y adiponectinaLos análisis bioquímicos séricos de glucosa, insulina, proteína C reactiva (PCR), colesterol total, HDL-colesterol y triglicéridos se realizaron utilizando el analizador COBAS INTEGRA 400 (Roche Diagnostic, Basilea, Suiza). El colesterol LDL se calculó utilizando la ecuación de Friedewald (colesterol LDL=colesterol total-colesterol HDL-triglicéridos/5)16. Se calculó la resistencia a la insulina con el modelo de homeostasis para la resistencia a la insulina (HOMA-IR) usando estos valores (glucosa [mml/l] x insulina [UI/l]/22,5)17. La resistina se midió mediante inmunoanálisis enzimático (ELISA) (R&D Systems, Inc., Minnesota, EE. UU.) con un rango normal de 8,65-21,43 ug/ml.
Análisis estadísticoSe utilizó el Paquete Estadístico para Ciencias Sociales, versión 23.0 (SPSS Statistics, IBM, Armonk, NY, EE. UU.) para realizar el análisis estadístico. Los datos continuos se presentan como media+desviación estándar. La normalidad de los datos se verificó mediante la prueba de Kolmogorov-Smirnov. Se utilizaron valores porcentuales y absolutos para los parámetros categóricos. Se utilizó para comparar las diferencias de las variables continuas la prueba de la t de Student (para variables paramétricas) o la prueba de Mann-Whitney (para variables no paramétricas). Se utilizaron análisis de correlación de Spearmen o Pearson para explorar la relación entre iMME y biomarcadores. Se utilizaron regresiones lineales univariante y multivariadas por pasos para investigar los determinantes de iMME. La muestra fue dividida en dos grupos utilizando la mediana de iMME (11,93kg/m2). En el modelo multivariante ajustado por edad, ingesta calórica y actividad física se incluyeron variables relacionadas con iMME en el análisis univariante (p<0,01). Los valores de p por debajo de 0,05 se consideraron estadísticamente significativos.
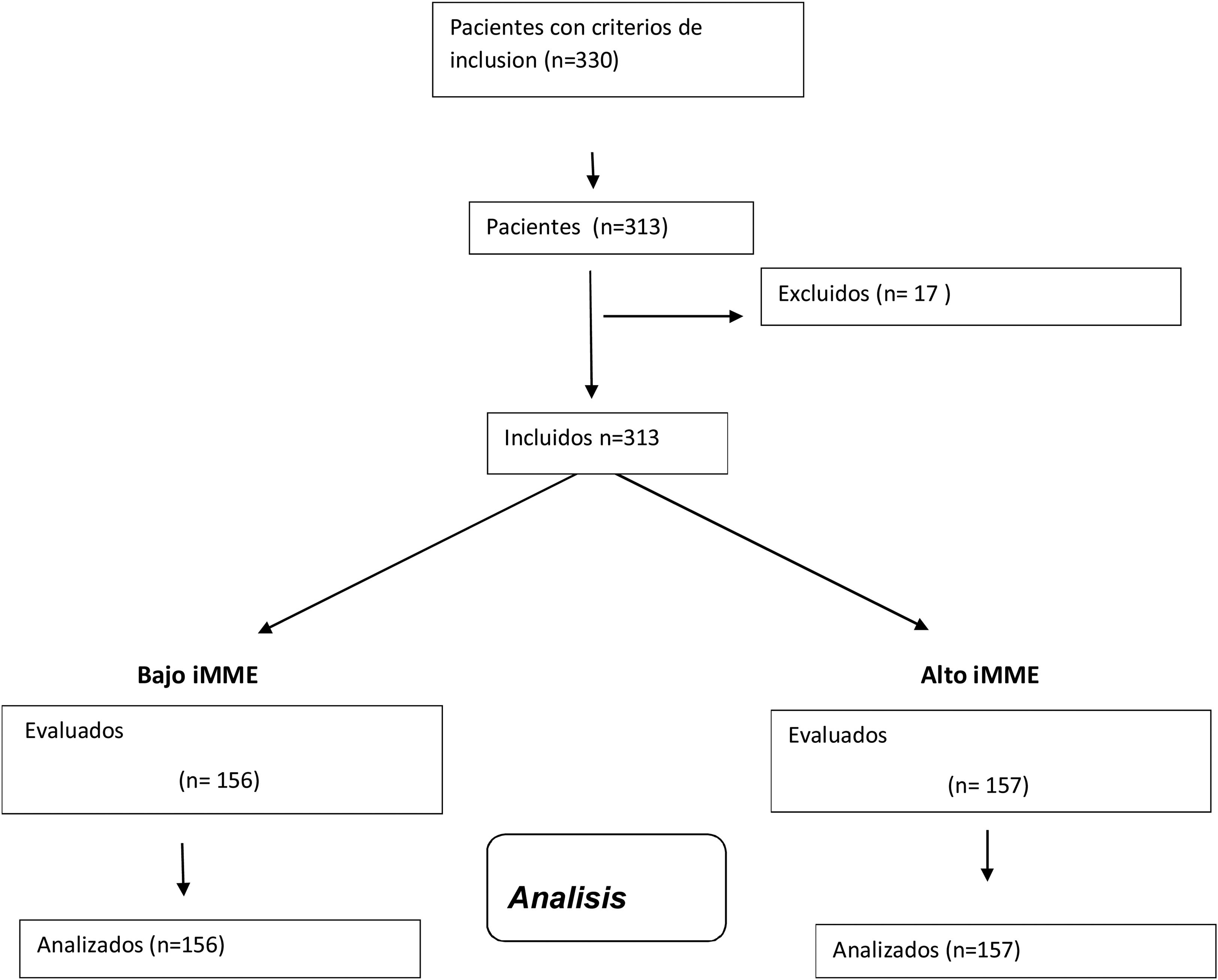
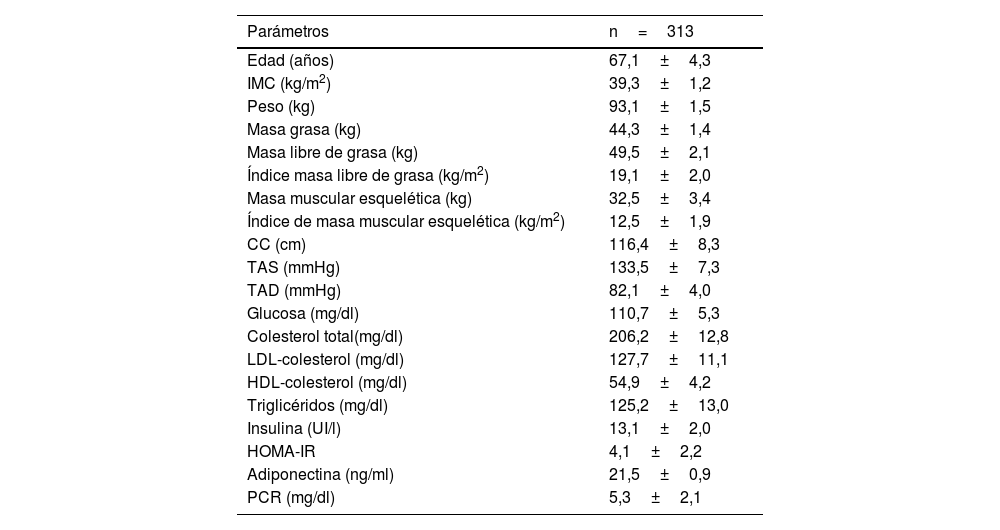
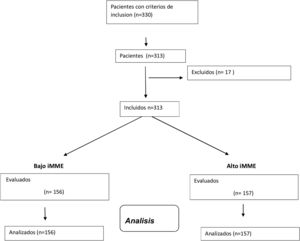
ResultadosSe incluyeron 313 mujeres con obesidad (fig. 1) con una edad media de 67,1+4,3 años (rango: 63-81). Las características antropométricas y bioquímicas se muestran en la tabla 1.
Parámetros de la muestra estudiada (media±SD)
| Parámetros | n=313 |
|---|---|
| Edad (años) | 67,1±4,3 |
| IMC (kg/m2) | 39,3±1,2 |
| Peso (kg) | 93,1±1,5 |
| Masa grasa (kg) | 44,3±1,4 |
| Masa libre de grasa (kg) | 49,5±2,1 |
| Índice masa libre de grasa (kg/m2) | 19,1±2,0 |
| Masa muscular esquelética (kg) | 32,5±3,4 |
| Índice de masa muscular esquelética (kg/m2) | 12,5±1,9 |
| CC (cm) | 116,4±8,3 |
| TAS (mmHg) | 133,5±7,3 |
| TAD (mmHg) | 82,1±4,0 |
| Glucosa (mg/dl) | 110,7±5,3 |
| Colesterol total(mg/dl) | 206,2±12,8 |
| LDL-colesterol (mg/dl) | 127,7±11,1 |
| HDL-colesterol (mg/dl) | 54,9±4,2 |
| Triglicéridos (mg/dl) | 125,2±13,0 |
| Insulina (UI/l) | 13,1±2,0 |
| HOMA-IR | 4,1±2,2 |
| Adiponectina (ng/ml) | 21,5±0,9 |
| PCR (mg/dl) | 5,3±2,1 |
CC: circunferencia de la cintura; HOMA-IR: homeostasis model assessment; IMC: índice de masa corporal; PCR: proteína C reactiva; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
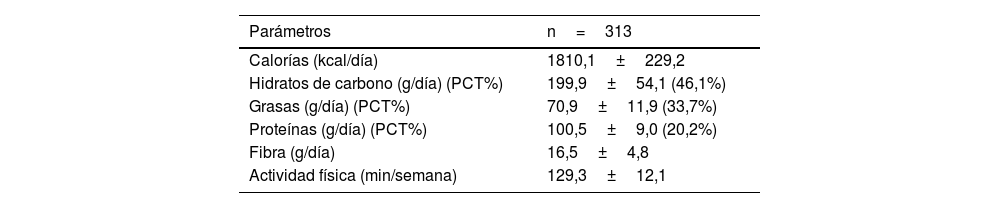
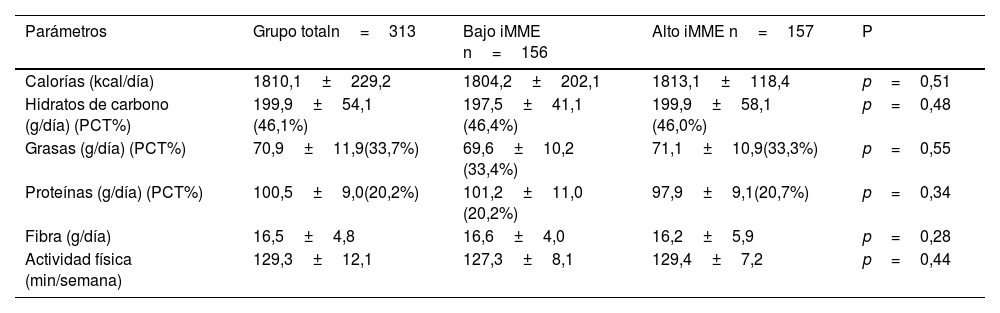
En la tabla 2 se muestran la ingesta dietética de macronutrientes y el ejercicio físico promedio semanal. La ingesta calórica total y la distribución de macronutrientes fueron las habituales para una población obesa de esta edad, con predominio de los hidratos de carbono y grasas en el aporte calórico.
Ingesta media y actividad física (media±SD)
| Parámetros | n=313 |
|---|---|
| Calorías (kcal/día) | 1810,1±229,2 |
| Hidratos de carbono (g/día) (PCT%) | 199,9±54,1 (46,1%) |
| Grasas (g/día) (PCT%) | 70,9±11,9 (33,7%) |
| Proteínas (g/día) (PCT%) | 100,5±9,0 (20,2%) |
| Fibra (g/día) | 16,5±4,8 |
| Actividad física (min/semana) | 129,3±12,1 |
PCT: porcentaje de las calorías total.
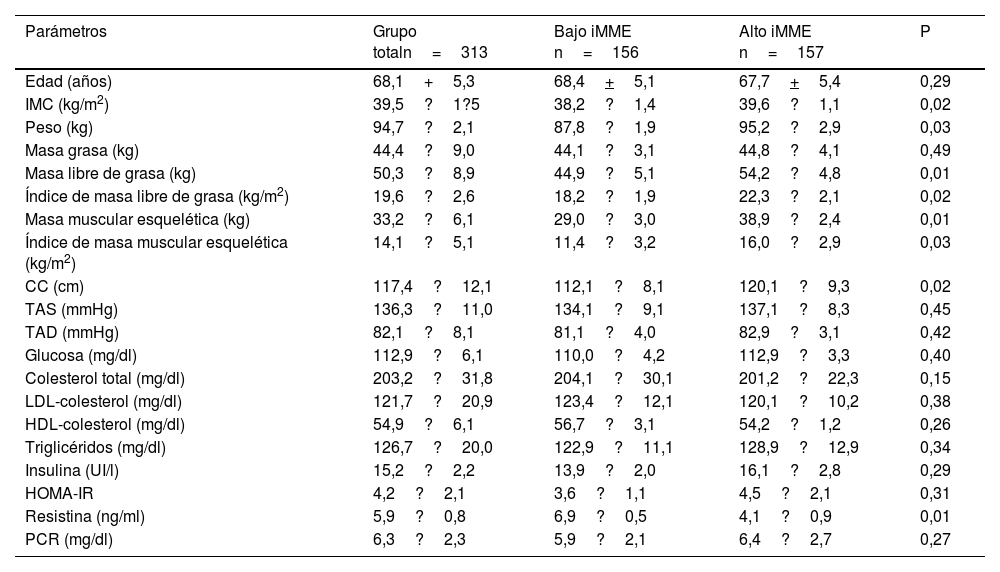
La tabla 3 muestra a los pacientes divididos en dos grupos diferentes según la mediana el valor medio de iMME (11,93kg/m2), iMME bajo frente a iMME alto. La edad media fue similar en ambos grupos. Como se esperaba, el IMC, el peso, la MLG, el índice de masa libre de grasa (iMLG), masa muscular esquelética (MME) e iMME fueron más elevados en el grupo de iMME alto que en el grupo de iMME bajo. En el grupo de iMME bajo, los niveles de resistina fueron más altos que los niveles de resistina en el grupo de iMME alto (valor delta: 2,8+0,3 ng/dl:p=0,01).
Comparación de parámetros antropométricos y bioquímicos en los dos grupos de mujeres con obesidad divididos por la mediana de iMME (media±SD)
| Parámetros | Grupo totaln=313 | Bajo iMME n=156 | Alto iMME n=157 | P |
|---|---|---|---|---|
| Edad (años) | 68,1+5,3 | 68,4+5,1 | 67,7+5,4 | 0,29 |
| IMC (kg/m2) | 39,5?1?5 | 38,2?1,4 | 39,6?1,1 | 0,02 |
| Peso (kg) | 94,7?2,1 | 87,8?1,9 | 95,2?2,9 | 0,03 |
| Masa grasa (kg) | 44,4?9,0 | 44,1?3,1 | 44,8?4,1 | 0,49 |
| Masa libre de grasa (kg) | 50,3?8,9 | 44,9?5,1 | 54,2?4,8 | 0,01 |
| Índice de masa libre de grasa (kg/m2) | 19,6?2,6 | 18,2?1,9 | 22,3?2,1 | 0,02 |
| Masa muscular esquelética (kg) | 33,2?6,1 | 29,0?3,0 | 38,9?2,4 | 0,01 |
| Índice de masa muscular esquelética (kg/m2) | 14,1?5,1 | 11,4?3,2 | 16,0?2,9 | 0,03 |
| CC (cm) | 117,4?12,1 | 112,1?8,1 | 120,1?9,3 | 0,02 |
| TAS (mmHg) | 136,3?11,0 | 134,1?9,1 | 137,1?8,3 | 0,45 |
| TAD (mmHg) | 82,1?8,1 | 81,1?4,0 | 82,9?3,1 | 0,42 |
| Glucosa (mg/dl) | 112,9?6,1 | 110,0?4,2 | 112,9?3,3 | 0,40 |
| Colesterol total (mg/dl) | 203,2?31,8 | 204,1?30,1 | 201,2?22,3 | 0,15 |
| LDL-colesterol (mg/dl) | 121,7?20,9 | 123,4?12,1 | 120,1?10,2 | 0,38 |
| HDL-colesterol (mg/dl) | 54,9?6,1 | 56,7?3,1 | 54,2?1,2 | 0,26 |
| Triglicéridos (mg/dl) | 126,7?20,0 | 122,9?11,1 | 128,9?12,9 | 0,34 |
| Insulina (UI/l) | 15,2?2,2 | 13,9?2,0 | 16,1?2,8 | 0,29 |
| HOMA-IR | 4,2?2,1 | 3,6?1,1 | 4,5?2,1 | 0,31 |
| Resistina (ng/ml) | 5,9?0,8 | 6,9?0,5 | 4,1?0,9 | 0,01 |
| PCR (mg/dl) | 6,3?2,3 | 5,9?2,1 | 6,4?2,7 | 0,27 |
CC: circunferencia de la cintura; HOMA-IR: homeostasis model assessment; IMC: índice de masa corporal; iMME: índice de masa muscular esquelética; PCR: proteína C reactiva; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
La tabla 4 muestra las ingestas calóricas y el ejercicio físico en todo el grupo y en los pacientes divididos en los dos grupos según el valor medio de iMME (11,93kg/m2). La ingesta total de energía y el porcentaje de macronutrientes fueron similares en ambos grupos.
Ingesta media y actividad física (media±SD) en los dos grupos de mujeres con obesidad divididos por la mediana de iMME
| Parámetros | Grupo totaln=313 | Bajo iMME n=156 | Alto iMME n=157 | P |
|---|---|---|---|---|
| Calorías (kcal/día) | 1810,1±229,2 | 1804,2±202,1 | 1813,1±118,4 | p=0,51 |
| Hidratos de carbono (g/día) (PCT%) | 199,9±54,1 (46,1%) | 197,5±41,1 (46,4%) | 199,9±58,1 (46,0%) | p=0,48 |
| Grasas (g/día) (PCT%) | 70,9±11,9(33,7%) | 69,6±10,2 (33,4%) | 71,1±10,9(33,3%) | p=0,55 |
| Proteínas (g/día) (PCT%) | 100,5±9,0(20,2%) | 101,2±11,0 (20,2%) | 97,9±9,1(20,7%) | p=0,34 |
| Fibra (g/día) | 16,5±4,8 | 16,6±4,0 | 16,2±5,9 | p=0,28 |
| Actividad física (min/semana) | 129,3±12,1 | 127,3±8,1 | 129,4±7,2 | p=0,44 |
PCT: porcentaje de las calorías total.
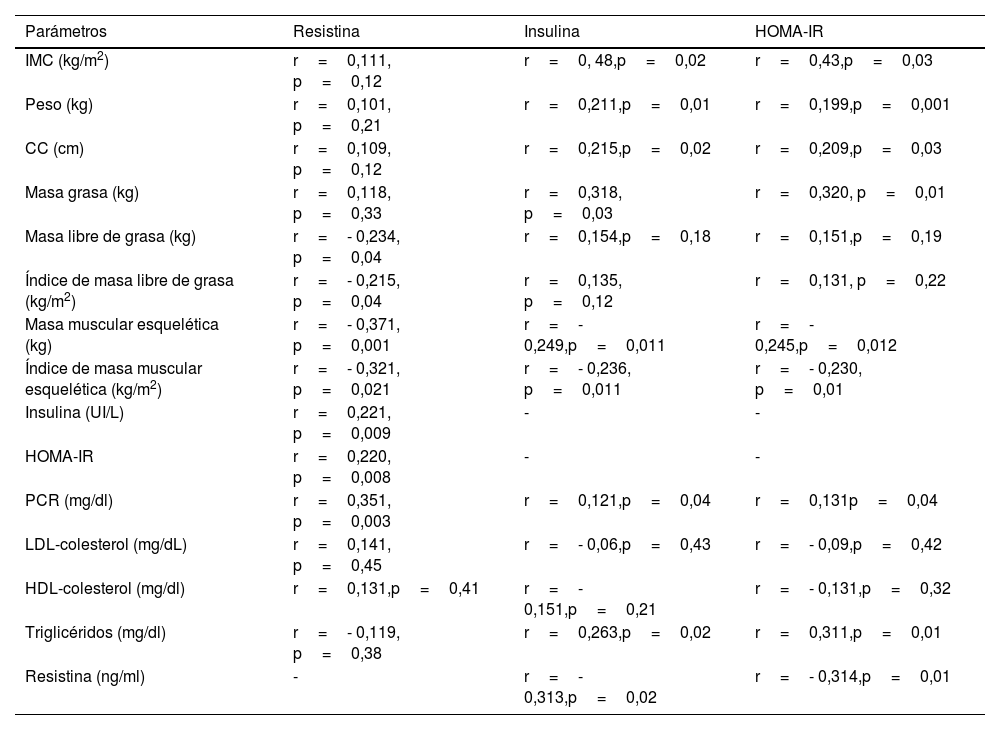
En la tabla 5 se muestra el análisis de correlación de los valores de resistina, insulina y HOMA-IR con los parámetros antropométricos y datos bioquímicos. Los niveles de resistina sérica no se correlacionaron con el IMC, peso ni masa grasa, pero sí se correlacionan inversamente con la MLG, iMLG, MME y el iMME. Esta adipoquina muestra una correlación positiva con los niveles de insulina, HOMA-IR y PCR. Los niveles de insulina en ayunas y HOMA-IR muestran una correlación positiva con el IMC, peso, la circunferencia de cintura, masa grasa y una correlación negativa con MME e iMME. Los niveles de HOMA-IR y los niveles de insulina muestran una correlación positiva con resistina, triglicéridos y proteína C reactiva.
Análisis de correlación entre los niveles de resistina, parámetros de impedanciometría bioeléctrica y resistencia a la insulina
| Parámetros | Resistina | Insulina | HOMA-IR |
|---|---|---|---|
| IMC (kg/m2) | r=0,111, p=0,12 | r=0, 48,p=0,02 | r=0,43,p=0,03 |
| Peso (kg) | r=0,101, p=0,21 | r=0,211,p=0,01 | r=0,199,p=0,001 |
| CC (cm) | r=0,109, p=0,12 | r=0,215,p=0,02 | r=0,209,p=0,03 |
| Masa grasa (kg) | r=0,118, p=0,33 | r=0,318, p=0,03 | r=0,320, p=0,01 |
| Masa libre de grasa (kg) | r=- 0,234, p=0,04 | r=0,154,p=0,18 | r=0,151,p=0,19 |
| Índice de masa libre de grasa (kg/m2) | r=- 0,215, p=0,04 | r=0,135, p=0,12 | r=0,131, p=0,22 |
| Masa muscular esquelética (kg) | r=- 0,371, p=0,001 | r=- 0,249,p=0,011 | r=- 0,245,p=0,012 |
| Índice de masa muscular esquelética (kg/m2) | r=- 0,321, p=0,021 | r=- 0,236, p=0,011 | r=- 0,230, p=0,01 |
| Insulina (UI/L) | r=0,221, p=0,009 | - | - |
| HOMA-IR | r=0,220, p=0,008 | - | - |
| PCR (mg/dl) | r=0,351, p=0,003 | r=0,121,p=0,04 | r=0,131p=0,04 |
| LDL-colesterol (mg/dL) | r=0,141, p=0,45 | r=- 0,06,p=0,43 | r=- 0,09,p=0,42 |
| HDL-colesterol (mg/dl) | r=0,131,p=0,41 | r=- 0,151,p=0,21 | r=- 0,131,p=0,32 |
| Triglicéridos (mg/dl) | r=- 0,119, p=0,38 | r=0,263,p=0,02 | r=0,311,p=0,01 |
| Resistina (ng/ml) | - | r=- 0,313,p=0,02 | r=- 0,314,p=0,01 |
HOMA-IR: homeostasis model assessment; PCR: proteína C reactiva.
Se utilizó un modelo de regresión lineal multivariante paso a paso ajustada por edad, ingesta y actividad física para investigar los determinantes de iMME. En modelo multivariado ajustado por edad, sexo, ingesta proteica, se incluyeron variables relacionadas con iMME en el análisis univariado (p<0,01). En este modelo con iMME como variable dependiente, los niveles de resistina explicaron el 12% de la variabilidad (Beta -0,38, IC95% -0,91- -0,11) y los niveles de insulina representaron el 22% de la variabilidad (Beta 1,58, IC95% 1,22-4,29).
DiscusiónEste es el primer estudio que evalúa la asociación de la masa muscular esquelética mediante el análisis de impedancia bioeléctrica (BIA) y la resistina en mujeres con obesidad. En nuestro estudio, los niveles séricos de resistina fueron más altos en el grupo de bajo índice de masa muscular esquelética (iMME) y demostraron una correlación positiva entre los niveles de resistina, y los niveles de insulina y HOMA-IR. Con una correlación negativa con la MLG, iMLG, MME e iMME.
La resistina se describió originalmente como una adipoquina que causaba resistencia a la insulina en ratones, siendo producida por el tejido adiposo blanco18. En los seres humanos, la resistina actúa como una molécula proinflamatoria, que es producida principalmente por células del sistema inflamatorio como monocitos, macrófagos y neutrófilos19, habiéndose demostrado que la resistina es un ligando del receptor tipo Toll 4 (TLR4) y está implicado en la activación de múltiples vías de señalización inflamatorias20. También se ha demostrado que la resistina empeora las vías de señalización de la insulina21 generando por tanto resistencia a la insulina, y por tanto provocando un deterioro de metabolismo glucídico y posiblemente desarrollo de diabetes mellitus. En nuestro trabajo se muestra una correlación inversa entre los niveles de insulina y HOMA-IR con los niveles circulantes de resistina. Desde el punto de vista fisiopatológico, estos datos sugieren que la resistina puede verse relacionada con la disminución de la masa muscular. Algunos trabajos han mostrado cómo en pacientes con sarcopenia los niveles de resistina son el doble que en población sana22, y también se ha encontrado una relación inversa entre la masa muscular determinada por ecografía muscular y la resistina en pacientes con enfermedad pulmonar obstructiva crónica13.
Como hemos comentado previamente la resistina es una molécula inflamatoria que se ha relacionado con múltiples enfermedades crónicas, como tumores23, arteriosclerosis y arteriopatía diabética24. Se ha demostrado en estos trabajos que la resistina no se correlaciona con la masa grasa, de manera similar a los hallazgos de nuestro estudio. Esta es una diferencia con los modelos murinos, en los que sí se correlacionaban los niveles de resistina con la masa grasa, ya que esta molécula se sintetiza fundamentalmente en este tejido en el modelo murino18, sin embargo, en los humanos, esta molécula se expresa en las células inflamatorias (macrófagos, monocitos, etc.), siendo por tanto un mediador inflamatorio, y no existiendo una correlación directa con la masa grasa. En nuestro estudio, hemos demostrado que con los niveles de resistina, aunque se correlacionan negativamente con los parámetros de masa muscular, no lo hacen con la masa grasa. Esto se debe a la relación con la masa libre de grasa que representa la masa muscular, hueso, etc., sin incluir la masa grasa. En nuestro trabajo demostramos por primera vez, cómo los niveles de resistina se correlacionan negativamente con la masa muscular en mujeres con obesidad y mayores de 60 años. Esta asociación de la resistina con la masa muscular puede ser debida a múltiples efectos, por ejemplo, efectos endocrinos, efectos inflamatorios y modulando el metabolismo energético10, como ya se ha demostrado en un trabajo previo con la masa muscular del cuádriceps25. En este trabajo25 con 412 pacientes del proyecto «Myoage», se detectó esa relación inversa en sujetos ancianos determinando el músculo mediante absorciometría con rayos X de doble energía. Se ha demostrado que la resistina inhibe la diferenciación de células satélites musculares y promueve su diferenciación a adipocitos, generando una disminución de la masa muscular total26. Esto sugiere una relación directa entre los niveles de resistina y la masa muscular. Por ejemplo, en otro trabajo realizado en 2000 sujetos sin riesgo cardiovascular, se demostró que la densidad del músculo a nivel abdominal determinada por tomografía axial computarizada correlacionó negativamente con los niveles de resistina27. Por otra parte, en un estudio realizado en estudiantes sanos, se demostró también una relación inversa entre los niveles de resistina y la masa muscular determinada por impedanciometría28. Todos estos datos en poblaciones diferentes a la evaluada en nuestro estudio, así como utilizando diferente tecnología para la determinación de la masa muscular, coinciden en la relación inversa entre la resistina y la masa muscular, como en nuestras+muestra de mujeres con obesidad.
Por último la relación entre los niveles de resistina y la resistencia a la insulina detectados en nuestro estudio, corroboran los resultados de la literatura21, existiendo un nexo a través de la situación proinflamatoria, como demuestra también la correlación con los niveles de PCR21.
Las limitaciones de nuestro estudio son las siguientes: en primer lugar, el diseño se ha realizado solo en mujeres caucásicas con obesidad, por lo que los datos no son generalizables a otras etnias, niños, sujetos con sobrepeso u otros pacientes con obesidad y diabetes. En segundo lugar, la investigación con un diseño transversal no permite ninguna inferencia de causalidad. En tercer lugar, el sesgo de selección es probable porque nuestro estudio se basó en un solo hospital. En cuarto lugar, la presencia de algún paciente con alteración de glucemia en ayunas puede influir los resultados obtenidos en relación con la resistencia a la insulina. En quinto lugar, otras adipocitoquinas y vías metabólicas pueden estar implicadas en nuestros hallazgos, que no hemos evaluado29. Finalmente, en nuestro estudio no hemos determinado la fuerza ni la funcionalidad muscular, por tanto, no podemos hablar realmente de sarcopenia, solo de masa muscular determinada por impedanciometría. Algunas fortalezas de nuestro estudio son el control de la ingesta nutricional como posible factor de confusión, así como la actividad física.
En conclusión, los niveles séricos de resistina se asocian con baja masa muscular esquelética en mujeres con obesidad mayores de 60 años. Teniendo en cuenta la evidencia del papel inflamatorio y antiproliferativo muscular de la resistina, nuestros resultados la señalan como un marcador potencial asociado al daño muscular y promueven más estudios en el área del tratamiento y el diagnóstico de esta adipoquina en el soporte nutricional. Se podrían explorar nuevas estrategias, como la intervención dietética, para modular la concentración de resistina, ya que investigaciones anteriores mostraron cambios en los niveles de resistina después de intervenciones dietéticas30.
Todos los datos generados o analizados durante este estudio se incluyen en este artículo.
Responsabilidades éticasEste protocolo de estudio fue revisado y aprobado por el Comité HCVUA, número de aprobación No 6/2021. Se obtuvo el consentimiento informado por escrito de todos los participantes individuales incluidos en el estudio.
Autoría/colaboradoresDaniel Antonio de Luis diseñó el estudio y escribió el artículo.
Juan José López Gómez, Emilia Gómez Hoyos y Olatz Izaola, realizaron la evaluación nutricional.
D. Primo y D. de Luis realizaron la evaluación bioquímica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.