La desconexión del ducto pancreático, o síndrome del ducto pancreático desconectado (SDPD), es una entidad clínica que consiste en la existencia de una situación anatómica en la que hay ausencia de la continuidad del conducto pancreático entre el tejido pancreático viable y el tracto gastrointestinal, causada por necrosis ductal tras pancreatitis aguda grave tratada mediante necrosectomía, drenaje percutáneo o médicamente.
No hay datos epidemiológicos claros sobre la incidencia real de SDPD. Se ha postulado que entre un 10 y un 30% de los pacientes con pancreatitis aguda grave desarrollan un SDPD.
La literatura existente sobre este tema es escasa, los términos empleados son confusos y los algoritmos terapéuticos son poco claros. Las opciones terapéuticas son endoscópicas y quirúrgicas.
Hemos efectuado una revisión sistemática de la literatura sobre SDPD.
Disconnected pancreatic duct syndrome (DPDS) is characterized by disruption of the main pancreatic duct with a loss of continuity between the pancreatic duct and the gastrointestinal tract caused by ductal necrosis after severe acute necrotizing pancreatitis treated medically, by percutaneous drainage, or necrosectomy.
There are no clear epidemiological data on the real incidence of DPDS; approximately 10 to 30% of patients with severe acute pancreatitis could develop DPDS. The existing literature is scarce, the terminology is confusing and therapeutic algorithms are not clearly defined. Both endoscopic and surgical management have been described.
We have performed a sytematic review of the literature on DPDS.
En 1991, Kozarek et al. denominan por primera vez desconexión del ducto pancreático, o síndrome del ducto pancreático desconectado (SDPD), a una entidad clínica ya referida previamente en la literatura médica que consiste en la existencia de una situación anatómica en la que hay ausencia de la continuidad del conducto pancreático entre el tejido pancreático viable y el tracto gastrointestinal, causada por necrosis ductal tras pancreatitis aguda grave tratada mediante necrosectomía, drenaje percutáneo o médicamente1–8. El segmento pancreático viable aislado continúa con su función exocrina, causando colecciones intra- o peripancreáticas inflamatorias o una fístula pancreática externa5–11.
Se considera que, además de la pancreatitis aguda, otras etiologías posibles de un SDPD pueden ser la pancreatitis crónica, el traumatismo pancreático, el páncreas divisum u otras causas2,9,12,13. Otros nombres empleados para definir este síndrome son: síndrome de la cola pancreática desconectada y remanente pancreático izquierdo desconectado2.
No hay datos epidemiológicos claros sobre la incidencia real de SDPD. Se ha postulado que entre un 10 y un 30% de los pacientes con pancreatitis aguda grave desarrollan un SDPD. Cada vez con mayor frecuencia se atiende a pacientes diagnosticados de SDPD11. La literatura existente sobre este tema es escasa, los términos empleados son confusos y los algoritmos terapéuticos son poco claros2,4,7,9. Por ello, hemos decidido realizar una revisión sistemática de la literatura sobre SDPD.
BúsquedaHemos efectuado una búsqueda en Pubmed (1966-2012) de artículos en inglés y español con los términos «disconnected pancreatic duct syndrome» (17) y «disconnected pancreas» (29) y, revisados los artículos, solo 15 eran pertinentes. Ante el escaso número de citaciones, se revisaron las citas de dichos artículos buscando un mayor información sobre este tema que no estuviera incluida con los términos de búsqueda. Hemos revisado finalmente un total de 23 artículos. No existen ensayos aleatorizados, guías clínicas ni metaanálisis sobre SDPD.
DefiniciónClásicamente en la pancreatitis aguda, se ha valorado como determinante de gravedad la necrosis glandular pancreática, pero en ciertos pacientes, la necrosis del epitelio ductal es más grave e importante que la necrosis glandular6. El SDPD se produce tras necrosarse un porcentaje variable de parénquima pancreático, habitualmente de localización central, lo que provoca una lesión ductal que causa que el remanente distal quede desconectado del conducto pancreático proximal y su producción exocrina no pueda drenar al tracto gastrointestinal. Todo ello hace que se forme una colección intraabdominal o una fistula pancreática externa (FPE)5,6,14. Cuando existe FPE, no suele existir ninguna comunicación entre la fístula y el ducto proximal, y la fístula está alimentada exclusivamente por el remanente distal14. En la serie de Howard de 27 pacientes con SDPD, el 70% cursa con FPE y un 30% con colección intraabdominal5.
El SDPD sucede habitualmente tras necrosectomía quirúrgica por pancreatitis aguda o walled-off pancreatic necrosis (WOPN) (50-75% de los pacientes con SPDP)2. Un 15-25% de los pacientes a los que se efectúa necrosectomía presentan FPE14,15. La pregunta es si esos datos son ciertos, porque no nos enfrentamos a más pacientes con SDPD2,9, ya que, además de los operados, también puede ocurrir en pacientes tratados mediante drenaje percutáneo. Probablemente, pacientes paucisintomáticos o con diagnósticos erróneos son los causantes del escaso número de pacientes diagnosticados de SDPD2. La existencia de casos no intervenidos indica que la causa es el daño ductal originado por la pancreatitis per se y no la intervención quirúrgica o percutánea realizada.
DiagnósticoUn diagnóstico correcto de SDPD es esencial, ya que el tratamiento a efectuar es diferente del utilizado en otras colecciones intra- o peripancreáticas pospancreatitis, como por ejemplo los pseudoquistes, o las FPE posnecrosectomía causadas por obstrucción ductal que pueden solventarse con una prótesis transpapilar colocada mediante CPRE7,15, y de las llamadas disrupciones parciales del ducto, que no deben considerarse SDPD ya que no son verdaderas desconexiones ductales13. Esta dificultad diagnóstica complica enormemente extraer conclusiones cuando se comparan resultados, ya que en las series, probablemente, se incluyen pacientes incorrectamente diagnosticados8.
La existencia en la tomografía axial computarizada (TAC) de un delgado y pequeño puente de tejido pancreático viable, comprimido inferior o posteriormente, previene de diagnosticar erróneamente un SDPD ya que estaremos ante una disrupción parcial5. Las colecciones fluidas que comprimen la glándula, usualmente desplazan el ducto que entra en ellas con un ángulo oblicuo y no recto con la pared de la colección, como ocurre en el SDPD6.
Los métodos empleados para diagnosticar un SDPD son: TAC, resonancia magnética nuclear (RMN) y pancreatografía mediante colangiopancreatografía retrograda endoscópica (CPRE)2,6,16. Se ha propuesto sustituir la pancreatografía de la CPRE por una colangiorresonancia nuclear magnética (CRMN) con estimulación de secretina, pero la primera tiene una sensibilidad algo superior para demostrar la fuga ductal, aunque es más invasiva5,6,9,10,13,14,16. La fistulografía cuando hay FPE puede ser útil en algunos casos para diferenciar entre fístula terminal o lateral5.
Los criterios diagnósticos clásicos de SDPD son: discontinuidad del ducto pancreático principal con evidencia de tejido pancreático viable distal y presencia de una colección fluida persistente en los métodos de imagen, o discontinuidad del ducto pancreático principal en la CPRE e imposibilidad de acceder o canular el ducto distal4,7–9,11,14. La incapacidad por parte del endoscopista para atravesar la zona desconectada con una guía o tutor era, a priori y clásicamente, una evidencia de que el ducto estaba completamente desconectado y no solo desestructurado, aunque actualmente el refinamiento técnico obtenido permite en ocasiones la canulación del remanente distal desconectado8,9,11.
Se han propuesto unos criterios más concretos de tal modo que estamos ante un SDPD si:
- -
En la TAC hay necrosis o colección en el cuello o cuerpo pancreático de al menos 2cm de páncreas y tejido viable pancreático distal desde la zona de necrosis, o un ducto pancreático entrando en la colección con un ángulo de 90°2,6,14.
- -
La extravasación de material de contraste inyectado en el ducto pancreático en la pancreatografía obtenida por CPRE, ecoendoscopia o intraoperatoria o la sección/desconexión completa del ducto en el remanente distal2,6,14.
En una TAC realizada 2 semanas tras el inicio de la pancreatitis aguda, se pueden reconocer ya algunos datos sugestivos de SDPD, pero no son definitivos8. El ducto pancreático distal puede observarse dilatado o no en las distintas pruebas de imagen6. Las necrosis inferiores a 2cm sin lesión ductal inicial pueden cicatrizar sin afectación del ducto pero posteriormente la fibrosis y la cicatrización tisular pueden producir una estenosis del ducto pancreático que puede causar pancreatitis recurrente, aunque no podemos hablar de SDPD2,6,8.
La localización más frecuente del SDPD es el cuello pancreático, especialmente en las pancreatitis litiásicas, y se puede deber a la particular vascularización de esta área pancreática2,9,10. Solo la arteria pancreática dorsal es la que nutre esta zona, mientras que las otras regiones pancreáticas están vascularizadas por más de una arteria. Una alteración del flujo durante la pancreatitis causa necrosis y una posible evolución a SDPD por lesión ductal8. Aunque la disposición anatómica con un angulación brusca del ducto de ascendente anterior a transverso posterior también puede contribuir a que esa sea la zona más afectada10.
ClínicaLa existencia de una colección o FPE tras una necrosectomía o drenaje de una necrosis pancreática infectada que no se solventa en un tiempo prudencial debe hacernos pensar en un SDPD4. El volumen de la fístula informa de la cantidad de tejido pancreático viable4.
La clínica es inespecífica y se han descrito los siguientes síntomas: dolor abdominal, náuseas y vómitos, intolerancia dietética y pérdida de peso2.
La litiasis es la etiología más frecuente de las pancreatitis que causan SDPD2. Un 50% de los pacientes con WOPN tratados mediante drenaje percutáneo desarrollan un SDPD3,17.
Los pacientes con SDPD tienen mayor riesgo de diabetes mellitus, problemas metabólicos y nutricionales por la pérdida de proteínas y electrolitos e hipertensión portal4. Las siguientes complicaciones han sido descritas en relación con el SDPD: colecciones recurrentes pancreáticas fluidas, ascitis y pseudoaneurismas3.
TratamientoClásicamente, el SDPD se había considerado que debía ser tratado mediante cirugía4,9. Pero actualmente existen múltiples opciones de tratamiento (tabla 1).
El SDPD puede cursar como una colección peripancreática o una FPE. El tratamiento difiere en ambos casos. Si el paciente presenta una colección que no incrementa su tamaño y está asintomático, puede, en principio, adoptarse una actitud expectante aunque habitualmente se desarrollarán síntomas en su seguimiento10. Si la colección cursa con síntomas (dolor, fiebre, pancreatitis recurrente), debe ser tratada, habitualmente con técnicas endoscópicas si es factible (drenaje interno [cistogastro o cistoduodenostomías] o prótesis hasta el remanente ductal). La punción mediante drenaje percutáneo debe evitarse ya que provocará una FPE de difícil resolución13.
Ante una FPE por SDPD, los pasos son: la estabilización médica, conocer la anatomía de la disrupción ductal y efectuar un tratamiento médico, endoscópico o quirúrgico10,17. El manejo médico (nutrición y análogos de la somatostatina) es lento y con una tasa de éxitos baja; las técnicas endoscópicas son complejas y no siempre factibles; y la cirugía es técnicamente difícil4,15,17. La FPE se produce habitualmente a través de uno de los drenajes de la necrosectomía o a través de un drenaje percutáneo previo2,10. No existen unas guías de actuación sobre el tratamiento óptimo en la FPE por SDPD. Habitualmente se inicia por el tratamiento médico, se prosigue con las técnicas endoscópicas y, si estas fracasan, se plantea la cirugía9.
Debemos esperar al menos 6 semanas antes de plantear un tratamiento quirúrgico ya que pospondremos la cirugía hasta que la inflamación pancreática haya cedido y la FPE se haya consolidado5,10,14,18. Pearson et al. se plantean la cirugía cuando persiste una fístula mayor a 100ml/día transcurridos 3 meses del inicio del SDPD4.
Hemos efectuado un resumen sobre las diversas técnicas endoscópicas y quirúrgicas:
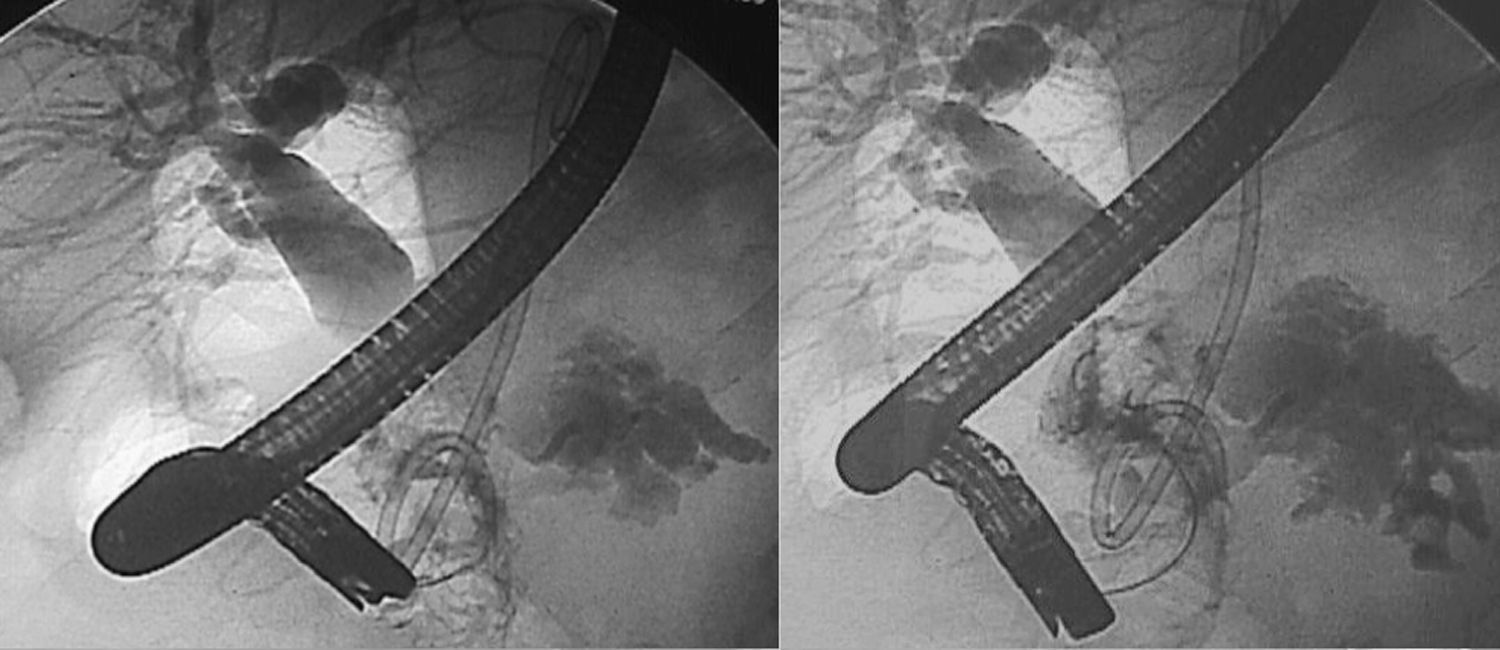
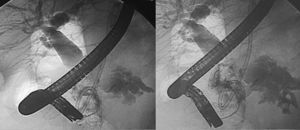
Técnicas endoscópicasLas técnicas endoscópicas no son solo diagnósticas sino actualmente terapéuticas en el SDPD4,9. Además, cuando no resuelven totalmente el SDPD, pueden servir como puente previo a la cirugía, facilitando una mejoría de las condiciones locales y generales del paciente14. La tasa de éxito de las series antiguas, sin clara definición de SDPD, oscilan entre el 25 y el 37% pero actualmente han mejorado, llegando al 61-75%. Los resultados son especialmente óptimos cuando hay colección, pero peores cuando hay FPE2,4,9,11,17. Los defensores de las técnicas endoscópicas destacan unos buenos resultados, nula mortalidad, baja morbilidad (25%) y, aunque la tasa de recidiva es cercana al 50%, existe la posibilidad de repetir el procedimiento9,11,17 (fig. 1).
La técnica básica inicial consiste en la CPRE y colocación de prótesis pero se debe tutorizar el remanente distal, hecho habitualmente muy difícil. Recordemos que el drenaje transpapilar simple no es útil. Como ya hemos dicho, clásicamente se consideraba que el no poder canular el remanente distal era diagnóstico de SDPD; el perfeccionamiento de las técnicas endoscópicas hace que, en la actualidad, en algunos pacientes (10-25%) sí se pueda llegar a canalizar el remanente ductal9,16. Como ya hemos dicho, el drenaje transpapilar ductal es muy efectivo en las fístulas laterales que no son verdaderas SDPD pero no suele conseguir solventar las terminales14.
Cuando la canulación distal no ha sido factible, existen otras opciones técnicas en la literatura basadas en el drenaje interno mediante ecoendoscopia; es decir, localizar la colección y el ducto mediante la ecoendoscopia y proceder a su comunicación con el tubo digestivo (estómago o duodeno), colocando una prótesis que conecte ambos19,20. Las diversas opciones son: realizar una pancreatografía transgástrica guiada mediante ecoendoscopia para localizar el ducto y, posteriormente, efectuar drenaje del ducto dilatado vía transgástrica9,20; efectuar un drenaje guiado mediante ecoendoscopia desde la cuarta porción duodenal9,19,21 o emplear técnicas mixtas rendez-vous entre radiología intervencionista y endoscopista17. Un 20-50% de los pacientes drenados por ecoendoscopia desarrollan diabetes mellitus9.
En los casos tratados mediante drenaje interno, no hay consenso sobre qué tipo de drenaje debe emplearse. Los permanentes entre la colección y el tubo digestivo han sido empleados con buenos resultados, aunque existe la posibilidad de su migración o infección3,17. Las prótesis no permanentes se pueden ocluir y pueden producir fracasos terapéuticos a corto-medio plazo13.
La embolización del ducto pancreático distal con cianocrilato ha sido empleada en muy pocos pacientes con resultados aceptables: aunque cierra la FPE, no soluciona el problema del remanente distal desconectado10,14,17,22,23.
Técnicas quirúrgicasLa cirugía puede considerarse como la solución definitiva ante el fracaso de las técnicas endoscópicas o como primera opción10. La crítica principal al tratamiento quirúrgico del SDPD es la morbilidad (0-14%) y mortalidad (0-8%), y la principal ventaja es su tasa de éxito del 80%2,10,15. Entre las posibles opciones quirúrgicas se encuentran las técnicas resectivas (pancreatectomía distal con/sin esplenectomía) y las derivativas (fistuloyeyunostomía en Y de Roux, pancreaticoyeyunostomía o pancreaticogastrostomía)2,4,5,7,14. Se recomienda efectuar colecistectomía si no se hubiera realizado previamente5.
Las técnicas derivativas tienen varias ventajas: teóricamente, son más sencillas (menos sangrado intraoperatorio, menos transfusión y menos tiempo operatorio), tienen una menor incidencia de complicaciones postoperatorias (6%) y menor estancia media, y preservan la función endocrina y exocrina con una tasa inferior de diabetes postoperatoria2,5,12,14. Aunque en la serie de Murage et al. presenta una tasa mayor de abscesos intraabdominales que las técnicas resectivas2. La tasa media de éxito de las técnicas derivativas en conjunto es cercana al 80%2. En la única serie que combina las 3 opciones derivativas no se observan diferencias en cuanto a resultados por emplear una u otra técnica2.
En la serie de Pearson et al. de 7 fistuloyeyunostomías (FY) no hubo recurrencia de la pancreatitis, ni dilatación del ducto pancreático, ni insuficiencia exocrina, pero la mitad de los pacientes presentaron insuficiencia endocrina moderada, tratada con antidiabéticos orales4. En otras series cortas de FY, presentan una tasa de éxito del 77 al 100%10,18. Los autores de estas series sobre FY remarcan la necesidad de tener un tracto fibroso bien formado para hacer la FY, de ahí la importancia de esperar un tiempo prudencial antes de realizar la intervención5,18. Murage et al. recomiendan la realización de una derivación ductomucosa ya que opinan que es mejor que la FY, aunque en ocasiones es difícil de realizar, ya que obliga a realizar una pequeña resección pancreática2.
La principal desventaja de la resección pancreática es la pérdida de tejido pancreático que puede comprometer aún más una función exocrina y endocrina ya frecuentemente deteriorada y la dificultad de una resección en órgano con pancreatitis previa, de ahí que habitualmente el sangrado intraoperatorio y la morbilidad (19%) sean mayores que en las técnicas derivativas4,10. Howard et al. recomiendan la resección cuando exista trombosis de la vena esplénica o hipertensión portal izquierda, no se pueda excluir malignidad y en pacientes con pancreatitis obstructiva2,8. Murage añade otra indicación más: un remanente ductal muy pequeño (inferior a 6cm)2. La tasa de éxito de las técnicas resectivas es aproximadamente del 75%2.
La recidiva de la fístula pancreática es mayor en el grupo de la pancreatectomía5. Los datos sobre la tasa de relaparotomía de ambos tipo de técnicas son dispares en las escasas series publicadas5 (figs. 1–3; tabla 1).
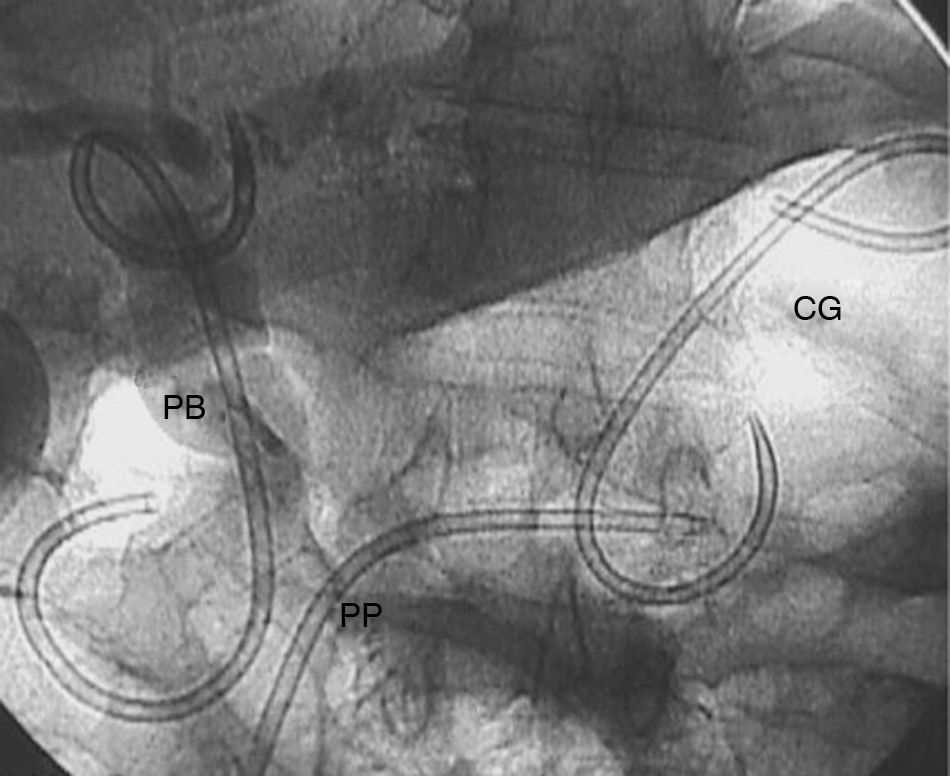
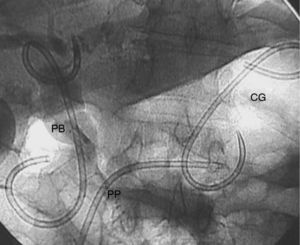
Paciente figura 1. PP: prótesis pancreática. PB: prótesis biliar. CG: cistogastrosotomía.
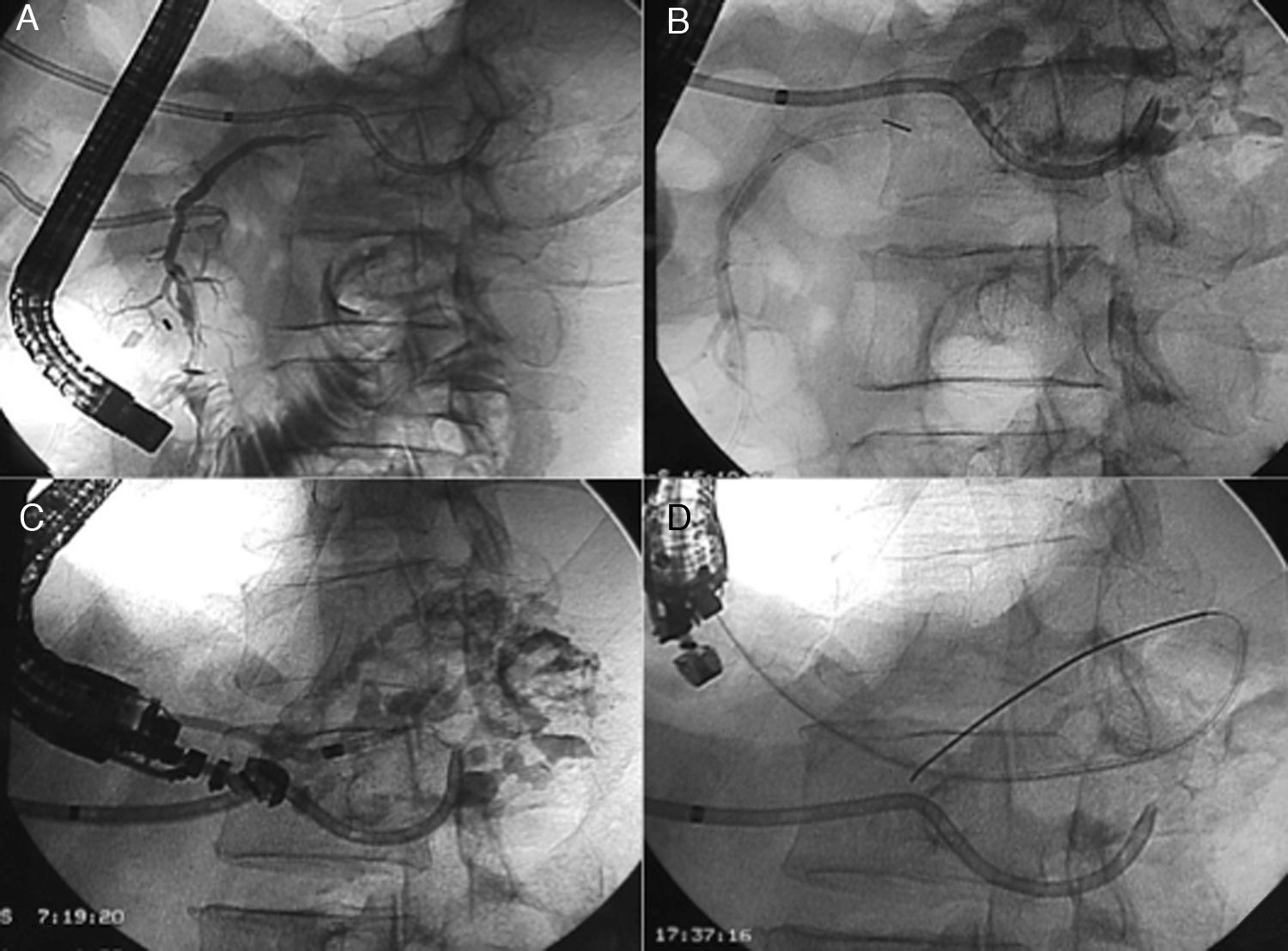
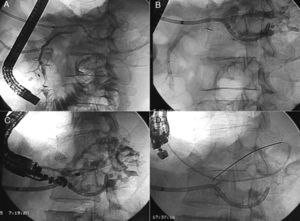
A y B: Pancreatografía retrógrada endoscópica (CPRE): A) Wirsung con transección completa en cuerpo yuxtacefálico con el conducto opacificado en cabeza, y falta de relleno en cuerpo y cola. B) Punta de catéter endoscópico (esfinterotomo) en la transección. Opacificación de colección residual y Wirsung de cola a través del catéter percutáneo. C y D) Pancreatografía endosonográfica (CPES) mediante punción transgástrica. C) Inyección de contraste a través de un dilatador introducido mediante Seldinger transgástrico hasta el wirsung de cola. D) Prótesis pancreatogástrica de plástico, sobre guía (pancreático-gastrostomía).
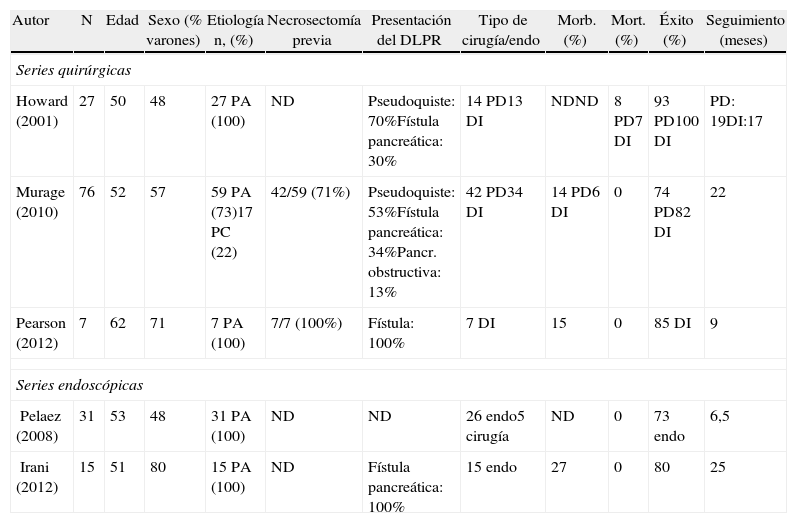
| Autor | N | Edad | Sexo (% varones) | Etiología n, (%) | Necrosectomía previa | Presentación del DLPR | Tipo de cirugía/endo | Morb. (%) | Mort. (%) | Éxito (%) | Seguimiento (meses) |
| Series quirúrgicas | |||||||||||
| Howard (2001) | 27 | 50 | 48 | 27 PA (100) | ND | Pseudoquiste: 70%Fístula pancreática: 30% | 14 PD13 DI | NDND | 8 PD7 DI | 93 PD100 DI | PD: 19DI:17 |
| Murage (2010) | 76 | 52 | 57 | 59 PA (73)17 PC (22) | 42/59 (71%) | Pseudoquiste: 53%Fístula pancreática: 34%Pancr. obstructiva: 13% | 42 PD34 DI | 14 PD6 DI | 0 | 74 PD82 DI | 22 |
| Pearson (2012) | 7 | 62 | 71 | 7 PA (100) | 7/7 (100%) | Fístula: 100% | 7 DI | 15 | 0 | 85 DI | 9 |
| Series endoscópicas | |||||||||||
| Pelaez (2008) | 31 | 53 | 48 | 31 PA (100) | ND | ND | 26 endo5 cirugía | ND | 0 | 73 endo | 6,5 |
| Irani (2012) | 15 | 51 | 80 | 15 PA (100) | ND | Fístula pancreática: 100% | 15 endo | 27 | 0 | 80 | 25 |
DI: derivación interna; Endo: endoscopia; ND: no disponible; PA: pancreatitis aguda; PD: pancreatectomía distal.
El SDPD es una entidad clínica que sucede habitualmente tras una pancreatitis aguda grave y que cursa con la aparición de una colección o de FPE. Es fundamental un diagnóstico correcto y debe ser diferenciada, mediante TAC y CRMN, del pseudoquiste de páncreas, la disrupción ductal parcial, la WOPN y otros síndromes pospancreatitis. El tratamiento era clásicamente quirúrgico pero actualmente puede ser endoscópico, ya sea CPRE o, habitualmente, drenaje interno guiado por ecoendoscopia. Las técnicas endoscópicas presentan baja morbimortalidad pero un éxito inferior a largo plazo que las técnicas quirúrgicas. La cirugía derivativa o resectiva es más efectiva pero con mayor morbimortalidad. No existen algoritmos terapéuticos consensuados internacionalmente pero cada vez es más habitual emplear primero técnicas endoscópicas y, si fracasan, plantear la cirugía. El SDPD es otra enfermedad más donde se demuestra que la colaboración multidisciplinaria entre radiólogos, gastroenterólogos y cirujanos es básica para atender a estos pacientes con enfermedad pancreática compleja.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.