La afectación metastásica a nivel ganglionar es el principal factor pronóstico en el carcinoma pulmonar localizado. Pese al estudio anatomopatológico de las piezas obtenidas tras una adecuada linfadenectomía mediastínica, la recidiva tumoral alcanza el 40% en pacientes estadio i tras la cirugía oncológica curativa. En este trabajo hemos realizado el estudio de micrometástasis por métodos moleculares en el ganglio centinela de pacientes con carcinoma pulmonar estadio i.
Material y métodosMarcaje del ganglio centinela mediante la inyección peritumoral de 2 mCi de nanocoloide de albúmina (Nanocol®) marcado con 99mTc en un volumen de 0,3ml tras la toracotomía. Guiados mediante la sonda gammagráfica Navigator® se procedió a su localización y exéresis. Se extrajo ARN de los tejidos y se analizó la presencia de ARNm de los genes CEACAM5, PLUNC y CK7.
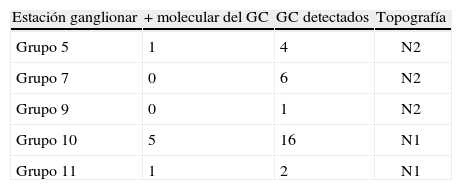
ResultadosSe incluyó a 29 pacientes. De los genes testados, el CEACAM5 y el PLUNC fueron los que mostraron una alta expresión en tejido pulmonar. De los 29 ganglios centinela analizados, 7 (24%) fueron positivos para estudio molecular. Se encontró ganglio centinela positivo en: 4/7 adenocarcinomas y 3/12 escamosos. Los ganglios afectos fueron: nivel 5 (1/3), nivel 7 (0/6), nivel 9 (0/1), nivel 10 (5/11), nivel 11 (1/1).
ConclusionesLa detección del ganglio centinela en pacientes con carcinoma pulmonar estadio i mediante marcaje con radioisótopo es factible. La aplicación de técnicas moleculares pone de manifiesto la afectación tumoral en casos estadificados como estadio i.
Metastatic lymph node affectation is the main prognostic factor in localized lung cancer. Pathological study of the obtained samples even after an adequate lymphadenectomy, present tumoral relapses of 40% of stage I patients after oncological curative surgery. In this paper we have studied micrometastasis in the sentinel lymph node by molecular methods in patients with stage I lung cancer.
Material and methodsThe sentinel node was marked by injecting peritumorally performed just after performing the thoracotomy with 2 mCi of nanocoloid of albumin (Nanocol®) marked with 99mTc in 0.3ml. Guided with a Navigator® gammagraphic sensor, we proceeded to its resection. RNA of the tissue was extracted and the presence of genes CEACAM5, PLUNC and CK7 in mRNA was studied.
ResultsTwenty nine 29 patients were included. Of the tested genes, CEACAM5 and PLUNC were the ones that showed a high expression in lung tissue. Of the 29 analyzed sentinel lymph nodes, 7 (24%) were positive in the molecular study. A positive sentinel lymph node was found in 4/7 adenocarcinomas and 3/12 squamous-cell tumors. Affected lymph nodes were: station 5 (1/3), station 7 (0/6), station 9 (0/1); station 10 (5/11); station 11 (1/1).
ConclusionsDetection of sentinel node in patients with stage i lung cancer by marking with radioisotope is a feasible technique. The application of molecular techniques shows the tumoral affectation in cases staged as stage i.
La linfadenectomía mediastínica en el carcinoma pulmonar es un procedimiento usual. Dentro del TNM, el especial tropismo de las células neoplásicas pulmonares por los territorios linfáticos hace que un adecuado y exhaustivo estudio de las adenopatías mediastínicas sea básico para establecer una correcta estadificación. La afectación linfática ganglionar por metástasis es, pues, un factor pronóstico de especial relevancia en el cáncer pulmonar1.
Al igual que sucede con el tamaño tumoral, a mayor número de ganglios afectados, mayor extensión anatómica y peor pronóstico2. En el carcinoma de pulmón, la clasificación ganglionar se rige exclusivamente por la ausencia (N0) o presencia (N1-3) y localización de ganglios afectados. Los descriptores N1-3 indican la localización ganglionar: a mayor N, mayor distancia del tumor primario y peor pronóstico.
Toda esta abundante información sobre el impacto pronóstico del número de ganglios y estaciones ganglionares comprometidas por el tumor ha sido posible porque se han extirpado y analizado los ganglios.
Incluso para los tumores en estadio i patológico, a mayor número de ganglios extirpados, mejor pronóstico, aunque no hay unanimidad sobre el número ideal de ganglios que extirpar: en los estudios retrospectivos publicados, este número oscila entre 6 y 153,4, recomendando 10 ganglios5.
La forma generalmente recomendada de linfadenectomía mediastínica es la disección ganglionar sistemática6. Es la técnica que ofrece mejores garantías para una correcta estadificación tanto para certificar y matizar el compromiso ganglionar como para certificar su ausencia.
Los esfuerzos dirigidos a estudiar con técnicas novedosas los ganglios obtenidos en la cirugía van dirigidos a optimizar el rendimiento de las piezas y a aumentar las posibilidades de curación, al establecer un tratamiento acorde a la estadificación de la enfermedad.
El estudio de micrometástasis ganglionares ha sido publicado como un factor de peor pronóstico7. En un estudio publicado por nuestro grupo8 la existencia de micrometástasis ganglionares halladas por métodos moleculares era un factor de más pronta recidiva tumoral. Sin embargo, el gran número de ganglios estudiados por paciente fue un parámetro que nos hizo inviable su aplicación sistemática.
La introducción del concepto de ganglio centinela (GC) bien conocido en tumores de mama y melanoma animó a la detección de dicho GC en el carcinoma pulmonar. Las limitaciones concernientes a su aplicación sistemática son numerosas y precisan de homogeneidad y validación.
El objetivo del presente trabajo es presentar nuestra experiencia en el marcaje del GC en pacientes con carcinoma pulmonar y su estudio molecular en busca de micrometástasis.
Material y métodosAnte un paciente con criterios de inclusión (tabla 1), se procedió al marcaje del GC mediante la inyección peritumoral de 2 mCi de nanocoloide de albúmina (Nanocol®) marcado con 99mTc en un volumen de 0,3ml tras la toracotomía. Pasados un mínimo de 15 min y guiados mediante la sonda gammagráfica Navigator®, se procedió a su localización y exéresis.
Criterios de inclusión de pacientes en el estudio
| Tumor estadio i tras estudio patológico |
| No haber recibido tratamiento adyuvante |
| Ausencia de otras neoplasias previas/sincrónicas |
| Diagnóstico de carcinoma pulmonar primario no de células pequeñas |
| Descartar afectación tumoral en el GC por hematoxilina-eosina |
Se recogieron muestras de tejido sano, tumoral y GC de todos los pacientes con carcinoma pulmonar no microcítico en estadio i en el momento de la cirugía, transcurriendo el menor tiempo posible (< 30min) para preservar lo más intacto el ARNm.
Parte del tejido (pulmón normal, tumor y GC) se congeló inmediatamente y se almacenó en un arcón congelador de –80°C. El resto del tejido se procesó rutinariamente, fijado en formol tamponado, embebido en parafina, realizando secciones teñidas con hematoxilina-eosina y estudio inmunohistoquímico (CKAE1/3; CK7; CK19).
Para el estudio inmunohistoquímico, se usó la técnica estándar (complejo avidina-biotina), en un inmunoteñidor automático (TechMate 500; Biotech Solutions, Dako, Dinamarca), evaluando la inmunorreactividad para CKAE1/3, CK7 y CK19, al ser estos los marcadores histológicos habituales para tejido pulmonar.
Se disecó el ganglio remitido como centinela para el estudio inmunohistoquímico y molecular. Dos terceras partes del ganglio linfático fueron procesadas para estudio anatomopatológico convencional y una tercera parte se preservó en 1ml de RNA later™ (QIAGEN), identificado con el nombre del paciente y fecha de nacimiento. De este material se extraerá el ARNm para RT-PCR.
Para la detección de metástasis ocultas por medio de RT-PCR como técnica molecular se escogieron los marcadores de expresión génica CK7, CEACAM5 y PLUNC. Se empleó GADPH como control de expresión génica, que nos permite evaluar la calidad de la muestra y normalizar el resultado del estudio de expresión.
La elección de los 3 marcadores se basa en el trabajo de Benlloch et al. (2009)8 donde se realizó un extensa búsqueda en el catálogo SAGE (http://cgap.nci.nih.gov/Catalog; Lash et al., 2000)9 con el objetivo de seleccionar genes con alta expresión en tejido pulmonar y baja o nula expresión en ganglios linfáticos benignos. Se seleccionaron los genes CK7, CEACAM5 y PLUNC como los más específicos para la detección de metástasis pulmonar, por lo que se considera a aquellos ganglios linfáticos con expresión de al menos 2 de los genes marcadores de presencia de células de origen pulmonar como positivos moleculares.
La fracción de tejido tumoral, pulmonar normal y de GC se manejó en frío y con material estéril. Se procedió a su triturado en un equipo TissueLyser® (QIAGEN) según protocolo recomendado por el fabricante. A partir del homogeneizado, se procedió a la extracción de ARN utilizando el kit QIAGEN RNA Mini Kit™ (QIAGEN) en un extractor automático de ácidos nucleicos (Qiacube™, QIAGEN). El ARN obtenido de las muestras se cuantificó utilizando el espectrofotómetro NanoDrop 2000® (NanoDrop Technologies). Para la obtención de ADNc, se procedió a realizar una RT-PCR empleando el kit GeneAmp RT-PCR™ (Applied Biosystems) a partir del 1μg de ARN total usando hexámeros al azar (random hexamers) de acuerdo a las instrucciones del fabricante. El ADNc se almacenó a –80°C hasta su utilización.
El estudio de expresión génica se realizó en un equipo ABI7500® (Applied Biosystems). Los primeros, las sondas y la Taqman Universal MX™ se adquirieron en la casa comercial Applied Biosystems. Se emplearon 2,5μl de ADNc para la amplificación de la PCR. Cada muestra se analizó por triplicado. En todos los ensayos se incluyeron controles negativos y positivos. Las condiciones de la PCR fueron: incubación inicial a 50°C durante 2min para activar la AmpErase UNG™; posteriormente a 95°C durante 10min para activar la AmpliTaq Gold polymerase™, seguido de 50 ciclos a 95°C durante 15 s, y a 60°C durante 1min. El tejido tumoral y pulmonar normal de cada paciente sirvió de control positivo. Los cebadores y las sondas se adquirieron como Assay-on-demand de Applied Biosystems (CK7 Hs00559840_m1, CEACAM5 Hs00237075_m1, PLUNC Hs 00213177_m1). Los ampliaciones incluían uniones exónicas para conseguir especificidad del ADNc y evitar amplificación de posible ADN genómico contaminante. El tejido pulmonar tumoral de cada paciente se empleó como control positivo de expresión de los genes analizados. Se empleó expresión del gen GADPH (Hs02758991_g1) como control endógeno de calidad de la muestra y de la cantidad de ARNm analizado.
ResultadosLa muestra estaba formada por 42 pacientes. Trece pacientes fueron excluidos del reclutamiento inicial: 2 por tratarse de tumores benignos, 3 por ser tumores metastásicos y 8 por encontrarse el GC afecto por metástasis en el estudio de hematoxilina-eosina convencional.
Los pacientes incluidos fueron 29: 21 hombres con una edad media de 64,28 años (rango: 49-79 años). El tamaño tumoral medio fue de 27,86±16,2mm (rango: 8-65mm). Se practicaron 20 lobectomías, una bilobectomía, una neumonectomía y 7 resecciones segmentarias.
El tiempo medio de espera entre la administración del radiofármaco y la identificación del GC fue de 59 min (rango 28-125 min).
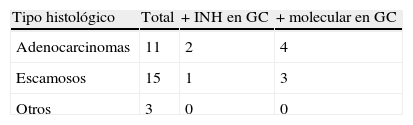
Los tipos histológicos fueron: 11 adenocarcinomas, 15 escamosos, 2 carcinomas neuroendocrinos y uno adenoescamoso.
De los genes testados, el CEACAM5 y el PLUNC fueron los que mostraron una alta expresión en tejido pulmonar y baja o nula expresión en tejido linfático no afecto por el tumor. De los 29 GC analizados (tabla 2), 7 (24%) fueron positivos para estudio molecular. De estos, 3 también mostraron citoqueratina positiva (CK7). Se encontró GC positivo en: 4/7 adenocarcinomas y 3/12 escamosos. El estudio molecular del GC viene reflejado en la tabla 3.
El análisis de datos se realizó con el programa SPSS versión 20. Se calcularon los estadísticos descriptivos de las variables, porcentajes, medias y desviaciones estándar.
Para el cálculo del tamaño muestral no puede hacerse una estimación estadística fiable al no existir suficientes estudios de condiciones similares; se recurrió a la literatura médica para valorar el tamaño muestral con relación a los estudios semejantes.
DiscusiónLa afectación metastásica a nivel ganglionar es el principal factor pronóstico en el carcinoma pulmonar localizado10. La detección de ganglios mediastínicos afectos por métodos de imagen (TC) o por medicina nuclear (PET-TC) lleva implícito un número de falsos negativos, de gran valor a la hora de establecer un pronóstico y tratamiento adecuado a la correcta estadificación. Pese al correcto estudio anatomopatológico de las piezas obtenidas tras la linfadenectomía mediastínica, la recidiva tumoral alcanza al 40% en pacientes estadio i tras una cirugía oncológica curativa11. La explicación de este elevado índice de recidivas es escasamente justificado.
La existencia de micrometástasis no identificadas por los métodos de estudio habituales (hematoxilina-eosina) es considerada como una explicación plausible. En una anterior publicación8 demostramos la presencia de dichas micrometástasis detectadas mediante métodos moleculares en ganglios mediastínicos. Sin embargo, el enorme esfuerzo en recursos humanos y coste económico que suponía analizar una media de 12 adenopatías por paciente nos hizo centrarnos en la detección del GC para su análisis molecular, reduciendo así costes.
El concepto de GC supone que el flujo linfático del tumor primario migra en primer lugar a ganglios en contiguidad anatómica antes que a otros más distantes12. Como sabemos, el GC ha sido bien estudiado en el melanoma y el carcinoma de mama13. En el caso del carcinoma pulmonar la finalidad de su detección es distinta a la de los casos comentados: aunque está descrito un aumento de posibles complicaciones tras la linfadenectomía mediastínica14 el motivo del estudio molecular es evitar una subestadificación (estadificar como estadio i pacientes que realmente tienen afectación molecular). Valorar el impacto en el pronóstico y las posibilidades de tratamiento de este subgrupo de pacientes es un segundo paso más ambicioso.
Sin embargo, la detección del GC en pulmón tiene una serie de particularidades. La administración del radiofármaco debe realizarse tras la toracotomía. La adecuada migración del marcador a través de la red linfática queda en duda, aunque Liptay10 cita una sensibilidad del 92%, siendo superior a otras técnicas como la inyección de colorantes (isosulfato azul) descrita por Little et al.15.
Por otro lado, el estudio ganglionar por hematoxilina-eosina ha mostrado afectación tumoral en 8 casos (5 en estaciones N1). La búsqueda de adenopatías en el campo quirúrgico con la sonda de detección, siguiendo las vías linfáticas descritas de forma anatómica, nos ha permitido un estudio más exhaustivo de lo habitual de las adenopatías pulmonares (N1) y detectar afectación tumoral a este nivel.
Como sabemos, los linfáticos subpleurales conectan directamente con las adenopatías a nivel de mediastino en el 20-25% de los pacientes16. Además, compartimos la opinión de Nomori et al.17 de que el GC en la cavidad torácica es lóbulo específico. Es lógico pensar que las estaciones por donde circula la linfa sean desde la lesión hacia ganglios cercanos (subpleurales/intraparenquimatosos: considerados N1) y, en algunos casos, directamente a los considerados N218 como los de la ventana aorto pulmonar19. El estudio de los patrones teóricos de drenaje linfático y la correcta localización de los ganglios marcados con radio isótopo a nivel particular en el momento de la cirugía puede explicar, al menos en parte, el fenómeno de las skip metastases y verificar un patrón más lógico de migración aunque el pronóstico de los pacientes con skip metastases mediastínicas (N1- y N2+) sigue suscitando controversia20.
En nuestro trabajo, los ganglios afectos en nivel N1 fueron 6/12 mientras que en N2 fueron 1/10, este en localización a nivel de ventana aorto pulmonar, resultados concordantes con lo expuesto en el párrafo anterior.
En cuanto al tipo histológico, se detectó GC en más de la mitad de los adenocarcinomas (57%) y el 25% de los carcinomas escamosos. Es conocida la diseminación metastásica más frecuente en los adenocarcinomas, hecho contrastado en nuestro estudio.
En conclusión, la detección del GC en pacientes con carcinoma pulmonar estadio I mediante marcaje con radioisótopo permite estudiar dicha adenopatía de forma más detenida. La aplicación de técnicas moleculares pone de manifiesto su afectación tumoral en casos estadificados como estadio i. Este dato explicaría, al menos en parte, la elevada incidencia de progresión de enfermedad en pacientes estadificados como i por métodos convencionales. El pronóstico y posibilidades de tratamiento de este subgrupo de pacientes es un reto a investigar.
FinanciaciónEste estudio ha sido realizado con una beca GIDO (Grupo de Investigación y Divulgación Oncológica).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.