La nesidioblastosis constituye una causa rara de enfermedad endocrina, que representa entre 0.5% al 5% de los casos. Se ha descrito en asociación con otras condiciones, como en pacientes previamente tratados con insulina o sulfonilurea, en tejido pancreático no tumoral de pacientes con insulinoma, y en pacientes con otros tumores de las células de los islotes de Langerhans. En el adulto se presenta como una disfunción difusa de las células β, de causa desconocida.
Caso clínicoFemenina de 46 años, con síndrome de Sheehan de quince años de evolución y en los últimos tres años, presentó eventos repetidos caracterizados de hipoglucemia. Se realizó rastreo corporal con octreótide, revelando captación de región pancreática en relación con insulinoma. Se sometió a pancreatectomía distal. El informe fue de un fragmento de páncreas de 8.5 × 3 × 1.5 cm con proliferación anormal de islotes pancreáticos en grupo de tamaño variable, algunos de ellos en relación al epitelio ductal. El estudio histopatológico mostró positividad para cromogramina, sinaptosina, insulina y glucagón en islotes hiperplásicos, que confirmó Nesidioblastosis difusa del adulto, negativo a malignidad. Actualmente la paciente se encuentra con adecuado control metabólico, y con remisión de los eventos de hipoglucemia.
ConclusionesLa nesidioblastosis es una patología de difícil diagnóstico, debe considerarse en todos los casos en donde no se logre la localización de un insulinoma, ya que esta puede estar presente hasta en el 4% de las hipoglucemias hiperinsulinémicas persistentes.
Nesidioblastosis is a rare cause of endocrine disease which represents between 0.5% - 5% of cases. This has been associated with other conditions, such as in patients previously treated with insulin or sulfonylurea, in anti-tumour activity in pancreatic tissue of patients with insulinoma, and in patients with other tumours of the Langerhans islet cells. In adults it is presented as a diffuse dysfunction of β cells of unknown cause.
Clinical caseThe case concerns 46 year-old female, with a history of Sheehan syndrome of fifteen years of onset, and with repeated events characterized with hypoglycaemia in the last three years. Body scan was performed with octreotide, revealing an insulinoma in the pancreatic region. A distal pancreatectomy was performed on the patient. The study reported a pancreatic fragment 8.5 × 3 × 1.5 cm with abnormal proliferation of pancreatic islets in groups of varying size, some of them in relation to the ductal epithelium. Histopathology study was showed positive for chromogranin, confirmed by positive synaptophysin, insulin and glucagon, revealing islet hyperplasia with diffuse nesidioblastosis with negative malignancy. The patient is currently under metabolic control and with no remission of hypoglycaemic events.
ConclusionsNesidioblastosis is a disease of difficult diagnosis should be considered in all cases of failure to locate an insulinoma, as this may be presented in up to 4% of persistent hyperinsulinaemic hypoglycaemia.
En 1938 Georgef Laidlaw acuñó el término nesidioblastosis para referirse a la neodiferenciación de las células de los islotes de Langerhans a partir del epitelio ductal exocrino pancreático; sin embargo, no fue hasta 1971 cuando Yakovac utilizó este término para describir lesiones del páncreas endócrino en neonatos, al describir 12 casos de niños con hipoglucemia hiperinsulinémica persistente. Actualmente la nesidioblastosis del adulto se define como cambios en el páncreas endócrino caracterizado por la proliferación anormal de las células de los islotes pancreáticos, que afecta en forma difusa a la glándula, formando brotes desde el epitelio ductal y que causa hipoglucemia hiperinsulinémica persistente en ausencia de un insulinoma1–4.
Caso clínicoPaciente femenina de 46 años, con antecedente de síndrome de Sheehan de 15 años de evolución, en tratamiento con 100mcg de levotiroxina y 5mg de prednisona/24h. Acudió por exacerbación de un cuadro clínico de 3 años de evolución manifestado por eventos repetidos, caracterizados por náuseas, mareos, diaforesis, palpitaciones y pérdida del estado de alerta asociados a hipoglucemia, los cuales revertían con la ingesta de azúcares simples.
Al examen físico presentaba tensión arterial de 120/70mmHg, frecuencia cardiaca de 70lpm, peso de 70kg, talla 155cm, IMC de 29kg/m2; el resto de la exploración física estaba dentro de los parámetros normales. Los estudios de laboratorio reportaron: hemoglobina 14.2g/dl; hematocrito 39.4%; plaquetas 287,000; leucocitos 9,300; glucosa 69mg/dl; urea 28mg/dl; creatinina 0.7mg/dl; T4 libre 1.22ng/dl; hormona estimulante de la tiroides 0.2μUI/ml. Se realizó prueba de ayuno que demostró la presencia de hiperinsulinismo endógeno con glucemia de 52mg/dl en ausencia de sintomatología adrenérgica y/o neuroglucopénica, insulinemia de 7.61μU/ml, péptido C de 6.5ng/dl, y proinsulina de 5.8pmol/l a las 72h.
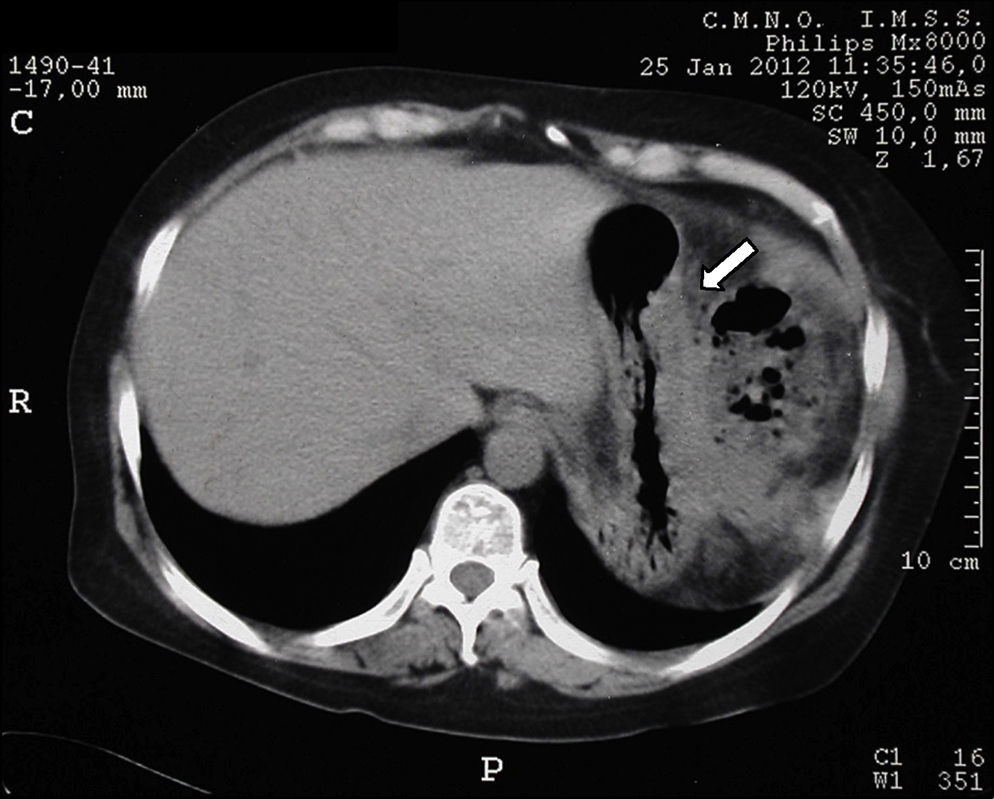
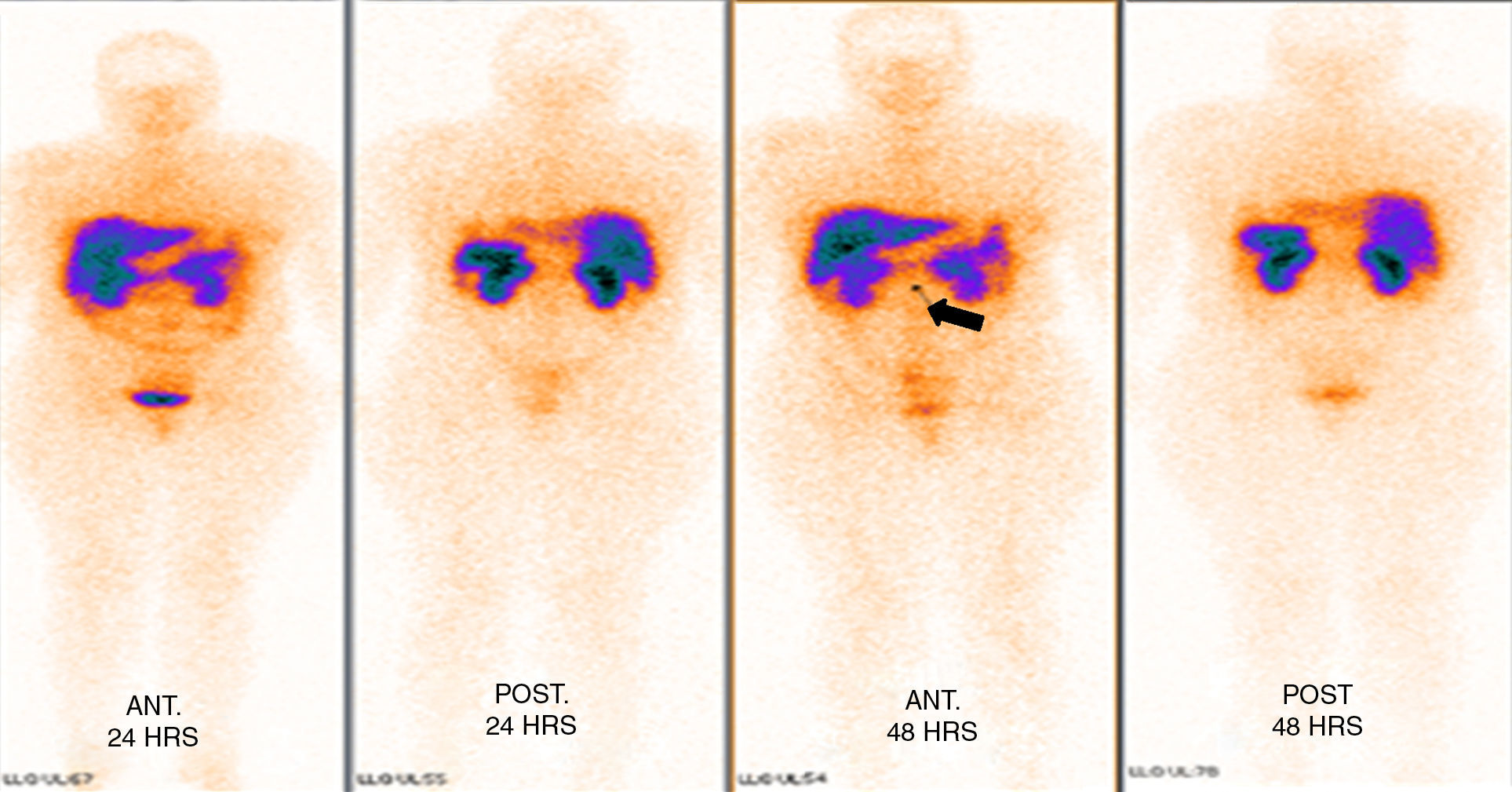
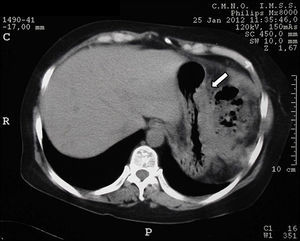
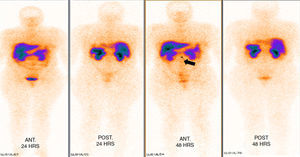
Los estudios de imagen por tomografía no mostraron evidencia de enfermedad en páncreas (fig. 1). Se realizó rastreo corporal con octreótide, mostrando captación de región pancreática hacia la línea media; el resto del rastreo sin evidencia de lesiones que sugieran actividad metastásica (fig. 2).
Debido a los hallazgos de los estudios de imagen, la paciente fue sometida a exploración pancreática; sin embargo, no se localizaron macroscópicamente ni a la palpación lesiones nodulares sospechosas, la glándula pancreática tenía características normales, por lo que se realizó pancreatectomía distal hasta el nivel de los vasos mesentéricos.
Las concentraciones de glucosa se mantuvieron normales, y en el postoperatorio inmediato presentó glucosas venosas entre 100 y 130mg/dl, requiriendo incluso una dosis de insulina rápida.
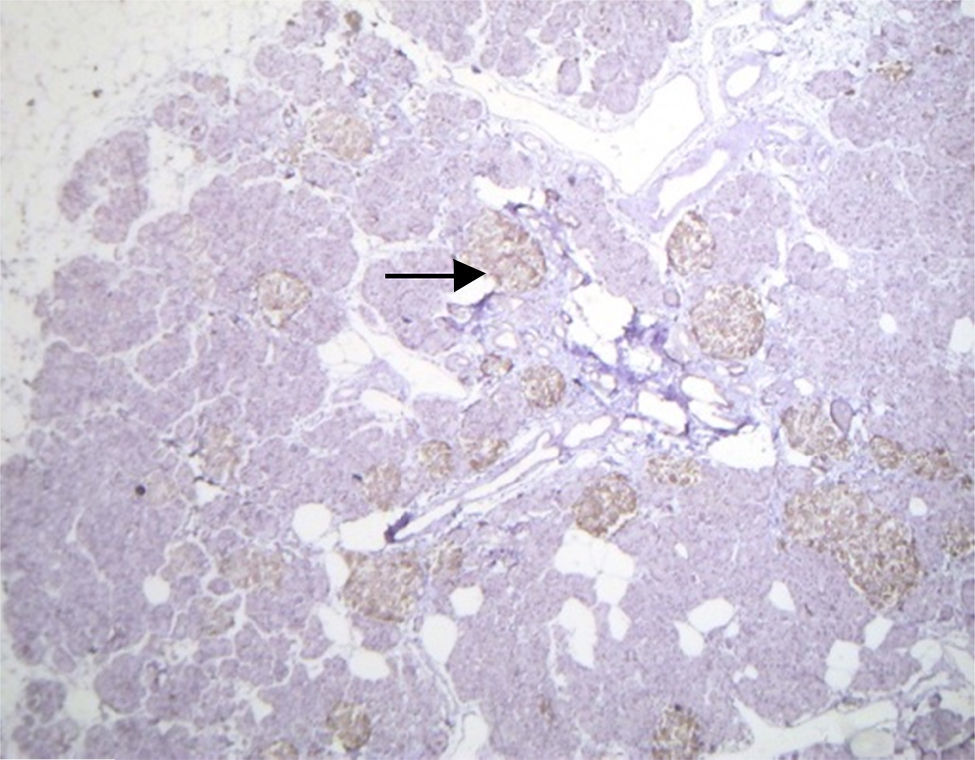
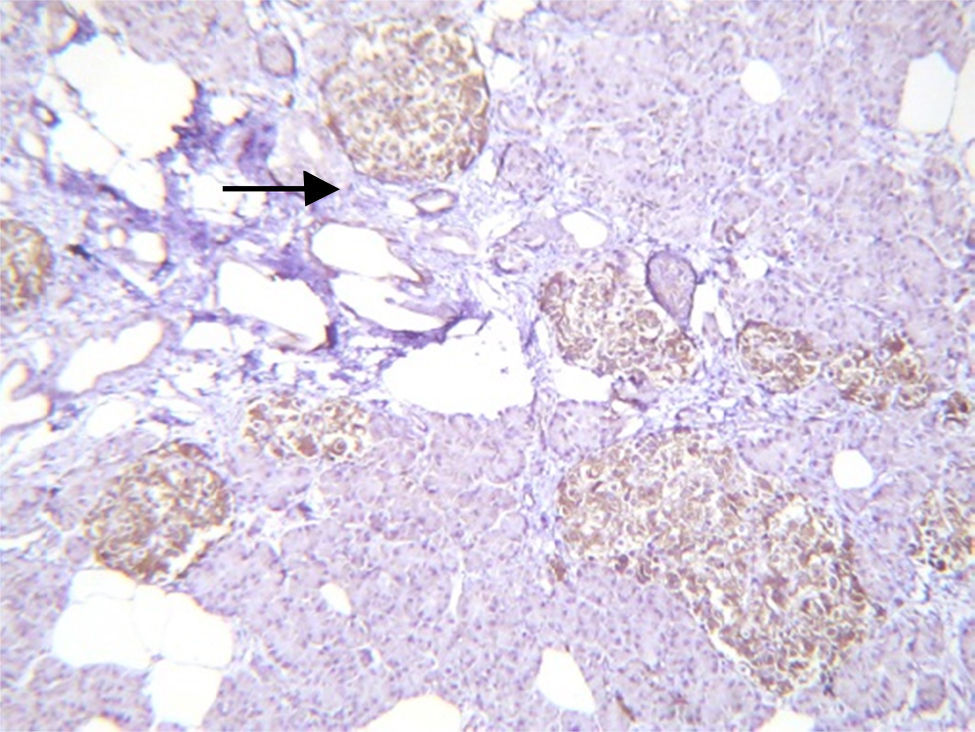
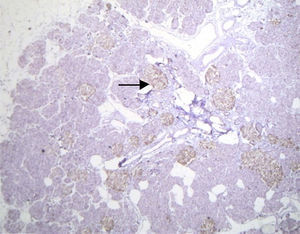
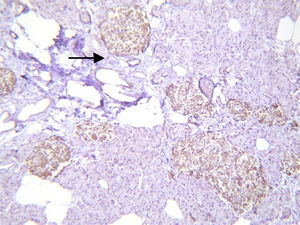
El estudio histopatológico macroscópico reportó un fragmento de páncreas de 8.5×3×1.5cm, de color amarillo, con superficie trabecular, con áreas de mayor congestión. Microscópicamente se observaron proliferaciones anormales de los islotes pancreáticos dispuestos en agrupaciones de tamaño variable, algunos de ellos en relación con el epitelio ductal formando complejos ductales agrandados, hipercromáticos, con citoplasma amplio y claro. La inmunohistoquímica reveló positividad en los islotes hiperplásicos para cromogranina A con intensificación periférica, sinaptosina difusa, glucagón en la periferia de los islotes y en las células α e insulina de forma difusa y en las células interacinares (figs. 3 y 4). Se reunieron criterios clínicos, radiológicos, histológicos e inmunohistoquímicos para realizar el diagnóstico de nesidioblastosis difusa del adulto, negativo a malignidad. Actualmente la paciente se encuentra con adecuado control metabólico y con remisión de los eventos de hipoglucemia.
La hipoglucemia hiperinsulinémica persistente es causada por la alteración en la función de la célula β del páncreas, la cual en los recién nacidos tiene como principal causa la nesidioblastosis, mientras que en los adultos son los insulinomas solitarios los causantes de este cuadro clínico, lo que hace que la nesidioblastosis del adulto se presente en tan solo el 0.5-5%. El primer caso de nesidioblastosis en un adulto fue reportado en el año 19752,3.
Se han identificado diversas anormalidades genéticas relacionadas con la patogénesis de hipoglucemia hiperinsulinémica persistente en la infancia, siendo las mutaciones más frecuentes las presentadas en los genes ABCC8 (SUR1) y KCNJ11 (Kir6.2), del brazo corto del cromosoma 11 los cuales codifican para subunidades del canal de potasio sensible a ATP en la membrana de la célula β, conduciendo a la permanente secreción de insulina. Asimismo, se han identificado recientemente otras 6 posibles causas, como son la pérdida de la función debido a mutaciones de glucocinasa (GCK), glutamato deshidrogenasa (GLUD1), hidroxiacil coenzima A deshidrogenasa (HADH1), transportador de piruvato de la membrana plasmática (SLC16A1), proteína desacopladora mitocondrial (UCP2), y factor de transcripción nuclear (HNF4a). Aunque si bien es cierto que estas alteraciones no se han reportado en adultos, es de interés conocer que las mutaciones del tipo GLUD1, GCK, SLC16A1, y algunas mutaciones leves de ABCC8 y KCNJ11 puedan no ser reconocidas durante la infancia y sean descubiertas por primera vez en la vida adulta, puesto que no es infrecuente que individuos afectados sean diagnosticados en la niñez o incluso después de la misma5,6.
El sustrato morfológico de estos cambios moleculares puede presentarse en los niños como hipertrofia difusa de la célula β (nesidioblastosis difusa) en el 60% o hipertrofia focal de la célula β (nesidioblastosis focal) en el 40%, sin embargo esta última forma no ha sido descrita en adultos1,2.
La nesidioblastosis del adulto fue inicialmente descrita en asociación con otras enfermedades, como en el síndrome de Zollinger-Ellison, adenomatosis endocrina múltiple, adenomatosis de célula β, enfermedad de von Hipple Lindau, fibrosis quística, linfoma orbitario con hipopituitarismo e insuficiencia suprarrenal, poliposis adenomatosa familiar, hipergastrinemia y polipeptidemia pancreática, en tejido pancreático no tumoral de pacientes con insulinomas. Con el aumento de las intervenciones de cirugía bariátrica, particularmente en el bypass gástrico, y aunque no está del todo claro el efecto fisiopatológico, en estos pacientes se encuentran incrementados los niveles de polipéptido con efecto trófico sobre la célula β, como el péptido 1 similar al glucagón, que contribuye a la hipertrofia de la células β del páncreas y consecuentemente a la hiperfunción de los islotes, culminando en hipoglucemia posprandial2,7,8.
Clínica y bioquímicamente no es posible distinguir entre la nesidioblastosis difusa y el insulinoma, por lo que es necesaria una relación estrecha entre clínicos y patólogos para poder así establecer el diagnóstico. Y antes de hacerlo, es imperativo excluir el diagnóstico de insulinoma3.
Algunos pacientes presentan síntomas de hipoglucemia predominantemente posprandial, y no en ayuno, como ocurre en los pacientes con hipoglucemia hiperinsulinémica persistente secundaria a insulinoma; sin embargo, la mayoría de los pacientes presentan los síntomas típicos de hipoglucemia (tríada de Whipple), síntomas adrenérgicos como diaforesis, palpitaciones, ansiedad, temblor, sensación de hambre, y síntomas de neuroglucopenia como confusión, visión borrosa, amnesia y pérdida de la conciencia2.
La prueba de referencia ideal para evaluar la presencia de hipoglucemia es la prueba de ayuno de 72h, cuyo objetivo es evaluar el papel de la insulina en la génesis de la hipoglucemia. En nuestra paciente, esta prueba evidenció la presencia de hiperinsulinismo endógeno, por lo que se procedió a realizar estudios de imagen con el fin de localizar la lesión.
La tomografía axial computada no demostró la presencia de una lesión, por lo que se procedió a la realización de un octreoscan que reveló la presencia de una imagen sugestiva de lesión en el cuello del páncreas con hipercaptación de contraste; sin embargo, la paciente clínicamente presentaba la tríada de Whipple con síntomas de hipoglucemia y niveles bajos de glucosa en sangre, que respondían a la administración de glucosa intravenosa, así como niveles séricos de insulina elevados, debido a lo cual existió la sospecha clínica de que la paciente era portadora de un insulinoma. Ante la presencia de un foco probable de insulinoma se inició el protocolo para la resección de la probable lesión6,9,10.
La resección quirúrgica es considerada el tratamiento de elección de la nesidioblastosis. Sin embargo, la extensión de la misma aún es controvertida11,12. La mayoría de los cirujanos realizan pancreatectomía distal, algunos incluso han llevado a cabo pancreatectomía del 90-95%, pero una pancreatectomía subtotal se asocia con diabetes insulinodependiente y disfunción pancreática exocrina en el 40% según algunos autores; con resección del 60% del páncreas, el 8% de los pacientes presentarán diabetes mellitus insulinodependiente, pero con mayor índice de recidivas de la hipoglucemia. Si la cirugía no resulta exitosa o está contraindicada, se pueden utilizar fármacos como diazóxido, octreótide o verapamilo. Nuestra paciente fue manejada quirúrgicamente con pancreatectomía distal, resecando el 70% del páncreas, teniendo como resultado una diabetes mellitus secundaria, y quedó dentro del 8% reportado por la literatura médica y agravada por el hecho de recibir tratamiento con esteroides para el síndrome de Sheehan6,10,13.
En el estudio histopatológico, la apariencia macroscópica del páncreas es normal; los hallazgos varían entre los pacientes y hasta en la tercera parte de los casos los cambios son mínimos, por lo que es difícil diferenciarlos del páncreas normal11,14,15.
Se han reportado en pacientes con nesidioblastosis otros hallazgos como son la sobreexpresión del factor de crecimiento similar a la insulina tipo 2, receptor a del factor de crecimiento similar a la insulina tipo 1, receptor β3 del factor de crecimiento transformador, y ectasia vascular tipo pielosis; esta última ha resultado útil para el diagnóstico. En nuestro caso se encontró hiperplasia de los islotes de Langerhans sin tumor, hiperplasia del epitelio ductal, excluyendo macroscópica y microscópicamente el diagnóstico de insulinoma, con islotes de formas irregulares y aumentados de tamaño y número, concluyendo el diagnóstico de nesidioblastosis difusa del adulto2,10,11,16.
ConclusiónLa nesidioblastosis es una patología de difícil diagnóstico, y debe ser considerada en todos los casos en los que no se logre la localización de un insulinoma, ya que esta puede estar presente hasta en el 4% de las hipoglucemias hiperinsulinémicas persistentes, puesto que la identificación y el tratamiento precoz representan un papel muy importante para el pronóstico de la misma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.