La introducción de la prótesis aórtica sin sutura Perceval S ha supuesto una gran alternativa para el tratamiento quirúrgico de la estenosis aórtica severa, especialmente en pacientes añosos.
Se trata de un estudio observacional, retrospectivo, de un grupo de pacientes de nuestro centro sometidos a reemplazo valvular aórtico con bioprótesis sin sutura Perceval S (LivaNova, Saluggia, Italia).
MétodosEntre junio de 2015 y octubre de 2018, 105 pacientes fueron sometidos a reemplazo valvular aórtico con bioprótesis Perceval S. Los procedimientos combinados fueron: reemplazo valvular mitral (n=1), reparación valvular tricúspide (n=2), revascularización miocárdica (n=16) y miectomía (n=1). El seguimiento clínico y ecocardiográfico se realizó al alta, a los 6 meses y anualmente.
ResultadosLa edad media fue de 80,5±3,8 años; 57 (54,3%) fueron mujeres. La mortalidad a los 30 días fue del 1,9% (2 de 105). La tasa de supervivencia a los 30 días fue del 98% y al año fue del 95%. La media del Euroscore II fue de 3,8±5,5%. Los tiempos de circulación extracorpórea y de isquemia fueron de 58,4±41,8min y de 44±19,9min para el reemplazo valvular aórtico aislado, 94,2±44,1min y 73,9±35,6min para procedimientos combinados, respectivamente. La media del gradiente de presión medio transvalvular fue de 13,5±4,9mmHg. La función ventricular izquierda aumentó desde el 56,8±10,8% al 58,6±11,1%. Solo 7 pacientes requirieron implante de marcapasos definitivo, con una incidencia del 6,7%. Solo 2 pacientes presentaron fuga paravalvular moderada al alta, que no requirió ningún tratamiento.
ConclusionesEl reemplazo valvular aórtico con la bioprótesis sin sutura Perceval S se asocia a una baja mortalidad y a un excelente comportamiento clínico y hemodinámico, especialmente en pacientes de edad avanzada.
Sutureless aortic valve replacement has emerged as an alternative for surgical treatment of severe aortic stenosis, especially in older patients.
This is an observational, retrospective study of a group of patients from a single centre undergoing aortic valve replacement with Perceval S sutureless bioprosthesis (LivaNova, Saluggia, Italy).
MethodsA total of 105 patients had an aortic valve replacement with a Perceval S bioprosthesis between June 2015 and October 2018. The combined procedures were, mitral valve replacement (n=1), tricuspid valve repair (n=2), myocardial revascularisation (n=16), and myectomy (n=1). The clinical and echocardiographic follow-up was performed at discharge, at 6 months, and yearly, after surgery.
ResultsThe mean age was 80.5±3.8 years, and 57 (54.3%) were women. The mortality rate at 30 days was 1.9% (2 out of 105).The 30-day survival rate was 98%, and at one year it was 95%. The mean Euroscore II was 3.8%±5.5%. The cardiopulmonary bypass and ischaemia times were 58.4±41.8min, and 44±19.9min for isolated aortic valve replacement, 94.2±44.1min and 73.9±35.6min for combined procedures, respectively. The mean trans-prosthetic gradient was 13.5±4.9mmHg. The left ventricle function increased from 56.8%±10.8% to 58.6%±11.1%. Only 7 patients have required a definitive pacemaker implant (6.7%). Only 2 patients presented with a moderate para-valvular leak that did not require any treatment.
ConclusionsAortic valve replacement with the Perceval S sutureless bioprosthesis is associated with low mortality and excellent clinical and haemodynamic behaviour, especially in elderly patients.
El reemplazo valvular aórtico (RVA) es el tratamiento de elección para la estenosis valvular aórtica cuando se trata de una estenosis aórtica grave sintomática (≤1cm2/m2), asintomática con disfunción ventricular izquierda o combinada con otro procedimiento de cirugía cardíaca1.
El RVA todavía representa el tratamiento gold standard en pacientes con estenosis aórtica severa sintomática2.
Debido al incremento de las comorbilidades y al aumento progresivo de la edad de los pacientes, ha surgido una tendencia hacia el implante de prótesis biológicas, evitando así los problemas asociados a la anticoagulación crónica3.
Aunque el concepto del implante de la válvula aórtica transcatéter por vía percutánea (TAVI, de «transcatheter aortic valve implantation») parece atractivo, la válvula aórtica calcificada no se extrae durante dicho procedimiento. Por lo tanto, la fuga perivalvular sigue siendo un problema importante4,5. Además, esta técnica también se asocia a una elevada incidencia de accidentes cerebrovasculares6,7, complicaciones vasculares y necesidad de implante de marcapasos definitivo.
Sin embargo, han demostrado mejor resultado que el tratamiento médico en pacientes inoperables así como la no inferioridad respecto a la cirugía en pacientes de alto riesgo8. Por ello, las válvulas percutáneas han tenido en los últimos años una gran expansión, e intentan expandir su implante en pacientes de moderado riesgo (PARTNER II trial y SURTAVI trial).
La reciente introducción de las nuevas prótesis aórticas sin sutura ofrece una gran alternativa quirúrgica a pacientes de elevada complejidad, permitiendo una reducción de los tiempos quirúrgicos y, por lo tanto, de la morbimortalidad asociada9,10.
Este estudio presenta nuestra experiencia con la prótesis Perceval S, en términos de mortalidad y morbilidad a 30 días y en el seguimiento, así como el comportamiento clínico y hemodinámico de esta prótesis.
MétodosPacientesEntre junio de 2015 y octubre de 2018, 105 pacientes con estenosis aórtica severa sintomática fueron sometidos, de manera electiva, a RVA con la bioprótesis aórtica sin sutura Perceval S.
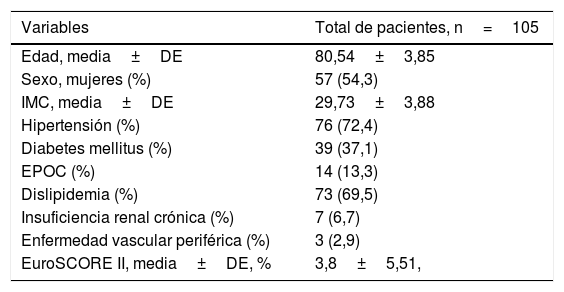
Las principales características de los pacientes se enumeran en la tabla 1. Los criterios de exclusión fueron: endocarditis aguda, un anillo aórtico o una anatomía de la aorta ascendente irregulares (aorta ascendente dilatada con diámetro de la unión sino-tubular ≥1,3 respecto del diámetro del anillo aórtico, y pacientes bicúspides puros).
Características basales de los pacientes
| Variables | Total de pacientes, n=105 |
|---|---|
| Edad, media±DE | 80,54±3,85 |
| Sexo, mujeres (%) | 57 (54,3) |
| IMC, media±DE | 29,73±3,88 |
| Hipertensión (%) | 76 (72,4) |
| Diabetes mellitus (%) | 39 (37,1) |
| EPOC (%) | 14 (13,3) |
| Dislipidemia (%) | 73 (69,5) |
| Insuficiencia renal crónica (%) | 7 (6,7) |
| Enfermedad vascular periférica (%) | 3 (2,9) |
| EuroSCORE II, media±DE, % | 3,8±5,51, |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; EuroSCORE II: sistema europeo para la evaluación del riesgo cardíaco operativo; IMC: índice de masa corporal.
El consentimiento informado se obtuvo de cada paciente, y el protocolo de estudio se ajusta a las pautas éticas de la Declaración de Helsinki de 1975 así como reflejada a priori en la aprobación por el comité de investigación clínica de nuestra institución (código de registro 2018/430).
Se realizó seguimiento clínico y ecocardiográfico intraoperatorio, al alta hospitalaria, a los 6 meses, y cada año durante el seguimiento.
DispositivoEl dispositivo Perceval S es una prótesis biológica compuesta de pericardio bovino montada en un stent de nitinol. Esta bioprótesis se pliega a través de un dispositivo diseñado para posicionar la prótesis en medio de dicho dispositivo a través de un sistema de soporte específico. Este sistema de soporte que sostiene la válvula montada en el stent y plegada permite guiar la prótesis a su posición correcta y deslizarla a través de las 3 suturas que sirven de guía (polipropileno 4-0), ubicadas en el nadir de cada seno valvular. Una vez que el sistema de soporte está en posición correcta, la prótesis se despliega, las suturas de guía se eliminan, y la válvula finalmente queda colocada. En este momento del procedimiento se realiza el modelado posdilatación de la prótesis con un balón hinchable (30s a una presión de 4 atmósferas) y la válvula se humedece con solución salina a 37°C para optimizar el posicionamiento final de la prótesis.
Esta válvula es recuperable y reemplazable si fuese necesario. Cuando ocurre una malposición, se puede retirar con seguridad incluso después de la dilatación con el balón. El procedimiento se realiza mediante un «movimiento en X» con la ayuda de una pinza de disección. Si la prótesis no muestra ninguna deformidad después del procedimiento de extracción, puede ser reimplantada en la posición intraanular correcta11.
Esta prótesis sin sutura está disponible en tamaños pequeño, mediano, grande y extragrande (S, M, L y XL). La prótesis Perceval S ha obtenido la aprobación europea (CE) en febrero de 2011 para tamaños S y M, en septiembre de 2011 para la talla L, y en noviembre de 2013 para el tamaño XL; la aprobación de la Administración de Medicamentos y Alimentos de EE.UU. ha sido otorgada en enero de 201612,13. De acuerdo con nuestro protocolo, no hemos establecido ninguna terapia de anticoagulación ni antiagregación para este tipo de prótesis.
Procedimientos operativosEn todos los pacientes se realizó la cirugía de RVA mediante esternotomía convencional dado que en nuestro centro es el abordaje estándar para RVA aislado. La circulación extracorpórea se realizó con canulación aórtica y auricular derecha, y el corazón ha sido parado mediante cardioplejía sanguínea fría y caliente por vía anterógrada.
La aortotomía transversal se realizó aproximadamente 2cm por encima de las comisuras, así como una visualización de la válvula previa al procedimiento quirúrgico.
Tras la exéresis de la válvula en su totalidad y decalcificación del anillo aórtico, se midió el diámetro del anillo aórtico para seleccionar el tamaño de la prótesis previo a su implante. La aortotomía se cerró con una doble sutura continua de polipropileno 4-0.
Inmediatamente después del implante y destete de la circulación extracorpórea, se realizó control del posicionamiento y del adecuado funcionamiento de la prótesis mediante un ecocardiograma transesofágico (ETE) intraoperatorio, prequirúrgico y posquirúrgico.
Estos procedimientos fueron realizados de la misma manera por todos los cirujanos del servicio.
Análisis estadísticoLas variables continuas se expresaron mediante la media±desviación estándar; las variables categóricas se expresaron mediante frecuencias y porcentajes. La mortalidad acumulada se representó mediante una curva de Kaplan-Meier.
Todos los cálculos se realizaron mediante el software estadístico R v.3 (R core team; R Foundation for Statistical Computing, Viena, Austria) y con RStudio v.1 (RStudio Team; Integrated Development Environment for R, Boston, EE.UU.). Para el análisis estadístico, se emplearon los siguientes paquetes estadísticos: dplyr1, ggplot22, tidyr3, survival4, 5, survminer6.
ResultadosLa media del EuroSCORE II fue del 3,8%±5,5%. Un total de 3 pacientes (2,85%) habían sido sometidos previamente a cirugía cardíaca (reoperados). Los tamaños de prótesis implantadas fueron los siguientes: S (n=9), M (n=29), L (n=35) y XL (n=32). Los procedimientos concomitantes fueron la cirugía de la válvula mitral (n=1), reparación de la válvula tricúspide (n=2), revascularización miocárdica (n=16) y miectomía (n=1). Los tiempos de circulación extracorpórea (TCEC) y tiempos de isquemia (TI) fueron de 58,4±41,8min y 44±19,9min para RVA aislado, y 94,2±44,1min y 73,9±35,6min para procedimientos combinados, respectivamente.
La tasa de mortalidad a 30 días fue del 1,9% (2 de 105). Un paciente falleció por insuficiencia cardíaca y el otro paciente por fallo multiorgánico. En cuanto al resto de pacientes, ninguno presentó una complicación postoperatoria.
La estancia media en la unidad de cuidados intensivos fue de 2,5±1,3 días y la estancia global fue de 6±2,9 días.
El implante de marcapasos permanente por bloqueo auriculoventricular durante el seguimiento fue necesario en 7 pacientes, con una incidencia del 6,7%. En todos los casos presentaron bloqueo auriculoventricular en el postoperatorio inmediato, presentando alteraciones de la repolarización previamente a la cirugía solo 4 pacientes del total, y el implante de marcapasos definitivo fue previo al alta en todos los pacientes.
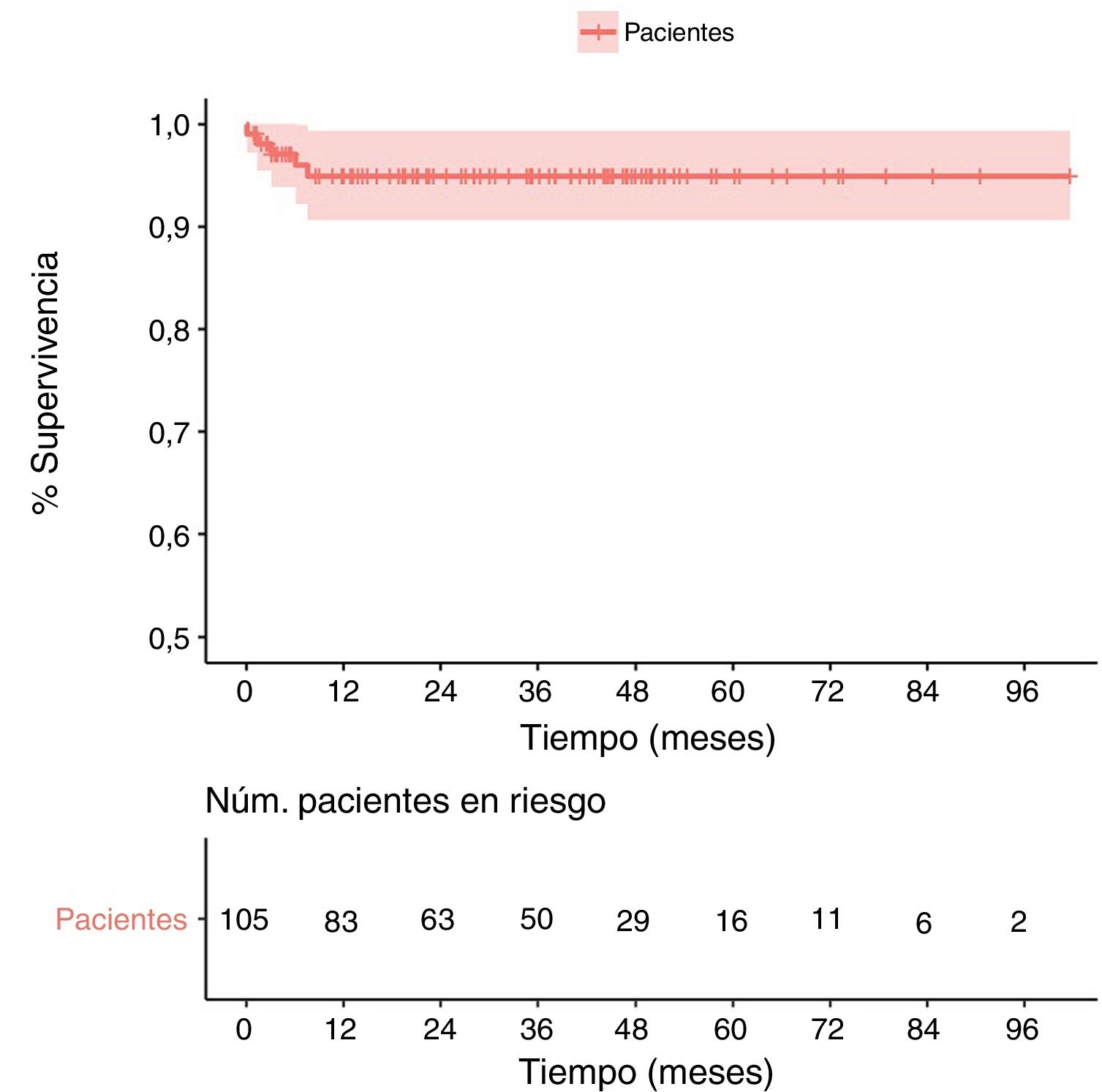
La tasa de supervivencia al mes fue del 98% y al año fue del 95% (fig. 1). No hubo ningún caso de endocarditis infecciosa ni de disfunción valvular protésica.
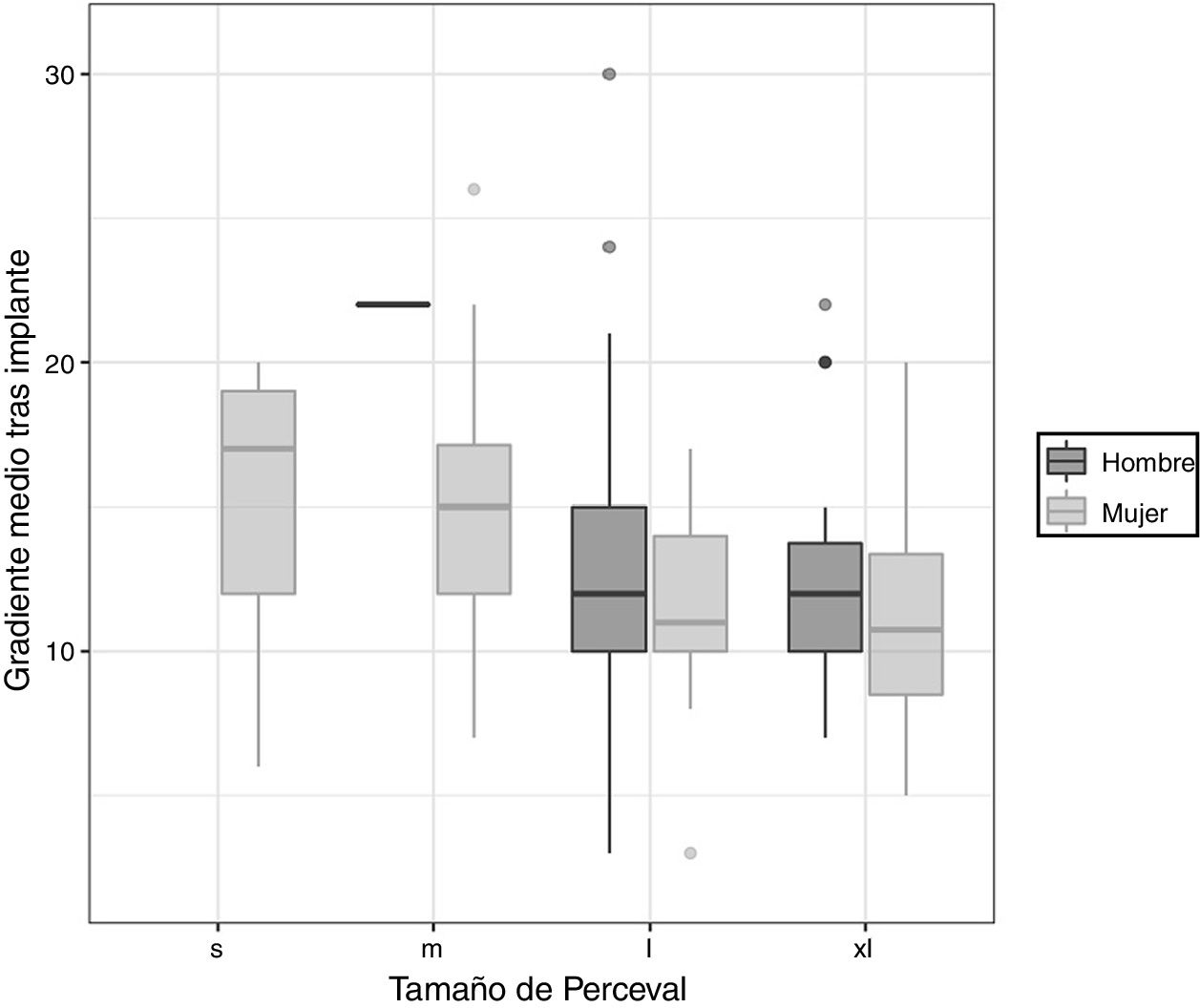
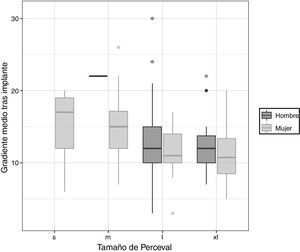
Los gradientes transvalvulares disminuyeron significativamente desde un valor preoperatorio de 48,4±15,2mmHg a 13,5±4,9mmHg en el seguimiento (p-valor = 0,001). Si comparamos los gradientes en función de los distintos tamaños de prótesis, llama la atención que entre las prótesis de tamaños S y M existe diferencia estadísticamente significativa entre los gradientes preoperatorios (p-valor = 0,0134) pero no entre los gradientes postoperatorios (p-valor = 0,945) (fig. 2).
La fracción de eyección del ventrículo izquierdo aumentó de un 56,8±10,8% a un 58,6±11,1% (p=0,40).
En el control con ETE, solo 2 pacientes presentaron fuga periprotésica significativa que no requirió ningún tratamiento. Ambos pacientes se mantienen en clase funcional NYHA II y sin repercusión sobre el ventrículo izquierdo en el seguimiento.
El seguimiento fue completo (100% de los pacientes). La media de seguimiento se sitúa en los 32 meses, con un máximo de 60 meses.
No se han descrito migraciones, trombosis o deterioro estructural de la prótesis durante el seguimiento.
DiscusiónEl RVA es el gold standard para el tratamiento de pacientes con estenosis aórtica severa sintomática.
El riesgo quirúrgico de los pacientes sometidos a RVA se ha visto incrementado en los últimos años debido al envejecimiento progresivo de la población y al aumento de las comorbilidades de dichos pacientes. Sin embargo, la aparición de las prótesis sin sutura ha permitido reducir significativamente los efectos adversos asociados a la cirugía14.
Este estudio muestra nuestra experiencia con la nueva prótesis sin sutura Perceval S (LivaNova, Saluggia, Italia) en términos de resultados clínicos y hemodinámicos.
Demostramos que el implante de la prótesis Perceval S es un procedimiento seguro y factible asociado a bajas tasas de mortalidad y a un excelente comportamiento hemodinámico en el seguimiento a medio plazo15,16. En nuestra experiencia, la tasa de mortalidad a los 30 días fue del 1,9% (2 de 105), y la tasa de supervivencia fue del 98% en el seguimiento.
Los primeros resultados clínicos de la prótesis Perceval S fueron publicados en 201117. Más recientemente, en un gran estudio de cohorte multicéntrico se evidenció la baja tasa de eventos al año de seguimiento18.
Tiempos de isquemia y de circulación extracorpóreaExiste una relación entre un mayor TI y TCEC y los resultados de morbimortalidad tras cirugía de sustitución aórtica19-21. La bioprótesis sin sutura representa un enfoque innovador para el RVA y ha sido diseñado de manera que permita un implante más rápido. Esta es una ventaja para todos los pacientes independientemente del riesgo quirúrgico.
Por lo tanto, el implante de la válvula aórtica sin sutura podría ser una alternativa al tratamiento de los pacientes con alto riesgo quirúrgico para RVA convencional.
Comportamiento hemodinámico de la prótesis Perceval S (LivaNova, Saluggia, Italia)La prótesis Perceval S presenta unas características y un comportamiento hemodinámico satisfactorio, incluso para tamaños pequeños.
En un estudio prospectivo reciente, las prótesis sin sutura demostraron una reducción del riesgo de mismatch paciente-prótesis respecto a las prótesis convencionales y se han postulado como de elección en pacientes con anillo aórtico pequeño22.
En nuestro grupo de pacientes, los gradientes preoperatorios han mejorado en comparación con los gradientes postoperatorios, manteniéndose estables en la mayoría de los casos al menos en los controles ecocardiográficos de los primeros meses de seguimiento (previo al alta, a los 6 meses y al año).
En relación con otros estudios, encontramos resultados similares en términos de fugas periprotésicas y comportamiento hemodinámico. En nuestra serie, solamente se dieron 2 casos con fuga periprotésica moderada que no precisaron tratamiento.
En nuestra opinión, sobredimensionar la prótesis no reduce la incidencia de fugas; por el contrario, puede estar asociado con la expansión incompleta de la bioprótesis e invaginación de la porción anular de la prótesis Perceval S. El tamaño del dispositivo es importante porque la válvula Perceval S está diseñada para expandirse a un diámetro exterior más grande que el diámetro anular medido del paciente. Es importante la adecuada expansión del stent dado que asegura el posicionamiento correcto de dicha prótesis. La prótesis Perceval S seleccionada para el implante debe coincidir con el diámetro medido del anillo aórtico. Algunos investigadores analizaron 54 pacientes que se sometieron a implante de la válvula Perceval S y se les realizó control y mediciones del anillo valvular mediante tomografía computarizada (TC) con contraste. Sin embargo, las mediciones ecocardiográficas mostraron menor precisión en comparación con las mediciones de la TC. Este estudio concluyó que posiblemente para una medición precisa del anillo aórtico, es preferible la TC con contraste23.
Se ha descrito en la literatura que la aparición de fugas periprotésicas es más frecuente en pacientes sometidos a implante de válvula aórtica transcatéter, así como una asociación de dicho procedimiento con un mayor riesgo de mortalidad a medio plazo, incluso en pacientes con fugas leves24.
Abordaje quirúrgico en el implante de la prótesis Perceval SLa reducción de los tiempos quirúrgicos en el implante de una válvula aórtica es una potencial ventaja de esta prótesis.
En nuestra experiencia todos los pacientes han sido intervenidos mediante esternotomía convencional, dado que es el procedimiento estándar para RVA aislado en nuestro centro. Hay estudios que demuestran mejores resultados en términos de reducción de los tiempos quirúrgicos en pacientes sometidos a RVA con un abordaje mínimamente invasivo como es la miniesternotomía.
No obstante, también hay evidencia de que el RVA mediante un abordaje mínimamente invasivo, como por ejemplo la minitoracotomía derecha, puede ser un procedimiento más largo de lo habitual y desafiante dado que requiere de una gran habilidad, incluso para cirujanos expertos25-27.
En nuestra serie, los pacientes sometidos a RVA con la prótesis Perceval S presentaron una media del TI de 50±26,6min y una media del TCEC de 65,5±44,5min.
La prótesis Perceval S en procedimientos combinadosLa prótesis Perceval S también puede ser ventajosa para pacientes que necesitan RVA junto con procedimientos concomitantes que, normalmente, prolongan los TI y TCEC.
En nuestra experiencia, 2 pacientes se sometieron a plastia tricuspídea y solamente un paciente se sometió a cirugía de la válvula mitral concomitantemente, que consistía en un recambio valvular mitral. Tanto el implante de una prótesis mitral como de un anillo mitral permiten la correcta implantación de la prótesis sin sutura. En la cirugía de la válvula mitral, realizamos primero el implante de la prótesis o anillo mitral y luego el implante de la prótesis Perceval S para evitar la desinserción de la prótesis sin sutura durante la cirugía mitral.
Prótesis Perceval S y necesidad de implante de marcapasos definitivoLa aparición del bloqueo auriculoventricular es una complicación infrecuente (1-3%) tras el RVA con prótesis convencional. Sin embargo, la incidencia es aún mayor en los pacientes con implante de TAVI (6-29%). En el caso de la prótesis sin sutura Perceval S se han reportado incidencias muy variadas (3-17%), con una media del 5,6%28.
En nuestra experiencia, la incidencia de bloqueo auriculoventricular e implante de marcapasos definitivo se ha mantenido en cifras aceptables, en comparación con los resultados de otros estudios; solo 7 pacientes precisaron implante de marcapasos definitivo, con una incidencia del 6,7%.
Todos los pacientes con implante de marcapasos definitivo habían presentado bloqueo auriculoventricular en el postoperatorio inmediato, de modo que el implante de marcapasos definitivo se ha realizado durante el ingreso en todos los casos.
En un estudio reciente, se ha visto la posibilidad de reducir la tasa de bloqueo auriculoventricular postoperatorio modificando la técnica de implante de la prótesis (reducción del tiempo de baloneo a <5s, decalcificación anular rigurosa, posicionamiento de la prótesis en el tracto de salida del ventrículo izquierdo y posterior reposicionamiento mediante tracción de los puntos de guía)29.
Se ha descrito en la literatura la presencia preoperatoria del bloqueo de rama derecha como un predictor independiente del trastorno de conducción postoperatorio30. En nuestra serie, del total de 7 pacientes que han presentado bloqueo auriculoventricular, solo 4 tenían alteraciones de la repolarización previamente a la cirugía.
En el estudio TRANSFORM (Experiencia Multicéntrica con la implementación rápida del sistema Edwards Intuity Valve para el Reemplazo de la Válvula Aórtica) ensayo clínico, la tasa de implante de marcapasos permanente para la prótesis Edwards Intuity (Edwards Lifesciences, Irvine, CA) fue del 11,9%31.
Seguimiento a largo plazo de la prótesis Perceval SEl seguimiento medio de nuestra serie ha sido de 32 meses, durante el cual no hubo ningún caso de endocarditis infecciosa ni de disfunción valvular o trombosis protésica.
Actualmente se han implantado más de 20.000 prótesis Perceval S en todo el mundo y han aparecido múltiples estudios y artículos en las revistas especializadas, teniendo información de seguimiento a largo plazo (6-9 años).
Shrestha et al. han publicado la experiencia más larga con la prótesis Perceval S, con una supervivencia a uno y 5 años del 92,1 y 74,7%, respectivamente, y no se han dado casos de migración, disfunción estructural ni trombosis de la válvula32.
Aunque es necesario un seguimiento más largo para estas prótesis (más allá de los primeros 10 años), la demostración de que el crimpado de la prótesis para su implantación no afecta la estructura del colágeno, los bajos gradientes conseguidos y el flujo no turbulento apuntan a favor de una larga durabilidad de esta prótesis.
ConclusionesNuestra experiencia con la prótesis sin sutura Perceval S (LivaNova, Saluggia, Italia) mostró resultados clínicos y hemodinámicos favorables incluso en tamaños pequeños, manteniéndose estables en el seguimiento a medio plazo.
El uso de esta prótesis ha favorecido el abordaje de pacientes de alta complejidad técnica (anillos aórticos pequeños, raíces aórticas calcificadas, reintervenciones y cirugías combinadas).
Dado que son resultados de un seguimiento a medio plazo, se necesita el aporte de más datos para valorar el rendimiento de esta prótesis a largo plazo. La técnica sin sutura y su futura evolución podrían considerarse opciones alternativas de tratamiento para el RVA, especialmente en pacientes complejos.
Conflicto de interesesNo existen conflictos de interés.