El clopidogrel (CPD) es un antiagregante plaquetario indicado en la prevención y tratamiento de acontecimientos aterotrombóticos como son el síndrome coronario agudo (SCA), el infarto cerebral o la enfermedad arterial periférica. Es muy frecuente su uso combinado con la aspirina (AAS), principalmente en pacientes que han sufrido un SCA y en los que se han sometido a revascularización coronaria percutánea.
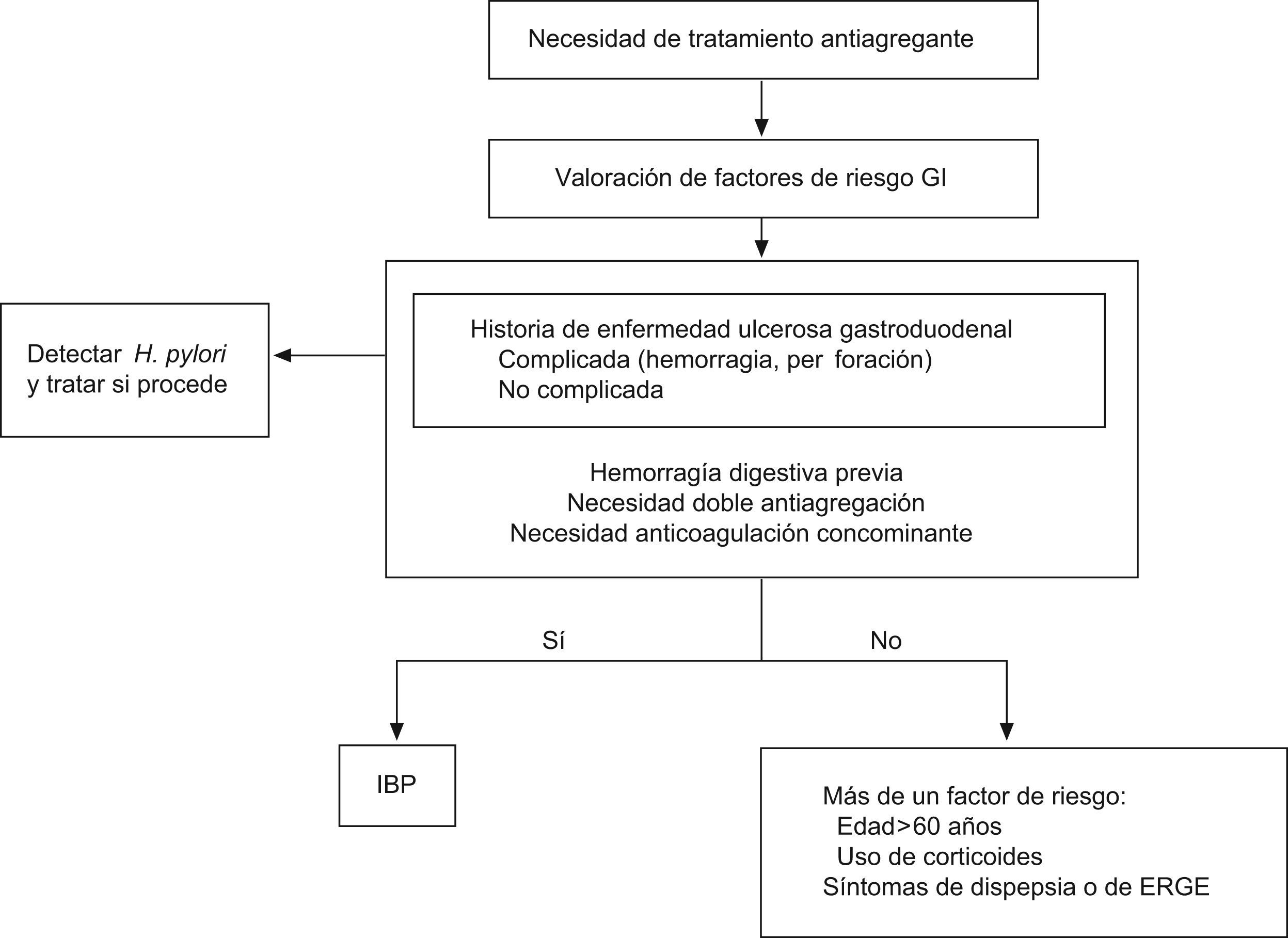
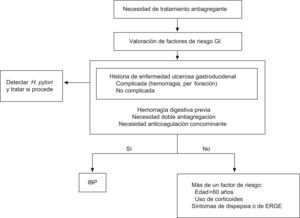
La antiagregación presenta una serie de riesgos GI que se incrementan al combinar dos antiagregantes o al asociarles antiinflamatorios no esteroideos (AINES), anticoagulantes o corticoides. El factor de riesgo más importante es el antecedente de úlcera gastroduodenal, especialmente en los pacientes que han tenido complicaciones hemorrágicas. Los efectos secundarios gastrointestinales del AAS se producen por la reducción de la producción de las prostaglandinas citoprotectoras (PGE2) a través de la inhibición de la COX-1 en las células de la mucosa gástrica. Esta inhibición es dependiente de la dosis y comienza a apreciarse a partir de 30mg/día, llegando a una inhibición máxima en torno a los 1.300mg/día. Estos efectos van desde síntomas como la dispepsia con o sin lesiones asociadas, a formas más graves como la hemorragia digestiva. El riesgo de complicaciones gastrointestinales con AAS a dosis bajas es del 1–2%, el cual no se modifica utilizando el AAS con cubierta entérica y aumenta si se combina con CPD1 (fig. 1).
Recomendaciones para la valoración y disminución del riesgo GI en pacientes con necesidad de antiagregación plaquetaria. Adaptado del documento de consenso de la ACCF1.
El CPD actúa bloqueando la activación y agregación plaquetaria, dificultando la cicatrización mediante la inhibición de la angiogénesis. Por lo tanto, aunque el CPD y otros antiagregantes como la ticlopidina, pueden no ser una causa primaria de úlcera gastroduodenal, sus efectos antiangiogénicos pueden impedir la correcta cicatrización de erosiones o ulceraciones producidas por otras causas como, por ejemplo, el Helicobacter pylori u otros fármacos.
Debido a lo expuesto previamente, la administración de fármacos inhibidores de la bomba de protones (IBP) se ha convertido en los últimos años en la piedra angular de las estrategias de prevención de lesiones GI en pacientes de riesgo con tratamiento antiagregante.
Farmacología del CPDEl CPD es un profármaco que ejerce su función tras un proceso de metabolización. In vivo, el 85% del CPD se inactiva por las esterasas plasmáticas y el 15% se convierte en el metabolito activo thiol (R-130964) por medio de las isoenzimas 2C19 y 3A4 del citocromo P-450. El metabolito activo inhibe la agregación plaquetaria uniéndose de manera irreversible al receptor P2Y12-ADP. Esta unión se asocia con una vasodilator-stimulated phosphoprotein (VASP, ‘defosforilación de la fosfoproteina estimulada vasodilatadora’). La medición de la fosforilación de la VASP (VASP-P) proporciona un platelet reactivity index (PRI, ‘índice de reactividad plaquetaria’), el cual se considera un indicador específico de la reactividad del receptor P2Y12 y, por lo tanto, un PRI <50% garantiza la actividad antiagregante del fármaco.
En el año 2003 se publicaron las primeras evidencias de respuesta antiagregante no uniforme al CPD en pacientes a los que se les había colocado un stent coronario. Dichas publicaciones iniciales llevaron a estudiar en profundidad los posibles mecanismos de resistencia a la acción del CPD, por ejemplo la inhibición competitiva del CYP-450 por diversos fármacos, como la inhibición de la isoenzima 3A4 por la atorvastatina o la eritromicina, o la inhibición de la isoenzima 2C19 por los IBP. Otro mecanismo de resistencia al CPD atañe a los polimorfismos genéticos que alteran la expresión de las isoenzimas del CYP-450, cuyo resultado es una actividad enzimática insuficiente para la conversión del CPD en su metabolito activo.
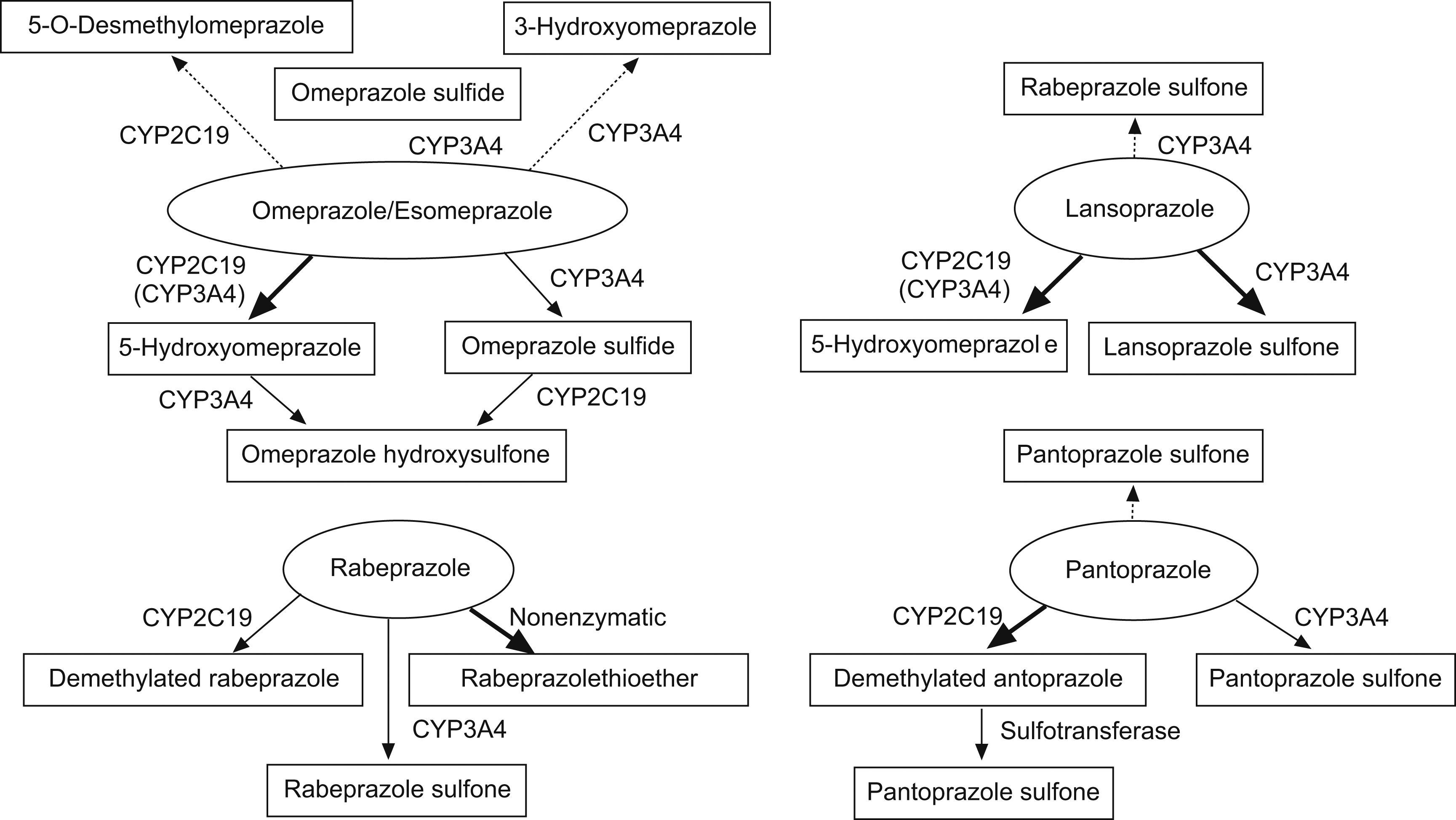
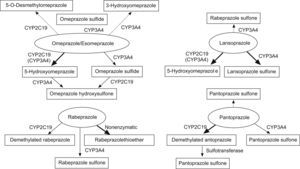
Farmacología de los IBPLos IBPs son IBP H+/K+ ATPasa, último paso de la secreción ácida gástrica. Estos fármacos sufren una biotransformación hepática extensa, donde son metabolizados por distintas isoenzimas del CYP450. Las principales isoenzimas involucradas en este metabolismo son el CYP2C19 y en menor medida el CYP34A. Los estudios que comparan el metabolismo vía CYP2C19 de los distintos IBP parecen demostrar una mayor utilización de esta vía por parte del omeprazol y el esomeprazol, siendo algo menor con el pantoprazol y lansoprazol2 (fig. 2). Al contrario que con los otros IBP, la ruta metabólica más importante del rabeprazol es la formación de un compuesto tioether por reducción no enzimática,sin embargo este metabolito sí es capaz de inhibir el CYP2C19 in vivo en un 30%.
Rutas metabólicas de los diversos IBP. Adapatado de Ishizaki et al2.
Gilard et al publicaron en 2006 un estudio observacional en el que los pacientes que tomaban IBP presentaban valores de PRI significativamente superiores. En 2008, el mismo grupo realizó un estudio prospectivo controlado, a doble ciego en pacientes a los que se les había implantado stents coronarios3 los cuales recibieron antiagregación con AAS (75mg/d) y CPD, junto con omeprazol (20mg/d) o placebo. En el día 7 el valor de PRI fue significativamente mayor en el grupo que tomaba omeprazol, siendo estos pacientes peores respondedores a CPD, [OR:4,31], 95% CI (2–9,2). Posteriormente otros autores como Siller-Matula et al4 evaluaron la modificación del PRI en pacientes que tomaban esomeprazol o pantoprazol junto al tratamiento antiagregante (CPD+AAS). El porcentaje de pacientes con PRI ≥69% fue similar en ambos grupos (25% vs 20%). Price et al5 en 2009 evaluaron la reactividad plaquetaria residual mediante método turbidométrico en 377 pacientes con enfermedad coronaria estable en tratamiento con CPD. El cotratamiento con IBP fue predictor independiente de una reactividad plaquetaria residual elevada lo cual se asoció a una tasa de mortalidad más elevada a los 6 meses (3% vs. 0%).
Tras el interés suscitado, diversos autores han evaluado el impacto clínico de la interacción farmacológica entre CPD e IBP. Tres estudios han realizado un análisis post hoc. En un estudio publicado por Dunn et al6 se muestra asociación independiente entre el uso de IBP y los eventos cardiovasculares adversos tanto a un mes como a un año de seguimiento. [OR 1,5], 95% CI (1,1–2,1). Otro estudio de Zairis et al7 y el análisis post hoc del estudio de Simon7 sobre polimorfismos genéticos no mostraron diferencias en cuanto a eventos cardiovasculares adversos a un año, en pacientes con y sin IBP, ni tampoco de forma específica con o sin omeprazol. Otros autores se han valido de estudios retrospectivos como el de Pezalla et al8, en el que la diferencia en las tasas de reinfarto entre el grupo control (1,38%) y el grupo de alta exposición a IBP (5,03%) fue estadísticamente significativa. Juurlink et al9 publicaron en 2009 un estudio de casos-control con pacientes que recibieron CPD tras tratamiento de IAM con un seguimiento de 90 días o hasta un reingreso por IAM o fallecimiento. El análisis multivariante mostró que el uso de IBP en los últimos 30 días se asociaba a un riesgo aumentado de reinfarto [OR 1,27], 95% CI (1,03–1,57) y que el 14% de reinfartos se podrían atribuir a la interacción farmacológica. Un análisis estratificado mostró que el uso de pantoprazol frente a otros IBP no se asociaba con reingreso por IAM [OR 1,02], 95% CI (0,70–1,47). Ho et al10 evaluaron recientemente mediante cohorte retrospectiva a 8.205 pacientes con SCA, de los cuales un 63,9% recibía un IBP además de CPD. Los resultados mostraron un incremento del riesgo de muerte o rehospitalización por SCA en pacientes con IBP [OR:1,25], 95% CI (1,11–1,41).
Finalmente, la controversia surge con los resultados del estudio CONGENT, único estudio aleatorizado que compara el omeprazol con placebo en pacientes tratados con CPD y que demuestran que el omeprazol no aumenta el riesgo de eventos cardiovasculares y reduce significativamente los efectos adversos gastrointestinales. Estos resultados cuestionan la relación entre los test ex vivo de agregación plaquetaria y los resultados clínicos. Sin embargo, a pesar de estos datos, la FDA lanzó en noviembre un aviso donde recomienda evitar el uso concomitante de CPD y omeprazol o esomeprazol.
Comentarios y conclusionesEl riesgo de efectos adversos gastrointestinales secundarios al tratamiento con AAS a dosis bajas aumenta al combinarla con CPD. El factor de riesgo más importante es el antecedente de ulcus gastroduodenal. Por lo tanto, la administración concomitante de IBP parece una precaución necesaria en los pacientes que reciben tratamiento antiagregante combinado, especialmente en aquellos con antecedentes personales de complicaciones gastrointestinales. Sin embargo, estudios recientes sugieren que el uso de IBP pueden interferir en la acción antiagregante del CPD mediante la inhibición de la transformación a su metabolito activo a través del CYP2C19 y, consecuentemente, producir una mayor incidencia de eventos cardiovasculares adversos. Por una parte es posible y biológicamente constatable una interacción verdadera entre CPD e IBP dado que ambos fármacos comparten la vía CYP2C19 y, por consiguiente, puede verse alterado su metabolismo. Además es posible que personas con ciertos polimorfismos genéticos sean propensas a una mayor interacción farmacológica. Otro aspecto a valorar sería si los diferentes fármacos del grupo de IBP interfieren de igual manera con el CPD, aunque los datos parecen más robustos para omeprazol y esomeprazol que para otros IBP, en consonancia con las rutas metabólicas específicas de cada fármaco. Sin embargo, el efecto clínico de esta interacción no ha sido demostrada mediante estudios prospectivos aleatorizados.
Con la evidencia científica actual es difícil extraer conclusiones que modifiquen la práctica clínica. Como recomendaciones finales sería prudente valorar la indicación de la antiagregación y los riesgos gastrointestinales y cardiovasculares de forma individualizada, con el fin de limitar el uso concomitante con IBP a los pacientes de riesgo o valorar la opción de proteger a los pacientes con anti-H2 a dosis dobles.