La cicatrización de las heridas isquémicas de la extremidad inferior puede fracasar a pesar de lograr una revascularización satisfactoria. El pie puede dividirse en 6 regiones anatómicas (angiosomas) nutridas por diferentes arterias que se originan en la arteria tibial posterior (3), la arteria tibial anterior (1), y la arteria peronea (2). En este estudio se investigó si el bypass a la arteria que nutre directamente el angiosoma isquémico influyó en la cicatrización de la herida y el salvamento de la extremidad. Se realizó un análisis retrospectivo de 52 heridas no cicatrizadas de la extremidad inferior (48 pacientes) que requirieron un bypass tibial a lo largo de un período de 2 años. Se revisaron las arteriografías preoperatorias para determinar la anatomía arterial con respecto al angiosoma específico de cada herida y la anatomía del bypass. Los pacientes se dividieron en 2 grupos: revascularización directa (RD, bypass en la arteria que nutre directamente el angiosoma isquémico) o revascularización indirecta (RI, bypass no relacionado con el angiosoma isquémico). El resultado de la herida se analizó con respecto a los siguientes criterios de valoración: cicatrización completa, amputación o fallecimiento no relacionado con la herida. También se anotó el tiempo de cicatrización de cada herida. Sobre la base de la arteriografía preoperatoria, en el 51% (n=27) de las heridas se realizó una RD del angiosoma isquémico, mientras que en el 49% (n=25) se realizó una RI. No se observaron diferencias estadísticamente significativas en las comorbilidades de ambos grupos. La revascularización se realizó mediante un bypass tibial utilizando la vena safena (n=34, 65%) o un implante de politetrafluoroetileno con un parche de vena distal (n=18, 35%). Los bypass se realizaron a las arterias tibial anterior (n=22, 42%), tibial posterior (n=17, 33%), o peronea (n=13, 25%) según el criterio del cirujano. Un bypass fracasó durante el período perioperatorio y fue excluido del análisis. Los bypass restantes seguían siendo permeables en el momento en que se evaluó la herida. Debido a una tasa de mortalidad del 17% solamente se dispuso de 43 heridas para el análisis de los criterios de valoración. Este análisis demostró que el 77% de las heridas (n=33) progresaron a una cicatrización completa y que el 23% (n=10) no lograron cicatrizar resultando en la amputación de la extremidad. En el grupo RD se produjo una cicatrización del 91% con una tasa de amputación del 9%. En el grupo RI se produjo una cicatrización del 62% con una tasa de amputación del 38% (p=0,03). En aquellas heridas que cicatrizaron, el tiempo total hasta la cicatrización no fue significativamente diferente (RD 162,4 días frente a RI 159,8 días; p=0,95). La revascularización desempeña un papel crucial en el tratamiento de las heridas isquémicas de la extremidad inferior. Creemos que la revascularización directa del angiosoma específico a la anatomía de la herida comporta mayores índices de cicatrización y salvamento de la extremidad. Si bien deben tenerse en cuenta muchos factores a la hora de elegir la arteria diana para la revascularización, es necesario considerar la revascularización de la arteria que nutre directamente al angiosoma isquémico.
Los avances en la revascularización distal de la extremidad inferior han revolucionado el salvamento de la extremidad isquémica. Una estrategia intensiva de revascularización incluye técnicas endovasculares, bypass venoso y bypass protésico así como adyuvantes para mejorar el rendimiento del injerto, como tejido de venas autólogas en las anastomosis distales o la adición de una fístula arteriovenosa distal1-4. Sin embargo, a pesar de estos avances, es posible que el bypass vascular no logre cicatrizar las heridas de una extremidad isquémica aun en el caso de que el paciente se haya sometido a una intervención de revascularización satisfactoria5-17.
Gooden et al18 mostraron que hasta el 25% de los pacientes con úlceras en el talón debían someterse a una amputación mayor a pesar de tener un pulso pedio detectable. El fracaso se debe en parte al tratamiento inadecuado de la herida durante el postoperatorio6. Sin embargo, es posible que las heridas no lleguen a cicatrizar debido a una incorrecta conexión vascular entre la arteria revascularizada y la zona isquémica local. Nuestra hipótesis es que la cicatrización de las heridas y el salvamento de la extremidad en casos de heridas isquémicas se verían optimizados mediante la revascularización directa (RD) de la zona del pie afectada.
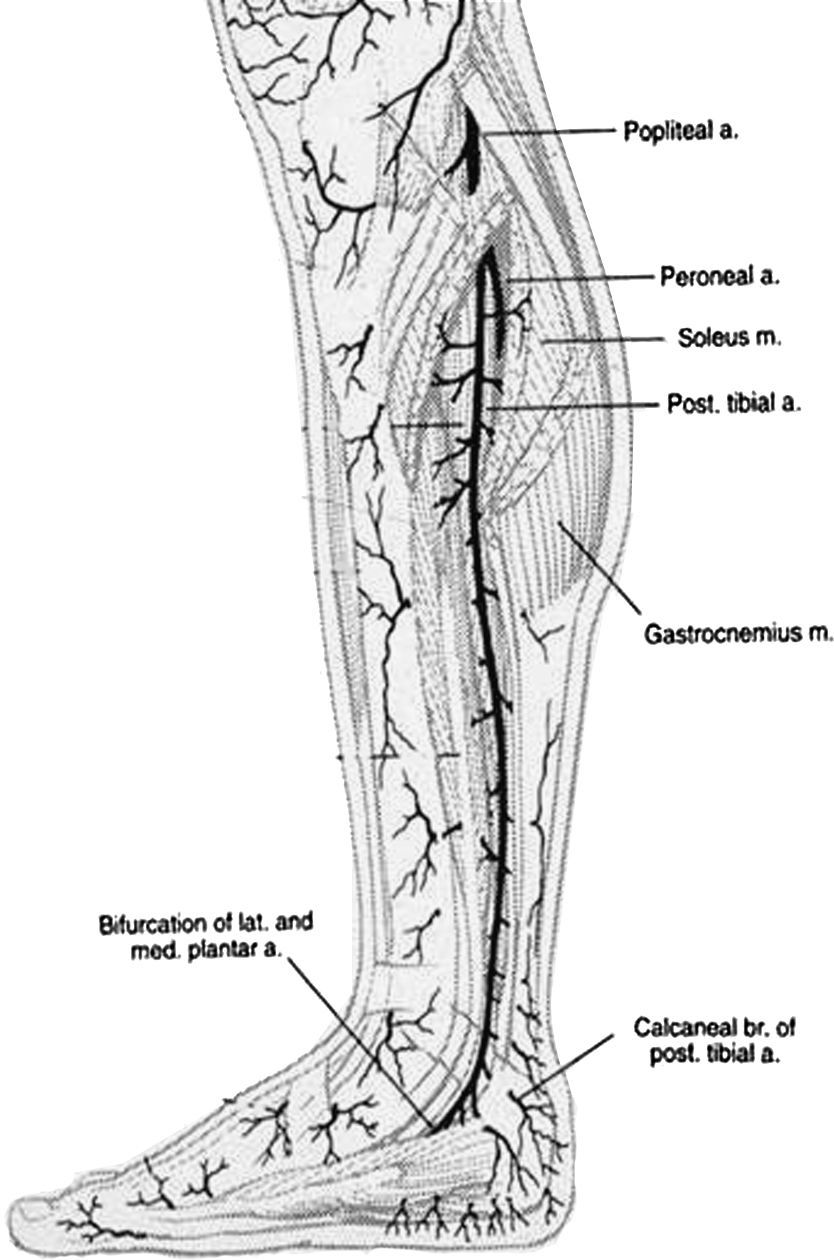
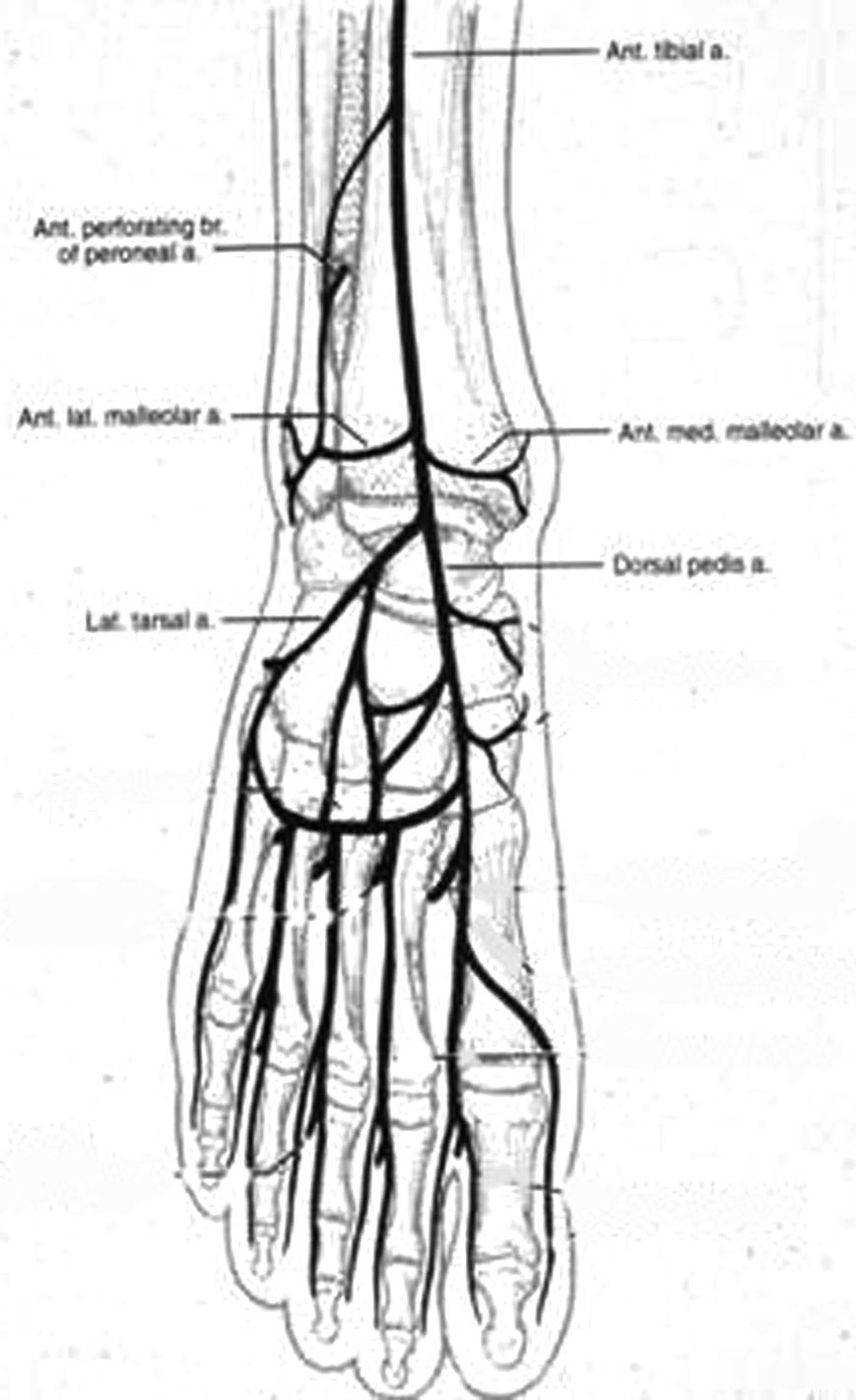
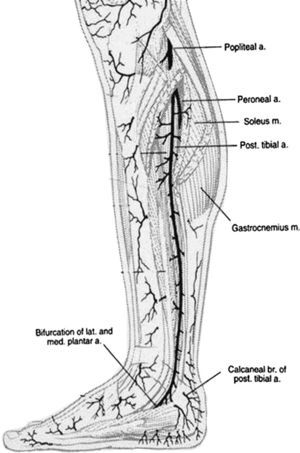
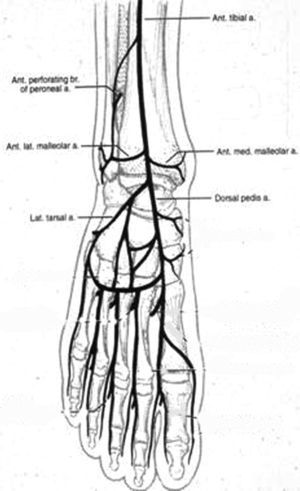
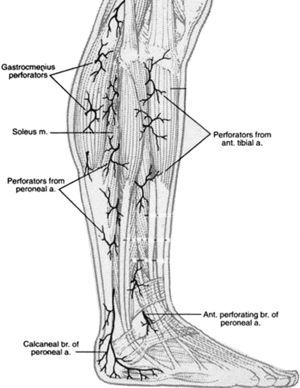
En 1987, Taylor y Palmer19,20 introdujeron el concepto de “angiosoma” que divide el cuerpo en territorios vasculares tridimensionales irrigados por arterias específicas y drenados por venas específicas. Taylor y Pan21 definieron 5 angiosomas diferenciados en el miembro inferior irrigados por la arteria safena media, la arteria tibial posterior, la arteria peronea y la arteria tibial anterior. La zona del pie y el tobillo está formada por 6 angiosomas diferentes que se originan en la arteria tibial posterior (n=3), la arteria tibial anterior (n=1), y la arteria peronea (n=2). La arteria tibial posterior da lugar a la rama calcánea que vasculariza la porción o medial del tobillo y plantar del talón, una rama plantar medial que vasculariza el dorso del pie, y una rama plantar lateral que vasculariza la porción lateral del antepié y plantar del medio tarso y del antepié (fig. 1). La arteria tibial anterior continúa por el dorso del pie como arteria pedia (fig. 2). La arteria peronea vasculariza la cara lateral del tobillo y plantar del talón a través de su rama calcánea y la cara anterior de la porción superior del tobillo a través de una rama anterior (fig. 3).
Angiosomas del pie originados en la arteria tibial posterior (n=3): rama calcánea, rama plantar medial, rama plantar lateral.
Popliteal a=A. Poplítea; Peroneal a=A. Peronea; Soleus m=M. Sóleo; Pst. Tibial a=A. tibial posterior; Gastrocnemius m.=M. Gastrocnemio; Bifurcation of lat. and med plantar a.=Bifurcación de la a. plantar lateral y medial; Calcanoar br of post tbial a=Rama calcánea de la a. tibial posterior.
Angiosoma del pie originado en la arteria tibial anterior (n=1): dorsal del pie.
Ant tibial a=A. tibial anterior; Ant perforating br of perineal a=Rama perforante anterior de la a. Peronea; Ant. Lat maleolar a=A. maleolar lateral anterior; Lat. tarsal a=A. tarsal lateral; Ant. med maleolar a=A. maleolar medial anterior; Dorsal pedis a=A. dorsal del pie.
Angiosomas del pie originados en la arteria perineal (n=2): rama calcánea, rama perforante anterior.
Gastrocnemius perforators=Perforadores de los gastrocnemios; Soleus m=M. Sóleo; Perforators from peroneal a=Peforadores de la a. Peronea; Calcanear br of peroneal a=Rama calcánea de la a. Peronea; Perforators from peroneal ant tibal a=Perforadores de la a. tibial anterior; Ant. perforating br of peroneal a=Rama perforante anterior de la a. peronea.
La literatura indica que suele ser suficiente realizar un bypass a una arteria distal para que cicatricen las heridas del pie y el tobillo. La elección de la arteria diana para el bypass está determinada por factores como la longitud del bypass, la disponibilidad del conducto, y la calidad de la arteria receptora. Emitimos la hipótesis de que además debe tenerse en cuenta la anatomía arterial específica del angiosoma isquémico. Por ejemplo, el bypass a la arteria dorsal del pie en casos de úlcera del talón ha logrado una cicatrización del 85% y el salvamento de la extremidad5, sin embargo, existe una tasa de fracasos del 15%. Es lógico que, para que la herida cicatrice, el flujo sanguíneo nuevo a la arteria dorsal del pie debe llegar al talón en una cantidad adecuada para que se produzca la cicatrización. Si las conexiones arteriales entre la circulación dorsal y plantar no son las adecuadas, es posible que la herida no tenga muchas oportunidades de cicatrizar. Es más probable que la RD de las arterias tibial posterior o peronea, ambas con ramas calcáneas que vascularizan directamente el talón plantar, permita la cicatrización de una herida en el talón plantar que la revascularización de la arteria dorsal del pie, que se basa en las conexiones arteria-arteria a través del arco podal para que el flujo de sangre llegue al tejido isquémico.
MétodosRevisamos de forma retrospectiva las historias clínicas de 56 pacientes consecutivos, con pérdida tisular por isquemia, que requirieron la reconstrucción vascular de la extremidad inferior para lograr la cicatrización de la herida. La demografía de los pacientes incluyó diabetes mellitus, insuficiencia renal crónica definida como concentración sérica de creatinina mayor o igual a 1,8, hipertensión arterial, y antecedentes de arteriopatía coronaria manifestada como angina o revascularización coronaria quirúrgica. Todas las heridas se trataron según el protocolo establecido en el Georgetown University Limb Center. El protocolo incluye una evaluación de la herida y del estado vascular mediante el examen de los pulsos y estudios del laboratorio de diagnóstico vascular para valorar el potencial de cicatrización. Se consideró la revascularización en los casos en que esta evaluación indicó una disminución de la capacidad cicatrizante manifestada como ausencia de pulsos podales, índice tobillo-brazo (ITBI) menor de 0,3, ondas Doppler monofásicas, valor absoluto de la presión transcutánea de oxígeno (TcO2) menor de 25 mmHg, o índice de TcO2 menor de 0,422. Se realizaron técnicas de imagen arterial con arteriografía en todas las extremidades que iban a someterse a revascularización. Las heridas se desbridaron antes de la revascularización en los casos en que existió gangrena húmeda o fasciitis necrotizante. Tras la revascularización, las heridas se desbridaron de forma seriada y se trataron con los cuidados tópicos adecuados hasta que presentaron signos de cicatrización como nuevo tejido de granulación. El desbridamiento se realizó semanalmente en el Limb Center hasta obtener un lecho limpio de tejido de granulación y posteriormente cada 2 semanas hasta que se produjo la cicatrización o se realizó la amputación. Durante estas visitas de seguimiento se realizaron mediciones de las heridas. Este protocolo fue similar en ambos grupos experimentales. Se añadieron tratamientos coadyuvantes a los cuidados tópicos para facilitar la cicatrización, como oxígeno hiperbárico, administración de factores de crecimiento tópicos, y cultivos de piel, según el criterio de los médicos del Limb Center. Si la herida no respondió a pesar del tratamiento exhaustivo, se consideró que la extremidad no era recuperable y se aconsejó la amputación.
Se revisaron las arteriografías preoperatorias de cada extremidad y las heridas se clasificaron según su localización con respecto al angiosoma primario, que incluyó la arteria tibial posterior (calcánea, plantar medial, plantar lateral), la arteria dorsal del pie, y la arteria peronea21 (calcánea, perforante anterior). Se revisaron las angiografías y los informes operatorios de forma ciega para delinear la anatomía arterial preoperatoria, el tipo de bypass y la localización de la anastomosis distal. Definimos 2 grupos de estudio sobre la base de la anatomía del bypass: revascularización directa (RD) e indirecta (RI). La RD, que supuso un bypass directo a la arteria que nutre el vaso principal del angiosoma donde se localizaba la úlcera (bypass a la arteria tibial anterior en caso de úlcera podal dorsal, bypass a la arteria peronea en caso de úlcera lateral del tobillo, y bypass a la arteria tibial posterior en caso de úlcera en el arco plantar medial). Una úlcera en el talón plantar se incluyó en el grupo directo si el bypass se realizó a la arteria peronea o tibial posterior. La RI supuso el bypass a una arteria no relacionada con el angiosoma isquémico. Se revisó la documentación exhaustiva sobre los cuidados de la herida proporcionada por el Limb Center para evaluar la tasa de cicatrización y los resultados clínicos finales de cada herida. Así pues, el resultado clínico se clasificó como cicatrización, fracaso que provocó una amputación mayor (amputación infragenicular o supragenicular), o muerte no relacionada con la herida. El resultado en todos los casos, bien fuese la cicatrización, bien una amputación, así como el tiempo hasta lograr la cicatrización completa, se compararon en ambos grupos de estudio. Además se comparó la incidencia de factores de riesgo entre ambos grupos. Entre estos factores de riesgo destacaron diabetes, hipertensión arterial, insuficiencia renal crónica y arteriopatía coronaria.
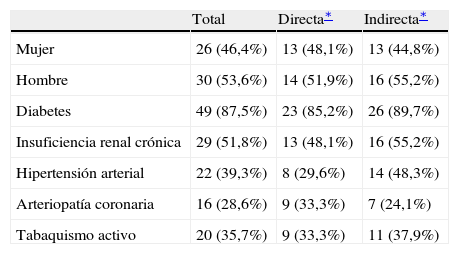
ResultadosSe revisaron 60 heridas en 56 pacientes consecutivos. En 8 pacientes no se pudo realizar el seguimiento, lo que dejó una cohorte de estudio de 52 heridas para análisis. Del total del grupo, el 87% de los pacientes eran diabéticos, en el 52% se diagnosticó insuficiencia renal crónica, y el 36% admitió ser fumador activo. No se observaron diferencias estadísticamente significativas en las comorbilidades de los dos grupos de bypass (tabla I).
Demografía de los pacientes
| Total | Directa∗ | Indirecta∗ | |
| Mujer | 26 (46,4%) | 13 (48,1%) | 13 (44,8%) |
| Hombre | 30 (53,6%) | 14 (51,9%) | 16 (55,2%) |
| Diabetes | 49 (87,5%) | 23 (85,2%) | 26 (89,7%) |
| Insuficiencia renal crónica | 29 (51,8%) | 13 (48,1%) | 16 (55,2%) |
| Hipertensión arterial | 22 (39,3%) | 8 (29,6%) | 14 (48,3%) |
| Arteriopatía coronaria | 16 (28,6%) | 9 (33,3%) | 7 (24,1%) |
| Tabaquismo activo | 20 (35,7%) | 9 (33,3%) | 11 (37,9%) |
Todos los bypass se realizaron en arterias infrageniculares. La arteria diana fue la arteria tibial anterior en 22 pacientes (42%), la arteria tibial posterior en 17 (33%), y la arteria peronea en 13 (25%). El bypass distal se realizó con la vena safena translocada en 34 casos (65%), y con politetrafluoroetileno (PTFE) y un parche de vena distal en 18 casos4 (35%). Uno de los bypass falló durante el período perioperatorio, fue el bypass en la arteria peronea con PTFE y un parche de vena distal. Aproximadamente un tercio de las heridas cicatrizaron con cuidados tópicos. Diez necesitaron el cierre primario diferido o un injerto cutáneo de espesor parcial (7 RD y 3 RI). En 21 pacientes se requirieron colgajos locales (12 RD y 9 RI). Estos colgajos incluyeron la amputación en rayo, transmetatarsiana y de Chopart. Se utilizaron dos colgajos libres para obtener el cierre final de la herida (1 RD y 1 RI).
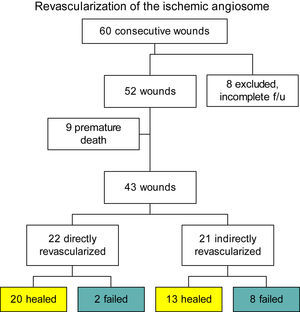
Treinta y tres de las 52 heridas (63,5%) progresaron hasta la cicatrización completa. Diez lesiones (19,2%) no lograron cicatrizar y los pacientes sufrieron una amputación mayor. El fallecimiento no relacionado con la herida antes de la cicatrización completa o la incapacidad para cicatrizar se produjo en 9 pacientes (17,3%). Se realizó el análisis detallado de los 43 pacientes restantes con cuidados completos de la herida. Se dispuso de arteriografías que permitieron delinear la anatomía vascular preoperatoria y se compararon con el tipo de bypass realizado. Sobre la base de los estudios preoperatorios y los informes operatorios, 22 de los bypass (51%) se realizaron directamente en la arteria que nutre el vaso principal del angiosoma ulcerado, mientras que 21 (49%) fueron sometidos a una RI (fig. 4). La anatomía del bypass en los grupos fue similar: RD (11 tibial anterior, 6 tibial posterior, 5 peronea) y RI (8 tibial anterior, 8 tibial posterior, 6 peronea). El tipo de bypass tampoco presentó diferencias significativas: RD (14 injertos venosos translocados, 8 injertos con parches de venas dístales)23 y RI (16 injertos venosos translocados, 5 injertos con parches de venas distales).
Cohorte de pacientes con seguimiento según el tipo de revascularización. 2 failed: 2 fracasos; 8 excluded, incomplete f/u: 8 excluidas, seguimiento incompleto; 8 failed: 8 fracasos; 9 premature death: 9 fallecimientos prematuros; 13 healed: 13 cicatrizadas; 20 healed: 20 cicatrizadas; 21 indirectly revascularized: 21 revascularizadas indirectamente; 22 directly revascularized: 22 revascularizadas directamente; 43 wounds: 43 heridas; 52 wounds: 52 heridas; 60 consecutive wounds: 60 heridas consecutivas; Revascularization of the ischemic angiosome: revascularización del angiosoma isquémico.
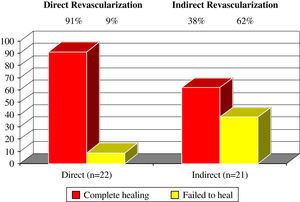
Al comparar la media del tiempo transcurrido hasta la cicatrización completa no se observaron diferencias estadísticamente significativas entre las heridas sometidas a RD frente a las sometidas a RI (RD 162,4 días frente a RI 159,8 días, p=0,95). Sin embargo, existió una diferencia estadísticamente significativa (test exacto de Fisher, p=0,03) en la tasa de cicatrización completa al comparar la RD (cicatrización de la herida 90,9%) frente a la revascularización indirecta (cicatrización de la herida 61,9%) (fig. 5). Los intervalos de seguimiento de la cicatrización fueron similares en ambos grupos a intervalos de 100 días. La cicatrización se produjo hacia los 100 días en 2 grupos RD (10%) y en 1 RI (8%), entre 100 y 200 días en 13 grupos RD (65%) y en 9 RI (69%), y en más de 200 días en 5 grupos RD (25%) y 3 grupos RI (23%). Se observó que la tasa de amputación más elevada fue cuatro veces mayor en el grupo RI (1 supragenicular, 7 infragenicular) en comparación con el grupo con RD de la herida (2 infragenicular) (tabla II).
Cicatrización completa de las heridas en función de la revascularización directa o indirecta en las 43 heridas con resultado y seguimiento conocido. Se observó una diferencia estadísticamente significativa en la tasa de cicatrización completa con p=0,03 (test exacto de Fisher). Complete healing: cicatrización completa; Direct (n=22): directa (n=22); Direct Revascularization: revascularización directa; Failed to heal: fracaso de la cicatrización; Indirect (n=21): indirecta (n=21); Indirect Revascularization: revascularización indirecta.
La revascularización eficaz sigue siendo el principal componente en el tratamiento de las úlceras isquémicas de la extremidad inferior. De forma intuitiva, proporcionar un flujo sanguíneo directo a la zona específica de una úlcera distal isquémica debería ser preferible a confiar en la revascularización inespecífica gracias a la neovascularización espontánea. El concepto de territorios vasculares diferenciados (es decir, angiosomas) del pie y el tobillo proporciona una base anatómica para analizar este concepto intuitivo. Esta estrategia selectiva frente a la revascularización del pie y el tobillo isquémicos se basa en el conocimiento de la anatomía de estos bloques tisulares tridimensionales irrigados por arterias “principales”. La arteria tibial posterior irriga 3 territorios vasculares del pie. Tras vascularizar la porción medial y posteromedial del tobillo, la arteria tibial posterior suministra flujo sanguíneo al talón medial y plantar a través de la rama calcánea, al arco plantar a través de la arteria plantar medial, y al mediopié plantar lateral y a todo el antepié plantar a través de la arteria plantar lateral. La arteria peronea distal vasculariza la porción anterolateral del tobillo a través de la rama perforante y la cara lateral y plantar del talón a través de la rama calcánea. La arteria tibial anterior vasculariza la porción anterior del tobillo y se convierte en la arteria dorsal del pie, que vasculariza el dorso del pie.
Nuestra evaluación retrospectiva de la revascularización, sobre la base del concepto del angiosoma, sugiere que es más probable que la RD del angiosoma isquémico sea satisfactoria a la hora de cicatrizar la herida y salvar la extremidad que la RI. La conclusión es que la consiguiente tasa de amputación también fue menor. Esto apoya nuestra hipótesis inicial de que es preferible proporcionar flujo sanguíneo anterógrado directo a la zona anatómica que contiene la herida que confiar en el flujo indirecto a través de las conexiones arteria-arteria de los vasos del pie.
Un aspecto igualmente importante en el tratamiento de las heridas isquémicas es la calidad de los cuidados de las heridas. Muchas extremidades con bypass satisfactorios deben amputarse debido a una infección masiva o incontrolable. El intento por cerrar de forma prematura una herida infectada provocará una mayor infección tisular y necrosis. Se ha demostrado que la TcO2 alrededor de una herida isquémica aumenta lentamente tras el bypass vascular y alcanza un máximo a las 2-4 semanas de la revascularización24. Esto indica que el efecto beneficioso cicatrizante conseguido tras restaurar el flujo sanguíneo puede no ser completo transcurrida una semana de la revascularización. Un cierre temprano intensivo de la herida o la amputación definitiva pueden no ser ventajosos. La herida debe prepararse cuidadosamente y la reconstrucción de los tejidos blandos debe retrasarse hasta que se hayan resuelto todos los signos de inflamación e infección y la herida presente signos iniciales de cicatrización. En nuestro centro, el tiempo entre la revascularización y la reconstrucción de los tejidos blandos suele ser de 2-4 semanas. A menudo se da de alta al paciente tras la revascularización y el desbridamiento inicial de la herida, realizándose el seguimiento de forma ambulatoria. Éste consiste en un plan para el cuidado de la herida diseñado por médicos del Limb Center y llevado a cabo por enfermeras domiciliarias con la evaluación y el tratamiento adicionales durante visitas periódicas al Limb Center. El estado de la revascularización también se evalúa durante estas vistas ambulatorias; se realiza el examen de los pulsos y eco-Doppler del injerto a intervalos estándar: 3, 6, y 12 meses. Cuando se considera que la herida está preparada para el cierre, el paciente vuelve al hospital para el desbridamiento final y el cierre apropiado de la herida, que puede ser mediante cierre primario tras un desbridamiento adicional, injerto cutáneo, o colgajos musculares locales rotados hacia la herida.
Es difícil determinar la calidad funcional de las conexiones arteria-arteria del pie y el tobillo. Puede ser útil la detección de anterógrado y retrógrado en las arterias distales, siempre que el flujo aferente sea suficiente para que pueda ser evaluado mediante eco-Doppler. Las señales Doppler de la arteria dorsal del pie pueden evaluarse mediante la compresión de la arteria tibial posterior. El estudio angiográfico no siempre muestra estas conexiones, especialmente en situaciones de compromiso del flujo arterial. Algunas RI conducen a la cicatrización de la herida. Por tanto, si estas conexiones existen y son las adecuadas, la RI puede ser satisfactoria. Esto refleja la experiencia clínica de que los elevados porcentajes de salvamento de la extremidad se logran gracias a un bypass satisfactorio, independientemente de la consideración sobre la anatomía del angiosoma. Berceli, Carsten y otros autores han demostrado que puede producirse la pérdida de la extremidad a pesar de la existencia de un bypass permeable5,7. Berceli et al5 notificaron una tasa de curación del 86% para las lesiones del talón tras el bypass de la arteria dorsal del pie a pesar de la falta de continuidad hacia el arco plantar, lo que supondría una RI según el concepto de angiosoma. Sin embargo, estos autores reconocen la dificultad que plantea esta situación y coinciden en que la cicatrización depende de la restauración del flujo sanguíneo local adecuado a la herida. En nuestra serie, el 62% de las heridas cicatrizaron gracias a una RI. Observamos que, si en la arteriografía no aparecen las conexiones arteria-arteria del pie y no existe neovascularización arterial en el angiosoma que contiene la úlcera isquémica, las posibilidades de cicatrización son más problemáticas. Nuestros resultados retrospectivos indican que, cuando el cirujano vascular tiene la posibilidad de elegir las arterias diana para la revascularización, debe dar preferencia a la arteria que vasculariza directamente el angiosoma afectado. Sin embargo, si la única arteria disponible no proporciona un flujo sanguíneo directo al angiosoma afectado, sigue estando indicada la revascularización a pesar de que no se aprecien de forma objetiva conexiones arteria-arteria. En estas situaciones, el salvamento de la extremidad puede no ser tan elevado como en los casos en que es posible una RD.
ConclusiónLa revascularización desempeña un papel crucial en el tratamiento de las heridas isquémicas de la extremidad inferior. Sobre la base de nuestra evaluación retrospectiva, creemos que la RD del angiosoma específico de la anatomía de la herida no cicatrizante conduce a un porcentaje más elevado de cicatrización y salvamento de la extremidad. La calidad de los cuidados posteriores de la herida también es un componente crítico para facilitar la cicatrización y evitar una mayor pérdida tisular. Si bien intervienen muchos factores en la elección de la arteria diana para la revascularización, a la hora de planificar la revascularización de la extremidad inferior también puede tenerse en cuenta la revascularización de la arteria que irriga directamente al angiosoma isquémico.
Presentado en el Southern Association for Vascular Surgery meeting, Puerto Rico, 18 de enero de 2007.