Se han identificado varios factores de riesgo de trombosis venosa profunda (TVP) y las trombofilias hereditarias constituyen un porcentaje significativo entre ellos. La más frecuente es la resistencia a la proteína C activada (PCA), y el factor V es la causa más habitual de resistencia a la PCA. La prevalencia de resistencia a la PCA en la población caucásica es elevada, mientras que entre personas con ascendencia asiática o africana ha demostrado ser baja en estudios anteriores. En este estudio se incluyeron 23 pacientes con TVP de la extremidad inferior. El diagnóstico se confirmó mediante eco-Doppler. Se estudió la resistencia a la PCA utilizando el sistema STA Staclot APC-R (Diagnostica Stago, Asnières, Francia), siguiendo las instrucciones del fabricante. Diez pacientes (43,5%) dieron positivo a la resistencia a la PCA, mientras que 13 (56,5%) dieron negativo. Se ha observado que la resistencia a la PCA, aunque se considera muy poco frecuente, tiene una prevalencia elevada en los pacientes con TVP procedentes del noreste de la India. Debe estimarse la resistencia a la PCA en todos los pacientes con TVP.
La trombosis venosa profunda (TVP) y sus secuelas, embolia pulmonar y síndrome postrombótico, son una causa significativa de morbilidad y mortalidad. Muchos casos de TVP se deben a trombofilias hereditarias. La resistencia a la proteína C activada (PCA) es la trombofilia hereditaria más habitual, y el factor V Leiden es la causa más común de resistencia a la PCA. Aunque no hay duda alguna de su elevada prevalencia entre la población caucásica, se considera que la prevalencia entre personas de ascendencia asiática o africana es baja o insignificante1.
Pacientes y MétodosEl estudio estuvo formado por 23 pacientes con TVP ingresados en un centro hospitalario terciario de la Banaras Hindu University, Varanasi, India. Todos los pacientes eran indios, de la región del noreste del país. El diagnóstico se confirmó mediante eco-Doppler. Todos los pacientes presentaron TVP de la extremidad inferior y se estudió su resistencia a la PCA, que fue determinada mediante el sistema STA Staclot APC-R (Diagnostica Stago, Asnières, Francia). La obtención de las muestras, su procesado y la estimación de la resistencia a la PCA se realizaron según las instrucciones del fabricante. Se obtuvieron muestras de sangre en el momento del ingreso hospitalario a razón de 9 volúmenes en 0,109mol/l (es decir, 3,2%) de solución anticoagulante a base de citrato trisódico (1 vol). La sangre se centrifugó para obtener plasma pobre en plaquetas y se almacenó a –80°C. La estimación de la resistencia a la PCA se realizó posteriormente por lotes, en los dos meses siguientes.
Se consideró que un tiempo de coagulación plasmática (obtenido mediante el sistema STA Staclot APC-R) igual o mayor de 120 s fue negativo a la resistencia a la PCA. Por otro lado, un tiempo de coagulación plasmática menor de 120 s se consideró positivo a la resistencia a la PCA. No se realizó el estudio genético de los pacientes debido a restricciones económicas y la no disponibilidad de la prueba.
Los pacientes que dieron positivo a la resistencia a la PCA fueron tratados con anticoagulación a largo plazo siguiendo las pautas del American College of Physicians y de la American Academy of Family Physicians.
Descripción de la pruebaEn el sistema STA Staclot APC-R, la coagulación de la muestra plasmática diluida se logra en presencia de plasma deficiente en factor V y veneno de Crotalus viridis helleri. Este veneno actúa como activador del factor X y por tanto inicia la cascada de la coagulación desde el factor X, eliminando así la influencia de todos los factores de la coagulación que actúan en una fase anterior.
La prolongación del tiempo de coagulación del plasma normal en presencia de la PCA resulta de su capacidad para inactivar el factor V activado del plasma estudiado.
El principio de la evaluación de la resistencia de la PCA se basa en una prolongación anormalmente corta del tiempo de coagulación del plasma estudiado en presencia de PCA y en medio con elevada concentración de calcio.
Según el manual del producto, la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de la prueba son 99,6, 99,7, 99,2 y 99,9%, respectivamente.
Saynalp et al2 demostraron que en las pruebas de resistencia a la PCA, basadas en la coagulación con la utilización de veneno de serpientes crotálidas como procoagulante, los valores de resistencia a la PCA de los pacientes con una mutación homocigota del factor V Leiden (70,4±13,5 s) fueron significativamente menores (p<0,001) que los de los individuos con la mutación heterocigota (87,6±13,4 s). Observaron que la sensibilidad y la especificidad fueron del 98,7 y 91,9%, respectivamente, para la identificación sistemática de la mutación del factor V Leiden.
De forma análoga, Oger et al3 demostraron que la prueba con el sistema STA Staclot APC-R tenía una sensibilidad global del 100% y una especificidad del 98,8%. Un proceso trombótico agudo no afectó el rendimiento de la prueba.
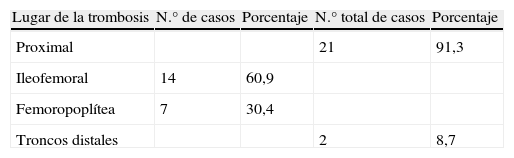
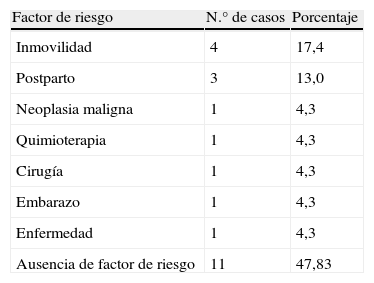
ResultadosSe estudiaron 23 pacientes con TVP confirmada mediante eco-Doppler. Eran 12 hombres (52,2%) y 11 mujeres (47,8%), con un promedio de edad de 37,83±14,33 años. Entre los 23 pacientes con TVP, 10 (43,5%) dieron positivo a la resistencia a la PCA, mientras que 13 (56,5%) dieron negativo a la resistencia a la PCA (tabla I). Veintiún pacientes (91,3%) presentaron una TVP proximal y 2 (8,7%) una TVP de troncos distales (tabla II). En un paciente el trombo se extendió a la vena cava inferior, mientras que en 4 de ellos se extendió a la vena safena interna. Entre los factores de riesgo asociados, la inmovilización (4 pacientes) y el posparto (3 pacientes) fueron los más comunes (tabla III). Nueve pacientes (39,1%) también dieron positivo para presencia de anticoagulante lúpico.
Como postuló Virchow, existen 3 factores de importancia crucial en el desarrollo de trombosis venosa: 1) alteraciones del flujo sanguíneo, 2) cambios hemáticos y 3) lesiones en la pared vascular.
Muchos pacientes tienen un estado de hipercoagulabilidad subyacente heredado o adquirido. La resistencia a la PCA es, de lejos, la trombofilia hereditaria más común. Fue descubierta por Dahlback en 1993. El factor V Leiden representa el 90-95% de los casos de resistencia a la PCA.
El factor V es una proenzima que se transforma en factor Va gracias a la acción de la trombina, y cuya función consiste en catalizar la activación de la protrombina en trombina. La trombina ligada a la trombomodulina funciona como un anticoagulante ya que activa el sistema de la proteína C. La PCA potenciada por el cofactor proteína S regula a la baja la actividad del sistema de coagulación escindiendo e inhibiendo los factores Va y VIIIa. En el factor V Leiden, la arginina en la posición 506 está sustituida por glutamina y esto hace que la molécula del factor Va sea resistente a la escisión por la PCA. Un segundo mecanismo de trombosis observado con el factor V Leiden es la reducción de su actividad como cofactor con la PCA y los fosfolípidos, en la inactivación del factor VIIIa4. El factor V Leiden se hereda de forma autosómica dominante, pero su penetrabilidad es muy variable. El riesgo de trombosis aumenta 5-10 veces en individuos heterocigotos y 50-100 veces en homocigotos.
Se han descrito otras mutaciones del factor V similares al factor V Leiden, con diferentes efectos. Las mutaciones en R306 son responsables del factor V Hong Kong (R306G) y del factor V Cambridge (R306T). Éste último está asociado con una reducción de la actividad del cofactor PCA en la inactivación del factor VIIIa y con una leve resistencia a la PCA en las pruebas del tiempo de tromboplastina parcial activada, mientras que la resistencia a la PCA no se ha documentado en el factor V Hong Kong. La mutación de este factor V Hong Kong es frecuente en pacientes chinos sanos, al igual que en pacientes con trombosis. La mutación I359T, factor V Liverpool, provoca una alteración en la N-glicosilación de Asn357, lo que también provoca una reducción de la actividad cofactor de la PCA en la inactivación del factor VIIIa y la prolongación del tiempo de tromboplastina parcial activada. El factor V Liverpool está asociado con un aumento del riesgo de trombosis. La resistencia a la PCA también puede ser adquirida, como sucede durante el embarazo, consumo de anticonceptivos orales, neoplasias malignas y presencia de anticoagulante lúpico.
Además se ha observado que la resistencia a la PCA es un factor de riesgo independiente de trombosis venosa, e independiente del factor V Leiden.
Se estima que la prevalencia de la resistencia a la PCA es del 3,6-6% en la población general, del 21% en pacientes no seleccionados con trombosis venosa, y del 10-64% en pacientes seleccionados con trombosis venosa5 (edad 45 años y/o trombosis recurrente). Si bien existe acuerdo sobre la elevada prevalencia de la resistencia a la PCA en la población caucásica, estudios previos han demostrado una prevalencia muy baja o nula en personas de ascendencia africana o asiática1.
Algunos estudios llevados a cabo en la India han demostrado que la prevalencia de la resistencia a la PCA en pacientes con TVP oscila entre el 10,5 y el 39,2%, mientras que la prevalencia del factor V Leiden fue del 3-15,8%6–10. Nuestro estudio halló que la prevalencia de la resistencia a la PCA era del 43,5% en pacientes no seleccionados con TVP. Solamente un estudio anterior ha demostrado una prevalencia tan alta como la de nuestro estudio (39,2%), pero este estudio se realizó en pacientes con TVP juvenil (< 45 años de edad). Esta prevalencia tan alta de resistencia a la PCA podría deberse a otros motivos diferentes del factor V Leiden, como mutaciones en el factor V o resistencia adquirida a la PCA.
ConclusiónLa resistencia a la PCA debida posiblemente al factor V Leiden, aunque es muy común en la población caucásica, se ha considerado muy poco frecuente en la población asiática o africana. En nuestro estudio hemos hallado una prevalencia elevada de resistencia a la PCA en pacientes con TVP procedentes del noreste de la India. De los 23 pacientes, 12 presentaron factores de riesgo asociados. En el 91% de los pacientes, la localización de los trombos fue proximal (ileofemoral/femoropoplítea). En el 43,5% de los pacientes se observó resistencia a la PCA y fueron tratados con anticoagulación a largo plazo. Concluimos que existe una prevalencia elevada de resistencia a la PCA en pacientes no seleccionados con TVP. Debe estimarse la resistencia a la PCA en todos los pacientes con TVP.