La hipopigmentación post-quemadura (HPQ) es una complicación frecuente en pacientes quemados, generando secuelas permanentes. El tratamiento es complejo, con escasa evidencia, e incluye el uso de procedimientos quirúrgicos descritos principalmente en reportes de casos y series de pacientes.
El objetivo de este trabajo fue describir las diferentes técnicas quirúrgicas disponibles en la literatura para el tratamiento de la HPQ.
MetodologíaSe realizó una revisión sistemática en Medline, Embase, PubMed, Cochrane y LILACS, incluyendo casos clínicos, series de casos, y artículos originales en inglés y español, que describieran técnicas quirúrgicas para el manejo de la HPQ crónica, hasta septiembre de 2020.
ResultadosVeintisiete artículos cumplían con los criterios de inclusión, describiendo siete técnicas quirúrgicas para el manejo de la HPQ: injerto cutáneo de espesor parcial, injerto epidérmico mediante ampollas, mini-injerto por punch, injerto de pequeños fragmentos epidérmicos, trasplante de queratinocitos-melanocitos no cultivados, autoinjerto de epitelio cultivado, y aprovechamiento de unidades foliculares. Estas técnicas fueron aplicadas en 301 pacientes, entre 5 y 68 años, 58% sexo femenino, incluyendo principalmente pacientes asiáticos, hispanos y afrodescendientes. Las principales localizaciones corporales tratadas fueron extremidades superiores, área facial y extremidades inferiores. Con todas las técnicas se describe repigmentación significativa, siendo la principal complicación la hiperpigmentación de la zona tratada.
Discusión - ConclusiónExisten siete técnicas quirúrgicas descritas para el manejo de la HPQ, sin embargo, faltan estudios comparativos de mayor calidad, por lo que la selección de la técnica dependerá de la experiencia clínica, disponibilidad de recursos técnicos, y las características individuales de cada paciente.
Post-burn hypopigmentation (PBH) is a frequent complication in burned patients, which may generate permanent sequelae. Treatment is complex, with limited evidence available, and includes the use of surgical procedures described mainly in case reports and case series.
The objective of this manuscript was to describe the different surgical techniques available in the literature for the treatment of PBH.
MethodologyA systematic review was carried out in Medline, Embase, PubMed, Cochrane and LILACS databases, including clinical cases, case series, and original articles written in English and Spanish, which described surgical techniques for the management of chronic PBH, until September 2020.
ResultsTwenty seven articles met the inclusion criteria, which described seven surgical techniques for the management of PBH, including: superficial dermabrasion with split thickness skin grafting, blister epidermal grafting, punch minigrafting, chip skin grafting, non-cultured keratinocyte-melanocyte transplantation, cultured epithelium autograft, and follicular unit exploitation. These techniques were applied in 301 patients, between 5 and 68 years old, 58% female, mainly Asian, Hispanic and Afro-descendant patients. The main body locations treated were upper extremities, facial area and lower extremities. Significant repigmentation is described with all the techniques, and the main complication was hyperpigmentation of the treated area.
Discussion and conclusionThere are seven surgical techniques described for the management of PBH, however, higher quality comparative studies are needed, therefore, the selection of the technique depends on clinical experience, availability of technical resources, and the individual characteristics of each patient.
Las cicatrices post-quemadura son una causa frecuente de morbilidad que afecta la calidad de vida de pacientes quemados, pudiendo asociarse a dolor crónico, contracturas, prurito, desfiguración cosmética y trastornos de la pigmentación1,2. Aunque la mayoría de las alteraciones pigmentarias se resuelven con el tiempo, la hipopigmentación post-quemadura (HPQ), también denominada leucodermia, suele ser permanente y de difícil manejo3.
En la fase aguda de la HPQ, se ha otorgado un rol fisiopatológico a la destrucción directa de melanocitos y melanina en la epidermis por el trauma térmico4. La HPQ crónica, en cambio, se explica por la destrucción de anexos cutáneos, desde los cuales migrarían células madre de melanocitos para producir melanina5,6. Por otro lado, el tejido fibroso cicatricial obstaculiza la migración de melanocitos e impide la transferencia de melanina. Recientemente, sin embargo, se ha planteado que la densidad de melanocitos en la zona de HPQ estaría conservada, existiendo un cambio en la estructura dendrítica, una tasa de reducida de proliferación, falta de señalización para activación de melanogénesis, y una defectuosa síntesis de melanina y transferencia desde melanocitos a queratinocitos7–9.
Las intervenciones quirúrgicas para el tratamiento de la HPQ suelen estar enfocadas en remover tejidos cicatriciales y, ya sea activar los melanocitos remanentes y/o transferir melanocitos y queratinocitos de sitios sanos a áreas afectadas, a modo de que puedan migrar centrífugamente y producir repigmentación de la piel afectada4–9.
Desafortunadamente, existe una falta de evidencia de alta calidad disponible en la literatura, y la mayoría de las revisiones de tratamientos quirúrgicos de la HPQ incluyen experiencias en pacientes con vitíligo u otras causas de leucodermia. El objetivo de este trabajo fue proporcionar una revisión sistemática actualizada y completa de todas las técnicas quirúrgicas descritas para el tratamiento de la HPQ, basada únicamente en la evidencia generada en pacientes quemados.
2METODOLOGÍALa revisión sistemática se realizó en concordancia con lo establecido en las guías PRISMA10.
Se realizó una búsqueda electrónica en cinco bases de datos (Medline, Embase, PubMed, Cochrane y LILACS) en septiembre de 2020, utilizando los siguientes términos: ((Burn) OR (postburn) OR (post burn) OR (post-burn) OR (burn scar) OR (burn injuries)) [All fields] AND ((Depigmentation) OR (Dyspigmentation) OR (Hypopigmentation) OR (leukoderma) OR (leucoderma) OR (achromic) OR (depigmented) OR (leukodermic)) [All fields] AND ((surgical) OR (treatment) OR (repigmentation)) [All fields]).
Dos revisores independientes con experiencia examinaron las publicaciones para determinar su elegibilidad a través del título, resumen y revisión de texto completo. Las discrepancias se resolvieron a través de un tercer revisor. Adicionalmente, se examinaron las referencias de los artículos seleccionados.
Se incluyeron casos clínicos, series de casos, y artículos originales en inglés y español, que describieran técnicas quirúrgicas para el manejo de la HPQ crónica, hasta septiembre de 2020. Se excluyeron del estudio artículos que describieran tratamientos no quirúrgicos, tratamiento de otras causas de leucodermia diferentes a quemaduras, artículos que evaluaran el manejo de otras secuelas post-quemadura no HPQ, revisiones o artículos desarrollados en animales o modelos experimentales.
Los manuscritos seleccionados fueron leídos exhaustivamente, incluyendo las técnicas quirúrgicas originales descritas y las experiencias posteriores con esas técnicas. De cada publicación se extrajo el número de pacientes, sexo, edad, ubicación anatómica de la HPQ, superficie corporal total en la que se aplicó la técnica, raza o fototipo de Fitzpatrick, período de seguimiento, resultados postquirúrgicos y complicaciones.
Los datos se agruparon en una hoja de cálculo de Microsoft Excel® (versión 16.16.2, Redmond, WA).
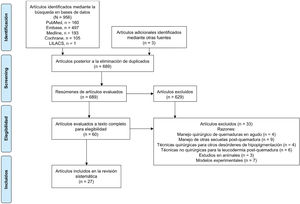
3RESULTADOSLa búsqueda inicial incluyó 956 referencias: Pubmed (n=160), Embase (n=497), Medline (n=193), Cochrane (n=105) y LILACS (n=1). El diagrama de flujo de selección incluyó finalmente 27 artículos que cumplían con los criterios de inclusión (Fig. 1).
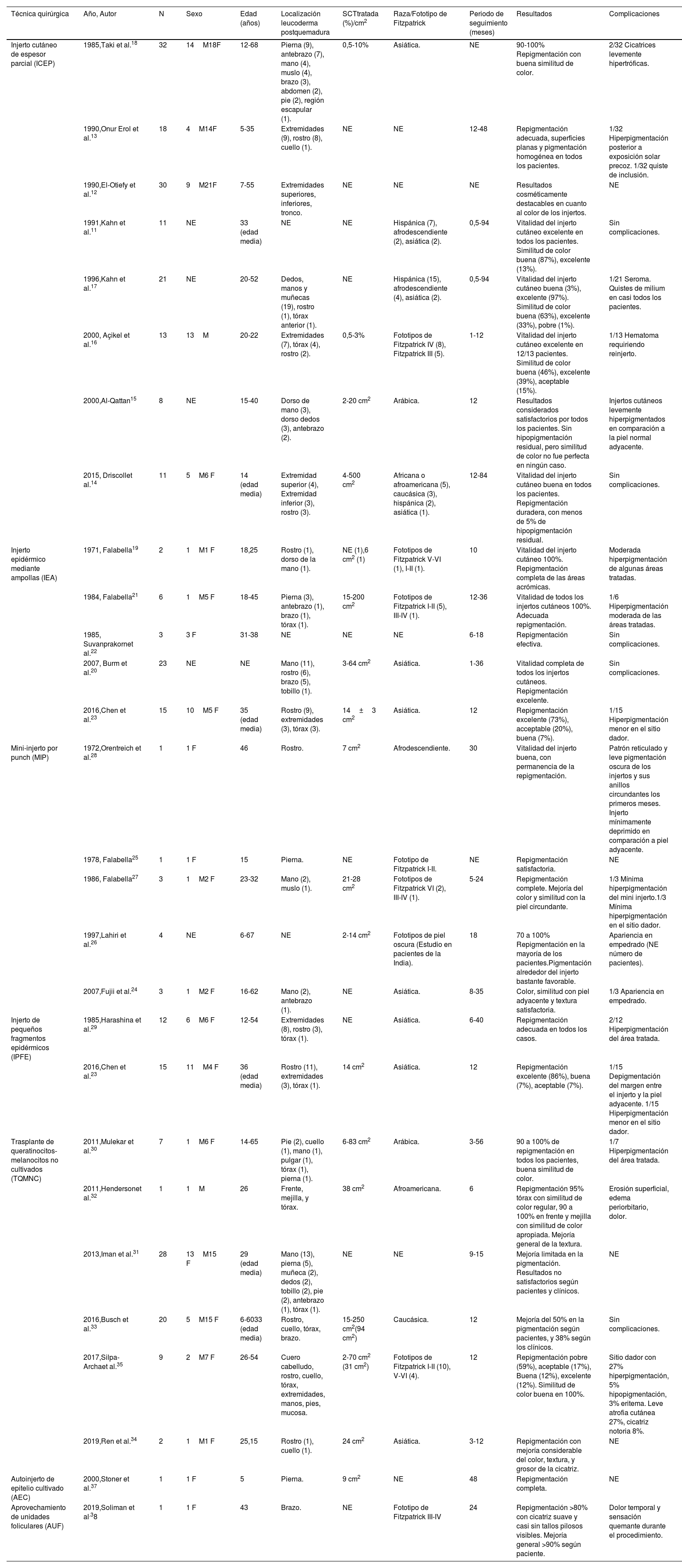
Se describen un total de siete técnicas quirúrgicas originales para el manejo de la HPQ, aplicadas en un total de 301 pacientes, entre 5 y 68 años, 58% de sexo femenino, incluyendo en su mayoría población de etnias con pigmentación cutánea más oscura, principalmente asiática, hispánica y afrodescendiente, seguido de razas y fototipos de piel más clara. La principal localización anatómica con HPQ fue la extremidad superior, seguida del área facial, extremidad inferior, tórax, cuello, abdomen y cuero cabelludo. Los resultados en general describen alto porcentaje de repigmentación con buena similitud de color con la piel circundante, siendo la principal complicación la hiperpigmentación de la zona tratada debido a exposición solar (Tabla 1).
Leucodermia post-quemadura
| Técnica quirúrgica | Año, Autor | N | Sexo | Edad (años) | Localización leucoderma postquemadura | SCTtratada (%)/cm2 | Raza/Fototipo de Fitzpatrick | Periodo de seguimiento (meses) | Resultados | Complicaciones |
|---|---|---|---|---|---|---|---|---|---|---|
| Injerto cutáneo de espesor parcial (ICEP) | 1985,Taki et al.18 | 32 | 14M18F | 12-68 | Pierna (9), antebrazo (7), mano (4), muslo (4), brazo (3), abdomen (2), pie (2), región escapular (1). | 0,5-10% | Asiática. | NE | 90-100% Repigmentación con buena similitud de color. | 2/32 Cicatrices levemente hipertróficas. |
| 1990,Onur Erol et al.13 | 18 | 4M14F | 5-35 | Extremidades (9), rostro (8), cuello (1). | NE | NE | 12-48 | Repigmentación adecuada, superficies planas y pigmentación homogénea en todos los pacientes. | 1/32 Hiperpigmentación posterior a exposición solar precoz. 1/32 quiste de inclusión. | |
| 1990,El-Otiefy et al.12 | 30 | 9M21F | 7-55 | Extremidades superiores, inferiores, tronco. | NE | NE | NE | Resultados cosméticamente destacables en cuanto al color de los injertos. | NE | |
| 1991,Kahn et al.11 | 11 | NE | 33 (edad media) | NE | NE | Hispánica (7), afrodescendiente (2), asiática (2). | 0,5-94 | Vitalidad del injerto cutáneo excelente en todos los pacientes. Similitud de color buena (87%), excelente (13%). | Sin complicaciones. | |
| 1996,Kahn et al.17 | 21 | NE | 20-52 | Dedos, manos y muñecas (19), rostro (1), tórax anterior (1). | NE | Hispánica (15), afrodescendiente (4), asiática (2). | 0,5-94 | Vitalidad del injerto cutáneo buena (3%), excelente (97%). Similitud de color buena (63%), excelente (33%), pobre (1%). | 1/21 Seroma. Quistes de milium en casi todos los pacientes. | |
| 2000, Açikel et al.16 | 13 | 13M | 20-22 | Extremidades (7), tórax (4), rostro (2). | 0,5-3% | Fototipos de Fitzpatrick IV (8), Fitzpatrick III (5). | 1-12 | Vitalidad del injerto cutáneo excelente en 12/13 pacientes. Similitud de color buena (46%), excelente (39%), aceptable (15%). | 1/13 Hematoma requiriendo reinjerto. | |
| 2000,Al-Qattan15 | 8 | NE | 15-40 | Dorso de mano (3), dorso dedos (3), antebrazo (2). | 2-20 cm2 | Arábica. | 12 | Resultados considerados satisfactorios por todos los pacientes. Sin hipopigmentación residual, pero similitud de color no fue perfecta en ningún caso. | Injertos cutáneos levemente hiperpigmentados en comparación a la piel normal adyacente. | |
| 2015, Driscollet al.14 | 11 | 5M6 F | 14 (edad media) | Extremidad superior (4), Extremidad inferior (3), rostro (3). | 4-500 cm2 | Africana o afroamericana (5), caucásica (3), hispánica (2), asiática (1). | 12-84 | Vitalidad del injerto cutáneo buena en todos los pacientes. Repigmentación duradera, con menos de 5% de hipopigmentación residual. | Sin complicaciones. | |
| Injerto epidérmico mediante ampollas (IEA) | 1971, Falabella19 | 2 | 1M1 F | 18,25 | Rostro (1), dorso de la mano (1). | NE (1),6 cm2 (1) | Fototipos de Fitzpatrick V-VI (1), I-II (1). | 10 | Vitalidad del injerto cutáneo 100%. Repigmentación completa de las áreas acrómicas. | Moderada hiperpigmentación de algunas áreas tratadas. |
| 1984, Falabella21 | 6 | 1M5 F | 18-45 | Pierna (3), antebrazo (1), brazo (1), tórax (1). | 15-200 cm2 | Fototipos de Fitzpatrick I-II (5), III-IV (1). | 12-36 | Vitalidad de todos los injertos cutáneos 100%. Adecuada repigmentación. | 1/6 Hiperpigmentación moderada de las áreas tratadas. | |
| 1985, Suvanprakornet al.22 | 3 | 3 F | 31-38 | NE | NE | NE | 6-18 | Repigmentación efectiva. | Sin complicaciones. | |
| 2007, Burm et al.20 | 23 | NE | NE | Mano (11), rostro (6), brazo (5), tobillo (1). | 3-64 cm2 | Asiática. | 1-36 | Vitalidad completa de todos los injertos cutáneos. Repigmentación excelente. | Sin complicaciones. | |
| 2016,Chen et al.23 | 15 | 10M5 F | 35 (edad media) | Rostro (9), extremidades (3), tórax (3). | 14±3 cm2 | Asiática. | 12 | Repigmentación excelente (73%), acceptable (20%), buena (7%). | 1/15 Hiperpigmentación menor en el sitio dador. | |
| Mini-injerto por punch (MIP) | 1972,Orentreich et al.28 | 1 | 1 F | 46 | Rostro. | 7 cm2 | Afrodescendiente. | 30 | Vitalidad del injerto buena, con permanencia de la repigmentación. | Patrón reticulado y leve pigmentación oscura de los injertos y sus anillos circundantes los primeros meses. Injerto mínimamente deprimido en comparación a piel adyacente. |
| 1978, Falabella25 | 1 | 1 F | 15 | Pierna. | NE | Fototipo de Fitzpatrick I-II. | NE | Repigmentación satisfactoria. | NE | |
| 1986, Falabella27 | 3 | 1M2 F | 23-32 | Mano (2), muslo (1). | 21-28 cm2 | Fototipos de Fitzpatrick VI (2), III-IV (1). | 5-24 | Repigmentación complete. Mejoría del color y similitud con la piel circundante. | 1/3 Mínima hiperpigmentación del mini injerto.1/3 Mínima hiperpigmentación en el sitio dador. | |
| 1997,Lahiri et al.26 | 4 | NE | 6-67 | NE | 2-14 cm2 | Fototipos de piel oscura (Estudio en pacientes de la India). | 18 | 70 a 100% Repigmentación en la mayoría de los pacientes.Pigmentación alrededor del injerto bastante favorable. | Apariencia en empedrado (NE número de pacientes). | |
| 2007,Fujii et al.24 | 3 | 1M2 F | 16-62 | Mano (2), antebrazo (1). | NE | Asiática. | 8-35 | Color, similitud con piel adyacente y textura satisfactoria. | 1/3 Apariencia en empedrado. | |
| Injerto de pequeños fragmentos epidérmicos (IPFE) | 1985,Harashina et al.29 | 12 | 6M6 F | 12-54 | Extremidades (8), rostro (3), tórax (1). | NE | Asiática. | 6-40 | Repigmentación adecuada en todos los casos. | 2/12 Hiperpigmentación del área tratada. |
| 2016,Chen et al.23 | 15 | 11M4 F | 36 (edad media) | Rostro (11), extremidades (3), tórax (1). | 14 cm2 | Asiática. | 12 | Repigmentación excelente (86%), buena (7%), aceptable (7%). | 1/15 Depigmentación del margen entre el injerto y la piel adyacente. 1/15 Hiperpigmentación menor en el sitio dador. | |
| Trasplante de queratinocitos-melanocitos no cultivados (TQMNC) | 2011,Mulekar et al.30 | 7 | 1M6 F | 14-65 | Pie (2), cuello (1), mano (1), pulgar (1), tórax (1), pierna (1). | 6-83 cm2 | Arábica. | 3-56 | 90 a 100% de repigmentación en todos los pacientes, buena similitud de color. | 1/7 Hiperpigmentación del área tratada. |
| 2011,Hendersonet al.32 | 1 | 1M | 26 | Frente, mejilla, y tórax. | 38 cm2 | Afroamericana. | 6 | Repigmentación 95% tórax con similitud de color regular, 90 a 100% en frente y mejilla con similitud de color apropiada. Mejoría general de la textura. | Erosión superficial, edema periorbitario, dolor. | |
| 2013,Iman et al.31 | 28 | 13M15 F | 29 (edad media) | Mano (13), pierna (5), muñeca (2), dedos (2), tobillo (2), pie (2), antebrazo (1), tórax (1). | NE | NE | 9-15 | Mejoría limitada en la pigmentación. Resultados no satisfactorios según pacientes y clínicos. | NE | |
| 2016,Busch et al.33 | 20 | 5M15 F | 6-6033 (edad media) | Rostro, cuello, tórax, brazo. | 15-250 cm2(94 cm2) | Caucásica. | 12 | Mejoría del 50% en la pigmentación según pacientes, y 38% según los clínicos. | Sin complicaciones. | |
| 2017,Silpa-Archaet al.35 | 9 | 2M7 F | 26-54 | Cuero cabelludo, rostro, cuello, tórax, extremidades, manos, pies, mucosa. | 2-70 cm2 (31 cm2) | Fototipos de Fitzpatrick I-II (10), V-VI (4). | 12 | Repigmentación pobre (59%), aceptable (17%), Buena (12%), excelente (12%). Similitud de color buena en 100%. | Sitio dador con 27% hiperpigmentación, 5% hipopigmentación, 3% eritema. Leve atrofia cutánea 27%, cicatriz notoria 8%. | |
| 2019,Ren et al.34 | 2 | 1M1 F | 25,15 | Rostro (1), cuello (1). | 24 cm2 | Asiática. | 3-12 | Repigmentación con mejoría considerable del color, textura, y grosor de la cicatriz. | NE | |
| Autoinjerto de epitelio cultivado (AEC) | 2000,Stoner et al.37 | 1 | 1 F | 5 | Pierna. | 9 cm2 | NE | 48 | Repigmentación completa. | NE |
| Aprovechamiento de unidades foliculares (AUF) | 2019,Soliman et al.38 | 1 | 1 F | 43 | Brazo. | NE | Fototipo de Fitzpatrick III-IV | 24 | Repigmentación >80% con cicatriz suave y casi sin tallos pilosos visibles. Mejoría general >90% según paciente. | Dolor temporal y sensación quemante durante el procedimiento. |
Descripción de los artículos seleccionados en la revisión sistemática.
N=Número de pacientes; SCT=Superficie corporal total; M=Masculino; F=Femenino, NE= No especificado.
El ICEP surge como una técnica sencilla que permite la repigmentación permanente, con mejores resultados estéticos y menor morbilidad de la zona donante en comparación con el injerto convencional11–13.
Primero, se debe preparar el sitio receptor mediante dermoabrasión superficial, que puede ser realizada con fresa de diamante o dermatomo eléctrico, sobrepasando por 2-4mm el contorno de la zona afectada, hasta notar un sangrado puntiforme de la dermis reticular14,15. Otra técnica de dermoabrasión fue descrita por Açikel et al., mediante el uso de láser de dióxido de carbono (CO2) en 13 pacientes, 12 de los cuales mostraron excelentes resultados, permitiendo una evaluación más precisa de la profundidad del tejido erosionado, menor sangrado, mayor uniformidad, y piel más suave con mínimo daño térmico16. Posteriormente, el injerto de piel fina puede obtenerse de abdomen, espalda, muslos o glúteos, con un dermatomo eléctrico con espesor entre 0,1 y 0,2 mm13–15,17,18. Así, se obtiene suficiente tejido conteniendo la capa basal de epidermis con su componente de melanocitos. El injerto posteriormente se fija al área dermabradada. Una mejoría aparente del área tratada se observa durante el primer reemplazo de apósito, y el área donante generalmente cicatriza en 2 semanas14–16.
La mayoría de los estudios con ICEP informan resultados satisfactorios, generando una cicatrización eficaz tanto de la zona donante como la zona afectada. Driscoll et al. realizaron este procedimiento en dieciséis ocasiones, con un área afectada promedio de 88 cm2 (abarcando hasta 500 cm2), resultando en una pigmentación adecuada y duradera en todos los casos, con menos de 5% de leucodermia residual14.
Se describen pocas complicaciones, como la hiperpigmentación causada por exposición solar durante el postoperatorio temprano13–15. Al Qattan utilizó ICEP en la extremidad superior de 8 pacientes, describiendo una ligera hiperpigmentación en el período de seguimiento, que se consideró menos significativa que la hipopigmentación previa al procedimiento15.
Una de las desventajas es la eventual diferencia de color entre el injerto y la piel adyacente al área tratada11,16,17. El ICEP, además, requiere un área donante de igual o mayor extensión a la zona receptora, lo que aumenta el riesgo de cicatrices en ambos sitios14. El riesgo de la anestesia general y los costos asociados constituyen otra desventaja14–16,18.
3.2Injerto epidérmico mediante ampollas (IEA)Este método consiste en formar bulas para obtener el tejido dador19. En 2007, Burm et al. consolidaron este procedimiento utilizando una bomba de succión portátil con manómetro y ventosas20. Un mini-injerto se obtiene idealmente del muslo o abdomen, colocando ventosas con presión negativa de 200mmHg para inducir la formación de ampollas. En un plazo de 3 a 4 horas, se debe desprender la cubierta epidérmica de la ampolla19–21. También se pueden formar ampollas por congelación con nitrógeno líquido durante 20-25 segundos, lo cual puede utilizarse para tratar áreas más pequeñas, mientras que el método de succión es indoloro y útil en áreas más grandes22.
El sitio receptor debe removerse mediante dermoabrasión superficial, o con ampollas mediante aplicación de nitrógeno líquido o por succión, las cuales se formarán en menos de 24 horas, sin embargo, el injerto solamente se puede realizar con éxito 3 a 4 días después de que el edema y los cambios inflamatorios hayan remitido19–22. El día del injerto, los mini-injertos obtenidos se aplican en el área afectada de forma superpuesta para evitar formación de fisuras acrómicas22,23.
Diversos autores han reportado una repigmentación moderada o completa, sin cicatrices ni alteraciones en la zona donante o receptora19–23.
Una ventaja de esta técnica es la posibilidad de obtener múltiples muestras de un sitio donante relativamente pequeño, sin cicatrices notorias19,20. Sin embargo, el área de tratamiento está limitada por el tamaño de la ventosa en una proporción 1:1 entre las ampollas del sitio donante y el receptor19,23. El IEA genera mínimas molestias, por lo que no requiere de abundante anestesia. En pocos casos se han descrito efectos adversos menores como hiperpigmentación del sitio donante19,21,23.
3.3Mini-injerto por punch (MIP)Esta técnica consiste en realizar, bajo anestesia local, mini-punchs de 1-2mm de diámetro en la zona afectada, o abrasiones superficiales con fresas dentales, uniformemente espaciadas por 4-5mm entre sí, con suficiente profundidad para alcanzar dermis de espesor parcial. Posteriormente, mediante mini-punchs se obtienen mini-injertos de igual diámetro y espesor en piel no foto-expuesta, y se colocan dentro de los orificios realizados en la zona receptora, inmovilizándolos durante al menos 1 semana24–28. Alternativamente, Fujii et al. realizaron mini-punchs de 0,25mm de diámetro, minimizando las cicatrices en el sitio donante, con mejores resultados en cuanto a color y textura en relación a la piel adyacente24.
Lahiri et al. utilizaron esta técnica obteniendo entre 70 y 100% de repigmentación en 49% de las lesiones, y entre 50 y 70% de repigmentación en 34% de ellas26.
Una ventaja de este procedimiento es que utiliza el fenómeno de “propagación del pigmento”, que es la propiedad de los melanocitos de migrar centrífugamente desde cada área injertada a la piel leucodérmica adyacente, permitiendo la repigmentación. Por lo tanto, se puede tratar un área receptora considerablemente más grande que el área donante24,27,28. Se pueden tomar hasta 200 mini-injertos de 1-2mm de diámetro desde un área donante de 25 cm2, y un injerto de 1mm puede originar una pigmentación 25 veces más grande25,27.
La repigmentación con apariencia en empedrado es el efecto adverso más común, sin embargo, tiende a desvanecerse con el tiempo dado la unión definitiva de las islas de repigmentación24–27. Otros efectos adversos descritos incluyen la hiperpigmentación del injerto, queloides y contracturas de la cicatriz24,26–28.
3.4Injerto de pequeños fragmentos epidérmicos (IPFE)Técnica descrita por Harashina et al., similar a la técnica de ICEP, sin embargo, en este caso se obtiene un injerto de espesor parcial (<0,3mm) de un tercio a un quinto del área receptora, que posteriormente se divide en pequeños trozos pasándolo dos veces por un mallador de injerto. Posteriormente, se dividen con bisturí en fragmentos tan pequeños como sea posible, los cuales se distribuyen homogéneamente por toda la zona receptora previamente dermabradada29.
Harashina et al. aplicaron esta técnica en 12 pacientes, logrando repigmentación adecuada en todos los casos29. Así mismo, Chen et al. trataron la región facial de 15 pacientes con área promedio de 14 cm2, reportando excelente repigmentación en 86% de los casos23.
La ventaja de este procedimiento es que permite tratar una superficie 3 a 5 veces mayor que el injerto del sitio donante. Esta técnica se basa en la capacidad de los melanocitos para migrar a la piel leucodérmica adyacente, bajo el mismo principio que el MIP, aunque más simple y con pigmentación más homogénea, minimizando también la desfiguración y discapacidad del sitio donante al utilizar injertos muy finos. Además, no genera demarcación entre la piel normal y el contorno del injerto, ni pigmentación en empedrado. Sin embargo, dos pacientes de las publicaciones descritas desarrollaron hiperpigmentación posterior debido a exposición solar23,29.
3.5Trasplante de queratinocitos-melanocitos no cultivados (TQMNC)Este procedimiento utiliza una suspensión no cultivada de queratinocitos y melanocitos, a partir de una muestra de piel superficial de una zona donante, que debe ser un décimo del tamaño de la zona receptora afectada30–35. Inicialmente se utilizó un procesamiento complejo, donde la muestra se incuba en una solución de tripsina, luego se separa la capa epidérmica y se centrifuga, obteniendo células que se suspenden en un medio específico. Esta suspensión celular se aplica posteriormente sobre la zona receptora previamente dermabradada, y se cubre con láminas de colágeno seco para proporcionar un ambiente óptimo para la vascularización y crecimiento celular30,32.
Mulekar et al. realizaron esta técnica con posterior aplicación de láser Excimer en la zona tratada, logrando un efecto sinérgico en la actividad y propagación de los melanocitos, con tasas de repigmentación entre 90 y 100%. Solo un paciente presentó hiperpigmentación posterior30.
Bush et al. realizaron el TQMNC en 20 pacientes mediante el sistema ReCell cubriendo defectos de hasta 250 cm233,36. Este sistema realiza un procesamiento rápido y automatizado de células autólogas del paciente in vitro, produciendo una suspensión mixta de células viables para ser aplicadas. En la zona receptora, en vez de dermoabrasión o láser, realizaron una activación percutánea del colágeno mediante micro-agujas para inducir micro-trauma, mejorando así la calidad de la cicatriz. Mediante esta combinación obtuvieron una mejoría del 50% en la pigmentación de sus pacientes33.
Por otro lado, Iman et al. evaluaron esta técnica en 18 pacientes que recibieron una suspensión de células epidérmicas autólogas pulverizada sobre el área afectada previamente dermabradada, y 10 pacientes que recibieron inyecciones de la suspensión en un área no dermabradada previamente. Ambos grupos experimentaron repigmentación leve y el recuento de melanocitos por campo evaluados histológicamente no fue estadísticamente diferente entre los grupos, ni antes y después del procedimiento31.
El TQMNC permite una relación entre área donante y receptora de 1:10, con repigmentación estadísticamente significativa probada en áreas de hasta 320 cm230,32,33. Su uso mediante pulverización logra una proporción de 1:40 entre área donante y receptora34.
Sin embargo, se han obtenido resultados contradictorios debido a la dispersión celular irregular en el área receptora, y las dificultades asociadas con la adecuada fijación de la suspensión celular en la piel31,35.
3.6Autoinjerto de epitelio cultivado (AEC)Técnica similar al TQMNC, con la diferencia de que el cultivo celular obtenido del sitio donante se somete a ciertas condiciones, incluyendo la adición de factor de crecimiento epidérmico, que le permiten una alta tasa de crecimiento celular y generar colonias estratificadas que se asemejan a la epidermis37.
Stoner et al. trataron a una niña de 5 años con HPQ de 9 cm2. El epitelio cultivado recién formado se aplicó como una hoja de células en el área leucodérmica previamente dermabradada, logrando una repigmentación evidente 6 semanas después. La presencia de melanocitos se confirmó mediante histoquímica y microscopía electrónica37.
El AEC permite la expansión de un pequeño trozo de epidermis en grandes cantidades de epitelio cultivado, sin limitaciones en el área de superficie que puede tratarse.
Las principales desventajas son el costo y el nivel de complejidad técnico, que requiere 2 etapas quirúrgicas y un laboratorio especializado30,37.
3.7Aprovechamiento de unidades foliculares (AUF)Soliman et al. describieron un protocolo de tres pasos para el tratamiento de la HPQ. Esta técnica consiste en la extracción de unidades foliculares individuales del cuero cabelludo mediante punchs de 0,8mm, y su posterior implantación separadas por 5mm en la zona leucodérmica. Luego, se trata la zona con fototerapia para estimular la pigmentación, y depilación láser, logrando una cicatriz repigmentada, de textura suave y sin vello. El AUF logra más del 80% de repigmentación, y más del 90% de satisfacción del paciente38.
Esta técnica aprovecha el potencial proliferativo de las unidades foliculares, logrando una mejor supervivencia y captación de los injertos, y repigmentación de áreas más grandes, con buenos resultados estéticos. Los pacientes solamente experimentan molestias mínimas temporales, sin efectos adversos significativos38.
4DISCUSIÓNLos procedimientos quirúrgicos detallados en la literatura internacional permiten tratar la HPQ de forma segura y con buenos resultados. La evidencia disponible se basa mayoritariamente en casos individuales y series de casos, existiendo una carencia de estudios comparativos o analíticos, por lo que no es posible establecer de forma definitiva las ventajas, desventajas, beneficios y riesgos de cada procedimiento. Debido a esto, la selección de la técnica dependerá de la experiencia del médico, la disponibilidad de recursos técnicos y las características del paciente.
El ICEP fue la primera técnica descrita, acumulando un mayor nivel de evidencia que otras técnicas. Sin embargo, los resultados estéticos no siempre son satisfactorios, la cicatrización de la zona donante e injertada puede ser deficiente, y el área posible de tratar es limitada11–18. El IEA puede considerarse como una técnica complementaria, permitiendo expandir ligeramente los injertos para cubrir una superficie receptora mayor, pero con desventajas similares al ICEP, mayor complejidad técnica, y necesidad de cirugía en dos etapas19–23.
Las técnicas de MIP e IPFE permiten restaurar la pigmentación utilizando un área donante pequeña en relación al área afectada23–29. El IPFE tiene la ventaja por sobre el MIP de ser más rápido y sencillo, logrando aparentemente mejores resultados estéticos en el sitio donante y receptor, aunque requiere de un mallador de injertos23,29.
Los injertos celulares como el TQMNC y AEC son técnicas recientes que permiten cubrir grandes extensiones de áreas a partir de sitios donantes de pequeño tamaño30–35,37. El TQMNC tiene menores requerimientos técnicos, menor costo, es más rápido y requiere un solo acto quirúrgico; a diferencia del AEC, que requiere un manejo avanzado del injerto para reproducir un epitelio cultivado33,34. Sin embargo, ambos son definitivamente complejos, y los resultados cosméticos son variables o contradictorios33,35,37,39,40.
El AUF constituye una reciente variación de la técnica usada comúnmente para trasplante capilar, que aprovecha el potencial proliferativo de las unidades foliculares con resultados promisorios, por lo que se podría considerar ante el fracaso a otras técnicas38.
Las técnicas quirúrgicas descritas han mostrado su aplicabilidad en pacientes de diferentes edades, incluyendo pacientes pediátricos; y en distintas razas y fototipos, incluyendo fototipos altos en quienes la HPQ es más notoria. En todos los casos mencionados se han obtenido resultados significativos3,11.
Sin embargo, todos los procedimientos son susceptibles de presentar efectos adversos en el sitio donante y receptor, lo cual hace necesario un adecuado manejo postoperatorio. La hiperpigmentación del sitio receptor, especialmente en razas con pigmentación más oscura, es generalmente secundaria a la exposición solar, fenómeno que se ve incrementado por el mayor contenido de melanina en las capas basales de estos pacientes11,14,17,19,26–28,32,35.
Dentro de las limitaciones de este trabajo, la mayoría de los estudios reportados son de más de 5 años de antigüedad, con bajo número de pacientes, y sin realizar una comparación de las distintas técnicas quirúrgicas.
5CONCLUSIONESSe han descrito siete técnicas quirúrgicas exclusivamente para el manejo de pacientes con HPQ, no obstante, se requieren futuras investigaciones comparativas para contrastar estos métodos, por lo que, actualmente, sus riesgos y beneficios deben ser evaluados caso a caso.
Conflicto de interesesLos autores declaran no haber recibido financiamiento para la realización del documento. Ninguno de los autores declara tener conflictos de interés.