Las zeolitas son aluminosilicatos ampliamente utilizados a nivel científico e industrial por la gran superficie específica que estos compuestos cerámicos presentan. Esta característica permite que puedan ser utilizadas como partículas alojadoras de otros compuestos y que, por lo tanto, podrían ser usadas como biomaterial con la posible propiedad de ser un liberador sostenido de medicamentos u otros compuestos que ayuden a la regeneración de tejidos, con su consecuente posible aplicación en el campo de la regeneración del tejido óseo. Sin embargo, como cualquier otro compuesto cerámico, las zeolitas necesitan ser sometidas a un proceso de sinterización que las conforme como un cuerpo sólido. Dicho proceso provoca cambios en su estructura interna y, en concreto, también varía su superficie específica. Para poder conformar este material como una pieza sólida y, al mismo tiempo, mantener su propiedad de alojador de otras moléculas en su interior, en este estudio se propone su mezcla con otros compuestos biocerámicos con propiedades de regeneración del tejido óseo como son el vidrio bioactivo 1393 (BG 1393) y el fosfato bicálcico, conformado por un 60% de hidroxiapatito y un 40% de beta fosfato tricálcico (60%/40% HA/β-TCP).
Zeolites are aluminosilicates widely known at a scientific and industrial level because of the great specific surface area they present. Thus, zeolites can be used to storage inside of them different compounds. In this way, zeolites could be a sustained deliver biomaterial of drugs or other molecules that could promote the tissue regeneration as, for example, bone tissue. Although, as any other ceramic compound, zeolites need to be sintered to be conformed as a solid material. This thermal process provokes changes in their inner structure and also modifies their specific surface area. In order to be able to conform this material as a solid sample and, at the same time, keep its high values of specific surface area, this study proposes to mix zeolites with other bioceramic compounds that also present bone tissue regeneration properties as bioactive glass 1393 (BG 1393) and biphasic calcium phosphates, formed by 60% of hydroxyapatite and 40% of beta tricalcium phosphate (60%/40% HA/β-TCP).
La regeneración de tejidos óseos es uno de los campos más prometedores de las ciencias médicas en las últimas décadas. La posibilidad de regenerar tejidos humanos permitiría la posibilidad de mejorar la calidad de vida de un gran número de personas de una población mundial que cada vez tiene una esperanza de vida mayor, con el consecuente envejecimiento de la población. Dentro de la multitud de tejidos humanos que pueden ser regenerados, el tejido óseo es uno de los más complejos de regenerar ya que, además de la consecuente dificultad biológica de fomentar la propia regeneración ósea, también debe de cumplir con los requerimientos mecánicos que el hueso humano natural presenta [1].
Diversos autores coinciden en señalar que las piezas tridimensionales destinadas a ser el soporte y la base para la colonización de dichas piezas deben de poseer ciertas características que faciliten la señalada regeneración del propio tejido óseo. Dichas propiedades son tales como bioactividad del propio material [2–4], de manera que se potencie la interacción entre el material y las células; una gran porosidad interconectada [2–5] que permita a las células entrar dentro de la pieza y propagarse a lo largo de ella para establecerse y comenzar la regeneración del propio tejido óseo; y una superficie física y químicamente apropiada [6–8], haciendo alusión a importantes parámetros para la proliferación celular como la rugosidad, topografía y microporosidad de la pieza.
Debido a que el tejido óseo humano está compuesto en, aproximadamente, un 65% de peso por fosfatos cálcicos es muy común el uso de dichos compuestos para piezas destinadas a la regeneración del tejido óseo. Dentro de los diferentes fosfatos cálcicos, dos de ellos son los mayoritariamente utilizados, el hidroxiapatito (HA) y el beta fosfato tricálcico (β-TCP). Ambos materiales presentan unas buenas propiedades osteoinductivas con muy bajos niveles de reabsorción en el cuerpo humano [9,10]. También es muy común la utilización de ambos compuestos conjuntamente, conocido entonces como una mezcla bifásica de fosfatos cálcicos, en donde se mejoran las propiedades biocompatibles y mecánicas que ambos compuestos presentarían por separado [10,11].
Otros compuestos cerámicos ampliamente utilizados para la regeneración de tejidos óseos son los vidrios bioactivos (BG). Estos son compuestos con estructura vítrea y con altos niveles de degradación en el cuerpo humano, con una posterior precipitación como capas de hidroxiapatito carbonatado [12,13].
Las zeolitas son aluminosilicatos que poseen una estructura microporosa cristalina y que son muy conocidos por su capacidad para hidratarse y deshidratarse fácilmente ya desde la antigüedad [14,15]. Aunque la mayor parte de la producción mundial de zeolitas se dedica a la venta como absorbente comercial [14,16], recientes estudios están demostrando que pueden ser utilizadas para otros usos, como catalizador (en el refinado de petróleo o la producción de naftas) o como detergente sin productos fosfatados [17,18]. Además, también se ha demostrado la biocompatibilidad de alguna especie de zeolitas, como ocurre con las ZSM-5 [19,20].
El hecho de que presenten una estructura microporosa provoca que las zeolitas ZSM-5 posean una superficie específica muy grande en comparación con otros compuestos cerámicos. Este hecho ha permitido que se investiguen los usos de este aluminosilicato como portador de medicamentos [19] y como material apto para la regeneración de tejidos óseos [20].
Este último aspecto se ve reforzado por su buena estabilidad térmica, química y mecánica [21]. Diversas publicaciones hablan de su buen comportamiento como recubrimiento de prótesis para actuar como fase intermedia entre el metal y el tejido humano [15] afirmándose incluso que se trata de un material osteoconductivo y osteoinductivo [21].
Para poder conformar piezas con estos materiales y que dichas piezas fomenten la proliferación y colonización celular destaca una técnica relativamente nueva denominada freeze casting. Esta técnica se basa en el congelamiento controlado y direccional de una suspensión acuosa de compuestos cerámicos. A medida que dicha suspensión se va solidificando, el hielo se congela en la misma dirección que el gradiente térmico creado. Al solidificarse el hielo, las partículas cerámicas son expelidas conformándose también en paredes en el espacio que no ocupa el hielo recién creado. La pieza conformada es sometida a un proceso de sublimación para evaporar el hielo, quedando solamente las partículas cerámicas. Dichas piezas, suelen ser sometidas a un proceso de sinterización para mejorar las propiedades mecánicas [5,22].
Este proceso de conformación ha sido aplicado a multitud de compuestos cerámicos con éxito previamente, tales como alúmina [22], hidroxiapatito [5,23], vidrios bioactivos [24], zeolitas [16], o grafeno [25].
El objetivo del presente estudio es demostrar la viabilidad de conformar este material por medio del novedoso método del freeze casting para que pueda llegar a ser utilizado como un compuesto capaz de realizar una liberación sostenida de otras moléculas que se puedan alojar en su interior. Uno de los factores que más se tendrán en cuenta es la presencia o no de la característica estructura lamelar que confiere dicho método de conformación y la presencia de poros en dicha estructura.
Parte experimentalMaterias primasPara la realización de este estudio se adquirieron zeolitas tipo ZSM-5 a la compañía Zeolyst International (Valley Forge, PA, Estados Unidos). El tipo concreto que se adquirió es el que la compañía denomina CBV 5524G, con un ratio SiO2/Al2O3 de 50 y un contenido en peso de 0,05% de Na2O.
El vidrio bioactivo 1393 (SiO2 [53%], Na2O [6%], CaO [20%], P2O5 [4%], K2O [12%] y MgO [5%] en peso) utilizado fue suministrado por la compañía SEM-COM Inc. (Toledo, Ohio, Estados Unidos). Para realizar este estudio se utilizó la mezcla de HA y β-TCP (60%/40%) ya preparada en esta proporción y suministrada por la compañía Trans-Tech (Adamstown, Maryland, Estados Unidos).
CaracterizaciónEstudio de dilatometríaEl estudio de dilatometría aporta datos estimativos sobre la temperatura óptima de sinterización de un compuesto. Para ello se prepararon piezas cilíndricas de 12mm de diámetro y 25mm de alto por medio de compresión a 125kg/cm2 a partir del material inicial de zeolitas en polvo. Las piezas obtenidas se procesaron hasta un máximo de 1.250°C a una razón de 5°C/min. El dilatómetro utilizado es un L75 Platinum Series (Linseis, Robinsville, New Jersey, Estados Unidos) y como medida patrón se utilizó un prisma de base cuadrada de alúmina.
Medición de la superficie específicaEn este estudio se utilizó el equipo Gemini 2360 (Micromeritics, Atlanta, Georgia, Estados Unidos). Este aparato calcula la superficie específica de la muestra basándose en la isoterma BET (Brunauer-Emmett-Teller) que relaciona área superficial del sólido en cuestión con la cantidad de volumen de N2 que es adsorbido como monocapa en la superficie de este.
Medición de la densidad realPara la medición de la densidad real de todas las materias primas cerámicas en polvo se utilizó un picnómetro AccuPyc 1330 (Micromeritics, Atlanta, Georgia, EE. UU.) con helio. Se mide la masa de la muestra inicial y con ese valor conocido el aparato mide el volumen de helio que se inserta en el interior del picnómetro. Con ello, se puede obtener el volumen que ocupa el polvo y con el valor de la masa y el volumen que ocupa la muestra, se calcula la densidad real del compuesto.
Microscopía electrónica de barridoLas piezas una vez conformadas que tenían una mínima consistencia mecánica fueron cortadas en discos, pulidas y analizadas a través de microscopía electrónica de barrido. Previamente, las muestras fueron recubiertas por una capa de oro por medio de un Sputter Coater 108 Auto (Cressington Scientific Instruments Inc., Watford, Reino Unido) durante 60 segundos.
El microscopio electrónico de barrido utilizado para la realización de estos experimentos fue un Field Emission Scanning Electron Microscope Jeol JSM-7500 (Jeol Ltd., Tokio, Japón).
Método de conformaciónFreeze castingEl proceso de conformación de freeze casting se ha llevado a cabo siguiendo dos protocolos diferentes. Por un lado, Ojuva et al. [16] ya han aplicado esta técnica a otro tipo de zeolitas, las 13X, con buenos resultados estructurales para las piezas finales. Este protocolo utiliza un aglutinante de tipo muy concreto, la bentonita, un compuesto no orgánico del tipo arcilla montmorillonita [14].
Por otro lado, de manera alternativa, también se ha seguido el protocolo establecido en las primeras publicaciones al respecto de la técnica de freeze casting, en las que únicamente se utilizan fosfatos cálcicos y diferentes aditivos poliméricos para dotar a la suspensión inicial de las propiedades reológicas adecuadas para llevar a cabo dicho procesamiento.
Todas las suspensiones iniciales de este estudio tienen un 20% de contenido cerámico para que las piezas finales puedan tener unos elevados valores de porosidad. Además de las correspondientes cantidades de compuestos cerámicos se añade lubricante PEG-300 (1% en peso del total de la suspensión), dispersante Darvan CN (1% peso) y aglutinante Aquazol 50 40% de pureza (5% peso) [5,24]. Las suspensiones finales son mezcladas durante 48 h en un molino de bolas para conseguir una buena homogeneización.
Una vez que el proceso de freeze casting está terminado y toda la pieza se encuentra solidificada, esta es introducida en un liofilizador para evaporar el hielo producido. Entonces, la pieza es sometida al tratamiento térmico de sinterización a la temperatura correspondiente. Este proceso térmico, a pesar de tener diferentes temperaturas finales siempre se lleva a cabo de la misma forma. Partiendo de la temperatura ambiente, las piezas son llevadas hasta 400°C con un incremento de 5°C/min. Una vez alcanzada la temperatura de 400°C esta se mantiene durante 4 h, para que se lleve a cabo la combustión de todos los aditivos poliméricos utilizados durante el proceso del freeze casting. Seguidamente, la temperatura es llevada hasta la temperatura de sinterización de nuevo a una razón de 5°C/min. La temperatura final de sinterización es mantenida por otras 4 h y después se va enfriando a 5°C/min hasta la temperatura ambiente.
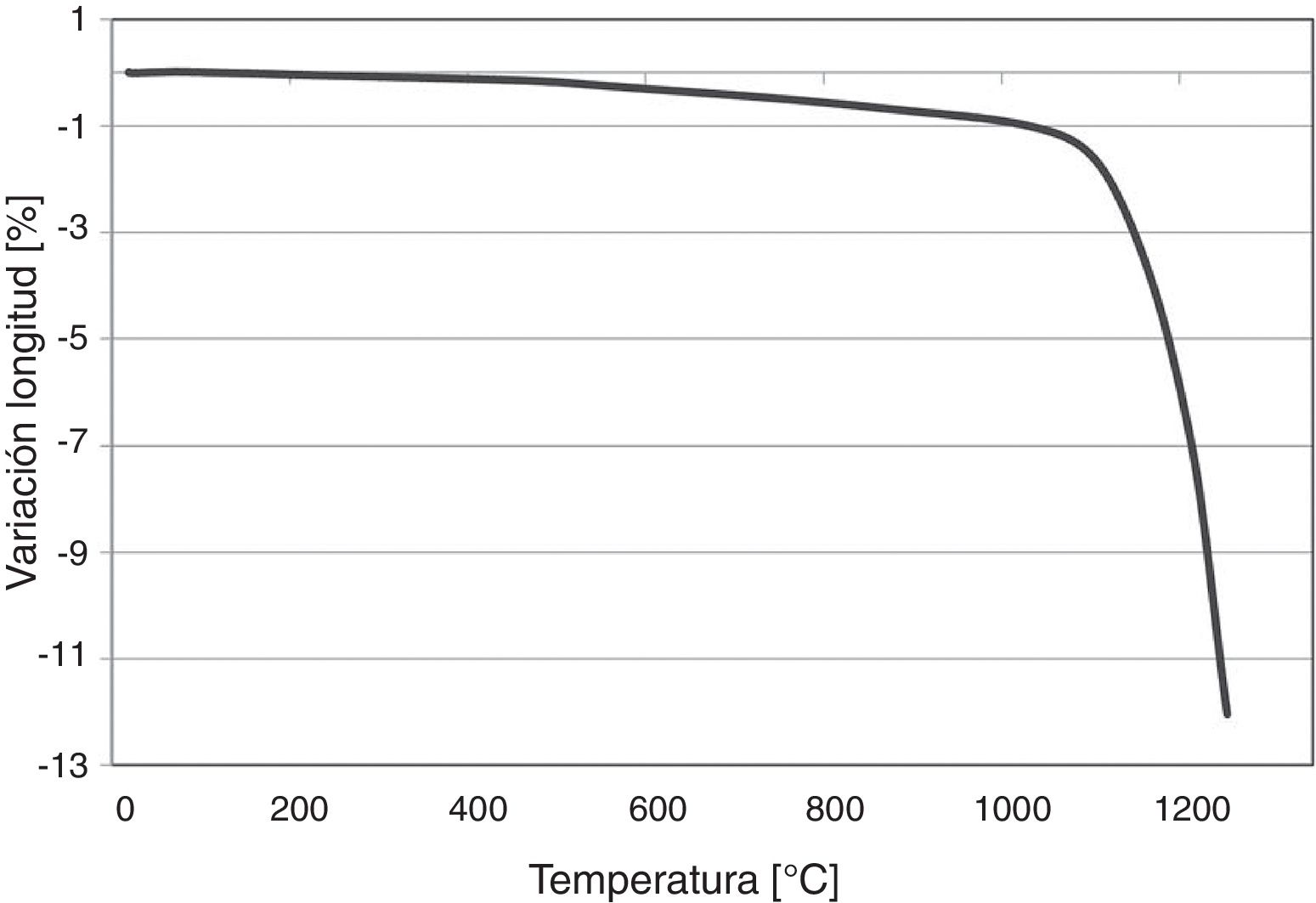
Resultados y discusiónEl estudio de las zeolitas tipo ZSM-5 se inicia con la dilatometría de este compuesto. Este análisis indica las dilataciones y contracciones que este material experimenta con el tratamiento térmico.
La figura 1 muestra la contracción que sufren las zeolitas al ser sometidas a un tratamiento térmico. Dichas piezas se contraen ligeramente, alrededor de un 1%, hasta alcanzar una temperatura ligeramente superior a 1.000°C, a partir de la cual la contracción se hace mucho mayor, alcanzando alrededor del 12% en torno a los 1.250°C. Esta gran contracción del material puede indicar una pérdida completa de la superficie específica del material, parámetro que se encuentra íntimamente ligado a la posibilidad de que sean utilizadas como transportadores moleculares.
Las zeolitas ZSM-5 poseen una superficie específica muy grande antes de ser tratadas térmicamente y se analiza cómo evoluciona la superficie específica de las zeolitas al ser sometidas a diferentes temperaturas.
Como se puede observar en la figura 2 la superficie específica de las zeolitas se mantiene en unos valores muy altos (> 300 m2/g) hasta los 1.000°C, en donde empieza a decrecer drásticamente.
Los resultados obtenidos del estudio de dilatometría y del de superficie específica concuerdan e indican que, para poder conservar la gran superficie específica de las zeolitas ZSM-5 durante el proceso de sinterización, es necesario no superar los 1.000°C de temperatura durante el tratamiento térmico.
Para realizar mezclas en volumen de los diferentes compuestos cerámicos se lleva a cabo una medición de la densidad real de estos a través de picnometría: fosfatos bicálcicos (conformados en un 60% de hidroxiapatita y un 40% de fosfato tricálcico; HA/β-TCP [60%/40%]), el vidrio bioactivo 1393 (BG 1393) y las zeolitas ZSM-5 (tabla 1).
Una vez obtenidos todos estos datos, se lleva a cabo el propio proceso de conformación del freeze casting. Primero se lleva a cabo utilizando zeolitas ZSM-5 y bentonita. En la bibliografía consultada se utiliza entre el 9 y el 16% del peso total de zeolitas como cantidad de bentonita. En el presente estudio se utiliza un 15%. De esta forma, para preparar 10ml de disolución se utilizan 4,69g de ZSM-5, 0,70g de bentonita y 8g de agua.
Las suspensiones son creadas y se procesan a través del freeze casting. Las piezas obtenidas son sinterizadas a temperaturas de 900, 950 y 1000°C.
La figura 3 muestra que el resultado del proceso térmico no es el deseado y que las piezas no han sido sinterizadas correctamente. Esto provoca que la más mínima manipulación de estas conlleve el colapso de las piezas. Por la manera en que las piezas han colapsado, se puede afirmar que sí tienen una configuración interna lamelar, obtenida gracias al proceso de freeze casting.
Por otro lado, se lleva a cabo el proceso de conformación por freeze casting con la inclusión del vidrio bioactivo 1393 y del fosfato bicálcico. El vidrio se empieza a reblandecer a temperaturas en torno los 675-700°C, con lo que el resultado que se espera obtener es que, cuando el vidrio se reblandezca, actúe como una especie de cemento entre todas las partículas, tanto las zeolitas como el HA/β-TCP.
Se formulan seis diferentes suspensiones iniciales en las que habrá distintas concentraciones de cada uno de los tres compuestos cerámicos, como se recoge en la tabla 2. Todas estas suspensiones tienen un 20% de contenido sólido inicial y las masas que se presentan en la tabla 2 están referidas para la preparación de 10ml de suspensión.
Porcentajes en peso y cantidad de cada compuesto utilizada para las suspensiones de ZSM-5, BG 1393 y HA/β-TCP
| ZSM-5 | BG 1393 | HA/β-TCP | ||||
|---|---|---|---|---|---|---|
| % | Masa (g) | % | Masa (g) | % | Masa (g) | |
| N.° 1 | 20 | 1,256 | 20 | 1,256 | 60 | 3,768 |
| N.° 2 | 15 | 0,942 | 25 | 1,570 | 60 | 3,768 |
| N.° 3 | 25 | 1,570 | 25 | 1,570 | 50 | 3,140 |
| N.° 4 | 20 | 1,256 | 30 | 1,884 | 50 | 3,140 |
| N.° 5 | 30 | 1,884 | 30 | 1,884 | 40 | 2,512 |
| N.° 6 | 15 | 0,942 | 15 | 0,942 | 70 | 4,396 |
Además de estos compuestos cerámicos, también se añaden 8g de agua, 0,06g de PEG-300, 0,31g de Aquazol y 0,06g de Darvan CN. El orden de adición al agua es lubricante, dispersante y aglutinante. Finalmente se añaden las cantidades correspondientes de zeolitas ZSM-5, vidrio bioactivo 1393 y HA/β-TCP, en este orden.
Una vez llevado a cabo todo el proceso de conformación del freeze casting y el correspondiente posterior sublimado del hielo de las muestras, estas fueron sometidas al proceso térmico de sinterización. Para este proceso se han elegido temperaturas de 825, 875 y 925°C.
Después de llevar a cabo el proceso de sinterización de las diferentes piezas obtenidas y una vez que han sido retiradas del horno, las piezas tienen consistencia para ser manejadas, a diferencia de las conformadas con bentonita.
Es importante que las piezas obtenidas mantengan la estructura lamelar y la gran porosidad interconectada obtenidas a través del proceso de freeze casting. Ambos parámetros son fundamentales para poder conseguir una buena colonización celular de las piezas para el cometido de regeneración del tejido óseo. Las piezas cilíndricas originales obtenidas del proceso del freeze casting son cortadas en discos y dichos discos son analizados por medio del SEM.
La figura 4 muestra las estructuras de la primera de las mezclas de zeolitas. A pesar de que a las temperaturas de 825 y 875°C aún sigue siendo distinguible la estructura lamelar, esta ha sido parcialmente obstruida. A la temperatura de 925°C la estructura está completamente bloqueada.
La figura 5 se corresponde con la mezcla número 2, en la que se ha aumentado la concentración del BG 1393 un 5% en detrimento de la concentración de zeolitas. En dicha figura se puede apreciar que se ha mejorado la conservación de la estructura lamelar, que aparece mucho más marcada.
La mezcla de zeolitas número 3ha sido analizada en la figura 6, en la que se reduce el contenido de HA/β-TCP en comparación con las dos primeras mezclas. En las imágenes de la microestructura de esta mezcla sigue estando presente la microestructura lamelar, aunque tampoco se aprecian poros abiertos, lo que podría comprometer la futura proliferación celular en su interior. Se aprecia poca diferencia en la microestructura para las tres diferentes temperaturas de sinterización.
En la figura 7 se recogen las imágenes de la mezcla número 4, en la que sí que se aprecia una buena constitución de canales y estructura lamelar a lo largo de toda la pieza para las tres temperaturas de sinterización que se han estudiado.
La mezcla número 5, también con un 30% de contenido de BG 1393, aunque con mayor presencia de zeolitas que la mezcla número 4 y con una reducción de la cantidad de HA/β-TCP muestra poros que, a priori, tienen un mayor tamaño que las anteriores mezclas, si bien es difícil de cuantificar solamente por medio de las imágenes SEM, tal y como se observa en la figura 8.
Por último, en la figura 9 se muestra la mezcla de zeolitas número 6, que tiene un alto contenido de HA/β-TCP y bajos contenidos de ZSM-5 y BG 1393 y tampoco muestra una buena conformación de la estructura interna a través de las imágenes que se han obtenido por SEM. Los poros aparecen bastante bloqueados.
De las 6 mezclas de compuestos cerámicos realizadas y, posteriormente, procesadas y sinterizadas, en dos de ellas se puede observar claramente que la estructura lamelar obtenida a través del proceso de freeze casting se mantiene sin llegar a ser bloqueada, las mezclas 4 y 5. Los espacios entre las paredes lamelares son de, aproximadamente, 20μm de ancho y de varios centenares de micras de largo. Ambas mezclas óptimas constaban de un 30% en volumen de BG 1393 y un 50 y 40% de fosfato bicálcico (en las mezclas 4 y 5, respectivamente) y el resto de zeolitas ZSM-5.
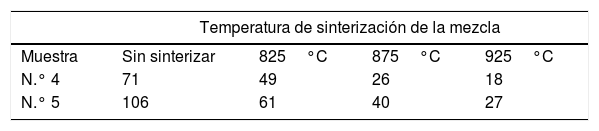
Para poder cuantificar la capacidad de las zeolitas para ser utilizadas como transportadores moleculares se lleva a cabo una medición específica de las mismas composiciones de compuestos que las mezclas 4 y 5 sin sinterizar y después de ser tratadas térmicamente.
En la tabla 3 se observa cómo los valores de superficie específica descienden a medida que se aumenta la temperatura de sinterización de ambas mezclas. Estos valores son bastantes más bajos que los de las zeolitas sin otros compuestos hasta su temperatura de sinterización a 1.200°C, en donde se producía una caída drástica de la superficie específica, con valores más bajos que los que presentan las diferentes mezclas llevadas a cabo. Es importante tener en cuenta que estas mezclas tienen entre un 20% y un 30% de zeolitas y que no se producen unas caídas de superficie tan drásticas como ocurre cuando se sinterizan las zeolitas puras.
ConclusionesLas zeolitas tipo ZSM-5 experimentan cambios drásticos en sus valores de superficie específica cuando son tratadas por encima de 1.000°C. Aplicar a estas zeolitas tratamientos térmicos por encima de este valor provoca que dejen de ser aptas para ser utilizadas como portadoras moleculares en procesos de regeneración ósea. Esta temperatura se encuentra por debajo de la temperatura de sinterización de este compuesto.
Como solución a este problema, en el presente estudio se propone la mezcla de las zeolitas ZSM-5 con otros compuestos biocerámicos, como son el fosfato bicálcico (60% HA, 40% β-TCP) y el vidrio bioactivo 1393. Se han realizado diferentes mezclas de los tres compuestos y las correspondientes suspensiones han sido procesadas a través de freeze casting.
El hecho de que los valores de la superficie específica de estas mezclas no caigan tan drásticamente como en el caso de la sinterización de las zeolitas puras indica que pueden seguir siendo usadas como alojadores moleculares una vez transformadas en piezas sólidas después del tratamiento térmico.
El presente trabajo se ha llevado a cabo con la financiación de la Fundación Pedro Barrié de la Maza.