La candidemia es una de las micosis oportunistas más frecuentes en todo el mundo. El escaso número de estudios epidemiológicos llevados a cabo en América Latina indica que las tasas de incidencia en esta región son mayores que las descritas en el hemisferio norte. A menudo el diagnóstico de la infección se establece tardíamente, lo que afecta al inicio del tratamiento antimicótico. Por esta razón, para el diagnóstico y el manejo de la candidemia está justificada una estrategia más científica, basada en parámetros específicos.
Recomendaciones para el diagnóstico y manejo de la candidemia constituye una serie de artículos preparados por miembros del grupo Latin America Invasive Mycosis Network. Su objetivo es proporcionar las mejores evidencias disponibles para el diagnóstico y el manejo de la candidemia.
El presente artículo, Recomendaciones para el diagnóstico de la candidemia en América Latina, ha sido redactado con el objetivo de brindar asesoramiento a los profesionales de la salud en lo referente al diagnóstico de la candidemia en pacientes que la padecen o están en riesgo de padecerla.
Mediante la base de datos PubMed se emprendió una búsqueda informatizada de los estudios publicados. Los miembros del grupo revisaron y analizaron exhaustivamente los datos. El grupo también se reunió en 2 ocasiones para proponer preguntas, abordar los puntos de vista conflictivos y deliberar sobre las recomendaciones terapéuticas.
Recomendaciones para el diagnóstico de la candidemia en América Latina incluye diversas recomendaciones sobre aspectos relacionados con los métodos diagnósticos para la detección de la candidemia, la identificación de las especies de Candida y las pruebas de sensibilidad antifúngica. Se expone también la disponibilidad de los métodos, sus costes y el marco en el que se aplican los tratamientos.
Este manuscrito es el primero de los artículos de esta serie dedicada al diagnóstico y tratamiento de las candidiasis invasoras. Otras publicaciones de esta serie son Recomendaciones para el diagnóstico de la candidemia en adultos en América Latina, Recomendaciones para el manejo de la candidemia en niños en América Latina, y Recomendaciones para el manejo de la candidemia en neonatos en América Latina.
Este artículo está publicado en inglés en este mismo número. Puede encontrarlo enhttp://dx.doi.org/10.1016/j.riam.2013.05.008
Candidemia is one of the most frequent opportunistic mycoses worldwide. Limited epidemiological studies in Latin America indicate that incidence rates are higher in this region than in the Northern Hemisphere. Diagnosis is often made late in the infection, affecting the initiation of antifungal therapy. A more scientific approach, based on specific parameters, for diagnosis and management of candidemia in Latin America is warranted.
‘Recommendations for the diagnosis and management of candidemia’ are a series of manuscripts that have been developed by members of the Latin America Invasive Mycosis Network. They aim to provide a set of best-evidence recommendations for the diagnosis and management of candidemia.
This publication, ‘Recommendations for the diagnosis of candidemia in Latin America’, was written to provide guidance to healthcare professionals on the diagnosis of candidemia, as well as on the usefulness and application of susceptibility testing in patients who have a confirmed diagnosis of candidemia.
Computerized searches of existing literature were performed by PubMed. The data were extensively reviewed and analyzed by members of the group. The group also met on two occasions to pose questions, discuss conflicting views, and deliberate on a series of management recommendations.
‘Recommendations for the diagnosis of candidemia in Latin America’ includes diagnostic methods used to detect candidemia, Candida species identification, and susceptibility testing. The availability of methods, their costs and treatment settings are considered.
This manuscript is the first of this series that deals with diagnosis and treatment of invasive candidiasis. Other publications in this series include: ‘Recommendations for the management of candidemia in adults in Latin America’, ‘Recommendations for the management of candidemia in children in Latin America’, and ‘Recommendations for the management of candidemia in neonates in Latin America’.
This article is also published in English in this issue. It can be found inhttp://dx.doi.org/10.1016/j.riam.2013.05.008
El diagnóstico de la candidiasis invasiva a menudo se efectúa tardíamente, lo que causa una demora en el inicio de la terapia antimicótica. El diagnóstico tardío puede ser el resultado de signos y síntomas clínicos inespecíficos18, como la precisión variable de las pruebas diagnósticas disponibles27, la demora en el crecimiento de los cultivos de Candida19, de que los hemocultivos no sean positivos hasta las etapas avanzadas de la infección18,25, del inadecuado volumen de la muestra para los hemocultivos25, o de los resultados negativos falsos debido al uso de agentes antimicóticos en la profilaxis25.
La superación de estas dificultades para el diagnóstico puede mejorar el tiempo requerido hasta instituir el tratamiento de la infección por Candida. Aquí se brindan recomendaciones para el diagnóstico de la candidiasis invasiva, incluyendo métodos para detectar la infección, identificación de las especies de Candida y pruebas de sensibilidad in vitro a los antifúngicos.
Métodos para detectar la infección hematógena por CandidaSe puede alcanzar el diagnóstico a través de métodos convencionales como el hemocultivo y la detección de marcadores serológicos como el 1-3-β-D-glucano (BDG), el manano o anticuerpos antimanano. Los métodos diagnósticos más nuevos incluyen la reacción en cadena de la polimerasa (PCR, Polymerase Chain Reaction) en muestras de sangre o biopsia de tejido, y el enzimoinmunoensayo (ELISA, Enzyme-Linked Inmunoabsorbent Assay) para detectar Candida.
HemocultivoEl hemocultivo es el mejor método disponible para el diagnóstico de la candidemia; sin embargo, es un procedimiento que requiere mucho tiempo. Esto puede afectar el momento de inicio de la terapia antimicótica y contribuir a un incremento de la morbimortalidad49. El tiempo hasta la detección puede estar influido por la especie de Candida. En un estudio retrospectivo, el tiempo promedio hasta tener cultivos positivos de Candida albicans y Candida glabrata fue de 35,3±18,1 y 80,0±22,4h, respectivamente19. El tipo de medio utilizado para el cultivo también puede influir sobre el tiempo hasta la detección. Una comparación de un medio selectivo para hongos y un medio aerobio estándar para el diagnóstico de candidemia mostró un ahorro significativo de tiempo cuando se utilizó el medio específico para hongos, con un ahorro promedio de tiempo de 8,8h para C. albicans y 43,7h para C. glabrata46.
Como se mencionó previamente, el hemocultivo es el gold standard para el diagnóstico de la candidemia. Sin embargo, su sensibilidad es variable51. A fin de optimizar este método se deben considerar cuidadosamente factores que pueden influir sobre la sensibilidad (por ejemplo, el volumen de sangre, el número de cultivos y el tiempo hasta la detección), así como el tamaño del inóculo y el tipo de frascos y medios de cultivo utilizados. En un estudio con 15 especies de Candida, los inóculos de mayor tamaño (10, 100, 1.000 células por frasco) brindaron una tasa de detección de crecimiento del 70, 73 y 79%, respectivamente27. Se ha observado una tasa similar de detección de Candida en frascos aerobios y micológicos8,27,45, que es mayor que la observada en frascos anaerobios8,27. El Grupo de Trabajo recomienda el uso de frascos aerobios para el diagnóstico de la candidemia mediante hemocultivo dado que este es el procedimiento estándar en todos los hospitales.
Sistemas de hemocultivoActualmente se dispone de varios sistemas de hemocultivo con diferente sensibilidad. Hay métodos convencionales (manuales), automatizados, y de lisis-centrifugación. El uso de medios bifásicos parece ser ligeramente mejor o equivalente al caldo de cultivo convencional para la recuperación de levaduras33. La sensibilidad de los sistemas automatizados de hemocultivo, como BacT/ALERT, BACTEC e Isolator está influida por el tipo de medios y frascos de cultivo utilizados28,46. La técnica de hemocultivo con lisis y centrifugación es el método disponible más sensible. Tiene un mejor rendimiento diagnóstico comparado con los sistemas de hemocultivo convencionales y reduce el tiempo de obtención del resultado38. Sin embargo, la lisis-centrifugación implica una alta carga de trabajo, es de alto coste y tiene una alta tasa de contaminación18. Por este motivo el Grupo de Trabajo considera que los sistemas de hemocultivo automatizados constituyen la mejor opción para el diagnóstico de la candidemia.
SerologíaActualmente se encuentran en desarrollo varias pruebas serológicas para la detección de candidemia. Debido a la limitada información sobre su valor diagnóstico, el Grupo de Trabajo no puede efectuar recomendaciones sobre su uso. Estos métodos incluyen el ensayo BDG65 y los ensayos de detección de manano y de anticuerpos antimanano1,47. Una reciente revisión de métodos serológicos para el diagnóstico de candidemia en pacientes críticos mostró una mayor sensibilidad diagnóstica con el uso combinado de antígenos y anticuerpos11.
BDG es un componente estructural de la pared celular de Candida que podría ser de utilidad como biomarcador de candidemia. Estudios que utilizaron el ensayo sérico de BDG para el diagnóstico de candidemia informaron de tasas del 57 al 100% de sensibilidad y del 44 al 92% de especificidad, superiores a las de los hemocultivos65. Sin embargo, el test de BDG es proclive a brindar resultados falsos positivos por la contaminación de β-glucanos con algunos antibióticos y materiales25. Las fuentes de β-glucanos incluyen membranas de diálisis y filtros hechos de celulosa, productos específicos de inmunoglobulinas, restos de algodón y esponjas utilizadas en cirugías, así como algunos fármacos (por ejemplo, lentinan, crestina, escleroglucano y esquizofilano)35,37,50,63. La detección de BDG ha sido ampliamente utilizada en investigación y aprobada por las agencias regulatorias de EE.UU. y Europa para el diagnóstico de la infección por Candida. Sin embargo, debido a la falta de disponibilidad y a los elevados costes es probable que muy pocos centros de América Latina utilicen este ensayo. Teniendo en cuenta su elevado valor predictivo negativo, la repetición de las pruebas con resultados negativos puede ayudar a descartar la candidemia. De todas maneras, por el momento no está demasiado claro de qué manera este test puede ser utilizado en la práctica diaria con el fin de ayudar al médico a decidir si se debe o no prescribir un antimicótico a un paciente con riesgo de desarrollar candidemia.
Detección de infecciones profundas por CandidaEstudios de imagenLa ecocardiografía ha demostrado ser una herramienta efectiva para el diagnóstico de la endocarditis inducida por especies de Candida15, y las imágenes de resonancia magnética (RM) y de tomografía computarizada (TC) han mostrado ser efectivas como herramientas no invasivas para la identificación de infección hepatoesplénica26,43. Aunque la RM y la TC son sensibles para detectar microabscesos micóticos asociados a la candidiasis diseminada crónica (CDC), el requerimiento de imágenes repetidas durante el curso de una infección limita su empleo. La ecografía asistida por ordenador ha mostrado ser exitosa para detectar microabscesos en el hígado o en el bazo, y puede ser repetida tantas veces como sea necesario, lo que la convierte en un método útil para la detección de CDC y el seguimiento de pacientes con la mencionada candidiasis36.
BiopsiaEl diagnóstico de infecciones por Candida a partir de muestras de tejidos puede ser difícil. Estos microorganismos colonizan comúnmente la piel y las membranas mucosas de los seres humanos y, por lo tanto, el aislamiento de muestras superficiales (esputo, secreciones traqueales y orina) no es necesariamente una demostración de invasión33. La infección orgánica profunda por Candida puede requerir la biopsia de tejidos para establecer el diagnóstico, tal como sucede en la neumonía producida por Candida; sin embargo, las muestras de tejido pueden contener pocos microorganismos y brindar un cultivo negativo64. La CDC se diagnostica a través de la identificación de estructuras micóticas en el microscopio o el crecimiento de hongos en materiales de biopsia, dado que los cultivos de sangre son positivos en menos de 20% de los pacientes con CDC43. Sin embargo, no siempre se puede detectar la presencia de Candida en la biopsia, y en algunos pacientes no sería factible efectuar una biopsia debido al riesgo de complicaciones43. En pacientes en riesgo que desarrollan lesiones cutáneas se utiliza la biopsia para confirmar el diagnóstico de infección diseminada; al igual que una biopsia pulmonar confirmará el diagnóstico de neumonía mediante la identificación de elementos micóticos invadiendo el tejido pulmonar.
Nuevas perspectivasRecientemente se desarrolló un ELISA para la detección de un antígeno de 65kDa producido por C. albicans, Candida tropicalis y Candida parapsilosis. En este estudio, esta nueva prueba diagnóstica detectó el antígeno de 65kDa en el 80% de los pacientes con candidemia4. La aparición de la PCR para la detección de ácidos nucleicos ha brindado un método alternativo más rápido y más preciso que el hemocultivo para la detección de especies de Candida en las muestras de sangre41. Además, se ha utilizado la PCR para la detección de Candida en muestras de biopsia en pacientes con CDC22,39.
Un reciente metaanálisis que incluyó 54 estudios encontró resultados positivos por PCR en el 85% (78-91%) de los pacientes con candidemia confirmada o posible, en comparación con apenas un 38% (29-46%) de aquellos con hemocultivos positivos3. Se ha mejorado la sensibilidad de la PCR para detectar la candidemia con el uso de muestras de suero y plasma en comparación con sangre entera. En un estudio se detectó ADN de Candida en el 71% de las muestras de suero y en el 75% de las muestras de plasma, en comparación con el 54% de las muestras de sangre entera41. Una limitación de este ensayo es la incapacidad para detectar ADN fúngico en el 25% de las muestras de sangre entera obtenidas al mismo tiempo que las muestras positivas de hemocultivo41.
Se han informado resultados que eran falsamente positivos o negativos cuando se utilizó la PCR para la detección de Candida en muestras clínicas de sangre, orina y líquido peritoneal7. Otro estudio describió resultados positivos falsos en 2 pacientes que habían sido tratados con antimicóticos azólicos, lo que puede indicar que la PCR tenía capacidad de detectar microorganismos no viables que no son recuperados por cultivo21. Comparada con los métodos de antígenos y anticuerpos, la PCR tiene mejor sensibilidad y especificidad diagnósticas11. A pesar de esto, no existe una estandarización internacional para este método y no hay pruebas de PCR comercialmente disponibles para el diagnóstico de las candidiasis. En consecuencia, los ensayos de PCR no son una herramienta fiable para ser usados en los laboratorios clínicos con el fin de identificar de manera temprana a los pacientes con candidemia.
Sumario de recomendaciones para métodos de diagnóstico en la candidiasis invasiva
- 1.
El hemocultivo es el gold standard como método para el diagnóstico de candidiasis invasiva.
- 2.
Se recomiendan los frascos aerobios y los sistemas de hemocultivo automatizados para una óptima sensibilidad.
- 3.
Debe identificarse la especie a la que pertenecen los aislamientos clínicos de Candida.
Otras recomendaciones sobre métodos diagnósticos
- 1.
Los estudios de imágenes (por ejemplo, ecocardiografía, RM y TC) pueden desempeñar un papel en el diagnóstico de la endocarditis y la CDC.
- 2.
Se puede considerar la histopatología y/o la microscopia directa para el diagnóstico de infecciones profundas por Candida, tanto para CDC o neumonía. En caso de CDC un examen microscópico negativo no indica la ausencia de enfermedad.
Es importante la identificación precoz de la especie para iniciar la terapia antimicótica apropiada o para modificar la terapia antifúngica en curso. Se puede identificar la especie mediante uno o más de los siguientes métodos: tinción y examen directo convencional, identificación mediante la prueba del tubo germinativo o colonias crecidas en medios cromogénos, panel de identificación de MicroScan Yeast, sistemas comerciales manuales (por ejemplo, API 20C y API 32C), sistemas comerciales automatizados (por ejemplo, VITEK 2), identificación molecular con PCR, Matrix-Assisted Laser Desorption Ionization Time-Of-Flight (MALDI-TOF) o hibridización fluorescente in situ de ácidos nucleicos peptídicos (Peptide Nucleic Acid-Fluorescent In Situ Hybridization [PNA-FISH]).
Tinción y examen directo convencionalEn general, la microscopia directa, utilizando diferentes tinciones, es un método relativamente rápido y barato para identificar inicialmente un patógeno como una levadura o una bacteria17. En pacientes con infecciones profundas por Candida la identificación microscópica de elementos micóticos en el material de biopsia o el crecimiento de hongos a partir de dichas biopsias se considera el gold standard para el diagnóstico de CDC32 o de la neumonía por Candida. También puede ser útil para el diagnóstico de candidiasis hematógena en pacientes que desarrollan lesiones cutáneas secundarias a la diseminación de Candida.
El diagnóstico microbiológico de infecciones fúngicas por microscopia directa de cortes de tejidos se realiza generalmente utilizando preparaciones en fresco (con hidróxido de potasio o blanco de calcofluor) y tinciones de Gram, Wright o Giemsa48. En las muestras se debe examinar la presencia de levaduras pequeñas, redondas u ovales, con gemaciones de pared delgada, que se observan agrupadas y con ramificaciones de seudohifas62; sin embargo, otros tipos de hongos también pueden mostrar esta morfología. Por tal motivo, puede ser necesaria la realización de otros exámenes para excluir otros géneros de hongos. La cápsula de Cryptococcus puede ser visualizada como un halo rojizo evanescente con la tinción de Gram, y la observación de artroconidias puede indicar la presencia de Trichosporon53. Es importante tener en cuenta que un examen microscópico negativo no excluye necesariamente una infección23,48.
Peptide nucleic acid-fluorescent in situ hybridizationEl PNA-FISH es un novedoso método molecular que ayuda a la rápida identificación de las especies más relevantes clínicamente de Candida60. Después de realizada una tinción de Gram para comprobar la presencia de Candida, se pueden estudiar las preparaciones con PNA-FISH: se observará una fluorescencia que es específica para determinadas especies de Candida. A pesar de que es un test útil, la necesidad de emplear microscopia fluorescente y el coste de los reactivos limita el uso de este ensayo en los laboratorios clínicos en América Latina.
Examen fenotípico del cultivoDetección rápidaEl examen de la producción del tubo germinativo es un método fácil y rápido para la identificación presuntiva de C. albicans57.
Medios cromógenosEn América Latina, el Grupo de Trabajo recomienda el uso del medio CHROMagar Candida para la identificación de Candida dado que es más preciso, aunque también se dispone de otros medios cromógenos de menor coste (por ejemplo, el medio comercializado por Oxoid). En un estudio, el medio CHROMagar Candida permitió la identificación de la especie en el 93% de los cultivos obtenidos, con una precisión de hasta el 92% a las 48h. El coste de esta técnica fue similar al de los métodos convencionales, por lo que es un método de examen que puede ser sufragado por laboratorios de países con recursos limitados30. Una restricción del método CHROMagar Candida es la falta de un amplio rango de colores, lo que reduce la identificación a un número limitado de especies. Esto incluye C. albicans (indistinguible por este método de Candida dubliniensis), C. tropicalis y Candida krusei. Los aislamientos de C. glabrata, C. parapsilosis, Candida guilliermondii, Candida kefyr y Candida lusitaniae tienen tonos variables en CHROMagar Candida, desde un blanco grisáceo hasta el rosa que son difíciles de definir dado que son tonos pasteles muy similares y no son específicos de ninguna de las especies66. Esta limitación subraya la necesidad de métodos alternativos para una identificación más exacta de las especies de Candida5. Al realizar el cultivo de muestras biológicas o de levaduras previamente aisladas en medios cromógenos es importante comprobar la presencia de cultivos mixtos que podrían indicar infecciones por más de un hongo patógeno.
CHROMagar Candida se prepara de acuerdo a las instrucciones del fabricante y se vierte en tubos de ensayo o placas de Petri estériles, permitiendo que se convierta en un gel. Las placas preparadas con el medio de cultivo pueden ser guardadas durante 24h a temperatura ambiente o durante un mes si se conservan en refrigeración y protegidas de la luz y la deshidratación9. Si son refrigeradas, las placas deben ser calentadas hasta alcanzar la temperatura ambiente hasta la inoculación de la muestra, efectuada mediante surcos sobre la placa e incubación a 30-37°C durante 48h9. La identificación de las especies se basa en el color de las colonias (tabla 1)29,52.
Color de las colonias según la especie tras incubación durante 2 días en medio CHROMagar Candida a 37°C
| Especies | Color y morfología52 |
| Candida albicans | Verde |
| Candida tropicalis | Azul oscuro a azul grisáceo (con un halo rosa en el agar) |
| Candida krusei | Rosa pálido a púrpura (de tono intenso y bordes más pálidos) y de textura seca |
Es esencial que se identifiquen la especie de todos los aislamientos que causan infecciones fúngicas invasivas. La identificación de las especies puede ser determinada mediante los siguientes métodos.
Métodos clásicos caserosEs posible verificar el perfil bioquímico de los aislamientos de levaduras utilizando pruebas caseras de fermentación y asimilación de azúcares. Varios laboratorios en América Latina preparan sus propios paneles de pruebas bioquímicas, que incluyen de 7 a 12 azúcares diferentes para asimilación y fermentación. Los resultados de dichos ensayos pueden ser comparados con los descritos en diferentes bases de datos existentes en libros de texto para determinar la especie.
Sistemas comerciales manualesEl perfil bioquímico de los aislamientos clínicos que se desea identificar puede ser comprobado mediante pruebas comerciales. Varios sistemas brindan diferentes parámetros asociados al crecimiento de las colonias y de la utilización de algún sustrato particular. Algunos detectan cambios en la turbidez al comparar con un pocillo de control (por ejemplo, API 20C AUX y API 32C), mientras que otros utilizan la producción o cambio de un determinado color en una serie de pocillos (por ejemplo, API Candida, Auxacolor y Uni-Yeast-Tek)18. Estas pruebas brindan resultados precisos para las especies más comunes de Candida, pero no son tan fiables para la identificación de las especies menos comunes. La precisión de los resultados depende en gran medida del número de ensayos disponibles en cada sistema comercial, así como de su base de datos (que puede ser limitada o amplia).
Sistemas comerciales automatizadosVITEK 2 es un instrumento completamente automatizado que utiliza una tecnología fluorescente para la identificación de levaduras y seudolevaduras en 15h24. La tarjeta fluorométrica inicial ha sido reemplazada por una tarjeta colorimétrica con el fin de ampliar la base de datos2. El panel de identificación de levaduras MicroScan es un sistema de microdilución para la identificación de levaduras en 4h. Tiene una tasa de éxito del 94% para la identificación de 22 especies de Candida40,59.
Identificación molecularComo se mencionó previamente, la PCR puede ser utilizada para la detección de ácidos nucleicos fúngicos. También puede servir para identificar especies de Candida en muestras de sangre, con una reducción del tiempo de identificación de las especies a 7h en comparación con una media de 3,5 días con los métodos fenotípicos habituales58. Además, la PCR puede detectar la presencia de más de una especie de Candida en un mismo paciente, mientras que los hemocultivos suelen demostrar solamente una especie. La capacidad de detectar e identificar más de una especie de Candida influye sobre el tratamiento y los resultados, particularmente cuando una de las especies es resistente a los compuestos azólicos14.
Nuevas perspectivas (proteómica)Se han utilizado sistemas de espectrometría de masa (MALDI-TOF) para la identificación de Candida en menos de 30min con una identificación correcta de hasta el 91%20. Se ha demostrado que el sistema MALDI-TOF tiene una tasa de éxito del 100% para la identificación de aislamientos de Candida, frente al 92% utilizando métodos bioquímicos (VITEK 2 y API C AUX)42.
La disponibilidad de métodos específicos de diagnóstico para la detección e identificación de una candidemia depende del marco clínico. Para los hospitales pequeños que no atienden a pacientes trasplantados ni tratan a muchos pacientes hematológicos o inmunodeficientes, el requerimiento mínimo sugerido por el Grupo de Trabajo para la identificación de levaduras es la capacidad de evaluar la micromorfología de las colonias complementada con la búsqueda de las principales especies de Candida utilizando el medio CHROMagar Candida, alguna prueba comercializada o un método casero para realizar las pruebas bioquímicas. En los hospitales terciarios, además de la micromorfología y del CHROMagar Candida, se recomienda la identificación mediante sistemas comerciales manuales (API 20C, API 32C), sistemas comerciales automatizados (VITEK 2) o métodos moleculares. Se debe considerar el uso de métodos moleculares para la identificación de patógenos emergentes cuando las herramientas convencionales brinden una identificación inconsistente y cuando se debe identificar un brote de infecciones fúngicas.
Sumario de recomendaciones para la identificación de especies deCandida
- 1.
El Grupo de Trabajo recomienda, como mínimo requerimiento, la observación de la micromorfología de las colonias complementada con la macromorfología utilizando el medio CHROMagar Candida.
- 2.
Para hospitales secundarios se recomienda la identificación de las especies utilizando uno o más de los siguientes métodos:
- a)
Micromorfología de las colonias.
- b)
Macromorfología (medio CHROMagar Candida).
- c)
Pruebas bioquímicas.
- I)
Métodos convencionales caseros.
- II)
Sistemas comerciales manuales con una base de datos limitada (por ejemplo, Auxacolor y Uni-Yeast-Tek).
- I)
- a)
- 3.
Para los hospitales de nivel terciario donde se tratan pacientes trasplantados, hematológicos o inmunodeficientes, el Grupo de Trabajo recomienda como requerimiento mínimo lo siguiente:
- a)
Micromorfología complementada por pruebas bioquímicas (API 20C, API 32C, VITEK 2 o MicroScan Yeast Identification Panel).
- b)
Métodos moleculares en situaciones específicas.
- a)
- 4.
Se deben considerar los métodos moleculares (PCR y MALDI-TOF) para la identificación de patógenos emergentes y cuando se investigan brotes de infección fúngica.
Es importante tener en cuenta que la identificación de las levaduras siempre debe tener prioridad sobre las pruebas de sensibilidad. El conocimiento local de la sensibilidad de los aislamientos clínicos a los antimicóticos puede influir en la elección del tratamiento. El Grupo de Trabajo alienta la colaboración entre laboratorios cuando se realizan pruebas de sensibilidad, ya que esto se traduce en una reducción de costes y un incremento de la precisión.
Si se efectúan pruebas de sensibilidad se debe tener en cuenta que todavía hay algunas controversias respecto a la definición de los valores de corte clínico para las equinocandinas y la anfotericina B. Las pruebas de detección de resistencia a fluconazol brindan resultados más fiables en comparación con otros agentes antifúngicos. Existen varias pruebas de sensibilidad in vitro para Candida. Entre estas se incluyen métodos como el M27-A del Clinical and Laboratory Standards Institute (CLSI) y el EDef 7.1 del European Committee on Antimicrobial Susceptibility Testing (EUCAST), métodos de difusión de disco (por ejemplo, el M44-A del CLSI), sistemas comerciales diversos (Fungitest, Sensititre YeastOne, Etest y Neo-Sensitabs) y otros métodos como la citometría de flujo y el VITEK 2.
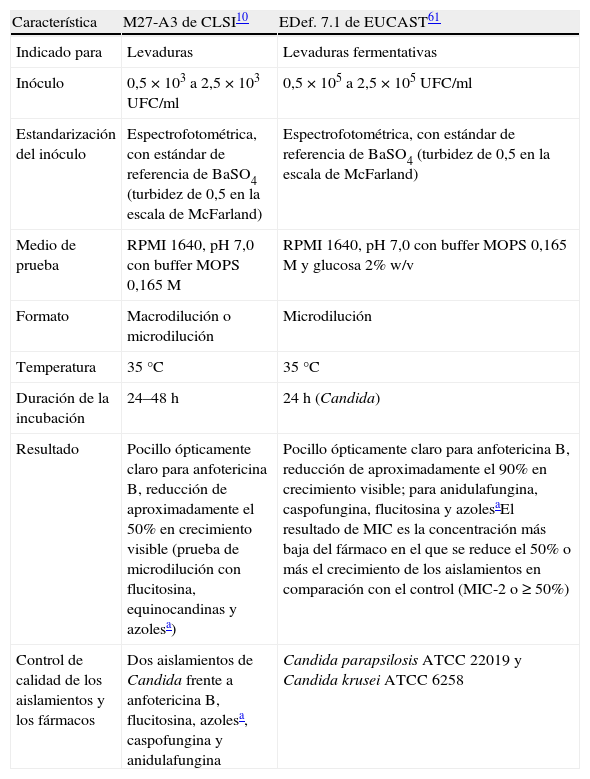
Métodos de referencia para pruebas de sensibilidad de CandidaEl método M27-A de dilución en caldo fue aprobado por el CLSI en 199754, y actualmente se le conoce como el método CLSI10. El método de dilución en caldo del EUCAST61 es conocido como EDef 7.1. Tanto el M27-A del CLSI como el EDef 7.1 del EUCAST especifican el tamaño del inóculo, los medios de cultivo, la duración y temperatura de incubación, y la lectura de los valores finales para los fármacos examinados (tabla 2).
Características de las pruebas de sensibilidad a los antifúngicos del CLSI y del EUCAST
| Característica | M27-A3 de CLSI10 | EDef. 7.1 de EUCAST61 |
| Indicado para | Levaduras | Levaduras fermentativas |
| Inóculo | 0,5×103 a 2,5×103UFC/ml | 0,5×105 a 2,5×105UFC/ml |
| Estandarización del inóculo | Espectrofotométrica, con estándar de referencia de BaSO4 (turbidez de 0,5 en la escala de McFarland) | Espectrofotométrica, con estándar de referencia de BaSO4 (turbidez de 0,5 en la escala de McFarland) |
| Medio de prueba | RPMI 1640, pH 7,0 con buffer MOPS 0,165 M | RPMI 1640, pH 7,0 con buffer MOPS 0,165M y glucosa 2% w/v |
| Formato | Macrodilución o microdilución | Microdilución |
| Temperatura | 35°C | 35°C |
| Duración de la incubación | 24–48h | 24h (Candida) |
| Resultado | Pocillo ópticamente claro para anfotericina B, reducción de aproximadamente el 50% en crecimiento visible (prueba de microdilución con flucitosina, equinocandinas y azolesa) | Pocillo ópticamente claro para anfotericina B, reducción de aproximadamente el 90% en crecimiento visible; para anidulafungina, caspofungina, flucitosina y azolesaEl resultado de MIC es la concentración más baja del fármaco en el que se reduce el 50% o más el crecimiento de los aislamientos en comparación con el control (MIC-2 o ≥50%) |
| Control de calidad de los aislamientos y los fármacos | Dos aislamientos de Candida frente a anfotericina B, flucitosina, azolesa, caspofungina y anidulafungina | Candida parapsilosis ATCC 22019 y Candida krusei ATCC 6258 |
Adaptada de Rodriguez-Tudela et al.55
CLSI: Clinical and Laboratory Standards Institute; EUCAST: European Committee for Antimicrobial Susceptibility Testing; MIC: concentración mínima inhibitoria; MOPS: ácido 3-(N-morfolino) propanosulfónico; RPMI: Roswell Park Memorial Institute; UFC: unidades formadores de colonias; w/v: peso/volumen.
Aunque con el método EDef 7.1 se obtienen habitualmente valores de concentración inhibitoria mínima (MIC, minimum inhibitory concentration) ligeramente inferiores16,55, ambos métodos brindan similares resultados, lo que indica que ambas metodologías no tienen dificultad para obtener estándares uniformados de pruebas de sensibilidad antifúngica. Sin embargo, estos métodos son de alto coste y representan una elevada carga de trabajo. Por lo tanto, su uso en los laboratorios de hospitales es actualmente limitado. Muchos laboratorios hospitalarios prefieren utilizar productos comercialmente disponibles que parecen ser más rápidos y más precisos que el método M27-A.
El método difusión de disco (M44-A del CLSI) brinda una zona de inhibición del crecimiento fúngico alrededor del disco, una medición que puede ser correlacionada con el valor de MIC. Para el fluconazol se ha demostrado una buena correlación entre las pruebas de sensibilidad basadas en disco y el método de referencia M27-A44,54. Este método no es muy utilizado en América Latina, ya que los discos de fluconazol y voriconazol tienen una distribución limitada.
Pruebas de sensibilidad comercialesEs importante tener en cuenta que algunos de los productos comerciales que se presentan en esta sección quizá no estén actualmente comercializados en América Latina. Los sistemas comerciales de valoración de MIC basados en caldos incluyen Candifast, Integral Systems Yeasts y Fungitest. Sin embargo, estos métodos muestran una correlación limitada con el método de referencia M2-7 A54.
El Sensititre YeastOne genera una respuesta colorimétrica. Este método tiene una concordancia ≥85% con el método de referencia M27-A54, y del 92% con el método de referencia EDef 7.113. Un trabajo reciente mostró una alta concordancia entre Sensititre YeastOne y el método del EUCAST, con una concordancia básica (global) ≥95,5%, según el antimicótico examinado12.
El E-test es una prueba de sensibilidad antimicrobiana que ha sido adaptada para ser utilizada con agentes antifúngicos. En este sencillo método el hongo es inoculado en la superficie de una placa de agar sobre la que se coloca una tira plástica que contiene un gradiente de concentraciones del antimicótico. Después de la incubación de un hongo sensible se puede observar una zona de inhibición y el valor de MIC se lee en el punto en el que la zona intersecciona con la tira31. Se ha descrito como aceptable la correlación entre el método E-test y los métodos de referencia M27-A y EDef 7.1 para la mayoría de las especies de Candida y para los antifúngicos azólicos13,54.
Neo-Sensitabs es un sistema comercial basado en discos o tabletas. Los resultados de este sistema no se correlacionan bien con los métodos de referencia M27-A y EDef 7.113,54.
Otros métodos para valorar la sensibilidadDesde hace largo tiempo se reconoce el uso de la citometría de flujo como una herramienta potencial para el estudio de la sensibilidad a los antifúngicos, y se ha descrito que brinda resultados rápidos en comparación con los métodos de referencia34,56. El sistema VITEK 2, utilizado para la identificación de levaduras, también puede ser empleado para el estudio de la sensibilidad. Un estudio comparativo encontró una excelente concordancia (del 92 al 98,2%) entre VITEK 2 y el método de referencia M27-A para la determinación de los valores MIC a los antimicóticos; sin embargo, se observaron discrepancias entre las especies6.
Sumario de recomendaciones para pruebas de sensibilidad deCandida
- 1.
La identificación de las levaduras siempre debe tener prioridad sobre las pruebas de sensibilidad.
- 2.
Los laboratorios deben colaborar entre sí a fin de reducir los costes e incrementar la precisión de las pruebas.
- 3.
Se recomiendan las pruebas de sensibilidad al fluconazol para los hospitales de atención terciaria.
A.L. Colombo ha recibido ayudas para la investigación de Pfizer, MSD, United Medical y Luminex, y ayudas para la formación médica de Pfizer, MSD, United Medical y Astellas. Además, ha ejercido como consultor para MSD, Pfizer y Gilead. J.A. Cortes ha recibido de Pfizer y MSD ayudas para la investigación y para la asistencia a charlas de formación médica. M. Nucci ha recibido ayudas para la investigación de Pfizer y MSD, y ha sido consultor y conferenciante para Pfizer, Merck, Astellas y Gilead. F. de Queiroz Telles ha participado en cursos de formación continuada en laboratorios de Astellas, MSD, Pfizer y United Medical, y en programas de investigación en laboratorios de Astellas, MSD y Pfizer. I.N. Tiraboschi ha sido conferenciante para Pfizer y Gilead. J. Zurita ha sido miembro del consejo asesor y consultor de Pfizer, ha recibido ayudas para la investigación de Wyeth y MSD por su participación en el estudio SMART.
Jacqueline Adam, PhD, de Choice Healthcare Solutions, brindó asistencia editorial para la redacción del primer borrador, los comentarios de los revisores y las sugerencias editoriales para las versiones en borrador del manuscrito; los fondos fueron provistos por Pfizer. Los autores son responsables de las opiniones, conclusiones y recomendaciones.
Cómo citar este artículo: Colombo AL, et al. Recommendations for the diagnosis of candidemia in Latin America. Rev Iberoam Micol. 2013;30:150–7.