Aunque en la última década ha mejorado el manejo de la candidiasis invasiva, todavía persisten aspectos controvertidos, en especial por lo que respecta a la estrategia diagnóstica y terapéutica.
ObjetivosIdentificar los conocimientos clínicos esenciales y formular unas recomendaciones con la obtención de un alto grado de consenso, necesarias en la asistencia de pacientes adultos no neutropénicos en estado crítico con candidiasis invasiva.
MétodosSe preparó una encuesta prospectiva cuyo texto se redactó en español, y se obtuvo un consenso mediante técnica DELPHI (un método de reestructuración de un proceso de comunicación con el que se obtiene un grado de consenso de los especialistas sobre el problema planteado). En primer término, se envió de forma anónima por correo electrónico a 25 especialistas nacionales de diferentes disciplinas médicas, expertos en infecciones fúngicas invasivas, de 5 sociedades científicas nacionales, incluidos intensivistas, anestesistas, microbiólogos, farmacólogos e infectólogos, que respondieron a 47 preguntas preparadas por el grupo de coordinación, tras una revisión exhaustiva de los estudios publicados durante los 5 últimos años. Los objetivos educativos contemplaron 5 categorías: epidemiología, instrumentos diagnósticos, scores, estrategias terapéuticas y de desescalada. Para ser seleccionado, el grado de acuerdo alcanzado entre los expertos del panel en cada uno de los ítems debía superar el 75%. En segundo término, después de extraer las recomendaciones de los ítems seleccionados, se celebró una reunión presencial donde se invitó a participar en una segunda ronda a más de 80 especialistas y se les solicitó la validación de las recomendaciones preseleccionadas.
ResultadosEn primer término, se realizó una preselección de 20 recomendaciones (epidemiología 4, scores 3, diagnóstico de laboratorio 4, tratamiento 6 y desescalada 3). Después de la segunda ronda, se validaron las 12 recomendaciones siguientes: 1) Epidemiología (2 recomendaciones): en la Unidad de Cuidados Intensivos considere la candidiasis y no olvide la existencia de especies de Candida diferentes de Candida albicans. 2) Técnicas diagnósticas (4 recomendaciones): ante la más mínima sospecha, es preciso practicar hemocultivos cada 2–3 días y, en caso de obtener un cultivo positivo, cada 3 días, hasta obtener el primer resultado negativo. Si es posible, se obtendrán muestras de fluidos y tejidos estériles (es importante el examen microscópico directo de las muestras). Siempre que sea posible, como instrumentos microbiológicos, deben emplearse métodos diferentes del cultivo. La determinación de la sensibilidad antifúngica es obligatoria. 3) Scores (una recomendación): como instrumento de cribado, se recomienda utilizar el Candida score y determinar la multicolonización en pacientes en alto riesgo. 4) Tratamiento (4 recomendaciones): debe instaurarse el tratamiento de forma precoz. Las equinocandinas son el tratamiento de elección. Es recomendable retirar cualquier vía venosa central insertada. Debe realizarse un estudio del fondo de ojo. 5) Desescalada (una recomendación): solo aplicable cuando se confirme la sensibilidad a fluconazol y después del transcurso de 3 días de estabilidad clínica. El mayor acuerdo se alcanzó en la optimización de los instrumentos microbiológicos y en la retirada del catéter, mientras que el menor correspondió al de desescalada y a los scores.
ConclusionesEn pacientes ingresados en la Unidad de Cuidados Intensivos, el manejo de la candidiasis invasiva requiere la aplicación de la amplia serie de conocimientos y habilidades resumidas en nuestras recomendaciones. Estas pueden ayudar a identificar a los pacientes potenciales, estandarizar su manejo global y mejorar su desenlace, en función de la metodología DELPHI.
Este artículo está publicado en inglés en este mismo número. Puede encontrarlo enhttp://dx.doi.org/10.1016/j.riam.2013.05.006.
Although there has been an improved management of invasive candidiasis in the last decade, controversial issues still remain, especially in the diagnostic and therapeutic approaches.
AimsWe sought to identify the core clinical knowledge and to achieve high level agreement recommendations required to care for critically ill adult patients with invasive candidiasis.
MethodsA prospective Spanish survey reaching consensus by the DELPHI technique was made. It was anonymously conducted by electronic mail in a first term to 25 national multidisciplinary experts in invasive fungal infections from five national scientific societies, including intensivists, anesthesiologists, microbiologists, pharmacologists and infectious diseases specialists, who answered to 47 questions prepared by a coordination group after a strict review of the literature in the last five years. The educational objectives spanned five categories, including epidemiology, diagnostic tools, prediction rules, and treatment and de-escalation approaches. The level of agreement achieved among the panel experts in each item should exceed 75% to be selected. In a second term, after extracting recommendations from the selected items, a face to face meeting was performed where more than 80 specialists in a second round were invited to validate the preselected recommendations.
ResultsIn the first term, 20 recommendations were preselected (Epidemiology 4, Scores 3, Diagnostic tools 4, Treatment 6 and De-escalation approaches 3). After the second round, the following 12 were validated: (1) Epidemiology (2 recommendations): think about candidiasis in your Intensive Care Unit (ICU) and do not forget that non-Candida albicans–Candida species also exist. (2) Diagnostic tools (4 recommendations): blood cultures should be performed under suspicion every 2–3 days and, if positive, every 3 days until obtaining the first negative result. Obtain sterile fluid and tissue, if possible (direct examination of the sample is important). Use non-culture based methods as microbiological tools, whenever possible. Determination of antifungal susceptibility is mandatory. (3) Scores (1 recommendation): as screening tool, use the Candida Score and determine multicolonization in high risk patients. (4) Treatment (4 recommendations): start early. Choose echinocandins. Withdraw any central venous catheter. Fundoscopy is needed. (5) De-escalation (1 recommendation): only applied when knowing susceptibility determinations and after 3 days of clinical stability. The higher rate of agreement was achieved in the optimization of microbiological tools and the withdrawal of the catheter, whereas the lower rate corresponded to de-escalation therapy and the use of scores.
ConclusionsThe management of invasive candidiasis in ICU patients requires the application of a broad range of knowledge and skills that we summarize in our recommendations. These recommendations may help to identify the potential patients, standardize their global management and improve their outcomes, based on the DELPHI methodology.
This article is also published in English in this issue. It can be found inhttp://dx.doi.org/10.1016/j.riam.2013.05.006.
La incidencia de candidemia en el paciente crítico no neutropénico ha experimentado un crecimiento significativo en los últimos años7–9. En nuestro país, la incidencia de candidemia se estima en 4,3 episodios/105 habitantes5, de los que entre un 33 y un 55% de los casos se localizan en las unidades de cuidados intensivos (UCI)11, porcentaje que podría haberse reducido en los últimos años.
Al incremento de la incidencia se suma el cambio en la distribución de las distintas especies de Candida47. La especie predominante en las UCI continúa siendo Candida albicans35, representando aproximadamente la mitad de los aislamientos; Candida parapsilosis y Candida glabrata son la segunda y tercera especies más aisladas en nuestro país, según un reciente estudio epidemiológico publicado49.
Además de una importante carga económica para los sistemas sanitarios, la infección por Candida en general y la candidemia en particular se asocian con una importante tasa de mortalidad en los pacientes críticos. Así, en Estados Unidos la candidemia se asocia con un incremento del 14,5% de la mortalidad en adultos, y del 10% en los pacientes pediátricos66. Por su parte, las tasas de mortalidad cruda y de mortalidad atribuible asociadas con la candidiasis invasiva se establecen, respectivamente, en el 40-78% y el 20-40%18,56.
Los nuevos antifúngicos de los últimos años ofrecen diferentes alternativas para el tratamiento de la candidiasis invasiva. Sin embargo, y dada la heterogeneidad de las recomendaciones de las diferentes sociedades científicas2,15,47, la estrategia terapéutica más eficiente aun no ha sido establecida. El resultado es una notable falta de consenso a la hora de establecer el diagnóstico y el tratamiento más adecuados para esta población de pacientes.
El presente estudio de investigación tiene como objetivo analizar la situación actual del manejo de la candidiasis invasiva en el paciente crítico no neutropénico en los hospitales de nuestro país. Para ello, y en una primera fase que abarcó el periodo de enero a septiembre de 2012, se conformó un panel de especialistas de 5 sociedades científicas –Asociación Española de Micología (AEM) como promotora; Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC); Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR); Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC); y Sociedad Española de Quimioterapia (SEQ)– con amplia experiencia en el tratamiento del paciente crítico no neutropénico, a los que se solicitó la cumplimentación de un cuestionario elaborado por los 5 coordinadores responsables de la investigación tras realizar una exhaustiva revisión de la literatura en los últimos 5 años. En los casos en los que las respuestas no alcanzaron un nivel de consenso suficiente, los expertos argumentaron las razones por las que se explicaba la divergencia de opiniones.
En un segundo término, y tras la elaboración de las recomendaciones resultantes por el grupo coordinador, se realizó una segunda vuelta en una reunión presencial donde 80 especialistas de toda la geografía nacional y que atienden de forma habitual a pacientes críticos adultos con candidiasis invasiva validaron de la misma forma mediante votación las recomendaciones preseleccionadas.
MétodosEl panel de especialistas fue constituido por 25 especialistas con una amplia distribución geográfica en nuestro país, pertenecientes a las 5 sociedades científicas colaboradoras en la investigación. La razón para su inclusión en el panel obedece a su experiencia tanto en la investigación de la candidemia como en el pronóstico y manejo clínico del paciente crítico no neutropénico con sospecha y/o confirmación de candidiasis invasiva.
Para llevar a cabo el estudio se ha empleado la metodología DELPHI con objeto de optimizar el proceso de consulta a los 25 miembros del panel. Concretamente, la metodología DELPHI posibilita el conocimiento de la opinión grupal, que no meramente individual, del colectivo de expertos en las diferentes áreas de información planteadas por los coordinadores. Para ello se requiere un nivel de consenso superior al 75% (19 de 25 participantes) del total de expertos consultados en cada una de las preguntas formuladas. En los casos en que la respuesta mayoritaria a una pregunta fue compartida por 15-18 participantes, el nivel de consenso se estableció como medio, mientras que en aquellos en los que fue únicamente compartida por 14 o menos expertos el nivel de consenso se definió como bajo.
Las cuestiones, 47 en total, elaboradas por los coordinadores (tabla 1) se distribuyeron en 5 secciones o especialidades diferenciadas: sección Epidemiología, 6 cuestiones (desarrolladas por E.M. y P.L.); sección Scores, 5 cuestiones (desarrolladas por A.R. y R.Z.); sección Diagnóstico de laboratorio, 14 cuestiones (desarrolladas por R.Z. y A.R.); sección Tratamiento, 11 cuestiones (desarrolladas por P.L. y E.M.); y sección Desescalada terapéutica, 9 cuestiones (desarrolladas por R.F. y R.Z.).
Listado de coordinadores del estudio Épico
| Nombre | Sociedad científicaa |
| Dr. Pedro Llinares Mondéjar | SEIMC/SEQ |
| Dr. Rafael Zaragoza Crespo | AEM |
| Dr. Emilio Maseda Garrido | SEDAR |
| Dr. Ricard Ferrer Roca | SEMICYUC/EDUSEPSIS |
| Dr. Alejandro H. Rodríguez Oviedo | SEMICYUC |
EDUSEPSIS: Proyecto Educacional en Sepsis Español.
AEM: Asociación Española de Micología, como promotora; EDUSEPSIS: Proyecto Educacional en Sepsis Español; SEDAR: Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor; SEMICYUC: Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias; SEQ: Sociedad Española de Quimioterapia.
La metodología del estudio contempló el desarrollo de 2 fases. En la primera, y con objeto de conocer los niveles de consenso para las diferentes preguntas planteadas, los 25 especialistas participantes (tabla 2) respondieron entre los días 18 y 29 de mayo de 2012, de forma anónima y a través de una aplicación telemática, a un cuestionario totalmente estructurado en base a preguntas en escala métrica (mayoría) y categórica. Los coordinadores, responsables de la búsqueda sistemática de literatura para la elaboración de las preguntas, no respondieron el cuestionario.
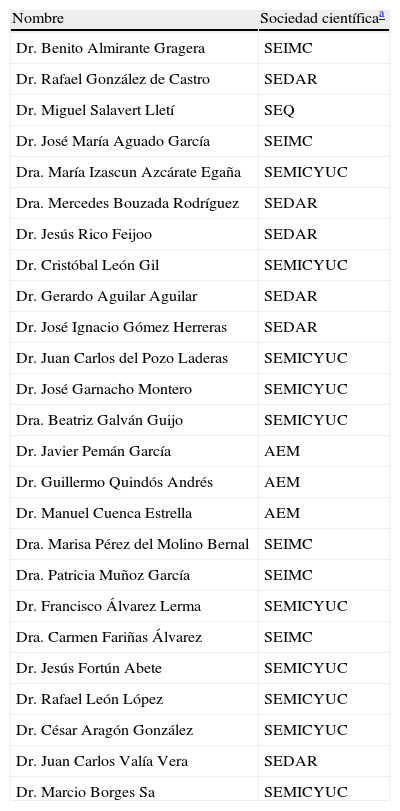
Expertos participantes en el proyecto Épico
| Nombre | Sociedad científicaa |
| Dr. Benito Almirante Gragera | SEIMC |
| Dr. Rafael González de Castro | SEDAR |
| Dr. Miguel Salavert Lletí | SEQ |
| Dr. José María Aguado García | SEIMC |
| Dra. María Izascun Azcárate Egaña | SEMICYUC |
| Dra. Mercedes Bouzada Rodríguez | SEDAR |
| Dr. Jesús Rico Feijoo | SEDAR |
| Dr. Cristóbal León Gil | SEMICYUC |
| Dr. Gerardo Aguilar Aguilar | SEDAR |
| Dr. José Ignacio Gómez Herreras | SEDAR |
| Dr. Juan Carlos del Pozo Laderas | SEMICYUC |
| Dr. José Garnacho Montero | SEMICYUC |
| Dra. Beatriz Galván Guijo | SEMICYUC |
| Dr. Javier Pemán García | AEM |
| Dr. Guillermo Quindós Andrés | AEM |
| Dr. Manuel Cuenca Estrella | AEM |
| Dra. Marisa Pérez del Molino Bernal | SEIMC |
| Dra. Patricia Muñoz García | SEIMC |
| Dr. Francisco Álvarez Lerma | SEMICYUC |
| Dra. Carmen Fariñas Álvarez | SEIMC |
| Dr. Jesús Fortún Abete | SEMICYUC |
| Dr. Rafael León López | SEMICYUC |
| Dr. César Aragón González | SEMICYUC |
| Dr. Juan Carlos Valía Vera | SEDAR |
| Dr. Marcio Borges Sa | SEMICYUC |
AEM: Asociación Española de Micología, como promotora; SEDAR: Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor; SEIMC: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica;; SEMICYUC: Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias; y SEQ: Sociedad Española de Quimioterapia.
Las cuestiones que no alcanzaron un nivel de consenso suficiente –la respuesta mayoritaria debía ser compartida por al menos 19 de los 25 expertos participantes para alcanzar el nivel de consenso del 75% requerido habitualmente en los estudios DELPHI– fueron propuestas para su inclusión en la segunda fase, desarrollada entre los días 8 y 14 de junio de 2012 a través de la aplicación telemática con la participación anónima de 22 de los 25 especialistas incluidos en la muestra inicial. El objetivo de esta segunda fase fue recabar los motivos y razones que explicaban la dispersión de opiniones entre el colectivo de expertos. Los coordinadores, responsables del análisis e identificación de las cuestiones con mayor divergencia de opinión, tampoco respondieron a las preguntas incluidas en la segunda fase.
Tras ello, como se ha explicado anteriormente, se generaron unas recomendaciones que pasaron a ser validadas en la reunión presencial el día 25 de septiembre de 2012
ResultadosPrimera fase. Expertos DELPHISección Epidemiología
1.-En su opinión, y entre los factores de riesgo que pueden afectar al paciente crítico, ¿hasta qué punto le parece importante la posibilidad de que se desarrolle una candidiasis invasiva?
Rationale: Las especies de Candida son una causa importante de infección en el paciente crítico5,31,34,63. Los datos del estudio EPIC II, realizado con 13.796 pacientes adultos ingresados en 1.265 UCI de 76 países, mostró que el 51% de los pacientes presentaron un proceso infeccioso, siendo Candida el tercer microorganismo implicado en la infección (17% de los pacientes infectados), tras Staphylococcus aureus (20,5%) y Pseudomonas (19,9%)29. En Estados Unidos, Candida se presenta como la principal causa de infección fúngica en pacientes hospitalizados66. Además, la incidencia de la infección por Candida en las UCI ha aumentado en distintos países a lo largo de los últimos años9.
Una amplia mayoría de los expertos consultados (88%) otorga un elevado nivel de importancia a la posibilidad de desarrollar una candidiasis entre los factores de riesgo que pueden afectar al paciente crítico. Concretamente, y en una escala de 0 a 10 puntos en la que el 10 representa el nivel de importancia máximo, 22 expertos otorgaron 7 o más puntos a la candidiasis. La puntuación media se estableció en 7,7 puntos, con una desviación típica de 1,9 puntos. El nivel de consenso fue alto (>75%).
2.-¿Hasta qué punto considera que la candidemia es un factor importante de mortalidad asociada en pacientes críticos?
Rationale: La candidiasis invasiva es una causa importante de mortalidad directa e indirecta en pacientes críticos neutropénicos y no neutropénicos. Las tasas de mortalidad cruda y de mortalidad atribuible asociada a la candidiasis invasiva se establecen, respectivamente, en el 40-78% y el 20-40%18,56. En Estados Unidos, la candidemia se asocia con un incremento del 14,5% de la mortalidad en adultos, así como del 10% en los pacientes pediátricos66. Sin embargo, en los pacientes inmunodeprimidos con cáncer, la candidiasis invasiva puede ser un marcador de gravedad, resultando difícil diferenciar la mortalidad directamente atribuible a la candidiasis invasiva de la causada por una infección concurrente o por la propia enfermedad tumoral subyacente.
El 76% de los miembros del panel de expertos considera que la candidemia es un factor muy importante de mortalidad asociada en pacientes críticos. Concretamente, y en una escala de 0 a 10 puntos, 19 expertos concedieron 7 o más puntos a la candidemia como factor de mortalidad. La puntuación media se estableció en 7,4 puntos, con una desviación típica de 2,2 puntos. El nivel de consenso alcanzado por los expertos fue alto (>75%).
3.-¿En qué medida considera importante el cambio en la distribución de especies de Candida en las últimas décadas y su influencia en el patrón de la sensibilidad antifúngica?
Rationale: En los últimos años se ha visto un cambio en la distribución de las especies de Candida en la UCI47,60. La especie predominante en las unidades de críticos continúa siendo C. albicans35, seguida de C. parapsilosis y C. glabrata59, presentando aproximadamente el 15% una sensibilidad reducida al fluconazol. Además, la distribución de las especies varía con la edad: la incidencia de candidemia debida a C. glabrata aumenta con la edad, situación contraria a lo que sucede con C. parapsilosis y Candida tropicalis52.
En torno a un 85% de los expertos consultados considera muy relevante el cambio en la distribución de especies de Candida en las últimas décadas, así como su influencia en el patrón de sensibilidad antifúngica. Concretamente, y utilizando la escala de 0 a 10 puntos, 21 expertos otorgaron 7 o más puntos al cambio en la distribución de Candida. La puntuación media se estableció en 7,6 puntos, con una desviación típica de 1,8 puntos. El nivel de consenso del panel fue alto (>75%).
4.-¿Hasta qué punto considera usted importante la identificación de factores de riesgo que pueden predisponer a la aparición de especies de Candida diferentes de C. albicans?
Rationale: Los estudios han identificado varios factores que predisponen a la aparición de infecciones producidas por especies de Candida diferentes de C. albicans (predominantemente C. glabrata y Candida krusei). Entre los mismos destacan el tratamiento previo con triazoles, la cirugía del tracto gastrointestinal en los 30 días previos al comienzo de la candidemia, y una edad superior a 65 años60. El tratamiento con azoles es un factor a tener muy en cuenta dado que tanto C. glabrata como C. krusei son potencialmente resistentes al fluconazol24. Por su parte, la aparición de C. parapsilosis se ha asociado con edades tempranas de la vida, la utilización de catéteres venosos centrales (CVC), la administración de equinocandinas y deficientes prácticas en el control de la infección, mientras que C. tropicalis es particularmente frecuente en pacientes neutropénicos con enfermedad hematológica subyacente52,59.
La inmensa mayoría de los especialistas consultados (92%) considera muy importante la identificación de factores de riesgo que puedan favorecer la aparición de especies de Candida diferentes a C. albicans. Concretamente, y otorgando 10 puntos a la máxima importancia y 0 a una importancia nula, 23 expertos concedieron 7 o más puntos a la identificación de potenciales factores de riesgo. La puntuación media se estableció en 8,5 puntos, con una desviación típica de 1,4 puntos. El nivel de consenso fue, una vez más, elevado (>75%).
5.-¿En qué medida considera importante valorar las características clínicas de los pacientes críticos en cuanto a que estas puedan condicionar la forma de presentación de la candidiasis invasiva?
Rationale: La candidiasis invasiva se puede manifestar como una candidemia aislada, una candidiasis invasiva sin candidemia documentada o una combinación de las 2 entidades. La cirugía previa y los tumores sólidos son significativamente más frecuentes en pacientes con candidiasis invasiva, mientras que el uso previo de antibióticos, la neutropenia y los tumores hematológicos son significativamente más comunes en pacientes con candidemia34. Además, la mortalidad cruda por candidemia en el paciente crítico se mantiene elevada y se relaciona con el huésped (diagnóstico de ingreso en UCI), y no con las variables del tratamiento56. Los procesos metastásicos ocurren en una proporción considerable de los pacientes con candidemia en la UCI y es necesario prestar atención a posibles focos secundarios.
Una amplia mayoría de los expertos consultados (88%) destaca la importancia de valorar las características clínicas de los pacientes críticos, dado que pueden condicionar la forma de presentación de la candidiasis. Concretamente, y en una escala de 0 a 10 puntos, en la que el 10 representa el nivel de importancia máximo, 22 expertos otorgaron 7 o más puntos a la valoración de las características clínicas. La puntuación media se estableció en 8,2 puntos, con una desviación típica de 1,4 puntos. El nivel de consenso fue alto (>75%).
6.-Indique su grado de acuerdo con los siguientes enunciados: 1) La especie de Candida es un factor determinante en la mortalidad asociada a la candidiasis invasiva; y 2) La enfermedad subyacente es un factor determinante en la mortalidad asociada a la candidiasis invasiva.
Rationale: Además de por el adecuado control del foco infeccioso, el resultado del proceso infeccioso viene condicionado por 3 factores: la sensibilidad a los antifúngicos del organismo infectante23,61, la virulencia del propio organismo6,26 y la gravedad de la enfermedad subyacente20,23. C. krusei, C. tropicalis y C. glabrata se han asociado a una elevada mortalidad mientras que C. parapsilosis se asocia a una menor patogenicidad. La gravedad de la enfermedad subyacente es un factor importante de mortalidad y, de hecho, la mortalidad total es mayor en pacientes críticos candidémicos que en la población general. En el estudio de Marriott et al.36, la edad, el diagnóstico en el momento de ingresar en la UCI (diferente de politraumatismo) y la ventilación mecánica en el momento de producirse la candidemia fueron factores independientes de mortalidad en el análisis multivariante. Estudios recientes6 demuestran que la utilización de equinocandinas y la administración precoz del tratamiento antifúngico reducen la mortalidad por una candidiasis invasiva. Es posible que el beneficio del tratamiento antifúngico quede enmascarado en pacientes de UCI por la gravedad de la enfermedad subyacente, y que al final esta condicione la mortalidad del paciente.
1) Cerca de un 85% de los miembros del panel entiende que la especie de Candida es un factor determinante en la mortalidad asociada a la candidiasis. Concretamente, y en una escala de 1 a 5 puntos en la que el 5 representa el grado máximo de acuerdo, 21 expertos otorgaron 4 o 5 puntos a la afirmación. La puntuación media se estableció en 4,1 puntos. Alto nivel de consenso (>75%).
2) El nivel de consenso es total a la hora de considerar la enfermedad subyacente como factor determinante de mortalidad asociada a candidiasis. Empleando la escala de 1 a 5 puntos, los 25 expertos consultados concedieron 4 o 5 puntos a la afirmación, estableciéndose la media en 4,8 puntos.
SecciónScores
1.-Ante un paciente con sepsis grave, fiebre, tratamiento antibiótico de amplio espectro y cultivos negativos, ¿en qué ha de basarse el facultativo para instaurar un tratamiento antifúngico?
Respuestas aportadas por los coordinadores: factores de riesgo, Candida score, multicolonización, marcadores, mala evolución.
La mayoría de los expertos consultados se basa en los factores de riesgo (8 expertos) o en el Candida score (8 expertos) para comenzar un tratamiento antifúngico en casos de sepsis grave, fiebre, tratamiento antifúngico de amplio espectro y cultivos negativos. Tan solo un especialista afirma basarse en los marcadores, mientras que la multicolonización o la mala evolución son las opciones seleccionadas en cada caso por 4 expertos. El nivel de consenso fue medio (>50 y <75%).
2.-Uno de los factores a considerar en el cálculo del Candida score es la multicolonización. ¿Considera indispensable la evaluación de multicolonización para la utilización del Candida score?
Rationale: Los estudios publicados en la literatura han demostrado que la multicolonización actúa como un factor pronóstico de candidiasis probada32, así como que el índice de colonización se correlaciona directamente con la infección fúngica invasiva3.
Una amplia mayoría de los expertos consultados (84%) considera indispensable la evaluación de la colonización múltiple para la utilización del Candida score. Concretamente, y en una escala de 0 a 10 puntos, en la que el 10 representa el nivel de importancia máximo, 21 expertos otorgaron 7 o más puntos a la valoración de las características clínicas. La puntuación media se estableció en 8 puntos, con una desviación típica de 1,9 puntos. El nivel de consenso fue alto (>75%).
3.-¿En qué medida utiliza usted el índice de colonización corregido (ICC) para guiar el tratamiento de la candidiasis invasiva?
Rationale: El índice de Pittet o ICC (número de muestras con alta colonización/número total de muestras analizadas) fue establecido para pacientes quirúrgicos y demostró que un índice de colonización corregido >0,4 tiene un valor predictivo positivo54 y un valor predictivo negativo del 100%55 para el desarrollo de candidiasis invasiva.
El 76% de los expertos consultados afirma no utilizar el ICC para guiar el tratamiento de la candidiasis invasiva, o hacerlo solo de forma muy esporádica. Concretamente, 10 expertos afirman utilizar el ICC solo «en algunos casos» y 9 no utilizarlo «en ningún caso», mientras que 6 reconocen emplearlo «en la mayoría de los casos». El nivel de consenso fue alto (>75%).
4.-De cada 10 casos de pacientes con riesgo de infección fúngica invasiva, ¿en cuántos utiliza el Candida score para guiar el tratamiento de la candidiasis invasiva?
Rationale: El Candida score presenta utilidad para valorar el riesgo de infección fúngica invasiva con un bajo valor predictivo positivo y un muy alto valor predictivo negativo. Así, el riesgo de desarrollar candidiasis invasiva en los pacientes críticos no neutropénicos con colonización por Candida que presentan un Candida score inferior a 3 es altamente improbable33, beneficiándose de la administración de tratamiento antifúngico precoz únicamente aquellos con un Candida score superior a 2,532.
El 72% de los expertos consultados afirma utilizar el Candida score para valorar el riesgo de infección fúngica invasiva. Concretamente, 18 de los expertos afirma utilizar este score en al menos 7 de cada 10 pacientes críticos no neutropénicos con colonización por Candida, mientras que 3 lo utilizan en 6 pacientes, 2 en 5 pacientes, uno en 4 pacientes y un experto en ningún caso. El nivel de consenso alcanzado por los expertos fue medio (>50 y <75%).
Dado que la pregunta no alcanzó el mínimo consenso exigido en la metodología DELPHI, dicha pregunta fue seleccionada para la segunda fase, en la que los expertos fueron consultados sobre sus motivos o razones para no utilizar tan habitualmente el Candida score en estas situaciones. Entre las razones aludidas destacaron: 1) «Su valor predictivo positivo es bajo y solo serviría para no utilizar antifúngicos, pero el valor predictivo negativo es muy bueno»; y 2) «Existe dificultad en la obtención de los cultivos de vigilancia; en el caso de haberse realizado, el tener resultados 72h más tarde impide hacer un tratamiento precoz que conllevaría una menor mortalidad».
5.-¿Hasta qué punto se encuentra usted de acuerdo en utilizar únicamente la muestra rectal y la orina para demostrar colonización?
Rationale: Un dato muy importante que aporta el estudio CAVA33 es el valor predictivo para la candidiasis invasiva de cada una de las localizaciones de las muestras de colonización de forma independiente, lo que permite limitar el número de muestras para los estudios de colonización a aquellas que resultaron significativas: muestra rectal y orina.
El 80% de los expertos consultados considera suficiente utilizar únicamente muestra rectal y orina para demostrar colonización. Concretamente, y utilizando una escala de 0 a 10 puntos, en la que el 10 representa el máximo grado de importancia, 20 expertos otorgaron 7 o más puntos a la utilización exclusiva de ambas muestras. La puntuación media se estableció en 7,4 puntos, con una desviación típica de 2,5 puntos. Alto nivel de consenso.
Sección Diagnóstico de laboratorio
1.-En su opinión, y en el caso de sospecha de candidiasis invasiva, ¿con qué frecuencia recomendaría usted la realización de hemocultivos?
Rationale: En la actualidad, los hemocultivos constituyen el gold standard en el diagnóstico de la candidiasis invasiva16,17,51. Sin embargo, se trata de una técnica que, al presentar una sensibilidad de únicamente el 50% requiere de otras pruebas complementarias que mejoren la tasa diagnóstica.
El 92% de los expertos consultados recomienda hacer hemocultivos a diario o, cuando menos, cada 2 o 3 días. Concretamente, 6 expertos abogan por realizarlos a diario y 16 cada 2 o 3 días, mientras que un especialista recomienda hacer hemocultivos una sola vez a la semana y 2 realizar un único hemocultivo y esperar los resultados. El nivel de consenso fue alto (>75%).
2.-Indique en qué medida solicita cada una de las 2 pruebas que se exponen a continuación para el diagnóstico de la candidiasis invasiva no candidémica.
2.1-Obtención de muestras de fluidos estériles o tejidos.
2.2-Técnicas de microscopia de las muestras de fluidos estériles o tejidos.
Rationale: El diagnóstico de certeza de la candidiasis invasiva no candidémica es muy difícil de alcanzar en nuestro día a día25, ya que requiere la identificación histológica de invasión tisular por Candida o la demostración de la existencia de levaduras en un fluido estéril16,22.
En el caso de la pregunta 2.1, la inmensa mayoría (96%) de los expertos consultados considera muy importante la obtención de fluidos estériles o tejidos para el diagnóstico de la candidiasis invasiva. Concretamente, y en una escala de 0 a 10 puntos, en la que el 10 representa el nivel de importancia máximo, 24 expertos concedieron 7 o más puntos a esta prueba diagnóstica. La puntuación media se estableció en 9,1 puntos, con una desviación típica de 1,3 puntos.
En lo referente a la pregunta 2.2, el 84% de los expertos consultados considera muy relevante la solicitud de técnicas de visión directa de las muestras de fluidos estériles o tejidos para el diagnóstico de la candidiasis invasiva. Concretamente, y utilizando la escala de 0 a 10 puntos, 21 expertos concedieron 7 o más puntos a esta prueba diagnóstica. La puntuación media se estableció en 8,2 puntos, con una desviación típica de 1,4 puntos. El nivel de consenso para ambas preguntas fue alto (>75%).
2.3- En el caso del paciente con sospecha de peritonitis por Candida, ¿hasta qué punto considera usted que es necesario enviar muestras perioperatorias al laboratorio de microbiología?
Rationale: En casos de sospecha de peritonitis por Candida, el diagnóstico debe basarse, preferentemente, en el análisis de muestras perioperatorias de líquido o tejido peritoneal43,62,69, prueba que ha demostrado presentar un elevado valor pronóstico19.
La totalidad de los expertos considera necesario el envío al laboratorio de microbiología de muestras perioperatorias de líquido o tejido peritoneal en casos de sospecha de peritonitis por Candida. Todos los expertos concedieron 7 o más puntos a esta necesidad, por lo que el consenso fue alto.
3.-¿Considera usted el aislamiento de Candida en muestras respiratorias diagnóstico de neumonía candidiásica?
Rationale: El 60% de los pacientes críticos no neutropénicos ingresados en UCI por períodos superiores a 7 días presenta colonización por Candida25. Sin embargo, y a pesar de la notable frecuencia en el aislamiento de Candida en las vías aéreas, Meersseman et al.39 observaron en un estudio de 2 años de duración una total ausencia de casos de neumonía candidiásica en las autopsias realizadas a pacientes con evidencias de neumonía, confirmando que la neumonía por Candida es extremadamente infrecuente en los pacientes en UCI16.
La totalidad de los expertos consultados no considera que el aislamiento de Candida en muestras respiratorias en pacientes críticos sea suficiente para establecer el diagnóstico de neumonía candidiásica. Concretamente, 18 expertos no consideran el aislamiento en ningún caso, mientras que 7 afirman que pueden llegar a considerarlo únicamente en determinados casos. El consenso fue del 100%.
4.-Atendiendo a los cambios epidemiológicos en la candidiasis invasiva, ¿entiende usted que, en los casos de candidiasis invasiva confirmada, es importante conocer la sensibilidad a los diferentes antifúngicos?
Rationale: En las últimas 2 décadas, la principal tendencia epidemiológica con respecto a la candidiasis invasiva en las UCI y unidades de oncología ha sido el menor aislamiento de C. albicans frente al incremento de especies de Candida no-C. albicans, muy especialmente de C. glabrata, C. tropicalis, C. krusei y C. parapsilosis35,47,60,66. En este contexto, las guías editadas por la IDSA en 2009 establecen la recomendación de realizar estudios de sensibilidad únicamente en los casos de fracaso terapéutico, así como testar frente a fluconazol los aislamientos de C. glabrata47.
La inmensa mayoría (96%) de los expertos consultados destaca la relevancia de conocer la sensibilidad a los diferentes antifúngicos en casos de candidiasis invasiva confirmada. Concretamente, y sobre la escala de 0 a 10 puntos para valorar la importancia, 24 expertos concedieron 7 o más puntos a la necesidad de establecimiento de la sensibilidad al tratamiento farmacológico. La puntuación media se estableció en 8,8 puntos, con una desviación típica de 1,2 puntos. El consenso alcanzado por el panel de expertos superó el 75%, por lo que fue alto.
5.-En su opinión, ¿hasta qué punto considera usted útil el uso de la medición de la procalcitonina sérica en el diagnóstico de sospecha de una candidemia?
Rationale: La determinación de procalcitonina sérica ha demostrado una notable precisión a la hora de discernir entre la bacteriemia y los estados inflamatorios no infecciosos en el paciente crítico con signos clínicos de sepsis13. En 2 estudios realizados en el paciente no neutropénico o quirúrgico la elevación de la procalcitonina sérica fue menor en la candidemia que en el caso de una bacteriemia, presentando en ambas un elevado valor predictivo negativo con niveles inferiores a 2 y 5 ng/ml12,37.
El 76% de los expertos consultados destaca la utilidad del uso de la medición de la procalcitonina sérica en el diagnóstico de sospecha de una candidemia. Concretamente, 4 especialistas consideran que resulta «muy útil», mientras que 15 definen la medición de la procalcitonina como «bastante útil». El nivel de consenso entre los especialistas superó el 75%, por lo que fue alto.
6.-¿Hasta qué punto considera usted necesario el uso de técnicas microbiológicas no basadas en el cultivo para el diagnóstico de la candidiasis invasiva?
Rationale: La combinación de los métodos diagnósticos tradicionales con pruebas microbiológicas independientes del cultivo puede constituir la clave para mejorar el diagnóstico y pronóstico de las fungemias en el paciente crítico25,50,51,62. Hasta la fecha, los resultados publicados con la detección de (1,3)-β-D-glucano, galactomanano, manano y antimanano, anticuerpos antimicelio o ácidos nucleicos son prometedores y podrían ser muy útiles como guía para un tratamiento antifúngico anticipado. En general se recomienda su uso como despistaje una o 2 veces a la semana en enfermos críticos con factores de riesgo –en especial enfermos quirúrgicos– a partir de los 5-7 días de ingreso hospitalario50. Sin embargo, y aun en la actualidad, las técnicas diagnósticas microbiológicas independientes del cultivo no se encuentran disponibles en la mayoría de los centros hospitalarios de nuestro país.
El 80% de los expertos consultados considera muy necesario el uso de técnicas microbiológicas no basadas en el cultivo para el diagnóstico de la candidiasis invasiva. Concretamente, y en una escala de valoración de la importancia de 0 a 10 puntos, 19 expertos concedieron 7 o más puntos a la necesidad del uso de técnicas diagnósticas microbiológicas. La puntuación media se estableció en 8 puntos, con una desviación típica de 1,7 puntos. Alto nivel de consenso.
7.-¿En qué medida utilizaría, en caso de disponer de esa técnica en el hospital, la detección combinada de antígeno manano y anticuerpo antimanano para el diagnóstico de la candidiasis invasiva?
Rationale: La detección, mediante ELISA, de antígeno manano y de anticuerpos frente a este antígeno de Candida ha demostrado su utilidad en el diagnóstico de candidiasis invasiva16,51; esta técnica se encuentra comercializada desde hace años. Además, y con objeto de evitar el escaso rendimiento de estas técnicas cuando se emplean por separado, se recomienda la realización conjunta de ambas pruebas en todo paciente con sospecha de candidasis invasiva41.
No se observa una opinión general compartida entre la mayoría de los expertos consultados en relación con la conveniencia de utilizar la detección combinada de antígeno manano y anticuerpo antimanano para el diagnóstico de la candidiasis invasiva. Concretamente, 5 y 8 especialistas consideran, respectivamente, que deberían utilizarse «prácticamente en todos los casos» y «en la mayoría de los casos». Por el contrario, 12 expertos consideran que su utilización solo resulta conveniente «en algunos casos». El nivel de consenso, del 52%, fue medio (>50 y <75%), por lo que la pregunta fue seleccionada para la segunda fase del estudio DELPHI.
8.-¿En qué medida utiliza usted la detección de (1,3)-ß-D -glucano para el diagnóstico de la candidiasis invasiva?
Rationale: La detección de betaglucano mediante cierta técnica actualmente en el mercado presenta una alta especificidad16,25,42,51 y valor predictivo positivo1,33,45 en pacientes con infección fúngica invasiva probada o probable.
Las respuestas muestran comportamientos divergentes entre los expertos consultados respecto a la frecuencia de utilización de la detección de (1,3)-ß-D-glucano para el diagnóstico de la candidiasis invasiva. Concretamente, 16 expertos –el 64% de la muestra– consideran que debería utilizarse «solo en algunos casos» o «en ningún caso», mientras que 7 y 2 especialistas responden que debería utilizarse «en la mayoría de los casos» o «prácticamente en todos los casos». El grado de consenso, de un 64%, fue medio, siendo la pregunta seleccionada para la segunda fase del estudio DELPHI.
9.-¿En qué medida utiliza usted, en caso de disponer de la técnica de inmunofluorescencia indirecta (C. albicans IFA IgG, Vircell) en su hospital, la detección de anticuerpos antimicelio para el diagnóstico de la candidiasis invasiva?
Rationale: La técnica de inmunofluorescencia indirecta (C. albicans IFA IgG, Vircell) para detectar anticuerpos antimicelio (CAGTA) tiene una alta sensibilidad y especificidad en caso de candidemia51,67,68, pudiendo resultar fundamental en el diagnóstico de la candidiasis invasiva en los pacientes quirúrgicos ingresados en las UCI59.
No se identifica un patrón general compartido por una mayoría de los expertos consultados en relación con la frecuencia de utilización de la detección de anticuerpos antimicelio para el diagnóstico de la candidiasis invasiva. Únicamente 13 expertos –el 52% de la muestra– consideran que debería utilizarse «solo en algunos casos» o «en ningún caso», mientras que 9 y 3 especialistas responden que debería utilizarse, respectivamente, «en la mayoría de los casos» o «prácticamente en todos los casos». El grado de consenso fue medio. La pregunta fue seleccionada para la segunda fase del DELPHI.
10.-¿En qué medida utiliza usted, en caso de contar con las técnicas moleculares de reacción en cadena de la polimerasa (PCR), la detección de ácidos nucléicos para el diagnóstico de la candidiasis invasiva?
Rationale: Los nuevos métodos moleculares mediante PCR en tiempo real constituyen, tal y como muestran numerosos trabajos publicados en la literatura16,30,38,51,65, una interesante alternativa para el diagnóstico rápido de la infección fúngica invasiva.
Las respuestas muestran la ausencia de un patrón de comportamiento general compartido por una mayoría de los expertos consultados. Únicamente 13 expertos –el 52% de la muestra– consideran que la detección de ácidos nucleicos para el diagnóstico de la candidiasis invasiva debería utilizarse «solo en algunos casos» o «en ningún caso», mientras que 7 y 5 especialistas responden que debería utilizarse, respectivamente, «en la mayoría de los casos» o «prácticamente en todos los casos». El consenso, de un 52%, tuvo un nivel medio, por lo que la pregunta fue seleccionada para la segunda fase del estudio.
Dado que las preguntas relativas a las técnicas microbiológicas no basadas en el cultivo –preguntas 7-10– no alcanzaron el mínimo consenso exigido por la metodología DELPHI, los 22 expertos participantes en la segunda fase fueron consultados por las técnicas –antígeno antimanano y anticuerpo antimanano; detección de (1,3)-ß-D-glucano; detección de anticuerpos antimicelio; y detección de ácidos nucleicos– que recomendarían para el diagnóstico de la candidiasis invasiva. Las respuestas han permitido identificar la detección de (1,3)-ß-D-glucano –opción elegida por 10 expertos– y la detección de ácidos nucleicos –opción elegida por 8 expertos– como las técnicas más ampliamente recomendadas por los especialistas consultados.
11.- Indique su grado de acuerdo con las siguientes afirmaciones: (1) La combinación de varias técnicas microbiológicas no basadas en el cultivo puede aumentar la rentabilidad diagnóstica en la candidiasis invasiva, y (2) La combinación de scores de predicción clínicos junto con el uso de técnicas microbiológicas no basadas en el cultivo puede ser una estrategia adecuada para iniciar un tratamiento precoz en la candidiasis invasiva.
Rationale: El uso, tanto en combinación como en solitario, de las distintas pruebas de diagnóstico independientes del cultivo, caso de la detección del antígeno de manano/anticuerpos antimanano, de la detección de betaglucano y, muy especialmente, la detección de ácidos nucleicos mediante PCR, puede ofrecer una ayuda significativa en el diagnóstico de la candidiasis invasiva4. Además, la combinación de estas pruebas con los métodos diagnósticos tradicionales puede resultar clave en la mejora tanto del diagnóstico como del pronóstico de la candidiasis invasiva en el paciente crítico51.
1) El 96% de los expertos consultados entiende que la combinación de varias técnicas puede aumentar la rentabilidad diagnóstica de la candidiasis invasiva. Concretamente, y en una escala de 1 a 5 puntos en la que el 5 representa el grado máximo de acuerdo, 24 expertos otorgaron 4 o 5 puntos a la afirmación. La puntuación media se estableció en 4,8 puntos. El consenso superó el 75%, por lo que fue alto.
2) El nivel de consenso es total a la hora de considerar la combinación de scores y técnicas microbiológicas no basadas en cultivos como una estrategia adecuada. Empleando una vez más la escala del 1 al 5, los 25 expertos consultados concedieron 4 o 5 puntos a la afirmación, estableciéndose la media en 4,8 puntos.
Sección Tratamiento
1.-En su opinión, ¿considera que una equinocandina debe ser el antifúngico de elección en el tratamiento de la candidasis invasiva?
Rationale: Las recomendaciones establecidas en las guías de práctica clínica de las diferentes sociedades científicas nacionales y supranacionales2,15,47 han generado una cierta controversia en torno al tratamiento de la candidasis invasiva. En este contexto, el trabajo de Andes et al.6 demuestra que el tratamiento con equinocandinas se asocia con un descenso significativo de la mortalidad por candidiasis invasiva.
El 76% de los expertos consultados –19 de los 25 especialistas– considera que la equinocandina debe ser el antifúngico de elección en el tratamiento de la candidiasis invasiva en la totalidad de los casos, con independencia de que el paciente haya recibido tratamiento previo con azoles. El nivel de consenso fue alto (>75%).
Los especialistas que respondieron que la equinocandina debe constituir el antifúngico de elección únicamente en aquellos pacientes que han recibido tratamiento previo con azoles, fueron consultados en una segunda fase del estudio sobre los motivos para justificar su respuesta. A continuación se exponen 2 de las razones aludidas por sendos especialistas: 1) «Depende de la epidemiología del centro y de las características del paciente. Si el paciente está estable y no ha recibido azoles en un hospital con prevalencia de cepas de C. albicans, no encuentro razón para entrar de lleno con las equinocandinas»; y 2) «Es evidente que la respuesta ‘considero que es necesario el tratamiento previo con azoles’, no es la correcta. Creo que hay situaciones concretas en que estaría indicado fluconazol en pacientes con candidemia documentada con sensibilidad a dicho antifúngico (en un 70-80% de las ocasiones) y con estabilidad clínica[…]».
2.-¿Hasta qué punto está usted de acuerdo con la administración de dosis de equinocandinas superiores a la estándar en el tratamiento de la endocarditis por Candida o en otros tipos de candidiasis invasiva?
Rationale: Los ensayos clínicos han demostrado la eficacia y seguridad asociadas al tratamiento con equinocandinas a dosis superiores a las estándar en el manejo de la candidiasis invasiva10,48. Así, la IDSA estableció en su guía publicada en 2009 la posibilidad de administrar dosis más elevadas de equinocandinas en el tratamiento de la endocarditis por Candida47.
Las respuestas muestran opiniones divergentes entre los expertos consultados en relación con dosis más altas de equinocandinas en el tratamiento de la endocarditis por Candida. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, únicamente 13 especialistas (52%) se mostraron «algo de acuerdo» o «totalmente de acuerdo», otorgando 4 o 5 puntos a la utilización de dosis más elevadas. La puntuación media se estableció en 3,4 puntos. Nivel de consenso medio (>50 y <75%).
La pregunta no alcanzó el mínimo consenso exigido en la metodología DELPHI, razón por la que fue seleccionada para la segunda fase del estudio, en la que los expertos que se mostraron favorables al uso de dosis más elevadas de equinocandinas en situaciones de endocarditis por Candida o en otro tipo de VCI fueron consultados sobre sus motivos. A continuación se exponen 2 de las razones aludidas por sendos especialistas: 1) «Se recoge en algunos casos clínicos y es la opinión de los expertos. Además, dicha pauta se menciona en la guía de la IDSA de 2009 cuando se refiere al tratamiento de la endocarditis»; y 2) «Dada la gravedad de la candidiasis invasiva o de la endocarditis, la optimización del tratamiento según el target pK/pD basado en la ratio AUC/MIC es prioritaria para alcanzar concentraciones óptimas en el foco de la infección. Además, estos fármacos tienen farmacocinética lineal y escasos eventos adversos».
3.-En el caso de paciente crítico en tratamiento con una equinocandina al que se aísla en hemocultivos C. parapsilosis, indíquenos, por favor, su nivel de acuerdo con cada uno de los 2 enunciados que le planteamos a continuación: 1) El tratamiento con equinocandina debe sustituirse por fluconazol independientemente de la evolución clínica del paciente; y 2) El tratamiento con fluconazol debe añadirse a la equinocandina hasta que se observe mejoría clínica.
Rationale: Las recomendaciones establecidas en las guías de práctica clínica de las diferentes sociedades científicas nacionales2,47 han generado una cierta controversia en torno al tratamiento de la candidasis invasiva por C. parasilopsis. En este contexto, si bien Pfaller et al.53 concluyeron que el fluconazol es más efectivo contra C. parapsilosis debido a mutaciones en el gen fks de Candida, el estudio de Kale-Pradhan et al.28 demostró la no inferioridad de la efectividad de las equinocandinas frente a otros antifúngicos en el tratamiento de la candidiasis invasiva causada por C. parasilopsis.
1) El 60% de los expertos consultados se muestra en desacuerdo con este cambio de tratamiento. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 15 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 2,6 puntos (grado de consenso medio). La pregunta fue seleccionada para la segunda fase del estudio DELPHI, donde el grado de divergencia resultó similar.
2) El 64% de los expertos consultados se muestra en desacuerdo con la conveniencia de la combinación de fluconazol y una equinocandina. Concretamente, y empleando la escala del 1 al 5 para valorar su grado de acuerdo, 16 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 2,3 puntos. El nivel de consenso fue medio.
4.-En caso de considerar necesaria la realización de un estudio oftalmológico en pacientes con candidemia, ¿cuándo lo llevaría a cabo?
Rationale: La bibliografía recoge un número escaso de estudios dirigidos a analizar las manifestaciones oculares durante la candidemia. En este contexto, y mientras la coriorretinitis se presenta como la afectación más frecuente (9-16%), la endoftalmitis suele aparecer en un porcentaje muy inferior de casos (1,6%)27,46. Sin embargo, y contrariamente a lo establecido en las recomendaciones de las guías de práctica clínica15,47, la necesidad de realizar un estudio oftalmológico en todos los pacientes con candidemia es contemplada en un número escaso de situaciones.
La inmensa mayoría de los expertos consultados (96%) considera que es necesario realizar un estudio oftalmológico en los pacientes con candidemia, bien en la primera semana bien entre la primera y la segunda semana. Tan solo un especialista refirió que el estudio oftalmológico no debe realizarse en el paciente consciente sin clínica. Por tanto, el nivel de consenso a este respecto fue alto.
5.-En el caso de un paciente con candidemia en tratamiento con una equinocandina que presenta una afectación ocular, ¿debería cambiarse el tratamiento a otro antifúngico?
Rationale: El ojo se presenta como un compartimento protegido, razón por la que el grado de penetración de los distintos antifúngicos sistémicos difiere de manera significativa47. De acuerdo con las evidencias alcanzadas por Ridell et al.57, ni las equinocandinas ni el posaconazol alcanzan concentraciones terapéuticas adecuadas en el vítreo. Por el contrario, el voriconazol se presenta como el antifúngico con mayor eficacia en el tratamiento de las manifestaciones oculares.
El 72% de los expertos consultados considera que, en los pacientes con candidemia y afectación ocular tratados con equinocandinas debería cambiarse el tratamiento a otro antifúngico «en todos los casos» o «en la mayoría de los casos». Por el contrario, 3 especialistas opinan que el cambio de tratamiento debe realizarse «solo en algunos casos», 3 que «no debe realizarse necesariamente», y uno que el cambio «depende de la evolución clínica». El grado de consenso fue medio.
6.-En su opinión, ¿se debe retirar el CVC en toda candidemia en el paciente crítico?
Rationale: La idoneidad de la retirada o mantenimiento del CVC en los pacientes con candidemia ha sido objeto de controversia en distintas publicaciones. Concretamente, y mientras distintos estudios no han demostrado ningún beneficio clínico asociado con la retirada del CVC44, diversos artículos refieren que su retirada conlleva una mejora estadísticamente significativa de la supervivencia6,40,60.
El consenso entre los expertos consultados sobre la necesidad de retirar el CVC en todo caso de candidemia en el paciente crítico es absoluto (100%).
7.-Según su opinión, ¿qué nivel de influencia puede tener el riesgo de hepatotoxicidad en la selección de un determinado tipo de equinocandina?
Rationale: El grado de afectación hepática (Child) puede condicionar la elección y dosificación de cada una de las equinocandinas por su distinto metabolismo y vía de eliminación. Como muestran los resultados del estudio de Wang et al.64, el 9,3% de los pacientes tratados con equinocandinas presenta una elevación de la concentración de enzimas hepáticas, situación que, sin embargo, no requiere la interrupción del tratamiento.
El 56% de los expertos consultados considera que el riesgo de hepatotoxicidad tiene «bastante influencia» o «mucha influencia» en la elección del tipo de equinocandina. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de influencia, 14 expertos otorgaron 4 o 5 puntos a la relación. La puntuación media se estableció en 2,6 puntos. El nivel de consenso alcanzado por los miembros del panel de expertos fue medio.
8.-Indique su grado de acuerdo con el siguiente enunciado: «El tratamiento con fluconazol en el paciente crítico con candidiasis invasiva no debería utilizarse de forma empírica, empleándose únicamente cuando se tenga conocimiento de la especie de Candida y su sensibilidad antifúngica en un paciente estable hemodinámicamente».
Rationale: La indicación del tratamiento con fluconazol en el paciente critico se ha visto modificada a lo largo de los últimos años2,15. Tanto C. glabrata como C. krusei son potencialmente resistentes al fluconazol24.
El 60% de los especialistas consultados se muestra de acuerdo con el enunciado. En concreto, y en una escala de 1 a 5 para valorar el grado de acuerdo, 15 expertos otorgaron 4 o 5 puntos a la afirmación. La puntuación media se estableció en 3,6 puntos. El consenso fue de nivel medio.
9.-¿Considera usted que a todo paciente con candidemia se le debería realizar un ecocardiograma transesofágico para despistaje de endocarditis?
Rationale: La posibilidad de que la candidemia cause una endocarditis infecciosa es importante desde el punto de vista del manejo clínico, precisándose más tiempo de tratamiento y considerando seriamente realizar una cirugía valvular en la mayoría de los pacientes23.
El 72% de los expertos consultados considera que el ecocardiograma transesofágico para despistaje de endocarditis a pacientes con candidemia debería realizarse únicamente en casos excepcionales. Por el contrario, 3 y 4 especialistas defienden que debe llevarse a cabo, respectivamente, «en todos los casos» y «en la mayoría de los casos». El grado de consenso fue medio.
10.-¿El tipo de antifúngico utilizado para el tratamiento de la candidiasis invasiva puede reducir la mortalidad asociada a esta enfermedad?
Rationale: Numerosas publicaciones han demostrado que la elección del antifúngico desempeña un papel fundamental en la supervivencia del paciente crítico con candidiasis invasiva. Así, el tratamiento con equinocandinas se asocia con una disminución significativa de la mortalidad6. Por su parte, la terapia previa con azoles se presenta como un factor de riesgo de mortalidad26,60.
Una amplia mayoría de los expertos consultados (92%) considera que el tipo de antifúngico utilizado para el tratamiento de la candidiasis invasiva puede reducir la mortalidad asociada a la candidiasis invasiva. Así, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 23 expertos otorgaron 4 o 5 puntos a la afirmación.
11.-La precocidad en el tratamiento de la candidiasis invasiva, ¿puede condicionar una menor mortalidad asociada a esta enfermedad?
La demora en el inicio del tratamiento de la candidiasis invasiva en el paciente crítico se asocia con un incremento de la mortalidad23,61. En este contexto, sin embargo, el estudio de Marriott et al.36 no observó una relación entre la tasa de mortalidad y el tiempo de inicio del tratamiento.
La totalidad de los expertos consultados (100%) considera que la precocidad en el tratamiento de la candidiasis invasiva puede reducir la mortalidad asociada a esta enfermedad. El grado de consenso fue alto.
Sección Desescalada terapéutica
Rationale: La sensibilidad a los antifúngicos varía entre las especies de Candida. C. albicans, C. tropicalis y C. parapsilosis son generalmente sensibles al fluconazol, mientras que C. glabrata es generalmente sensible dosis-dependiente o resistente, y C. krusei es intrínsecamente resistente70. El fluconazol es más efectivo que las candinas en el tratamiento de las infecciones por C. parapsilosis debido a mutaciones en el gen fks de Candida53.
Para el tratamiento de la candidemia en el paciente no neutropénico se recomienda el uso de fluconazol en pacientes estables y sin tratamiento previo con azoles. En el paciente hemodinámicamente inestable (APACHE II ≥15), con criterios de sepsis grave, tratado previamente con azoles o con sospecha de candidemia resistente a azoles se recomienda tratamiento empírico con una equinocandina15,47.
La valoración de la sensibilidad a los antifúngicos podría ayudar a la optimización del tratamiento antifúngico, incluyendo la desescalada a fluconazol14,58. Sin embargo, la evaluación de la sensibilidad no se realiza en todos los centros debido a varias razones, como el retraso en la obtención de los resultados y el coste de las pruebas. La identificación de la especie y la evaluación de la sensibilidad a antifúngicos requieren una media de 5 días. Por otro lado, la evaluación de la sensibilidad a los antifúngicos ha demostrado ser coste-efectiva en el contexto de la candidemia y puede ayudar a identificar a pacientes con especies de Candida resistentes que están recibiendo tratamiento inapropiado y pacientes que serían candidatos para desescalar a fluconazol58.
Basándose en recomendaciones de expertos, la guías de la IDSA sugieren que los laboratorios evalúen rutinariamente la sensibilidad al fluconazol de los aislamientos de C. glabrata y de otras especies de Candida que no respondan al tratamiento antifúngico empírico o en el caso de que exista una alta sospecha de resistencia a los azoles47.
La desescalada del tratamiento antifúngico no suele estar bien protocolizada, no se realiza regularmente y dispone de escasa evidencia científica que la avale, especialmente en el paciente crítico. Para optimizar el uso de antimicrobianos con el fin de conseguir la máxima efectividad, reducir los efectos adversos y administrar un tratamiento coste-efectivo, debemos asegurar un correcto tratamiento antifúngico inicial pero también desescalar cuando sea posible en términos de eficacia antimicótica y reducción de costes14,58.
La desescalada antifúngica debe ser guiada por los resultados microbiológicos, la sensibilidad a los antifúngicos, las medicaciones concomitantes que recibe el paciente y la evolución clínica. Difícilmente se dispone de esta información completa antes de 5 días, por lo que la decisión de desescalar, en muchas ocasiones, se realiza tardíamente.
1.-En los casos de candidiasis invasiva confirmada por C. albicans en pacientes que están recibiendo tratamiento empírico con una equinocandina se debe desescalar siempre a fluconazol independientemente del estado clínico.
Rationale: El tratamiento antifúngico debe basarse en la especie de Candida y en el estado clínico del paciente58. Así, en el paciente hemodinámicamente inestable (APACHE II ≥15) o con criterios de sepsis grave se recomienda el tratamiento empírico con una equinocandina15,47. Además, el estudio de Andes et al.6 demuestra que el tratamiento con equinocandinas se asocia con un descenso significativo de la mortalidad por candidiasis invasiva.
El 76% de los expertos consultados no considera que en los casos de candidiasis invasiva confirmada por C. albicans en pacientes que están recibiendo tratamiento empírico con una equinocandina se deba desescalar siempre a fluconazol con independencia del estado clínico. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 19 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 2 puntos. El grado de consenso alcanzado fue alto (>75%).
2.-En los casos de candidiasis invasiva confirmada por C. albicans en pacientes que están recibiendo tratamiento empírico con una equinocandina se puede desescalar independientemente de si se conoce la sensibilidad a fluconazol.
Rationale: La sensibilidad de C. albicans al fluconazol es muy elevada. En el estudio de Zuluaga et al.70, el 95,2% de los aislamientos de C. albicans fue sensible a fluconazol, sin que se observara ningún aislamiento resistente.
El 80% de los expertos consultados considera que en los casos de candidiasis invasiva confirmada por C. albicans en pacientes que están recibiendo tratamiento empírico con una equinocandina no se debe desescalar sin conocer la sensibilidad al fluconazol. Concretamente, y en la escala de 1 a 5 puntos para valorar el grado de acuerdo, 20 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 2 puntos. El grado de consenso fue alto.
3.-En el caso de una candidiasis invasiva confirmada por C. glabrata en un paciente que está recibiendo tratamiento empírico con una equinocandina se debe desescalar siempre a fluconazol independientemente del estado clínico.
Rationale: Para el tratamiento de la candidemia en el paciente no neutropénico se recomienda el uso de fluconazol si el paciente está estable y no ha recibido un tratamiento previo con azoles. En el paciente hemodinámicamente inestable (APACHE II ≥15), con criterios de sepsis grave, tratado previamente con azoles, o con sospecha de candidemia por una especie de Candida resistente a los azoles se recomienda el tratamiento empírico con una equinocandina15,47.
La inmensa mayoría de los expertos consultados (96%) considera que en el caso de una candidiasis invasiva confirmada por C. glabrata en un paciente que está recibiendo tratamiento empírico con una equinocandina no se debe desescalar a fluconazol sin tener en cuenta el estado clínico. Así, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 24 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 1,2 puntos. El grado de consenso fue alto.
4.-En el caso de una candidiasis invasiva confirmada por C. glabrata en un paciente que está recibiendo tratamiento empírico con una equinocandina se puede desescalar independientemente de si se conoce la sensibilidad al fluconazol.
Rationale: Las guías editadas por la IDSA en 2009, si bien establecen la recomendación de realizar estudios de sensibilidad antifúngica únicamente en los casos de fracaso terapéutico, también recomiendan estudiar la sensibilidad al fluconazol de los aislamientos clínicos de C. glabrata47. Como concluye el estudio de Garnacho-Montero et al.24, debe tenerse en cuenta que C. glabrata es potencialmente resistente al fluconazol. Por su parte, el trabajo de Collins et al.14 concluye que la realización de pruebas de sensibilidad in vitro al fluconazol en aquellos aislamientos de C. glabrata de pacientes con candidiasis confirmada se asocia con mejores resultados, tanto clínicos como económicos.
El 96% de los expertos consultados considera que en el caso de una candidiasis invasiva confirmada por C. glabrata en un paciente que está recibiendo tratamiento empírico con una equinocandina no se puede desescalar sin conocer la sensibilidad al fluconazol. Concretamente, y en la escala de 1 a 5 puntos para valorar el grado de acuerdo, 24 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 1,2 puntos. El grado de consenso, una vez más, fue alto.
5.-En el caso de una infección por C. krusei en un paciente que evoluciona favorablemente y que está recibiendo tratamiento empírico con una equinocandina se debe desescalar a voriconazol.
Rationale: C. krusei es intrínsecamente resistente al fluconazol22. Por su parte, el voriconazol presenta una actividad superior al fluconazol frente a C. krusei21.
El 76% de los especialistas consultados considera que, en un caso de infección por C. krusei en un paciente que evoluciona favorablemente y que está recibiendo tratamiento empírico con una equinocandina, no es adecuado desescalar a voriconazol. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 19 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 1,8 puntos. El grado de consenso fue alto.
La pregunta fue seleccionada para la segunda fase del estudio DELPHI con objeto de conocer los motivos argumentados por los expertos que consideraron adecuado desescalar a voriconazol en esta situación. A continuación se exponen 2 de las razones aludidas por sendos especialistas: 1) «Si la evolución clínica es buena, C. krusei también tiene una elevada sensibilidad al voriconazol con valores de CMI muy bajos, por lo que sería una muy buena opción»; y 2) «Se trata de una alternativa totalmente válida, aceptada en las diferentes guías. Si no hay contraindicaciones para el uso del voriconazol (y si tenemos concentraciones plasmáticas del mismo) siempre es una alternativa desescalar o pasar a la vía oral».
6.-En caso de tratamiento antifúngico por sospecha de candidiasis invasiva no demostrada, teniendo el paciente una buena evolución clínica, ¿qué medidas tomaría usted al quinto día de tratamiento?
Las respuestas muestran la enorme divergencia de opiniones entre los expertos consultados en relación con la medida a llevar a cabo en esta situación. Así, 7 especialistas (28%) optarían por suspender el tratamiento antifúngico, 6 expertos (24%) mantendrían el mismo tratamiento durante 14 días, 6 especialistas desescalarían a un azol, y 2 expertos (8%) no precisan qué medida llevarían a cabo. El grado de consenso a este respecto fue, en definitiva, bajo (<50%).
7.-En caso de tratamiento antifúngico por sospecha de candidiais invasiva no demostrada, no habiendo mejoría clínica en el paciente, ¿qué medidas tomaría usted al décimo día de tratamiento?
El 76% de los expertos consultados afirma que en un caso de tratamiento antifúngico por sospecha de candidiasis invasiva no demostrada, en el que tras 10 días no se observa mejoría clínica, suspendería el tratamiento antifúngico y reevaluaría al paciente. Asimismo, 3 especialistas aseguraron que modificarían el tratamiento como única medida, mientras que 2 lo mantendrían durante 14 días y uno añadiría otro antifúngico. El grado de consenso fue alto.
8.-En un paciente con candidemia causada por una especie de Candida sensible al fluconazol, tratado inicialmente con una equinocandina y que se encuentra estable, ¿cuándo entiende usted que se debe pasar el tratamiento a vía oral con fluconazol?
La gran mayoría de los expertos consultados (84%) considera que en los pacientes con candidemia causada por una especie sensible a fluconazol que han sido tratados inicialmente con una equinocandina y que, además, se encuentran estables, se debe cambiar el tratamiento a vía oral con fluconazol en un plazo máximo de 2 o 3 días después de la estabilización. El grado de consenso fue alto.
Si bien la pregunta alcanzó el consenso suficiente requerido por la metodología DELPHI, los 4 expertos que consideraron necesario un plazo superior a los 2-3 días después de la estabilización del paciente fueron consultados en la segunda fase por aquellos motivos que justificaban su respuesta. A continuación se exponen 2 de las razones aludidas por sendos especialistas: 1) «Primero, en el contexto del paciente crítico, en muy pocas ocasiones es posible usar la vía oral aunque el fármaco tenga una excelente absorción por vía digestiva. En segundo lugar, aunque no hay estudios que lo avalen, pienso que 2 o 3 días es un periodo muy corto. Las guías recomiendan 7 a 10 días. Personalmente, lo realizo a los 5-7 días, siempre que la evolución sea favorable, se haya retirado el CVC si es el origen y el agente etiológico sea sensible a fluconazol»; y 2) «En el fondo de la cuestión subyace la creencia de que el paciente puede tener una infección por una especie resistente al fluconazol. Las pruebas microbiológicas de sensibilidad in vitro no son exactamente equivalentes a lo que pasa in vivo. Por tanto, ligar la estabilidad del paciente y la sensibilidad microbiológica al mismo resultado no me parece coherente».
9.-En general, en aquellos pacientes críticos con candidiasis invasiva no se debe desescalar.
El 72% de los expertos consultados considera que, en general, es adecuado desescalar en casos de candidiasis invasiva en pacientes críticos. Concretamente, y en una escala de 1 a 5 puntos, en la que el 5 representa el grado máximo de acuerdo, 18 expertos otorgaron 1 o 2 puntos a la afirmación. La puntuación media se estableció en 2,1 puntos. El grado de consenso alcanzado, inferior al 76%, fue de grado medio.
Recomendaciones tras la primera faseTras conocer el resultado obtenido con la metodología DELPHI aplicada al paciente crítico no neutropénico con sospecha o confirmación de candidiasis invasiva se extraen como conclusión las 20 recomendaciones expuestas en la tabla 3, basadas en aquellas cuestiones que tuvieron un alto grado de acuerdo para, posteriormente, ser validadas en la reunión presencial con los expertos hospitalarios.
Recomendaciones de la primera fase
| Sección Epidemiología |
| 1. Puesto que la incidencia de candidiasis invasiva en pacientes ingresados en las áreas de críticos ha aumentado en las últimas décadas, considere de forma precoz esta posibilidad en los pacientes críticos con un proceso infeccioso |
| 2. Las infecciones fúngicas más frecuentes en los pacientes críticos son las causadas por el género Candida, y si bien, C. albicans continúa siendo la especie responsable de un mayor número de candidiasis, considere que las especies de Candida no- C. albicans se detectan cada vez con más frecuencia, superando en algunas series a C. albicans |
| 3. Si bien es fundamental conocer la epidemiología local, en el paciente crítico con candidiasis invasiva considere la posibilidad de especies de Candida resistentes a fluconazol en aquellos que han recibido tratamiento previo con triazoles, en los que presentan insuficiencia renal crónica y en enfermos neutropénicos |
| 4. Puesto que algunas especies de Candida, como C. tropicalis, C. krusei y C. glabrata, se han asociado a una mayor mortalidad en el paciente crítico, considere la utilización precoz de antifúngicos eficaces frente a estas especies |
| Sección Scores |
| 1. Determine el Candida score en todo paciente crítico con sospecha de candidiasis invasiva como herramienta de despistaje |
| 2. Investigue la presencia de colonización múltiple en todos los pacientes con riesgo |
| 3. Asocie la determinación de biomarcadores al Candida score |
| Sección Diagnóstico de laboratorio |
| 1. Realice hemocultivos en el momento de sospecha de candidiasis invasiva y cada 2-3 días si persiste la infección. En el caso de aislar Candida, realice hemocultivos de control hasta su negatividad |
| 2. Cultive los fluidos estériles o los tejidos y realice una observación directa al microscopio siempre que sea posible |
| 3. Ante la sospecha de candidiasis invasiva, utilice de forma rutinaria una técnica microbiológica no basada en el cultivo, si dispone de ella en su centro |
| 4. Solicite un estudio de sensibilidad antifúngica en caso de candidiasis invasiva confirmada |
| Sección Tratamiento |
| 1. Inicie el tratamiento precozmente desde el momento en que considere el diagnóstico de candidiasis invasiva, ya que la precocidad del tratamiento reduce la mortalidad |
| 2. Una equinocandina debe ser el tratamiento empírico de elección en el paciente crítico independientemente del uso previo de azoles |
| 3. Solo en situaciones muy especiales de estabilidad hemodinámica, sin administración previa de azoles y conociendo la epidemiología local, se podría considerar el tratamiento con azoles |
| 4. Se recomienda al menos un estudio oftalmológico en todo paciente con candidemia por el riesgo de coriorretinitis y endoftalmitis al ser la afectación ocular un marcador de mayor duración del tratamiento |
| 5. Si hay afectación ocular y el paciente está en tratamiento con una equinocandina, debido a su mala penetración ocular se recomienda el cambio a otro antifúngico |
| 6. Siempre que sea posible, se recomienda la retirada del catéter venoso central en un paciente con candidemia |
| Sección Desescala terapéutica |
| 1. En el paciente crítico con candidiasis invasiva confirmada por C. albicans o C. glabrata que está recibiendo tratamiento empírico con equinocandinas, considere desescalar el tratamiento a fluconazol si hay estabilidad clínica y la especie es sensible a fluconazol |
| 2. En el paciente crítico con candidiasis invasiva confirmada por un aislamiento de Candida sensible a fluconazol que está recibiendo tratamiento empírico con equinocandinas, considere desescalar el tratamiento a fluconazol 2 o 3 días después de la estabilización clínica |
| 3. En los pacientes que reciben tratamiento antifúngico por sospecha de candidiasis invasiva no demostrada, al décimo día sin mejoría clínica suspenda el tratamiento antifúngico y reevalúe al paciente |
Usando la misma metodología se reunieron de forma presencial 80 expertos hospitalarios que votaron las recomendaciones descritas en la tabla 3. Solo fueron elegidas aquellas que tuvieron un nivel de consenso superior al 75%. Las recomendaciones finales se exponen en la tabla 4.
Recomendaciones finales Épico
| Sección Epidemiología |
| 1. Puesto que la incidencia de candidiasis invasiva en pacientes ingresados en las áreas de críticos ha aumentado en las últimas décadas, considere de forma precoz esta posibilidad en los pacientes críticos con un proceso infeccioso |
| 2. Si bien es fundamental conocer la epidemiología local, en el paciente crítico con candidiasis invasiva considere la posibilidad de la existencia de especies de Candida resistentes a fluconazol en aquellos que han recibido tratamiento previo con triazoles, en los que presentan insuficiencia renal crónica y en enfermos neutropénicos |
| Sección Scores |
| 1. Investigue la presencia de colonización candidiásica múltiple y determine el Candida score en todo paciente crítico con sospecha de candidiasis invasiva como herramienta de despistaje |
| Sección Diagnóstico de laboratorio |
| 1. Realice hemocultivos en el momento de sospecha de candidiasis invasiva y cada 2-3 días si persiste la infección. En el caso de aislar Candida, realice hemocultivos de control hasta su negatividad |
| 2. Cultive los fluidos estériles o los tejidos y realice una observación directa al microscopio siempre que sea posible |
| 3. Ante la sospecha de candidiasis invasiva, utilice de forma rutinaria una técnica microbiológica no basada en el cultivo, si dispone de ella en su centro |
| 4. Solicite un estudio de sensibilidad antifúngica en caso de candidiasis invasiva confirmada |
| Sección Tratamiento |
| 1. Inicie el tratamiento precozmente desde el momento en que considere el diagnóstico de candidiasis invasiva |
| 2. Una equinocandina debe ser el tratamiento empírico de elección en el paciente crítico e inestable |
| 3. Se recomienda al menos un estudio oftalmológico en todo paciente con candidemia. Si existe afectación ocular, debe tenerse en cuenta la mala penetración de las equinocandinas |
| 4. Siempre que sea posible, se recomienda la retirada del catéter venoso central en un paciente con candidemia |
| Sección Desescalada terapéutica |
| 1. En el paciente crítico con candidiasis invasiva confirmada por un aislamiento de Candida sensible al fluconazol que está recibiendo tratamiento empírico con una equinocandina, considere desescalar a fluconazol tras 2 o 3 días de estabilidad clínica |
El manejo de los enfermos con sospecha o confirmación de candidiasis invasiva requiere un gran conocimiento de esta infección. El desarrollo de recomendaciones basado en la metodología DELPHI resume, con objeto educacional, dicho conocimiento y puede ayudar a reconocer de una forma precoz a potenciales pacientes, estandarizar su manejo y mejorar su pronóstico
Conflicto de interesesEl estudio para la elaboración de este consenso ha sido patrocinado por Laboratorios MSD España.
A Carmen Romero y Ainhoa Torres (Entheos Grupo editorial) por su gran dedicación y profesionalidad.
LISTA DE COORDINADORES, EXPERTOS PORTAVOCES Y MÉDICOS ASISTENCIALES
COORDINADORES
Rafael Zaragoza Crespo
Servicio de Medicina Intensiva, Hospital Universitario Dr. Peset. Valencia
Pedro Llinares Mondéjar
Unidad de Enfermedades Infecciosas, Complejo Hospitalario Universitario A Coruña
Emilio Maseda Garrido
Servicio de Anestesiología, Hospital Universitario La Paz. Madrid.
Ricard Ferrer Roca
Servicio de Medicina Intensiva, Hospital Universitario Mútua de Terrassa. Barcelona.
Alejandro H. Rodríguez Oviedo
Servicio de Medicina Intensiva, Hospital Universitario Juan XXIII. Tarragona
EXPERTOS
Benito Almirante Gragera
Enfermedades Infecciosas, Hospital Universitari Vall d’Hebron. Barcelona
Rafael González de Castro
Servicio de Anestesiología, Hospital Universitario de León. León.
Miguel Salavert Lletí
Enfermedades Infecciosas, Hospital Universitario y Politécnico La Fe. Valencia
José María Aguado García
Enfermedades Infecciosas, Hospital Universitario 12 de Octubre: Madrid
María Izascun Azcárate Egaña
Medicina Intensiva, Hospital Universitario de Donostia. Guipúzcoa
Jesús Rico Feijoo
Servicio de Anestesiología y Reanimación, Hospital Universitario Río Hortega. Valladolid
Cristóbal León Gil
Medicina Intensiva, Hospital Universitario de Valme. Sevilla.
Gerardo Aguilar Aguilar
Servicio de Anestesiología y Reanimación, Hospital Clínico Universitario de Valencia
José Ignacio Gómez Herreras
Anestesiología y Reanimación, Hospital Clínico Universitario de Valladolid
Juan Carlos del Pozo Laderas
Medicina Intensiva, Hospital Universitario Reina Sofia. Córdoba
José Garnacho Montero
Medicina Intensiva, Hospital Virgen del Rocio. Sevilla
Beatriz Galván Guijo
Medicina Intensiva, Hospital Universitario La Paz. Madrid
Javier Pemán García
Microbiología, Hospital Universitario La Fe. Valencia
Guillermo Quindós Andrés
Inmunología, Microbiología y Parasitología, Facultad de Medicina y Odontología, Universidad del País Vasco
Manuel Cuenca Estrella
Microbiología, Centro Nacional de Microbiología, Instituto de Salud Carlos III. Madrid.
Maria Luisa Pérez del Molino Bernal
Microbiología y Parasatología, Complejo Hospitalario Universitario de Santiago de Compostela
Patricia Muñoz García
Microbiología y Enfermedades Infecciosas, Hospital Universitario Gregorio Marañón. Madrid
Francisco Álvarez Lerma
Medicina Intensiva, Hospital Universitari del Mar. Barcelona
Carmen Fariñas Álvarez
Unidad de Enfermedades Infecciosas, Hospital Universitario Marqués de Valdecilla. Santander
Jesús Fortún Abete
Enfermedades Infecciosas, Hospital Ramón y Cajal. Madrid.
Rafael León López
Medicina Intensiva, Hospital Universitario Reina Sofía. Córdoba
César Aragón González
Medicina Intensiva, Hospital Carlos Haya. Málaga
Juan Carlos Valía Vera
Servicio de Anestesiología y Reanimación, Consorcio Hospital General Universitario de Valencia
Marcio Borges Sa
Medicina Intensiva, Hospital Son Llàtzer. Palma de Mallorca
Mercedes Bouzada
Servicio de Anestesiología de Reanimación y Tratamiento del Dolor. Hospital Clínico Universitario de Santiago de Compostela
MÉDICOS ASISTENCIALES
Luis Suárez Gonzalo
Unidad de Reanimación y Cirugía Cardiotorácica, Hospital La Paz. Madrid
Cruz Soriano Cuesta
Medicina Intensiva, Hospital La Paz. Madrid
Esther López Ramos
Unidad de Cuidados Intensivos, Hospital Universitario Príncipe de Asturias. Madrid.
Fernando Arméstar Rodríguez
Medicina Intensiva, Hospital Germans Trias i Pujol de Badalona. Barcelona
Eva Benveniste Pérez
Medicina Intensiva, Hospital Germans Trias i Pujol de Badalona. Barcelona
Francisco Javier González de Molina Ortíz
Medicina Intensiva, Hospital Universitario Mútua Terrassa. Barcelona
Jordi Vallés Daunis
Medicina Intensiva, Hospital Parc Taulí. Barcelona
Susana Sancho Chinesta
Unidad de Cuidados Intensivos, Hospital Universitario Dr. Peset. Valencia
Roberto Reig Valero
Medicina Intensiva, Hospital General de Castelló. Castellón
Francisco López Medrano
Unidad de Enfermedades Infecciosas, Hospital Universitario 12 de Octubre. Madrid
Miguel Angel Alcalá Llorente
Medicina Intensiva, Hospital Universitario Fundación Jimenez Díaz. Madrid
María José Pérez-Pedrero Sánchez
Medicina Intensiva, Hospital Virgen de la Salud. Toledo
Mercedes Catalán González
Medicina Intensiva, Hospital Universitario 12 de Octubre. Madrid.
Paula Vera Artazcoz
Medicina Intensiva, Hospital de la Santa Creu i Sant Pau. Barcelona
Montserrat Vallverdú Vidal
Medicina Intensiva, Hospital Universitario Arnau de Vilanova Lleida
Alejandra García Roche
Medicina Intensiva, Hospital Universitari Vall d’Hebron. Barcelona
Manuel Jesús Rodríguez Carvajal
Unidad de Cuidados Intensivos, Hospital Juan Ramón Jimenez. Huelva
Angel Caballero Sáez
Medicina Intensiva, Hospital San Pedro. Logroño
Emilio Díaz Santos
Medicina Intensiva, Hospital de Sant Joan Despí Moisès Broggi. Barcelona
Teresa Tabuyo Bello
Unidad de Cuidados Intensivos, Complejo Hospitalario Universitario A Coruña
Juan Ramón Fernández Villanueva
Medicina Intensiva, Hospital Clínico Univertisario de Santiago de Compostela
María Teresa Rey Rilo
Anestesiología, Hospital Universitario Fundación Jiménez Díaz-Capio. Madrid
Vicente Torres Pedrós
Anestesiología, Hospital Universitario Son Espases. Palma de Mallorca
María Aranda Pérez
Unidad de Cuidados Intensivos, Hospital Son Llàtzer. Palma de Mallorca
Ángel Arenzana Seisdedos
Unidad de Cuidados Intensivos, Hospital Virgen Macarena. Sevilla
Rafael García Hernández
Servicio de Anestesiología, Hospital Universitario. Puerta del Mar. Cádiz
Antonio Ayelo Navarro
Servicio de Anestesiología, Hospital General Almansa. Albacete
José Luis Antón Pascual
Medicina Intensiva, Hospital San Juan de Alicante
Carlos Castillo Arenal
Unidad de Cuidados Intensivos, Hospital de Txagorritxu. Álava
Nuria Gonzalez Jorrín
Unidad de Reanimación, Hospital Donostia. Guipúzcoa
Francisco Esteve Urbano
Medicina Intensiva, Hospital Universitario de Bellvitge. Barcelona
Francisco Álvarez Lerma
Medicina Intensiva, Hospital Universitari del Mar. Barcelona
Gonzalo Tamayo Medel
Unidad de Reanimación, Hospital Universitario Cruces. Vizcaya
Unai Bengoetxea Uriarte
Unidad de Reanimación, Hospital Universitario Basurto, Vizcaya
Juan Carlos Pardo Talavera
Unidad de Cuidados Intensivos, Hospital Morales Meseguer. Murcia
Roberto Jiménez Sánchez
Medicina Intensiva, Hospital General Universitario Santa Lucía. Murcia
Guillermo Quindós Andrés
Inmunología, Microbiología y Parasitología, Facultad de Medicina y Odontología, Universidad del País Vasco
Violeta Fernández García
Servicio de Anestesiología y Reanimación, Hospital Universitario Central de Asturias. Oviedo
Pedro Picatto Hernández
Servicio de Anestesiología y Reanimación, Hospital Universitario Central de Asturias. Oviedo
Armando Blanco Vicente
Medicina Intensiva, Hospital Universitario Central de Asturias. Oviedo
José Castaño Pérez
Unidad de Cuidados Intensivos, Hospital Virgen de las Nieves. Granada
María Victoria de la Torre Prados
Unidad de Cuidados Intensivos, Hospital Virgen de la Victoria. Málaga
José Manuel Soto
Medicina Intensiva, Hospital Clínico Universitario San Cecilio. Granada
César Aragón González
Medicina Intensiva, Hospital Regional Sas Carlos Haya. Málaga
Ana Loza Vázquez
Medicina Intensiva, Hospital Universitario de Valme. Sevilla
Fernando Maroto Monserrat
Medicina Intensiva, Hospital San Juan de Dios. Sevilla
José Garnacho Montero
Unidad de Cuidados Intensivos, Hospital Virgen del Rocío. Sevilla
Estrella Terradillos Martín
Servicio de Anestesiología y Reanimación, Hospital Gregorio Marañón. Madrid
José Peral Gutiérrez de Ceballos
Medicina Intensiva, UCI, Hospital General Universitario Gregorio Marañón. Madrid
Luis Quecedo Gutiérrez
Servicio de Anestesiología, Hospital de la Princesa. Madrid
Javier García Cortés
Servicio de Anestesiología y Reanimación, Hospital Universitario de Gran Canaria Dr. Negrín. Las Palmas de Gran Canaria
Catalina Sánchez Ramírez
Medicina Intensiva, Hospital Universitario de Gran Canaria Dr. Negrín. Las Palamas de Gran Canaria
Marta Gurpegui Puente
Medicina Intensiva, UCI Polivalente, Hospital Universitario Miguel Servet. Zaragoza
Pilar Luque Gómez
Medicina Intensiva y Unidad de Cuidados Intensivos, Hospital Clínico Universitario “Lozano Blesa” de Zaragoza
María Reyes Iranzo Valero
Servicio de Anestesiología, Hospital Universitario Puerta de Hierro. Madrid
Isidro Prieto del Portillo
Medicina Intensiva, Hospital Ramón y Cajal. Madrid
Luis Gajate Martín
Servicio de Anestesiología y Reanimación, Hospital Ramón y Cajal. Madrid
Manuel Cervera Montes
Medicina Intensiva, Hospital Arnau de Vilanova. Valencia
María Ángeles Ballesteros Sanz
Medicina Intensiva, Hospital Universitario Marqués de Valdecilla. Santander
María del Valle Ortiz
Unidad de Cuidados Intensivos, Hospital Universitario de Burgos
Eduardo Tamayo Gómez
Servicio de Anestesiología y Reanimación, Hospital Clínico de Valladolid
Felipe Bobillo de Lamo
Unidad de Cuidados Intensivos, Hospital Clínico de Valladolid
María Clara García Bernardo
Servicio de Anestesiología y Reanimación, Hospital del Río Ortega. Valladolid
Miguel Angel Pereira Loureiro
Servicio de Anestesiología y Reanimación y UCI, Complejo Hospitalario Universitario de Vigo
María Milagros Cid Manzano
Servicio de Anestesiología, Complexo Hospitalario Universitario de Ourense
María Elena Vilas Otero
Servicio de Anestesiología y Reanimación, Complejo Hospitalario Universitario de Vigo
Jorge Ángel Pereira Tamayo
Servicio de Anestesiología y Reanimación, Complejo Hospitalario Universitario de Vigo
Marina Varela Durán
Servicio de Anestesiología y Reanimación, Complejo Hospitalario Universitario de Pontevedra
José Ricardo Gimeno Costa
Medicina Intensiva, Hospital Universitai i Politecnic La Fe. Valencia
Ignacio Moreno Puigdollers
Servicio de Anestesiología y Reanimación, Hospital Universitari i Politecnic La Fe. Valencia
María Teresa Recio Gómez
Unidad de Cuidados Intensivos, Complejo Hospitalario San Pedro de Alcántara. Cáceres
Juan Francisco Machado Casas
Medicina Intensiva, Complejo Hospitalario de Jaén
Rafael Léon López
Medicina Intensiva, Hospital Universitario Reina Sofía. Córdoba
Silverio Salvador Antoni
Servicio de Anestesiología y Reanimación, Hospital General Universitario de Alicante
Carolina Giménez Esparza
Unidad de Cuidados Intensivos, Hospital Vega Baja de Orihuela. Alicante
Joaquín Lobo Palanco
Medicina Intensiva, Complejo Hospitalario de Navarra
Rocío Armero Ibáñez
Servicio de Anestesiología y Reanimación, Hospital Universitario Dr. Peset. Valencia
En el Anexo 1 se incluye la lista de todos los miembros del grupo.
Cómo citar este artículo: Zaragoza R, et al. Épico project. Development of educational recommendations using the DELPHI technique on invasive candidiasis in non-neutropenic critically ill adult patients. Rev Iberoam Micol. 2013;30:135–49.