La candidemia es una de las micosis oportunistas más frecuentes en todo el mundo. El escaso número de estudios epidemiológicos llevados a cabo en América Latina indica que las tasas de incidencia en esta región son mayores que las descritas en el hemisferio norte. A menudo el diagnóstico de la infección se establece tardíamente, lo que afecta el inicio del tratamiento antimicótico. Por esta razón, para el diagnóstico y el manejo de la candidemia está justificada una estrategia más científica, basada en parámetros específicos.
Recomendaciones para el diagnóstico y manejo de la candidemia constituye una serie de artículos preparados por miembros del grupo Latin America Invasive Mycosis Network. Su objetivo es proporcionar las mejores evidencias disponibles para el diagnóstico y el manejo de la candidemia.
El presente artículo, Recomendaciones para el manejo de la candidemia en neonatos en América Latina, ha sido redactado con el objetivo de orientar a los profesionales de la salud en el manejo de los neonatos que padecen, o pueden padecer, candidemia.
Mediante la base de datos PubMed se emprendió una búsqueda informatizada de los estudios publicados. Los miembros del grupo revisaron y analizaron exhaustivamente los datos. El grupo también se reunió en dos ocasiones para proponer preguntas, abordar los puntos de vista conflictivos y deliberar sobre las recomendaciones terapéuticas.
Recomendaciones para el manejo de la candidemia en neonatos en América Latina incluye aspectos sobre profilaxis, terapia empírica, tratamiento de la candidemia demostrada, evaluación y seguimiento del paciente después del diagnóstico de candidemia, manejo de los recién nacidos con infección por Candida del catéter venoso central y manejo de otras complicaciones.
Este manuscrito es el cuarto de los artículos de esta serie dedicada al diagnóstico y tratamiento de las candidiasis invasoras. Otras publicaciones de esta serie son Recomendaciones para el diagnóstico de la candidemia en América Latina, Recomendaciones para el manejo de la candidemia en adultos en América Latina, y Recomendaciones para el manejo de la candidemia en niños en América Latina.
Este artículo está publicado en inglés en este mismo número. Puede encontrarlo enhttp://dx.doi.org/10.1016/j.riam.2013.05.012
Candidemia is one of the most frequent opportunistic mycoses worldwide. Limited epidemiological studies in Latin America indicate that incidence rates are higher in this region than in the Northern Hemisphere. Diagnosis is often made late in the infection, affecting the initiation of antifungal therapy. A more scientific approach, based on specific parameters, for diagnosis and management of candidemia in Latin America is warranted.
‘Recommendations for the diagnosis and management of candidemia’ are a series of manuscripts that have been developed by members of the Latin America Invasive Mycosis Network. They aim to provide a set of best-evidence recommendations for the diagnosis and management of candidemia.
This publication, ‘Recommendations for the management of candidemia in neonates in Latin America’, was written to provide guidance to healthcare professionals on the management of neonates who have, or who are at risk of, candidemia.
Computerized searches of existing literature were performed by PubMed. The data were extensively reviewed and analyzed by members of the group. The group also met on two occasions to pose questions, discuss conflicting views, and deliberate on a series of management recommendations.
‘Recommendations for the management of candidemia in neonates in Latin America’ includes prophylaxis, empirical therapy, therapy for proven candidemia, patient work-up following diagnosis of candidemia, central venous catheter management, and management of complications.
This manuscript is the fourth of this series that deals with diagnosis and treatment of invasive candidiasis. Other publications in this series include: ‘Recommendations for the diagnosis of candidemia in Latin America’, ‘Recommendations for the management of candidemia in adults in Latin America’, and ‘Recommendations for the management of candidemia in children in Latin America’.
This article is also published in English in this issue. It can be found inhttp://dx.doi.org/10.1016/j.riam.2013.05.012
Existe escasa información sobre la epidemiología de la candidemia en la población pediátrica. Un estudio retrospectivo sobre la incidencia de la candidemia en EE. UU. publicado en el año 2000 reportó 43 casos pediátricos (<18 años de edad) por cada 100.000 ingresos hospitalarios103. La mortalidad asociada a la candidemia en niños es generalmente inferior a la de los adultos, oscilando entre 13 y 23%31,102,103.
La candidemia es la tercera causa más común de sepsis de inicio tardío en neonatos de pretérmino57,91. Los resultados de una encuesta mundial (1997-2000) sobre aislamientos de Candida, que incluyó hospitales de EE. UU., Canadá, América Latina y Europa, mostraron que Candida albicans era la causa más común de infección en todos los grupos de edad investigados (≤1, 2-15, 16-64 y ≥65 años), con tasas de infección bastante uniformes en todas las edades73. En los lactantes y en el resto de los pacientes pediátricos (niños≤1 año y de 2-15 años de edad), las especies aisladas más predominantes fueron C. albicans y Candida parapsilosis; muy pocas infecciones se debieron a Candida krusei o Candida glabrata (3%). Se ha descrito una mayor mortalidad en neonatos con infecciones causadas por C. albicans en comparación con las causadas por otras especies de Candida16,27,91: 43% en las candidemias causadas por C. albicans comparado con 20% en las causadas por C. parapsilosis y 0% de las causadas por Candida tropicalis16. En las candidiasis invasoras la mortalidad es del 24% en las causadas por C. albicans, y del 0% en las causadas por C. parapsilosis27, y en las ocasiones de sepsis la mortalidad en los casos provocados por C. albicans es del 44%, claramente superior al 16% de mortalidad en el caso de C. parapsilosis91.
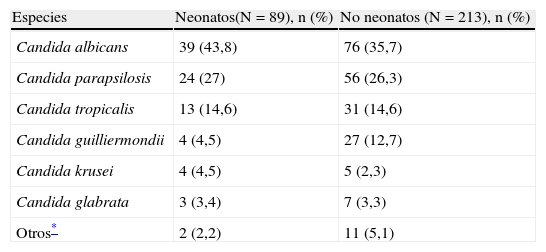
Datos de América LatinaLa información epidemiológica sobre candidemia en niños en América Latina es limitada70,76,79. En un estudio prospectivo de vigilancia en niños y adultos de 23 hospitales de 8 países de América Latina (Argentina, Brasil, Chile, Colombia, Ecuador, Honduras, México y Venezuela) llevado a cabo entre noviembre de 2008 y octubre de 2010, 302 de los 752 aislamientos clínicos (40%) se obtuvieron de pacientes menores de 18 años de edad, con una incidencia promedio de 0,98 casos por 1.000 ingresos hospitalarios. De estos 302 episodios de candidemia, 89 (29%) se produjeron en neonatos (≤28 días), con una mediana de edad a la presentación de la candidemia de 16 días (rango: 1 a 28 días). En los otros 213 niños (no neonatos), la mediana de edad a la presentación de la candidemia fue de 2 años (rango, 0,2 a 18 años). Las principales especies aisladas en neonatos y niños fueron C. albicans (44 y 36%, respectivamente), C. parapsilosis (27 y 26%), Candida tropicalis (15 y 15%), y Candida guilliermondii (5 y 13%) (tabla 1)85. La mortalidad global fue del 31% en la población pediátrica: 41% en neonatos, 26% en niños de un mes a un año, 24% en niños de 1 a 12 años, y 35% en pacientes de 13 a 18 años de edad (p=0,049 neonatos frente a no neonatos)85.
Distribución de las especies en 302 episodios de candidemia en niños de 23 hospitales de 8 países de América Latina
| Especies | Neonatos(N=89), n (%) | No neonatos (N=213), n (%) |
| Candida albicans | 39 (43,8) | 76 (35,7) |
| Candida parapsilosis | 24 (27) | 56 (26,3) |
| Candida tropicalis | 13 (14,6) | 31 (14,6) |
| Candida guilliermondii | 4 (4,5) | 27 (12,7) |
| Candida krusei | 4 (4,5) | 5 (2,3) |
| Candida glabrata | 3 (3,4) | 7 (3,3) |
| Otros* | 2 (2,2) | 11 (5,1) |
Fuente: Santolaya et al.85.
Para caracterizar mejor la candidemia en neonatos y niños se necesitan una serie de datos adicionales. Estos datos incluyen características demográficas, presentación clínica, factores de riesgo, tratamiento, mortalidad, aspectos microbiológicos, sensibilidad a los antifúngicos de las especies aisladas, tipo de población afectada (niños neutropénicos frente a no neutropénicos, pacientes de unidad de cuidados intensivos [UCI] y pacientes no-UCI), distribución de las especies aisladas, epidemiología de los aislamientos resistentes, efectos de la profilaxis sobre la resistencia6, mortalidad, resultados a largo plazo (particularmente consecuencias sobre el neurodesarrollo)22, y características de la infección temprana frente a la infección de inicio tardío6. Se requieren, asimismo, amplios estudios aleatorizados y controlados para evaluar la eficacia de los diferentes tratamientos6.
Un mayor conocimiento de la candidemia en neonatos y niños ayudará a definir las mejores prácticas para el manejo de los pacientes. En la actualidad, no hay guías de tratamiento por separado para niños y neonatos con candidemia, y no existe ninguna guía de tratamiento de consenso en América Latina. Las siguientes guías brindan recomendaciones para el tratamiento de la candidemia en neonatos en América Latina, y se basan en evidencias de la práctica clínica actual, la situación regional respecto a la candidemia en pacientes pediátricos, y la opinión experta de los autores.
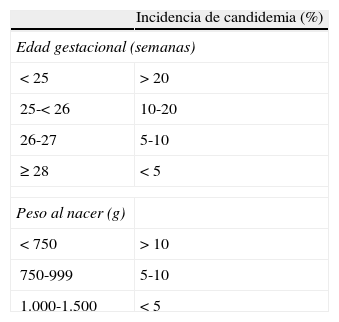
Características clínicas particulares que influyen en el manejo de la candidemia en neonatosFactores de riesgo para la infección por CandidaLas características clínicas de los neonatos que nacen de forma prematura y con bajo peso (particularmente con extremo bajo peso [EBPN], de menos de 1.000g y por debajo de las 28 semanas de gestación), incrementan su susceptibilidad a infectarse por Candida7 (tabla 2). Los neonatos prematuros nacen con un sistema inmune inmaduro, por lo que carecen de funciones inmunológicas básicas como quimiotaxis, producción de citoquinas, producción de anticuerpos y fagocitosis61. Los recién nacidos prematuros a menudo necesitan intervenciones médicas agresivas, y como resultado de ello pueden tener varios factores de riesgo para candidemia, como uso de nutrición parenteral total (NPT), catéter venoso central (CVC), ventilación mecánica, antibióticos de amplio espectro, bloqueadores H2, corticoides, estancia prolongada en UCI neonatal y cirugía abdominal o torácica16,24,72,84.
Incidencia de candidemia en neonatos según edad gestacional y peso al nacer
| Incidencia de candidemia (%) | |
| Edad gestacional (semanas) | |
| <25 | >20 |
| 25-<26 | 10-20 |
| 26-27 | 5-10 |
| ≥28 | <5 |
| Peso al nacer (g) | |
| <750 | >10 |
| 750-999 | 5-10 |
| 1.000-1.500 | <5 |
Adaptada de Kaufman43.
Los neonatos frecuentemente tienen candidemia persistente, es decir, hemocultivos positivos durante más de 72h en un paciente que está recibiendo una terapia efectiva. Los recién nacidos con candidemia pueden desarrollar complicaciones serias que se deben a la diseminación de la infección al sistema nervioso central (SNC), corazón, ojos, riñones, bazo e hígado. Los pacientes con complicaciones del SNC pueden experimentar deterioro del neurodesarrollo, que puede mantenerse después de la resolución de la infección por Candida. En un estudio, el 73% de los neonatos con EBPN que padecían candidemia fallecieron o mostraron signos de deterioro del neurodesarrollo en los siguientes 18-22 meses16. En comparación con neonatos no infectados con Candida, los que presentaron candidiasis tuvieron mayores probabilidades de tener parálisis cerebral de moderada a grave y defectos de visión y audición16.
Los factores de riesgo para infección porCandidaen neonatos incluyen:
- 1.
Edad gestacional<28 semanas.
- 2.
Peso al nacer<1.000g.
- 3.
NPT.
- 4.
CVC.
- 5.
Ventilación mecánica.
- 6.
Antibióticos de amplio espectro.
- 7.
Bloqueadores H2.
- 8.
Corticoides.
- 9.
Estancia prolongada en UCI neonatal.
- 10.
Cirugía abdominal o torácica.
En neonatos con candidiasis invasora:
- 1.
La candidemia persistente puede ser frecuente.
- 2.
Existe la posibilidad de hemocultivos negativos.
- 3.
La infección puede diseminarse a SNC, corazón, ojos, riñones, bazo e hígado, causando complicaciones serias.
El elevado riesgo de candidemia en neonatos es un fundamento sólido para la profilaxis en este grupo de pacientes. La candidemia tiene una elevada prevalencia en neonatos con EBPN internados en UCI44,50. Hasta el 60% de los neonatos con bajo peso de nacimiento pueden estar colonizados por Candida en su primer mes de vida, y hasta el 20% pueden desarrollar una infección fúngica invasora44. Debido a las características clínicas inespecíficas de la enfermedad y a la baja sensibilidad de las pruebas diagnósticas, la candidiasis invasora puede ser difícil de diagnosticar en neonatos, lo que lleva a un reconocimiento tardío de la infección60.
La elevada incidencia de complicaciones asociada a la infección por Candida en neonatos, incluyendo el deterioro del neurodesarrollo al que son proclives, apoya el uso de la profilaxis53,68. En el momento del egreso hospitalario, los neonatos con EBPN infectados con Candida presentan mayores tasas de neumopatías crónicas, leucomalacia periventricular y retinopatía severa que los neonatos con EBPN no infectados por este agente33.
Relación riesgo-beneficio de la profilaxis en neonatosLos potenciales beneficios de la profilaxis contra Candida deben ser ponderados frente a los riesgos, considerando la eficacia de la profilaxis, la incidencia de candidiasis, la mortalidad asociada, la seguridad a corto y largo plazo, el potencial desarrollo de patógenos resistentes y las posibles alternativas (tabla 3).
Eficacia de la profilaxis de infección por Candida en neonatos
| Estudio | Métodos | Intervención | Resultados | Conclusión |
| Kaufman et al.44 | ECA prospectivo, doble ciego, un sitio, 100 neonatos EBPN. Vigilancia semanal con cultivos | FLU IV vs. placebo, 3mg/kg/día durante 6 semanas. Semanas 1-2: c/3 días. Semanas 3-4: días alternos. Semanas 5-6: diario | Colonización fúngica: FLU 22%, placebo 60% (RD: 0,38; IC 95%: 0,18-0,56; p=0,002). IFI: FLU 0%, placebo 20% (RD: 0,20; IC 95%: 0,04-0,36; p=0,008) | FLU como profiláctico es efectivo para prevenir colonización fúngica e IFI en EBPN |
| Manzoni et al.60 | ECA multicéntrico, prospectivo, doble ciego. MBPN. Vigilancia semanal y pruebas de sensibilidad | FLU IV vs. placebo desde el nacimiento hasta el día 30 (o 45 en EBPN). Dosificación: 6mg/kg o 3mg/kg vs. placebo (aleatorización 1:1:1) | Colonización: FLU 6mg, 9,8%; FLU 3mg, 7,7%; placebo, 29,2%; p<0,001. IFI: FLU 6mg, 2,7%; FLU 3mg, 3,8%, placebo 13,2%; (p=0,005) | FLU reduce incidencia de colonización e IFI en MBPN |
| Kicklighter et al.50 | ECA prospectivo, ITT. MBPN. Cultivos rectales días 0, 7, 14 y 28. Toxicidad de FLU: niveles de AST y ALT. Pruebas de sensibilidad | FLU IV u oral vs. placebo. Dosificación: 6mg/kg desde nacimiento hasta día 28. Día 1-7: c/72h. Día 8-28: c/24h | Colonización rectal: FLU, 15%, placebo, 46% (p=0,0005). Sin diferencia en frecuencia de sepsis por Candida. Niveles ALT: FLU 18,1UI/l; placebo 15UI/l (p=0,008). Especie más común: C. albicans | FLU disminuye la colonización, sin efecto en sepsis por Candida. Se requieren mayores estudios para determinar el efecto en la sensibilidad |
| Kaufman et al.45 | ECA prospectivo, doble ciego. EBPN con CVC y/o tubo endotraqueal. Vigilancia semanal con cultivos | FLU: 3mg/kg/día durante 6semanas. Esquema A: cada 72-48 y 24h. Esquema B: 2 veces/semana | Colonización: Grupo A 12%; Grupo B 10% (p=NS). Sepsis por Candida: Grupo A 5%; Grupo B 3%. RD: −0,02 (IC 95%: −0,14–0,10; p=0,68). Todos los aislamientos sensibles a fluconazol | Dos veces/semana, similar a otros esquemas. Dosificación menos frecuente puede demorar o prevenir la resistencia a los antifúngicos |
| Arrieta et al.5 | ECA prospectivo, abierto, MBPN. Vigilancia semanal con cultivos. Pruebas de función renal y hepática. Mortalidad | L-AmB 5mg/kg, una vez/semana vs. placebo desde primera semana de vida y durante 6semanas o hasta disminución de factores de riesgo | Colonización en el grupo L-AmB mayor antes de administración del fármaco de estudio. Grupo L-AmB: 20%, grupo placebo: 5%. Colonización reducida en grupo L-AmB durante el período de estudio: 5 vs. 15%. Candidiasis: Grupo L-AmB 0 casos, placebo un caso. Seguridad y mortalidad sin diferencias entre ambos grupos | L-AmB una vez/semana bien tolerada en MBPN. No se evaluó la eficacia (los datos no lo permiten) |
| Aydemir et al.8 | ECA prospectivo, 278 MBPN. Vigilancia semanal. Cultivos y pruebas de sensibilidad | Nistatina (1ml, 100.000U/ml/8h) o FLU (3mg/kg c/3 días) o placebo desde nacimiento hasta día 30 (MBPN) o día 45 (EBPN) | Colonización: nistatina 11,7%, FLU 10,8%, placebo 42,9% (p<0,001). IFI: nistatina 4,3%, FLU 3,2%, placebo 16,5% (p<0,001) | Nistatina y FLU reducen colonización e IFI en MBPN. Nistatina, alternativa efectiva y bien tolerada |
| Romeo et al.82 | Estudio prospectivo, 249 neonatos pretérmino. Probióticos en colonización GI y sepsis de inicio tardío por Candida. Evaluación neurológica a un año | Tres grupos: Lactobacillus reuteri (5 gotas/día=1×108UFC); Lactobacillus rhamnosus (1 cápsula/día=6×109UFC); sin intervención (aleatorización 1:1:1) | Colonización menor de las heces en grupo con probióticos vs. control (p<0,01). Sepsis por Candida: probióticos vs. control (p=NS). Evaluación neurológica al año: menor frecuencia anomalías neurológicas en grupo probióticos vs. control (p<0,05) | El uso de probióticos es efectivo para la prevención de la colonización GI por Candida y la sepsis de inicio tardío, y reduce los resultados neurológicos anormales |
| Manzoni et al.59 | Análisis secundario de datos de ECA multicéntrico. LFB oral en 472 MBPN | Grupo A1: LFB 100 mg/día; Grupo A2: LFB+L. rhamnosus GG (106UFC/día). Grupo B: placebo. Período estudio: 6 semanas | Colonización: A1 17,6%; A2 16,6%; B 18,5% (p=0,89). IFI: grupos A1 y A2 (0,7-2,0%), grupo B (7,7%; p=0,002). No hubo muertes atribuibles a IFI en grupos A1 y A2, vs. 2 muertes en grupo placebo | Lactoferrina reduce la incidencia de IFI en MBPN pretérmino |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CVC: catéter venoso central; EBPN: neonatos con extremado bajo peso (<1.000g); ECA: estudio controlado y aleatorizado; FLU: fluconazol; GI: gastrointestinal; IC: intervalo de confianza; IFI: infección fúngica invasiva; ITT: intención de tratar; IV: intravenoso; L-AmB: anfotericina B liposomal; LFB: lactoferrina bovina; MBPN: neonatos con muy bajo peso al nacer (<1.500g); MIC: concentración inhibitoria mínima; NS: no significativo; PBO: placebo; RD: diferencia de riesgo; UFC: unidades formadoras de colonias; UI/l: unidades internacionales por litro.
La profilaxis en neonatos tiene un perfil de relación riesgo-beneficio favorable cuando se considera la elevada mortalidad asociada a la infección por Candida en esta población. Sin embargo, los datos de mortalidad son limitados, ya que los estudios multicéntricos a menudo informan solamente de la mortalidad global (todas las causas) asociada con las infecciones fúngicas, más que de la mortalidad específica y directamente atribuida a la candidemia. En neonatos con muy bajo peso de nacimiento (MBPN, <1500g) con sepsis fúngica, la tasa de mortalidad en estudios multicéntricos fue de 28% (OR de candidemia versus otros microorganismos, 1,67: p<0,05) comparada con 7% en neonatos con MBPN sin infección90. La mortalidad global es más elevada en los neonatos con EBPN, y oscila entre 37 y 40%33,44,46. El número de fallecimientos atribuibles de forma directa a las infecciones fúngicas es probablemente menor que la mortalidad global descrita en muchos estudios. El análisis de un único centro con tamaño muestral más pequeño ha reportado una mortalidad menor atribuible de forma directa a la sepsis fúngica46.
Los beneficios de la profilaxis deben ser ponderados también frente al riesgo de selección de microorganismos resistentes. En base a estudios realizados con adultos neutropénicos e infectados con el VIH, el uso de antimicóticos se asocia con el desarrollo de resistencia a fluconazol en especies previamente sensibles, así como el surgimiento de especies intrínsecamente resistentes1,41,51,67. Una revisión sistemática de estudios clínicos aleatorizados encontró que la profilaxis con fluconazol incrementó el riesgo de colonización, pero no modificó de manera significativa el riesgo de infecciones invasoras con especies de Candida resistentes o sensibles dependientes de dosis a fluconazol; sin embargo, el tamaño muestral fue limitado y los datos eran tanto de neonatos como de pacientes pediátricos y adultos19. En contraste, varios ensayos aleatorizados y controlados (tabla 3) y estudios observacionales en neonatos describieron que no era evidente un incremento de especies resistentes; sin embargo, estos estudios pueden haber tenido bajo poder estadístico para detectar esas diferencias8,34,44,58,60,62,95.
Los resultados a largo plazo de la profilaxis contra Candida no han sido estudiados en un gran ensayo multicéntrico, aleatorizado y controlado (tabla 3)6,22,28. Dado que los neonatos tienen un incremento del riesgo de colestasia, la administración de un fármaco potencialmente hepatotóxico es de particular preocupación2. Un estudio retrospectivo no aleatorizado, con controles históricos, encontró un incremento de la hiperbilirrubinemia conjugada en neonatos con EBPN que recibieron profilaxis con fluconazol, en comparación con neonatos que no recibieron profilaxis2. En un estudio similar, se observó un incremento de colestasia en neonatos que recibieron profilaxis con fluconazol. Sin embargo, dos tercios de los pacientes tenían otros trastornos que predisponían a la colestasia, principalmente la duración de la NPT34.
Aunque no se ha informado una incidencia significativa de toxicidad relacionada con fluconazol8,9,44,95, un ensayo encontró una elevación transitoria de las concentraciones de aspartato aminotransferasa y alanina aminotransferasa en neonatos tratados con fluconazol, que retornaron a valores normales en las siguientes 2 semanas (tabla 3)60. Un estudio de seguimiento de los supervivientes de 8 a 10 años de edad encontró que la profilaxis con fluconazol para la prevención de infecciones invasoras por Candida en neonatos con EBPN no parece asociarse a efectos adversos a largo plazo48.
Aunque los estudios en general han demostrado eficacia de la profilaxis con fluconazol, las tasas reales de candidiasis y de eficacia varían según el país y la UCI neonatal49. Por lo tanto, una evaluación precisa de los riesgos y beneficios de la profilaxis depende de la información local al menos de cada país. Hay pocas alternativas a la profilaxis con antifúngicos para la prevención de las infecciones por Candida en neonatos. Recientemente, se informó sobre el uso profiláctico de lactoferrina bovina, que redujo la incidencia de infección fúngica invasora en neonatos con MBPN (tabla 3)59. El diagnóstico preciso y temprano de la infección invasora por Candida en neonatos continúa siendo un desafío, dado que los hemocultivos, el gold standard para el diagnóstico, tienen baja sensibilidad25.
Identificación de neonatos para la profilaxisNo todos los recién nacidos necesitan profilaxis para la candidiasis invasora. Varios estudios han identificado ciertos factores de riesgo que pueden ser considerados para identificar aquellos neonatos con alto riesgo de infección como candidatos para la profilaxis. Como se mencionó previamente, el bajo peso al nacer, el nacimiento prematuro, la intubación, la prolongación de la estancia en el hospital o en la UCI neonatal, el uso de CVC, el tratamiento con antibióticos de amplio espectro, el uso de bloqueadores H2 y la NPT se asocian con candidiasis invasora29,57,84. Algunos estudios informan también sobre asociaciones con enfermedad gastrointestinal29 y sepsis bacteriana57.
Varios estudios han investigado el uso de profilaxis en grupos selectos de neonatos, incluyendo neonatos con MBPN50,56, con EBPN (tabla 3)2,44,45, y neonatos con MBPN con algún factor de riesgo adicional (CVC, tratamiento durante más de 10 días con antibióticos de amplio espectro o colonización fúngica previa)17,62. La Sociedad Norteamericana de Infectología recomienda el uso de profilaxis para los neonatos con EBPN en UCI neonatales con altas tasas de incidencia de candidiasis invasora, observando la resistencia a los agentes antifúngicos, la toxicidad relacionada con los fármacos y los resultados del neurodesarrollo71.
Profilaxis con fluconazolA pesar de las potenciales preocupaciones respecto al costos63,66, en un estudio realizado en un centro, la profilaxis con fluconazol en neonatos de alto riesgo de desarrollar candidiasis invasora fue encontrada costo-efectiva95. La dosis de 3 mg/kg/día dos veces por semana se ha señalado como aquella capaz de disminuir la colonización y la infección invasora por Candida, con la menor exposición posible a la droga en neonatos de EBPN45, además de ser costo-efectiva49.
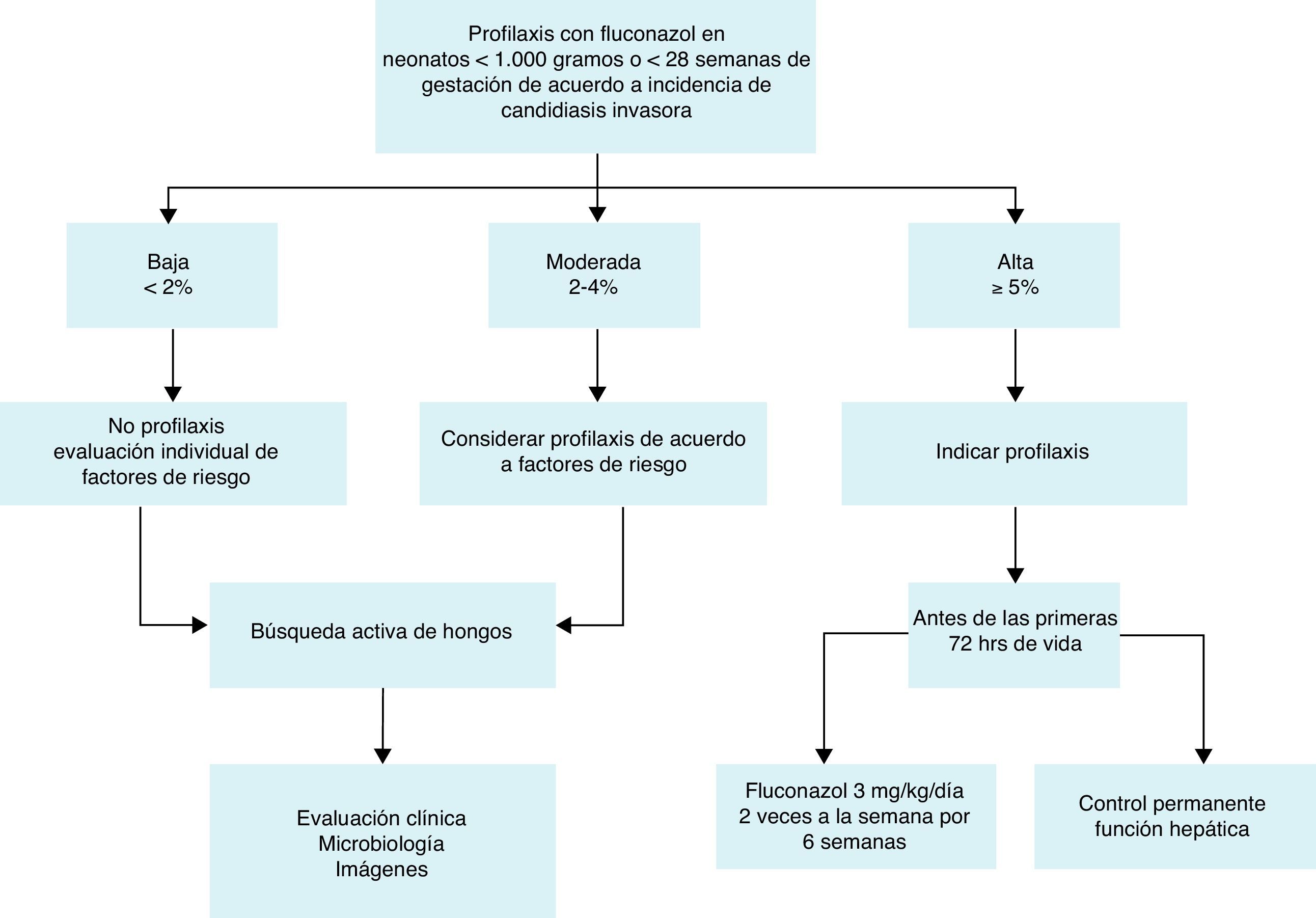
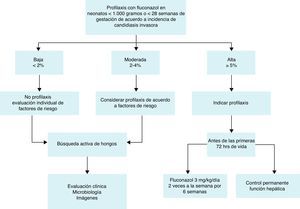
Recomendaciones de profilaxisEn base a estas consideraciones, el Grupo de Trabajo recomienda la profilaxis con fluconazol (3mg/kg/día 2 veces por semana durante 6 semanas) en neonatos con EBPN44,60 que están ingresados en una UCI neonatal con una elevada incidencia de candidiasis invasora, definida como ≥ 5%. Si no se conoce la incidencia, se debe considerar la profilaxis con fluconazol de acuerdo con los factores de riesgo presentes (figura 1). En la tabla 4 se presenta un resumen de los datos descritos en revisiones sistemáticas y metaanálisis en lo referente a la eficacia de la profilaxis contra Candida en neonatos.
Sumario de recomendaciones para la profilaxis deCandidaen neonatos:
Los principales factores de riesgo para identificar neonatos como candidatos para la profilaxis son:
- 1.
Bajo peso al nacer (<1000g) y prematuridad extrema (<28 semanas).
- 2.
Se recomienda profilaxis con fluconazol (3mg/kg/día 2 veces a la semana durante 6 semanas) en neonatos con EBPN que están ingresados en una UCI neonatal con elevada incidencia de candidiasis invasora (≥5%).
- 3.
Si la incidencia no es conocida o si es<5%, se debe considerar la profilaxis con fluconazol según los factores de riesgo.
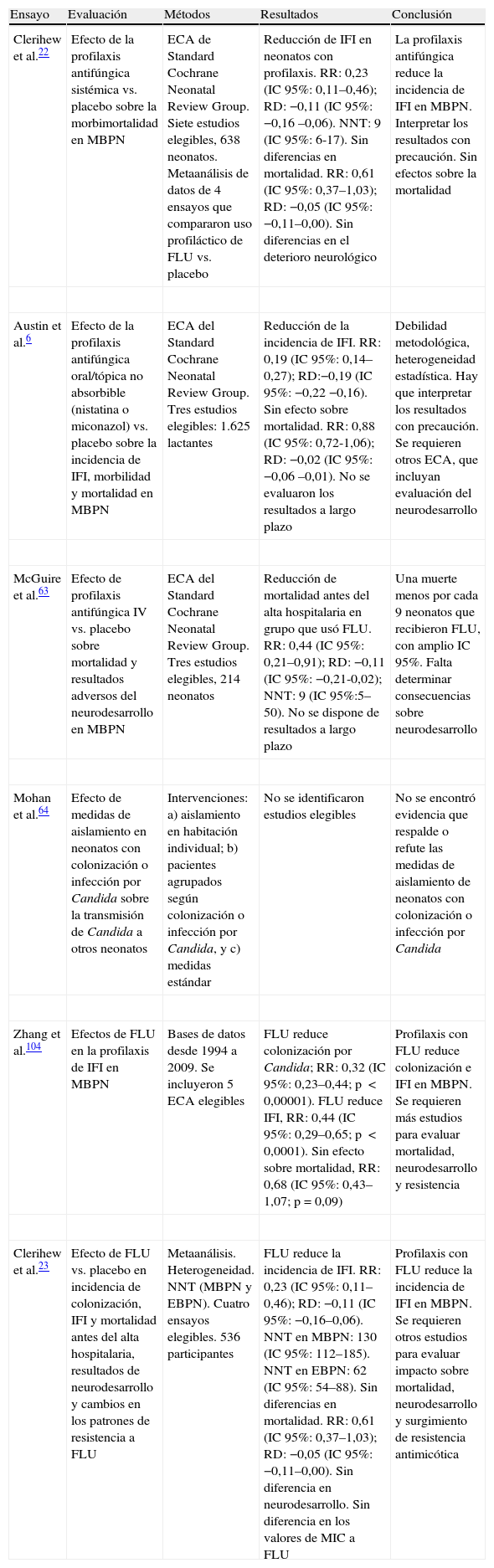
Eficacia de la profilaxis de Candida en neonatos (revisiones sistemáticas y metaanálisis)
| Ensayo | Evaluación | Métodos | Resultados | Conclusión |
| Clerihew et al.22 | Efecto de la profilaxis antifúngica sistémica vs. placebo sobre la morbimortalidad en MBPN | ECA de Standard Cochrane Neonatal Review Group. Siete estudios elegibles, 638 neonatos. Metaanálisis de datos de 4 ensayos que compararon uso profiláctico de FLU vs. placebo | Reducción de IFI en neonatos con profilaxis. RR: 0,23 (IC 95%: 0,11–0,46); RD: −0,11 (IC 95%: −0,16 –0,06). NNT: 9 (IC 95%: 6-17). Sin diferencias en mortalidad. RR: 0,61 (IC 95%: 0,37–1,03); RD: −0,05 (IC 95%: −0,11–0,00). Sin diferencias en el deterioro neurológico | La profilaxis antifúngica reduce la incidencia de IFI en MBPN. Interpretar los resultados con precaución. Sin efectos sobre la mortalidad |
| Austin et al.6 | Efecto de la profilaxis antifúngica oral/tópica no absorbible (nistatina o miconazol) vs. placebo sobre la incidencia de IFI, morbilidad y mortalidad en MBPN | ECA del Standard Cochrane Neonatal Review Group. Tres estudios elegibles: 1.625 lactantes | Reducción de la incidencia de IFI. RR: 0,19 (IC 95%: 0,14–0,27); RD:−0,19 (IC 95%: −0,22 −0,16). Sin efecto sobre mortalidad. RR: 0,88 (IC 95%: 0,72-1,06); RD: −0,02 (IC 95%: −0,06 –0,01). No se evaluaron los resultados a largo plazo | Debilidad metodológica, heterogeneidad estadística. Hay que interpretar los resultados con precaución. Se requieren otros ECA, que incluyan evaluación del neurodesarrollo |
| McGuire et al.63 | Efecto de profilaxis antifúngica IV vs. placebo sobre mortalidad y resultados adversos del neurodesarrollo en MBPN | ECA del Standard Cochrane Neonatal Review Group. Tres estudios elegibles, 214 neonatos | Reducción de mortalidad antes del alta hospitalaria en grupo que usó FLU. RR: 0,44 (IC 95%: 0,21–0,91); RD: −0,11 (IC 95%: −0,21-0,02); NNT: 9 (IC 95%:5–50). No se dispone de resultados a largo plazo | Una muerte menos por cada 9 neonatos que recibieron FLU, con amplio IC 95%. Falta determinar consecuencias sobre neurodesarrollo |
| Mohan et al.64 | Efecto de medidas de aislamiento en neonatos con colonización o infección por Candida sobre la transmisión de Candida a otros neonatos | Intervenciones: a) aislamiento en habitación individual; b) pacientes agrupados según colonización o infección por Candida, y c) medidas estándar | No se identificaron estudios elegibles | No se encontró evidencia que respalde o refute las medidas de aislamiento de neonatos con colonización o infección por Candida |
| Zhang et al.104 | Efectos de FLU en la profilaxis de IFI en MBPN | Bases de datos desde 1994 a 2009. Se incluyeron 5 ECA elegibles | FLU reduce colonización por Candida; RR: 0,32 (IC 95%: 0,23–0,44; p <0,00001). FLU reduce IFI, RR: 0,44 (IC 95%: 0,29–0,65; p <0,0001). Sin efecto sobre mortalidad, RR: 0,68 (IC 95%: 0,43–1,07; p=0,09) | Profilaxis con FLU reduce colonización e IFI en MBPN. Se requieren más estudios para evaluar mortalidad, neurodesarrollo y resistencia |
| Clerihew et al.23 | Efecto de FLU vs. placebo en incidencia de colonización, IFI y mortalidad antes del alta hospitalaria, resultados de neurodesarrollo y cambios en los patrones de resistencia a FLU | Metaanálisis. Heterogeneidad. NNT (MBPN y EBPN). Cuatro ensayos elegibles. 536 participantes | FLU reduce la incidencia de IFI. RR: 0,23 (IC 95%: 0,11–0,46); RD: −0,11 (IC 95%: −0,16–0,06). NNT en MBPN: 130 (IC 95%: 112–185). NNT en EBPN: 62 (IC 95%: 54–88). Sin diferencias en mortalidad. RR: 0,61 (IC 95%: 0,37–1,03); RD: −0,05 (IC 95%: −0,11–0,00). Sin diferencia en neurodesarrollo. Sin diferencia en los valores de MIC a FLU | Profilaxis con FLU reduce la incidencia de IFI en MBPN. Se requieren otros estudios para evaluar impacto sobre mortalidad, neurodesarrollo y surgimiento de resistencia antimicótica |
EBPN: neonatos con extremado peso bajo (<1.000g); ECA: estudio controlado y aleatorizado; FLU: fluconazol; IC: intervalo de confianza; IFI: infección fúngica invasiva; IV: intravenoso; MBPN: neonatos con muy bajo peso al nacer (<1.500g); MIC: concentración inhibitoria mínima; NNT: número necesario de tratar; PBO: placebo; RD: diferencia de riesgo; RR: riesgo relativo.
El Grupo de Trabajo no puede brindar una recomendación para el tratamiento empírico de la candidiasis invasora en neonatos, dado que no hay herramientas validadas para identificar candidatos y solamente un número bajo de estudios (ninguno de los cuales fue un ensayo prospectivo) han investigado estrategias de tratamiento empírico. En un estudio retrospectivo de neonatos en el Hospital de Clínicas de Porto Alegre, Brasil, se documentó una mortalidad relacionada con Candida en 11 de 18 pacientes de un control histórico, comparada con la supervivencia de todos los pacientes de un grupo de 6 que recibieron tratamiento empírico para la candidiasis invasora74. En este estudio, la terapia empírica fue administrada a neonatos con MBPN o a neonatos graves, que tenían signos clínicos de infección y/o neutropenia y que habían sido tratados con antibióticos (vancomicina o cefalosporinas de tercera generación) durante 7 o más días, en asociación con NPT, ventilación mecánica, corticoides, bloqueadores H2 o la presencia de candidiasis mucocutánea. Un modelo predictivo multivariado en 6.172 neonatos que nacieron con un peso inferior a 1.250g y en los que se habían tomado muestras para hemocultivos después del tercer día de vida, demostró que la trombocitopenia y el uso de cefalosporinas o antibióticos carbapenémicos en los 7 días previos a la toma de hemocultivos fueron factores de riesgo para una candidiasis invasora posterior13.
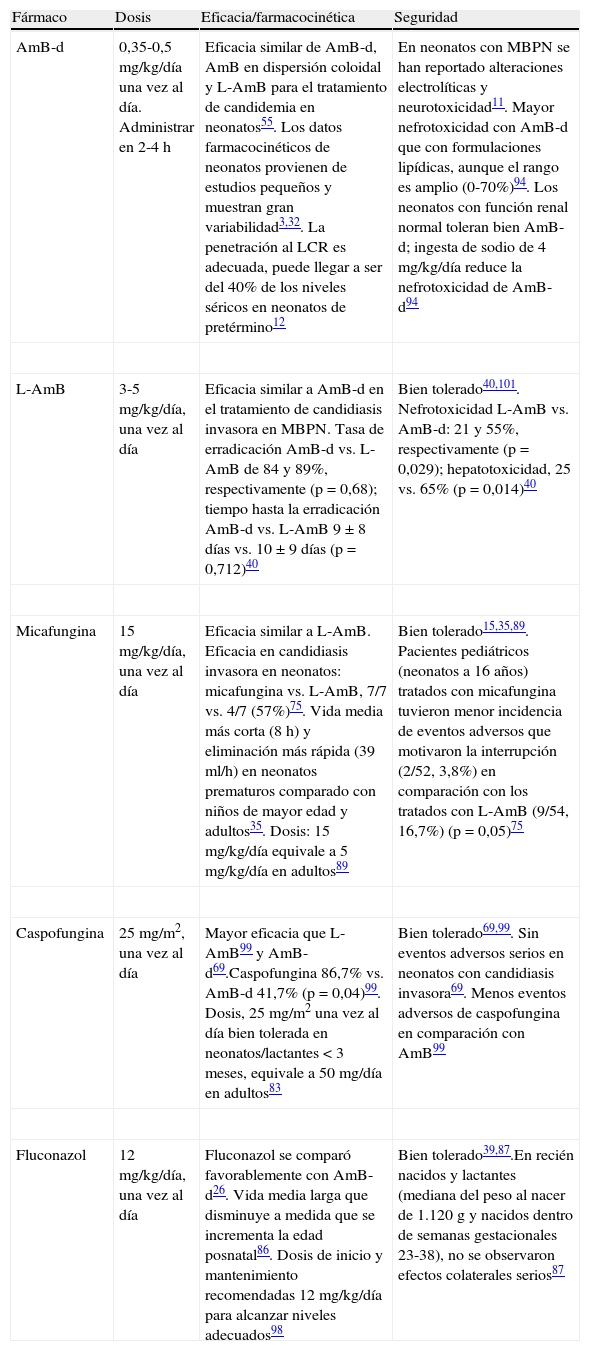
Tratamiento de la candidiasis invasora en neonatosDe acuerdo con la experiencia clínica y los datos disponibles, las primeras opciones recomendadas para el tratamiento de la candidiasis neonatal son: anfotericina B deoxicolato (AmB-d), anfotericina B liposomal (L-AmB) o una equinocandina (micafungina o caspofungina) (tabla 5).
Tratamiento farmacológico de la candidiasis neonatal
| Fármaco | Dosis | Eficacia/farmacocinética | Seguridad |
| AmB-d | 0,35-0,5mg/kg/día una vez al día. Administrar en 2-4h | Eficacia similar de AmB-d, AmB en dispersión coloidal y L-AmB para el tratamiento de candidemia en neonatos55. Los datos farmacocinéticos de neonatos provienen de estudios pequeños y muestran gran variabilidad3,32. La penetración al LCR es adecuada, puede llegar a ser del 40% de los niveles séricos en neonatos de pretérmino12 | En neonatos con MBPN se han reportado alteraciones electrolíticas y neurotoxicidad11. Mayor nefrotoxicidad con AmB-d que con formulaciones lipídicas, aunque el rango es amplio (0-70%)94. Los neonatos con función renal normal toleran bien AmB-d; ingesta de sodio de 4mg/kg/día reduce la nefrotoxicidad de AmB-d94 |
| L-AmB | 3-5mg/kg/día, una vez al día | Eficacia similar a AmB-d en el tratamiento de candidiasis invasora en MBPN. Tasa de erradicación AmB-d vs. L-AmB de 84 y 89%, respectivamente (p=0,68); tiempo hasta la erradicación AmB-d vs. L-AmB 9±8 días vs. 10±9 días (p=0,712)40 | Bien tolerado40,101. Nefrotoxicidad L-AmB vs. AmB-d: 21 y 55%, respectivamente (p=0,029); hepatotoxicidad, 25 vs. 65% (p=0,014)40 |
| Micafungina | 15mg/kg/día, una vez al día | Eficacia similar a L-AmB. Eficacia en candidiasis invasora en neonatos: micafungina vs. L-AmB, 7/7 vs. 4/7 (57%)75. Vida media más corta (8h) y eliminación más rápida (39ml/h) en neonatos prematuros comparado con niños de mayor edad y adultos35. Dosis: 15mg/kg/día equivale a 5mg/kg/día en adultos89 | Bien tolerado15,35,89. Pacientes pediátricos (neonatos a 16 años) tratados con micafungina tuvieron menor incidencia de eventos adversos que motivaron la interrupción (2/52, 3,8%) en comparación con los tratados con L-AmB (9/54, 16,7%) (p=0,05)75 |
| Caspofungina | 25mg/m2, una vez al día | Mayor eficacia que L-AmB99 y AmB-d69.Caspofungina 86,7% vs. AmB-d 41,7% (p=0,04)99. Dosis, 25mg/m2 una vez al día bien tolerada en neonatos/lactantes<3 meses, equivale a 50mg/día en adultos83 | Bien tolerado69,99. Sin eventos adversos serios en neonatos con candidiasis invasora69. Menos eventos adversos de caspofungina en comparación con AmB99 |
| Fluconazol | 12mg/kg/día, una vez al día | Fluconazol se comparó favorablemente con AmB-d26. Vida media larga que disminuye a medida que se incrementa la edad posnatal86. Dosis de inicio y mantenimiento recomendadas 12mg/kg/día para alcanzar niveles adecuados98 | Bien tolerado39,87.En recién nacidos y lactantes (mediana del peso al nacer de 1.120g y nacidos dentro de semanas gestacionales 23-38), no se observaron efectos colaterales serios87 |
AmB: anfotericina B; AmB-d: anfotericina B deoxicolato; L-AmB: anfotericina B liposomal; LCR: líquido cefalorraquídeo; MBPN: neonatos con muy bajo peso (<1.500g).
Los datos sobre el tratamiento de la candidiasis neonatal son muy limitados y solamente un ensayo ha mostrado datos comparativos75. Este ensayo aleatorizado y controlado, multinacional y doble ciego, estudió el tratamiento de primera línea de la candidiasis invasora con micafungina (2mg/kg) y lo comparó con L-AmB (3mg/kg). En un subestudio de 106 pacientes pediátricos (población con intención de tratamiento), 19 de los cuales habían nacido de forma prematura, un total de 98 tuvieron un diagnóstico confirmado de infeccción por Candida y fueron incluidos en análisis de eficacia terapéutica. El tratamiento fue exitoso en 35 de 48 pacientes (72.9%) que recibieron micafungina y en 38 de los 50 (76%) que recibieron L-AmB. Ambos tratamientos fueron bien tolerados, pero la incidencia de eventos adversos que condujeron a la interrupción de la terapia fue menor en el grupo de micafungina (2 de 52 pacientes, 3,8%) que en el grupo de L-AmB (9 pacientes de 54, 16,7%; p=0,05). Dentro del subgrupo de pacientes neonatales (0 días a<4 semanas de vida), en 4 de 7 pacientes (57,1%) que recibieron L-AmB se obtuvo el éxito terapéutico.
A pesar de la eficacia de L-AmB, esta terapia no está disponible en la mayoría de los hospitales de América Latina. Sin embargo, hay mayor disponibilidad de AmB-d, que ha sido ampliamente utilizada en neonatos, es mejor tolerada en esta población que en los adultos94, y es tan eficaz como L-AmB en el tratamiento de la candidiasis invasora en neonatos y lactantes94. L-AmB tiene un mejor perfil de seguridad que AmB-d52, y no se conocen las consecuencias a largo plazo del tratamiento con AmB-d en esta población.
EquinocandinasTambién se recomienda el uso de micafungina o caspofungina para el tratamiento de la candidiasis neonatal. La infección del SNC debe ser descartada antes de su uso, debido a que se desconoce la eficacia en el tratamiento de las infecciones del SNC (ver el apartado «Manejo de las complicaciones en los neonatos»). Algunos ensayos con un número reducido de pacientes han demostrado eficacia de micafungina75 y caspofungina69 en el tratamiento de los neonatos con candidiasis invasora. Aunque los datos son limitados, las investigaciones preliminares han mostrado que micafungina es bien tolerada en los neonatos4,35,75,89. Dosis únicas de micafungina (0,75 a 3,0mg/kg) fueron bien toleradas en neonatos prematuros con peso>1.000g; sin embargo, el incremento en la filtración del fármaco produjo concentraciones plasmáticas bajas35. Una investigación posterior mostró que dosis repetidas de 15mg/kg también fueron bien toleradas en neonatos y brindaron concentraciones plasmáticas equivalentes a una dosis de 5mg/kg en adultos89. Los datos sobre el uso de caspofungina en neonatos también son limitados; las investigaciones preliminares mostraron que la administración una vez al día de caspofungina (25mg/m2) fue bien tolerada en neonatos y lactantes (<3meses), y que esta dosis brindó una concentración plasmática similar a la obtenida en los adultos, que reciben 50mg/día83.
FluconazolFluconazol es eficaz y bien tolerado por los neonatos. Sin embargo, dado que este tratamiento es fungistático, no es considerado una opción de primera línea para la candidiasis invasora neonatal, excepto para el caso de las candidiasis del tracto urinario. Además, los neonatos pueden haber recibido previamente fluconazol como profilaxis. Se puede efectuar la desescalada terapéutica y pasar de la utilización de un fármaco fungicida a usar fluconazol cuando el paciente está estable y se tiene información de la sensibilidad a los antifúngicos de la especie de Candida aislada.
Se recomienda fluconazol (12mg/kg/día) para el tratamiento de la candidiasis del tracto urinario en neonatos97. El fluconazol es muy soluble en agua, se excreta principalmente por la orina en su forma activa, y alcanza fácilmente concentraciones urinarias que superan la concentración mínima inhibitoria para la mayoría de las cepas de Candida18. Varios estudios han descrito el tratamiento exitoso con fluconazol de lactantes y recién nacidos con infección del tracto urinario por C. albicans36,93.
Control de la infecciónLos estudios han encontrado evidencias de la transmisión de Candida a través de contacto directo e indirecto, e infección cruzada con personal de salud. Sin embargo, en neonatos con colonización o infección por Candida no hay evidencias que respalden o refuten el uso de medidas de aislamiento del paciente (aislamiento de cohorte en una habitación para un solo paciente o un grupo de pacientes infectados), más allá de las medidas rutinarias de control de infecciones que se practican en las unidades neonatales, siendo relevante realizar una buena higiene de manos (tabla 4)64,80,92. Las medidas para control de infección a fin de prevenir la candidiasis invasora pueden incluir la detección y erradicación prenatal de candidiasis vaginal en la madre, programas de asesoramiento para limitar el uso de antibióticos de amplio espectro (específicamente cefalosporinas de tercera generación y antibióticos carbapenémicos), bloqueadores H2 y dexametasona posnatal, particularmente durante los períodos de alto riesgo de infección, períodos en que los neonatos requieren CVC, NPT y tubos endotraqueales47. Además, es necesario prevenir la enterocolitis necrosante a través de protocolos de estimulación de la lactancia materna y tener protocolos estandarizados para la inserción y manejo del CVC49.
Sumario de recomendaciones para el tratamiento de la candidiasis invasora en neonatos:
- 1.
Las primeras opciones terapéuticas recomendadas son anfotericina B (AmB-d o L-AmB) o una equinocandina (micafungina o caspofungina).
- 2.
Se debe descartar la infección del SNC antes de utilizar equinocandinas.
- 3.
Se puede efectuar una desescalada terapéutica a fluconazol cuando el paciente está estable y se posee información de la sensibilidad del aislamiento a los antifúngicos.
- 4.
Se recomienda fluconazol para el tratamiento de la candidiasis del tracto urinario.
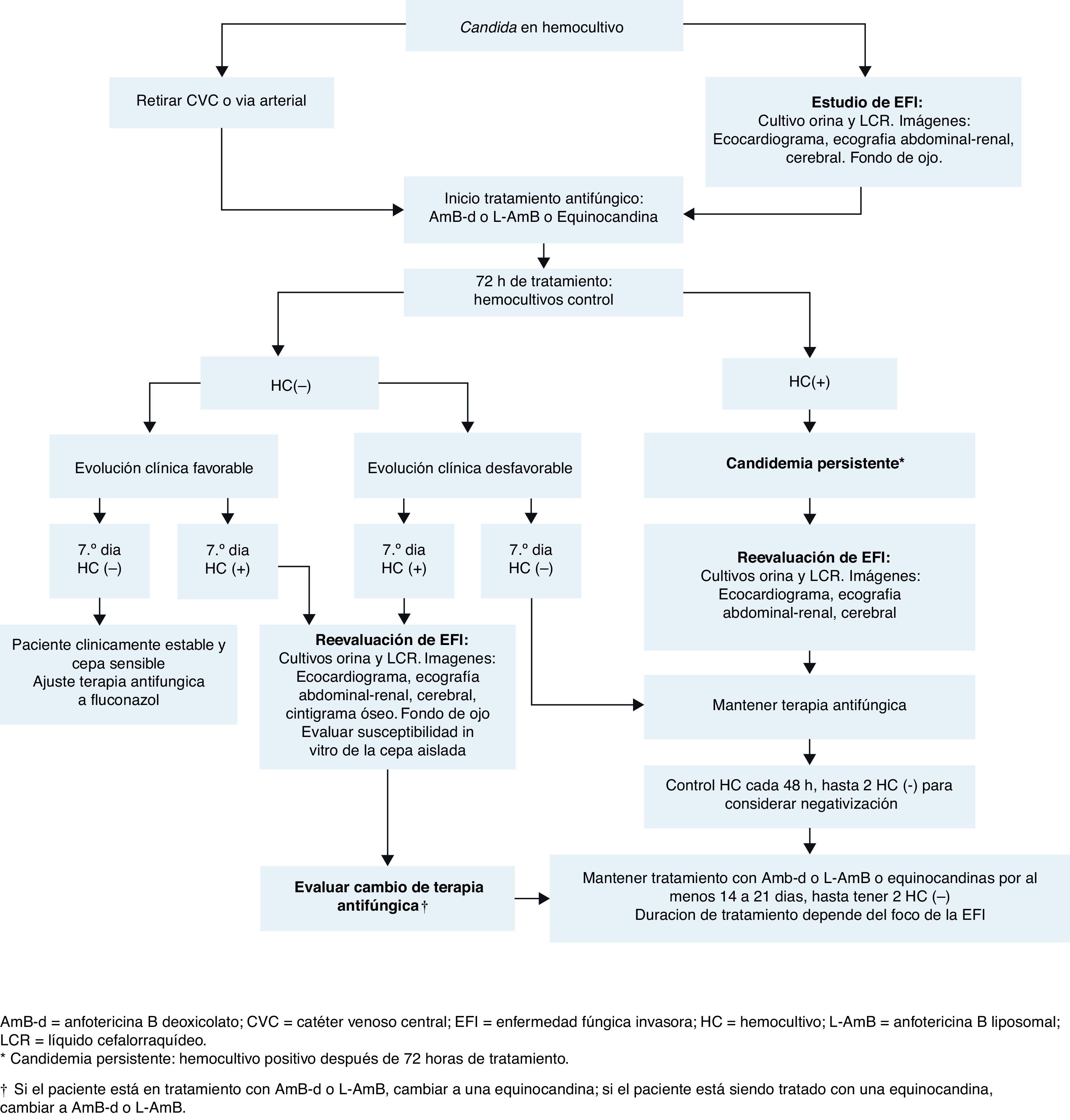
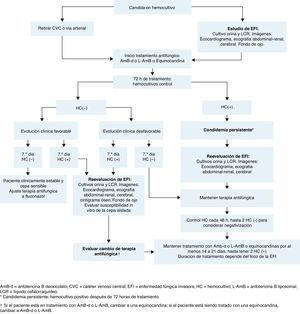
En la figura 2 se muestra el manejo de los neonatos después del diagnóstico de candidemia. La evaluación basal en el seguimiento del paciente con candidiasis invasora neonatal incluye: cultivo de orina, punción lumbar y evaluación del líquido cefalorraquídeo (LCR) con citoquímico y cultivo, dado que los cultivos pueden ser positivos a pesar de un recuento de células normal;14,71 ecografía de cráneo, abdominal y renal para buscar abscesos en riñones, bazo e hígado (lo que debe ser descartado en todos los neonatos con candidemia); ecocardiograma14 (recomendado en neonatos con candidemia para detectar endocarditis); y evaluación con examen de fondo de ojo, recomendado para, todos los neonatos con candidemia a fin de descartar retinitis o endoftalmitis)14,71.
Se debe efectuar un hemocultivo después de las primeras 72h de tratamiento, y después, cada 48h hasta alcanzar la esterilización de la sangre (2 hemocultivos negativos consecutivos). En lactantes y recién nacidos, el volumen de sangre extraído para cultivo se basa en la edad y el peso corporal, con una relación sangre-caldo de cultivo de 1:5 o 1:10, según las recomendaciones de la técnica77. Si los cultivos continúan siendo positivos a pesar de un tratamiento apropiado (≥72h después del inicio de la terapia antifúngica), se recomienda una segunda evaluación (similar a la evaluación basal) para encontrar posibles focos de infección. Si el hemocultivo continúa positivo a los 7 días de tratamiento, se recomienda efectuar un ecocardiograma para descartar endocarditis y estudio de imagen de huesos y cerebro (idealmente con resonancia magnética o TAC) para evaluar la diseminación de la infección.
Sumario de recomendaciones para la evaluación del paciente después del diagnóstico de candidemia en neonatos
- 1.
Evaluación basal del paciente:
- a.
Cultivo de orina.
- b.
Punción lumbar y evaluación del LCR.
- c.
Ecografía de cráneo.
- d.
Ecografía abdominal.
- e.
Ecocardiograma.
- f.
Evaluación de fondo de ojo.
- a.
- 2.
Efectuar hemocultivos después de las primeras 72h de tratamiento y luego cada 48h hasta la esterilización de la sangre (2 hemocultivos negativos consecutivos).
- 3.
Evaluación secundaria del paciente (si los cultivos continúan positivos después de 72h de tratamiento):
- a.
Igual que en la evaluación basal.
- a.
- 4.
Evaluación secundaria del paciente (si los hemocultivos continúan positivos después de 7 días de tratamiento):
- a.
Igual que en la evaluación basal, más estudios de imagen de huesos y cerebro.
- a.
Los neonatos con candidemia sin complicaciones sépticas deben ser tratados hasta 2 semanas después de obtener 2 hemocultivos negativos consecutivos (figura 2)43. El tratamiento debe extenderse en los neonatos con candidemia persistente o candidemia con complicaciones sépticas, tal como se comenta más adelante. En estos casos, la duración del tratamiento debe ser determinada mediante un abordaje individual, basado en las manifestaciones clínicas y las características del paciente.
Manejo del catéter en neonatosLos datos epidemiológicos relacionados con el manejo del catéter y el retiro del mismo son limitados y no se dispone de cifras específicas en América Latina. En un estudio de neonatos de EBPN con candidemia, las tasas de mortalidad y deterioro del neurodesarrollo fueron mayores en aquellos pacientes con retraso en el retiro del catéter (>1 día después del inicio del tratamiento antifúngico), en comparación con los niños en los que los catéteres fueron retirados o reemplazados inmediatamente16. Otro estudio, en neonatos con retiro temprano del catéter (≤3 días después del primer hemocultivo positivo para Candida), encontró que la candidemia se resolvía más rápidamente y que la tasa de mortalidad fue menor en comparación con la observada en neonatos en quienes se demoró el retiro del catéter (>3 días)42. El Grupo de Trabajo recomienda que los catéteres de los neonatos con candidemia sean retirados lo antes posible, considerando siempre la necesidad de una vía de acceso intravenosa y la potencial dificultad de hallar un nuevo sitio de acceso para el catéter en estos pacientes.
Manejo de las complicaciones en los neonatosCandidemia persistenteLos hemocultivos positivos persistentes se asocian con complicaciones focales (SNC, ojos, corazón, huesos, riñones, bazo e hígado) y con una elevada tasa de mortalidad14. Por lo tanto, se deben obtener cultivos seriados del sitio (o de los sitios) infectado(s), para predecir la necesidad de una vigilancia intensiva y la intervención para el manejo de las complicaciones focales (figura 2)21,68. No se han encontrado diferencias en las características basales de los pacientes en 2 estudios que compararon neonatos con y sin candidemia persistente21,54. En uno de estos estudios, la infección persistente fue definida como un hemocultivo repetido positivo, obtenido≥24h después de alcanzar el objetivo de dosificación de la terapia antifúngica21. En el otro estudio, la candidemia fue considerada persistente cuando su duración oscilaba entre 7 y 22 días54. Una duración mayor a un día entre el momento del hemocultivo y la dosis inicial del tratamiento antifúngico sistémico implica un incremento del riesgo para el desarrollo de candidemia persistente en los neonatos78. En un estudio de cohorte prospectiva de una única institución, que incluyó neonatos de MBPN con diagnóstico de candidiasis invasora, el 10% de los neonatos tuvieron candidemia persistente definida como un cultivo positivo durante≥2 semanas, a pesar de la terapia antifúngica16. En el mismo estudio de 307 neonatos con candidiasis invasora, hasta el 21% de los pacientes tuvieron hemocultivos negativos en forma intermitente mientras estaban recibiendo terapia antifúngica16. Esto demuestra que los cultivos posteriores en un neonato con diagnóstico previo de candidemia pueden dar resultados falso-negativos. Un hemocultivo negativo no es suficiente para indicar ausencia de infección en estos pacientes y se requieren al menos 2 hemocultivos negativos para confirmar la ausencia de infección43.
Tratamiento de las complicacionesEl tratamiento de las complicaciones que surgen por la diseminación de la infección por Candida no está bien definido en los ensayos clínicos; sin embargo, la penetración tisular de los antifúngicos disponibles para el tratamiento es un aspecto importante. Fluconazol tiene una excelente penetración tisular y aproximadamente el 70% de la dosis administrada se elimina sin cambios por la orina; por lo tanto, fluconazol es la mejor elección para las candidiasis renales y del tracto urinario18,88,100. Una alternativa al uso de fluconazol es la AmB-d. La L-AmB no está indicada en la infección renal por Candida debido a su limitada penetración tisular71. La endocarditis generalmente se asocia con candidemia persistente53,54,81. Aun así, la endocarditis fúngica también se ha observado en un paciente con un solo hemocultivo positivo14,68. El abordaje terapéutico para los neonatos con endocarditis por Candida incluye el tratamiento con fármacos fungicidas con la capacidad de penetrar en las biopelículas. Los antifúngicos más adecuados son las equinocandinas (micafungina o caspofungina) o la L-AmB, junto con la rápida retirada del CVC y probablemente el uso de cirugía en el contexto de una terapia prolongada. Debido al alto riesgo de mortalidad, es difícil decidir realizar una cirugía en neonatos y, habitualmente, los cirujanos prefieren que los pacientes sean tratados durante 2-3 semanas antes de considerarla.
El tratamiento de la osteomielitis por Candida requiere un abordaje quirúrgico y un tratamiento prolongado durante al menos 4-6 semanas. Las opciones terapéuticas incluyen 2-4 semanas de tratamiento con fármacos fungicidas, ya sea L-AmB (3-5mg/kg/día), AmB-d (0,5-1mg/kg/día) o una equinocandina (micafungina o caspofungina), seguido por fluconazol a una dosis de 12mg/kg/día96.
Los neonatos con candidemia cuya duración es de al menos 5 días tienen mayores probabilidades de desarrollar complicaciones oftalmológicas. La endoftalmitis puede producirse tan tempranamente como en el primer día de infección; sin embargo, es una complicación más probable en la candidemia prolongada. La terapia antifúngica sistémica habitualmente tiene éxito en el tratamiento de esta complicación10. Se ha informado de un amplio rango de daño ocular en neonatos con candidiasis invasora (0-44%). En un estudio retrospectivo, se observaron anormalidades de la retina en 4 de 67 pacientes (6%) cuando se efectuó un examen de oftalmoscopia indirecta. En los casos de infección ocular en neonatos con candidiasis invasora, se recomienda un tratamiento prolongado con AmB-d o L-AmB20. Los posibles beneficios de las equinocandinas podrían ser limitados debido a las concentraciones casi indetectables de estas en el humor vítreo96.
Infección del sistema nervioso centralLa infección del SNC es una complicación relativamente frecuente de la candidemia; sin embargo, los hallazgos de los cultivos del LCR son variables, y un LCR normal no excluye la infección del SNC30. El tratamiento de elección es L-AmB o AmB-d. En neonatos, las concentraciones de AmB-d en el LCR pueden alcanzar el 40-90% de los valores séricos (penetración razonablemente buena)12. L-AmB puede tener una mejor penetración en el SNC en comparación con AmB-d, y se puede, además, administrar a dosis más elevadas, considerando su buen perfil de seguridad100. En un estudio observacional multicéntrico, la esterilización del LCR requirió más tiempo en los neonatos que recibieron AmB-d y flucitosina que en aquellos que recibieron solamente AmB-d16.
Se carece de datos que orienten en el uso de otros tratamientos en la meningitis por Candida. Los datos preclínicos sugieren que micafungina penetra en la mayoría de los subcompartimentos del SNC; sin embargo, se requieren investigaciones clínicas para establecer la eficacia en el tratamiento de la infección del SNC en neonatos. Se pueden requerir dosis más elevadas de micafungina para alcanzar concentraciones adecuadas dentro del SNC37. En un estudio de seguridad y farmacocinética de micafungina en lactantes, se observó que el 82,6% de los pacientes tuvieron una disminución mayor de la carga micótica dentro del SNC con una dosis de 10mg/kg/día38. Dos estudios de tratamiento de candidemia con caspofungina demostraron su eficacia en un pequeño número de neonatos con meningitis por Candida65,69. Sin embargo, en el momento de la publicación de esta recomendación, las equinocandinas no están indicadas para el tratamiento de las complicaciones del SNC.
Sumario de recomendaciones para el manejo de las complicaciones en neonatos:
Infección renal o del tracto urinario:
- 1.
Fluconazol, 12mg/kg/día.
Endocarditis:
- 1.
Tratamiento prolongado con L-AmB o equinocandinas.
- 2.
Retiro inmediato del CVC.
- 3.
Cirugía (después del tratamiento antifúngico).
Osteomielitis:
- 1.
Cirugía.
- 2.
Tratamiento prolongado con AmB-d, L-AmB o equinocandinas, seguido por fluconazol.
Compromiso ocular:
- 1.
Tratamiento prolongado con AmB-d o L-AmB.
Infección del SNC:
- 1.
Tratamiento prolongado con AmB-d o L-AmB.
A.L. Colombo ha recibido ayudas para la investigación de Pfizer, MSD, United Medical y Luminex, y ayudas para la formación médica de Pfizer, MSD, United Medical y Astellas. Además, ha ejercido como consultor para MSD, Pfizer y Gilead. J.A. Cortes ha recibido de Pfizer y MSD ayudas para la investigación y para la asistencia a charlas de formación médica. M. Nucci ha recibido ayudas para la investigación de Pfizer y MSD, y ha sido consultor y conferenciante para Pfizer, Merck, Astellas y Gilead. F. de Queiroz Telles ha participado en cursos de Formación Continuada en laboratorios de Astellas, MSD, Pfizer y United Medical, y en programas de investigación en laboratorios de Astellas, MSD y Pfizer. I. N. Tiraboschi ha sido conferenciante para Pfizer y Gilead. J. Zurita ha sido miembro del consejo asesor y consultor de Pfizer, y ha recibido ayudas para la investigación de Wyeth y MSD por su participación en el estudio SMART.
A Meredith Kalish, MD, y Brigitte Teissedre, PhD, de Choice Healthcare Solutions, por su asistencia editorial, financiada por Pfizer. Los autores son responsables de las opiniones, conclusiones y recomendaciones.
Cómo citar este artículo: Santolaya ME, et al. Recommendations for the management of candidemia in neonates in Latin America. Rev Iberoam Micol. 2013;30:158–70.