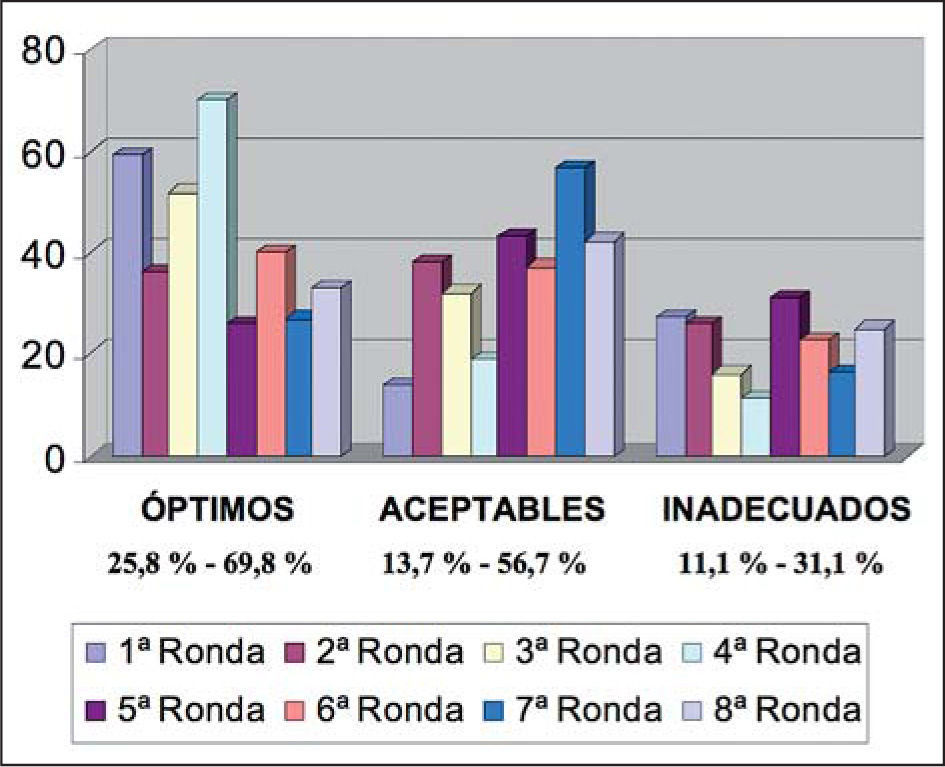
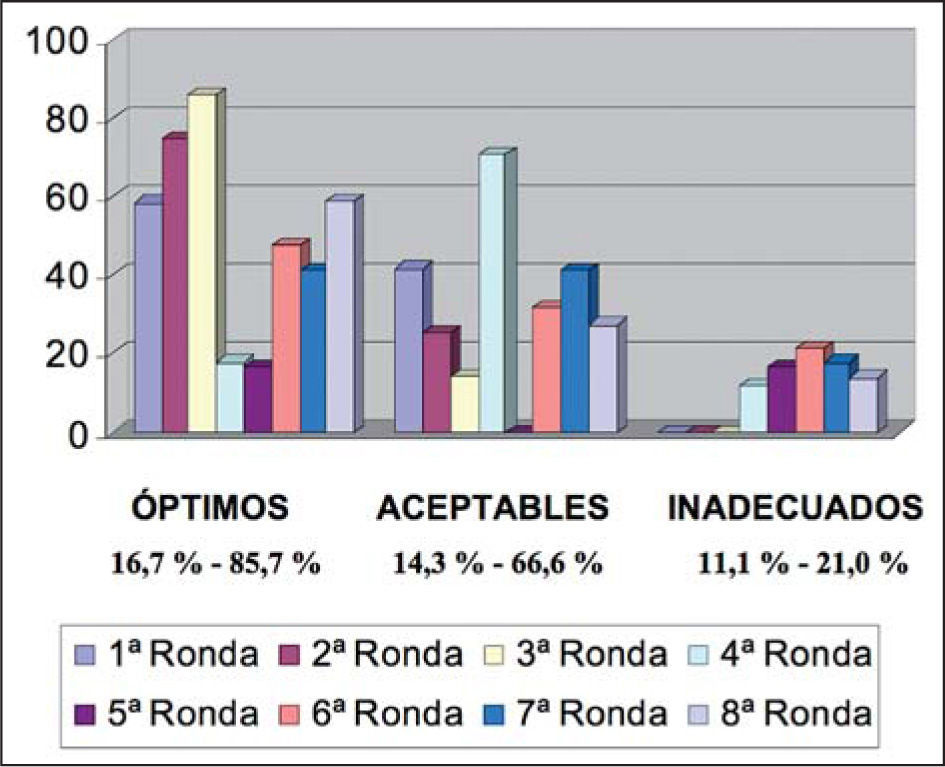
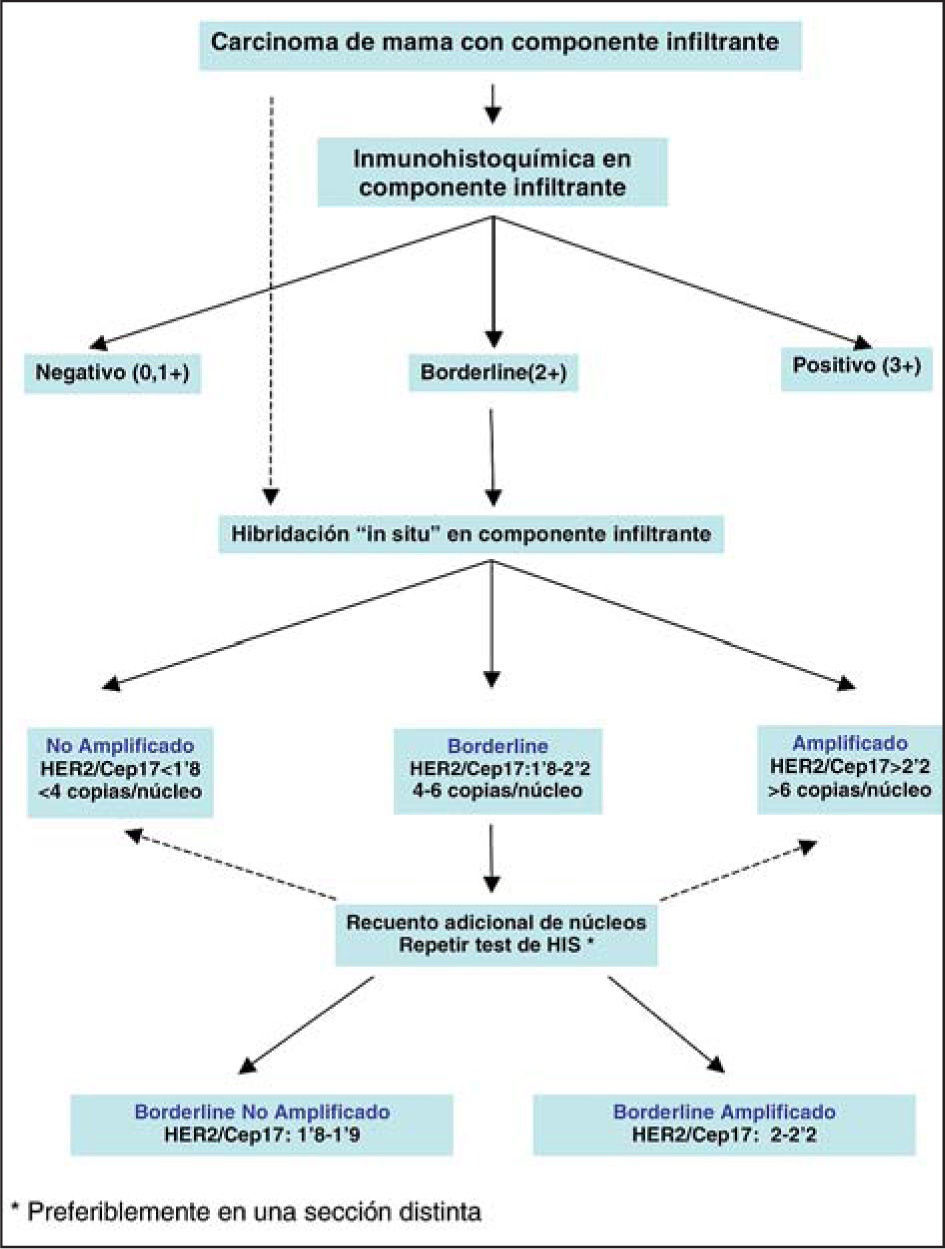
La identificación de los carcinomas de mama con amplificación/sobreexpresión de HER2 es crítica en la práctica clínica diaria ya que estas neoplasias requieren un tratamiento específico que incluye el uso de terapias dirigidas. Tanto las técnicas de hibridación in situ como las técnicas inmunohistoquímicas son métodos apropiados para la identificación de cánceres de mama HER2 positivos. Sin embargo, numerosos estudios, incluidos los desarrollados por la Asociación para la Garantía de Calidad en Patología de la SEAP (AGCP) y la experiencia de centros de referencia nacionales en la determinación de HER2 han puesto de manifiesto importantes problemas de reproducibilidad entre laboratorios. Por estos motivos, patólogos expertos en la determinación de HER2 de estos centros de referencia, así como oncólogos médicos con una contrastada actividad en cáncer de mama, en representación de las sociedades respectivas (SEAP y SEOM), han trabajado para debatir y consensuar las recomendaciones nacionales de determinación de HER2. Estas recomendaciones se basan no sólo en la experiencia de los participantes en el consenso, sino también en la experiencia internacional publicada en recientes guías de distintos países, tales como Estados Unidos, Reino Unido y Canadá.
En este consenso, se recomiendan los requisitos mínimos que un laboratorio de Anatomía Patológica debe cumplir para garantizar la adecuada determinación de HER2 en la práctica diaria. Aquellos laboratorios que carezcan de los estándares mínimos expuestos en esta guía deberían trabajar en alcanzarlos y durante este proceso remitir a laboratorios de referencia las muestras en las que la determinación de HER2 tenga implicaciones clínicas para las pacientes.
Breast cancers with HER2 alterations are critical to identify because such tumors require unique treatment, including the use of targeted therapies. HER2 alterations at the DNA (amplification) and protein (overexpression) level usually occur in concert, and both in situ hybridization and immunohistochemistry can be accurate methods to assess these alterations. However, recent studies including those conducted by the Association for Quality Assessment of the Spanish Society of Pathology and the experience of several national reference centres for HER2 testing have suggested that serious reproducibility issues exist with both techniques. To address this, a joint committee of both the Spanish Society of Pathology and the Spanish Society of Medical Oncology has met to review guidelines for HER2 testing. Consensus recommendation are based not only on panellist's experience but also in those consensus guidelines previously reported in several countries, such as United Stated, United Kingdom and Canada.
These guidelines include minimal requirements that Pathology Department must meet in order to guarantee appropriate HER2 testing in breast cancer. Pathology laboratories that do not meet these standards must put effort to reach them and, in the meantime, send clinical cases to reference centres.