Evaluar la captación metabólica de diferentes signos tomográficos observados en pacientes con hallazgos estructurales incidentales sugestivos de neumonía por COVID-19 mediante PET/TC con 18F-FDG.
Material y métodosSe analizaron retrospectivamente 596 estudios PET/TC realizados desde el 21 de febrero de 2020 hasta el 17 de abril de 2020. Tras excluir 37 exploraciones (trazadores PET diferentes a la 18F-FDG y estudios cerebrales), se evaluó la actividad metabólica de varios cambios estructurales integrados en la puntuación CO-RADS mediante el SUVmáx de estudios multimodales con 18F-FDG.
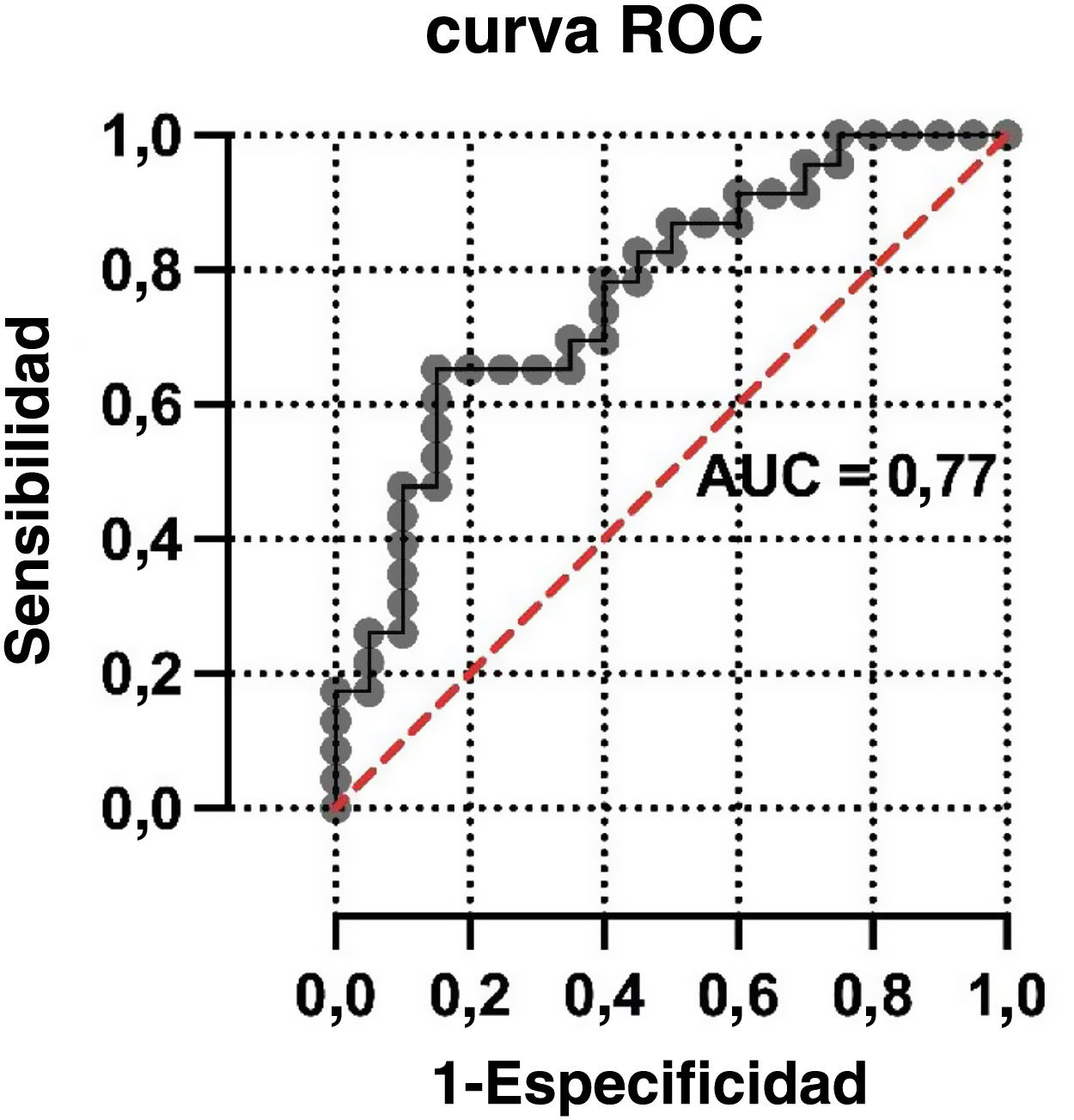
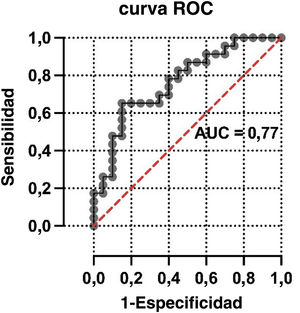
ResultadosSe incluyeron 43 pacientes r COVID-19 en la 18F-FDG PET/TC (edad media: 68±12,3 años, 22 varones). Los valores de SUVmáx fueron mayores en los pacientes con categorías CO-RADS 5-6 respecto a los de categorías CO-RADS inferiores (6,1±3,0 vs. 3,6±2,1, p=0,004). En los pacientes con CO-RADS 5-6, las opacidades en vidrio deslustrado, la bilateralidad y las consolidaciones mostraron valores de SUVmáx más elevados (valores de la p de 0,01, 0,02 y 0,01, respectivamente). La distribución parcheada y el patrón crazy paving también se asociaron a valores de SUVmáx más elevados (valores de p de 0,002 y 0,01). Tras el análisis multivariable, el SUVmáx se asoció significativamente con un diagnóstico estructural positivo de neumonía por COVID-19 (odds ratio=0,63, intervalo de confianza del 95%=0,41-0,90; p=0,02). La curva ROC del modelo de regresión destinado a confirmar o descartar el diagnóstico estructural de neumonía por COVID-19 mostró un AUC de 0,77 (error estándar=0,072; p=0,003).
ConclusionesEn aquellos pacientes remitidos a 18F-FDG PET/TC por indicaciones oncológicas y no oncológicas estándar (43/559; 7,7%) durante la pandemia, la obtención de imágenes multimodales es una herramienta útil durante la detección incidental de neumonía. Diferentes hallazgos en la TC característicos de la neumonía por COVID-19, específicamente los incluidos en las puntuaciones CO-RADS diagnósticas (5-6), se asociaron con valores SUVmáx más elevados.
To evaluate the metabolic uptake of different tomographic signs observed in patients with incidental structural findings suggestive of COVID-19 pneumonia through 18F-FDG PET/CT.
Material and methodsWe retrospectively analyzed 596 PET/CT studies performed from February 21, 2020 to April 17, 2020. After excluding 37 scans (non-18F-FDG PET tracers and brain studies), we analyzed the metabolic activity of several structural changes integrated in the CO-RADS score using the SUVmax of multimodal studies with 18F-FDG.
ResultsForty-three patients with 18F-FDG PET/CT findings suggestive of COVID-19 pneumonia were included (mean age: 68±12.3 years, 22 male). SUVmax values were higher in patients with CO-RADS categories 5–6 than in those with lower CO-RADS categories (6.1±3.0 vs. 3.6±2.1, p=0.004). In patients with CO-RADS 5–6, ground-glass opacities, bilaterality and consolidations exhibited higher SUVmax values (p-values of 0.01, 0.02 and 0.01, respectively). Patchy distribution and crazy paving pattern were also associated with higher SUVmax (p-values of 0.002 and 0.01). After multivariate analysis, SUVmax was significantly associated with a positive structural diagnosis of COVID-19 pneumonia (odds ratio=0.63, 95% confidence interval=0.41–0.90; p=0.02). The ROC curve of the regression model intended to confirm or rule out the structural diagnosis of COVID-19 pneumonia showed an AUC of 0.77 (standard error=0.072, p=0.003).
ConclusionsIn those patients referred for standard oncologic and non-oncologic indications (43/559; 7.7%) during pandemic, imaging with 18F-FDG PET/CT is a useful tool during incidental detection of COVID-19 pneumonia. Several CT findings characteristic of COVID-19 pneumonia, specifically those included in diagnostic CO-RADS scores (5–6), were associated with higher SUVmax values.
En diciembre de 2019, se aisló en Wuhan, China, una cepa de coronavirus denominada SARS-CoV-2 (síndrome respiratorio agudo severo coronavirus 2) causante de la enfermedad por coronavirus 2019 (COVID-19), y que se extendió rápidamente a prácticamente todo el mundo, provocando una situación de pandemia global. Inicialmente, Italia y España fueron los países más afectados después de China.
El espectro clínico de la COVID-19 es muy variable. En la mayoría de los casos, se manifiesta como síntomas inespecíficos e incluso puede permanecer asintomático. La mayoría de los pacientes sobreviven a la infección primaria sin desarrollar complicaciones; sin embargo, una proporción considerable de la población desarrolla complicaciones potencialmente mortales, como una neumonía grave con síndrome de distrés respiratorio agudo.
Aunque se ha expresado preocupación por la baja sensibilidad de la prueba de la reacción en cadena de la polimerasa con transcriptasa inversa (rRT-PCR) en muestras obtenidas del tracto respiratorio, hasta la fecha constituye la prueba de referencia para el diagnóstico de la COVID-191. Algunas técnicas de imagen, como la TC torácica, pueden mostrar hallazgos altamente sugestivos de la infección desde fases tempranas. Además, se ha visto que algunos de los patrones de la TC observados en pacientes con neumonía por COVID-191 eran incluso más sensibles que los resultados de la rRT-PCR.
Los pacientes con cáncer, especialmente los mayores de 60 años, constituyen una subpoblación de alto riesgo durante los brotes por COVID-192. La imagen multimodal PET/TC con 18flúor-fludeoxiglucosa [18F]FDG desempeña un papel importante en el proceso de evaluación, seguimiento y monitorización de la respuesta al tratamiento en diferentes enfermedades de índole oncológica, infecciosa e inflamatoria. Aunque esta modalidad de imagen no se utiliza de forma rutinaria en el tratamiento de los pacientes con COVID-19, en algunos casos puede aportar un valor diagnóstico complementario considerando la información tomográfica y metabólica obtenidas simultáneamente en un mismo estudio. Además, un conocimiento más profundo de los tejidos afectados por la infección por SARS-CoV-2 puede aportar nuevos conocimientos sobre la patogenia de la infección vírica y de la respuesta del huésped, e incluso podría ayudar a diagnosticar la afectación pulmonar y a distancia en casos seleccionados. Sin embargo, aún no se ha evaluado en detalle el potencial valor diagnóstico de la actividad metabólica combinada con aquellos hallazgos tomográficos pulmonares sugestivos de neumonía por COVID-19 en los estudios PET/TC. Mediante la aplicación de la PET/TC con [18F]FDG, en nuestro estudio se propuso explorar el comportamiento metabólico pulmonar de diferentes hallazgos incidentales en el parénquima pulmonar e integrados en las categorías del Sistema de Informe y Registro de datos de COVID-19 (CO-RADS), y que han demostrado su utilidad diagnóstica en la neumonía por COVID-193,4.
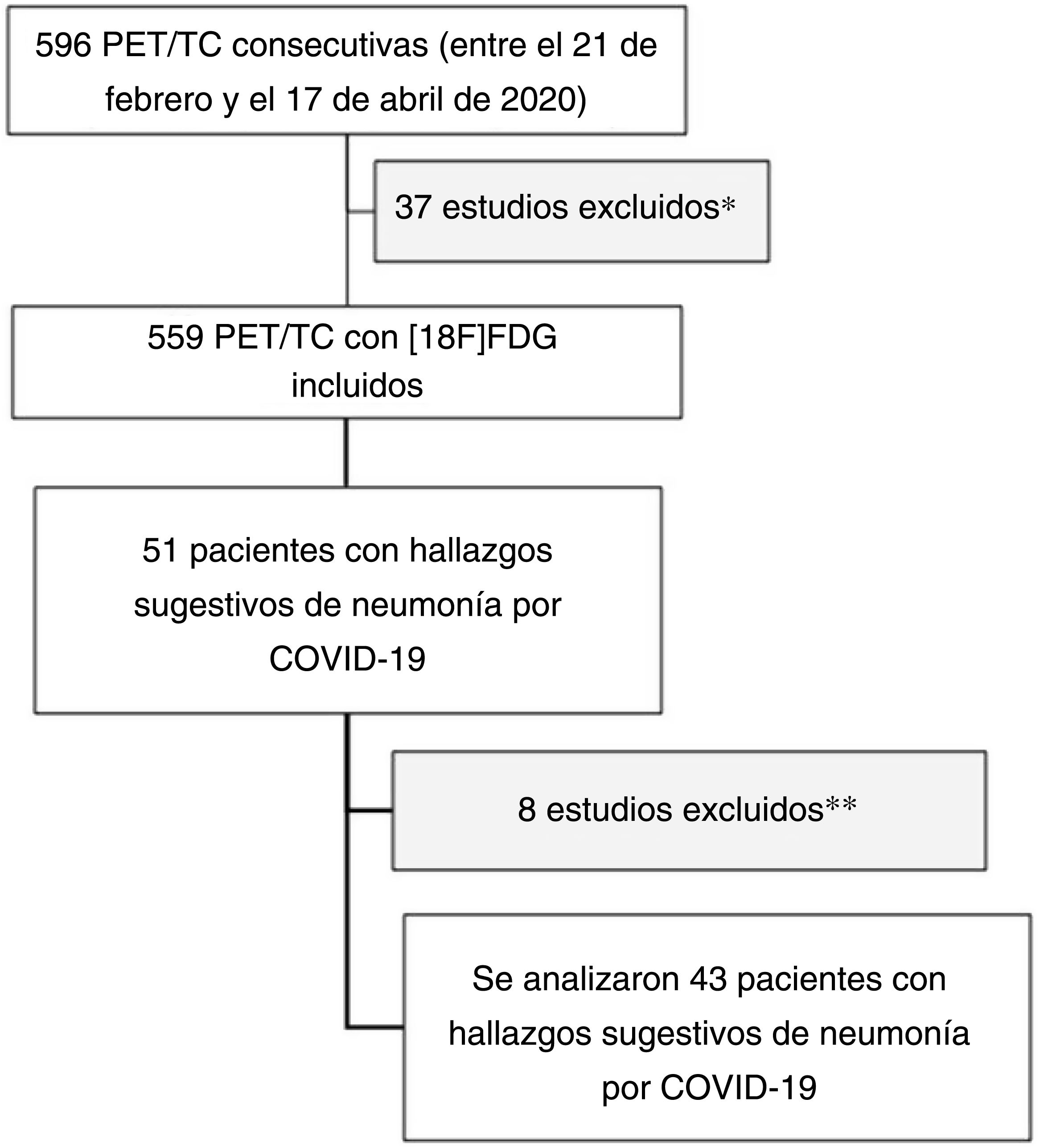
Material y métodosSelección de los pacientesEntre el 21 de febrero y el 17 de abril de 2020 se realizaron un total de 596 estudios PET/TC. Tras excluir aquellos estudios PET realizados con radiotrazadores distintos de la [18F]FDG y los estudios cerebrales localizados, un total de 559 estudios consecutivos con [18F]FDG fueron incluidos. De acuerdo con las recomendaciones de la Asociación Europea de Medicina Nuclear en el momento de la elaboración del estudio, aquellos pacientes que presentaran algún síntoma sugestivo de infección de las vías respiratorias eran tributarios de suspenderse dicha prueba. Los datos obtenidos de estos estudios PET/TC fueron revisados retrospectivamente para identificar a aquellos con hallazgos incidentales sugestivos de neumonía por COVID-19. Se evaluó la presencia de los diferentes signos estructurales descritos dentro de las categorías de la clasificación CO-RADS, así como el valor máximo de captación estandarizado (SUVmáx) en las imágenes de la PET de pulmón3,4. Se recogieron las variables demográficas, la indicación de la PET/TC (oncológica vs. no oncológica), enfermedades autoinmunes/procesos inflamatorios conocidos y los resultados de la rRT-PCR, cuando estuvieron disponibles. La figura 1 muestra el diagrama de flujo del estudio.
Diagrama de flujo del diseño observacional.
*: Estudios PET/TC con radiotrazadores diferentes de la [18F]FDG y estudios cerebrales selectivos (PET cerebral funcional o tumoral).
**: limitaciones técnicas secundarias a imágenes de la TC torácica subóptimas para obtener una adecuada interpretación experta de los hallazgos estructurales.
Siguiendo el protocolo habitual de adquisición de la PET/TC con [18F]FDG, se precisó un mínimo de 6h de ayuno (4h en pacientes diabéticos) y un nivel de glucemia <200mg/dl previo a la adquisición. Todos los estudios se realizaron tras la administración intravenosa de [18F]FDG (5MBq/kg), permaneciendo el paciente en reposo durante los 50min previos a la adquisición. Todos los estudios se obtuvieron siguiendo las directrices de la Asociación Europea de Medicina Nuclear empleando el mismo equipo (Biograph 6 True Point; Siemens) con un detector de TC de 6 anillos, realizando un TC diagnóstico (Topogram Dose Modulation System, CARE Dose4D, grosor de corte: 5mm, intervalo de reconstrucción: 3mm). En ausencia de contraindicaciones, se administró un agente de contraste yodado por vía intravenosa (130ml, 45s de latencia, velocidad: 2,5ml/s). Se reconstruyó un primer estudio de TC torácica en fase inspiratoria realizando cortes de 2,5mm de grosor, 60mAs y 110KV, con un tiempo de rotación del tubo de 0,6s y un pitch o factor de desplazamiento del corte de 1,2. A continuación, se obtuvo la TC corporal en respiración libre desde la base del cráneo hasta la parte proximal de los muslos, con modificaciones dependiendo de la localización de la patología. Por último, se adquirió el estudio PET con la misma localización que el estudio TC, con un tiempo de adquisición de 3min por movimiento de la mesa de exploración (bed). Las imágenes de la PET se reconstruyeron de forma iterativa con y sin corrección de atenuación (en base a la información de la TC) y se reorientaron según cortes axiales, sagitales y coronales.
Interpretación de las imágenesTodas las exploraciones PET/TC fueron revisadas por al menos dos médicos especialistas (un médico nuclear y un radiólogo). Un radiólogo experto registró todos los signos individuales sugestivos de neumonía por COVID-19 y los clasificó según los criterios CO-RADS3,4. El médico nuclear delimitó los volúmenes de interés con el fin de obtener el SUVmáx del parénquima pulmonar. El diagnóstico de neumonía por COVID-19 se estableció a partir de la combinación de hallazgos pulmonares estructurales en la PET/TC con una rRT-PCR positiva, o según el criterio clínico del médico tratante.
Análisis estadísticoLas variables discretas se presentaron como n (%) y las continuas como media±desviación estándar o mediana (rango intercuartil). En primer lugar, se realizó un análisis univariante para describir el SUVmáx de la captación de [18F]FDG de los diferentes hallazgos en el parénquima pulmonar detectados en la TC torácica, determinados por un radiólogo que desconocía los hallazgos metabólicos en todos los pacientes. Los diferentes hallazgos estructurales se calcularon de forma absoluta y según su frecuencia relativa (n, %), tanto en los pacientes incluidos en el grupo diagnóstico (puntuaciones CO-RADS: 5-6) como en el grupo con hallazgos no sugestivos de neumonía COVID-19 (puntuaciones CO-RADS: 2-4)3,4. Para aquellos hallazgos que se detectaron con mayor frecuencia (al menos en el 50% de los pacientes con infiltrados pulmonares), se comparó el SUVmáx de los pacientes con CO-RADS 5-6 vs. CO-RADS 2-4 mediante una prueba «t-test» para datos no apareados o mediante una prueba no paramétricas de Mann-Whitney. En aquellos hallazgos estructurales menos frecuentes (detectados en menos del 50% de los pacientes), se compararon los valores de SUVmáx de los pacientes con vs. sin cada uno de los hallazgos de la TC (sí/no). Este primer enfoque analítico tenía como objetivo estimar la captación de la [18F]FDG asociada a los diferentes hallazgos estructurales individuales, signos y patrones incluidos en las categorías CO-RADS. A continuación, se aplicó un análisis multivariante. Se ajustó un modelo de regresión logística con la variable dependiente binaria considerada como el diagnóstico tomográfico de neumonía COVID-19 (puntuación CO-RADS 5-6), teniendo en cuenta su elevado rendimiento diagnóstico3,4. A continuación, los hallazgos estructurales y metabólicos seleccionados obtenidos mediante imagen multimodal se consideraron variables independientes para predecir el diagnóstico tomográfico de neumonía por COVID-19. Debido al bajo número de exploraciones FDG con diagnóstico estructural de alta sospecha o diagnóstico estructural confirmado, únicamente se incluyeron en el modelo aquellas variables multimodales no consideradas o con un menor peso relativo dentro de la puntuación CO-RADS que demostraron un valor de la p<0,05 tras el análisis univariable. Se evaluó la bondad de ajuste obteniendo la razón de verosimilitud logarítmica (G-cuadrado). Se calcularon los coeficientes beta estimados, las odds ratio (cociente de posibilidades) con un intervalo de confianza del 95%, así como los valores Z para cada variable independiente. Se construyó una curva ROC de eficacia diagnóstica para el modelo, caracterizada por su área bajo la curva (AUC), error estándar y poder predictivo negativo y positivo. Todos los análisis estadísticos se llevaron a cabo con el programa GraphPad Prism 9.0, considerando un valor significativo de la p<0,05 (bilateral).
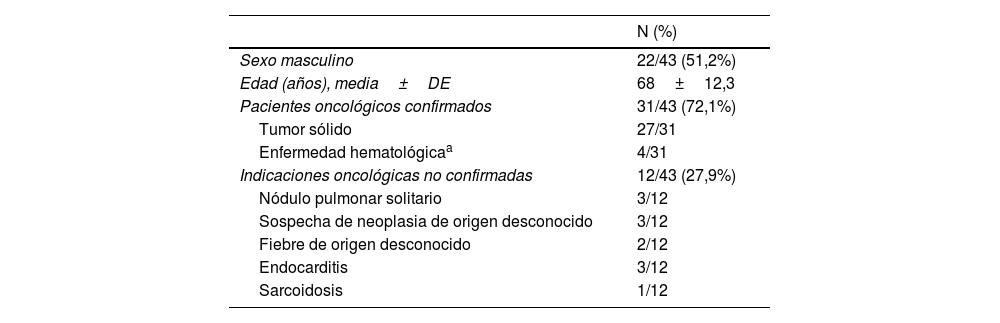
ResultadosCaracterísticas de la población del estudioSe analizaron un total de 43 pacientes con signos sugestivos de neumonía por COVID-19, de 559 pacientes consecutivos remitidos para PET/TC. El 51,2% eran varones, de edades comprendidas entre los 42 y 93 años. La tabla 1 resume las variables demográficas y las indicaciones de la PET/TC de todos los sujetos incluidos. Los pacientes incluidos fueron remitidos principalmente para la realización de una PET/TC por motivos de estadificación (n=8), planificación de la radioterapia (n=2), evaluación de la respuesta/seguimiento del tratamiento (n=19), o por la sospecha de recurrencia (n=2) de enfermedades oncológicas (31/43, 72,1%), según el criterio clínico del equipo prescriptor de Oncología. Ninguno del resto de los pacientes (n=12, 27,9%) refirió antecedentes de enfermedad oncológica confirmada. Estos pacientes fueron remitidos por sospecha de un proceso inflamatorio/infeccioso o durante la evaluación diagnóstica rutinaria del hallazgo de un nódulo pulmonar solitario o de un proceso neoplásico de origen desconocido.
Características de la población del estudio. Variables demográficas e indicaciones de la PET/TC en pacientes con hallazgos en parénquima pulmonar sugestivos de neumonía por COVID-19 (n=43)
| N (%) | |
|---|---|
| Sexo masculino | 22/43 (51,2%) |
| Edad (años), media±DE | 68±12,3 |
| Pacientes oncológicos confirmados | 31/43 (72,1%) |
| Tumor sólido | 27/31 |
| Enfermedad hematológicaa | 4/31 |
| Indicaciones oncológicas no confirmadas | 12/43 (27,9%) |
| Nódulo pulmonar solitario | 3/12 |
| Sospecha de neoplasia de origen desconocido | 3/12 |
| Fiebre de origen desconocido | 2/12 |
| Endocarditis | 3/12 |
| Sarcoidosis | 1/12 |
DE: desviación estándar.
Ocho de los 43 pacientes con neumonía sugestiva de COVID-19 presentaban enfermedades autoinmunes o inflamatorias conocidas en el momento de la PET/TC, siendo 6 clasificados como CO-RADS 5-6 y 2 como CO-RADS 4.
La rRT-PCR estuvo disponible en 14 pacientes: siendo positiva en 8 de ellos (dando lugar a la categoría CO-RADS 6) y siendo negativa en los 6 pacientes restantes (3 clasificados como CO-RADS 4, y 3 como CO-RADS 5).
CO-RADS y SUVmáxVeinte pacientes presentaron una categoría CO-RADS 5-6 y 23 pacientes se clasificaron como CO-RADS 2-4. Los pacientes incluidos en ambos grupos CO-RADS (puntuaciones: 5-6 vs. 2-4) fueron comparables en cuanto a su distribución por sexo (varón: 50,0 vs. 52,2%, p>0,99) y edad (68,9±12,2 vs. 67,0±13,4 años, p=0,65). Los valores SUVmáx fueron mayores en aquellos pacientes que presentaban una categoría CO-RADS 5-6 respecto a aquellos sujetos con categorías CO-RADS más bajas e inespecíficas (6,1±3,0 vs. 3,6±2,1, p=0,004). Por el contrario, los valores SUVmáx no mostraron diferencias según la indicación de la PET/TC (confirmación de proceso neoplásico: 4,6±2,9 vs. indicaciones no oncológicas: 5,1±2,8, p=0,62), así como tampoco según la presencia de tumores sólidos vs. trastornos hematológicos (4,5±2,8 vs. 5,2±3,5, p=0,65).
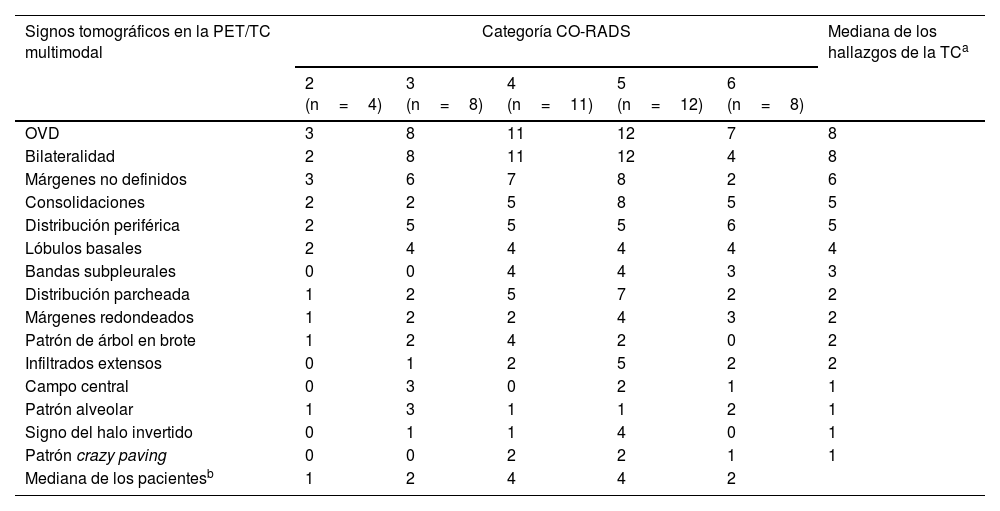
La tabla 2 muestra la frecuencia de los hallazgos tomográficos principales. Todos los pacientes mostraron un mínimo de 2 hallazgos estructurales en la TC torácica, con un importante solapamiento de patrones y signos en cada paciente. En casi todos los pacientes se observaron opacidades en vidrio deslustrado (OVD) (41/43, 95,3%), predominantemente de distribución bilateral (n=37). En 5 pacientes se observaron 8 hallazgos concomitantes en la TC de categorías CO-RADS (en 3 de ellos CO-RADS 5-6), 7 hallazgos en 10 pacientes (CO-RADS 5-6: 7), 6 hallazgos en 16 pacientes (CO-RADS 5-6 en 7 de ellos), 5 hallazgos en 6 pacientes (CO-RADS 5-6: 1), 4 hallazgos en 4 pacientes y 3 hallazgos en 3 pacientes (clasificados como CO-RADS 5-6 en uno de cada grupo). Todos los pacientes excepto 3 (17/20) clasificados como CO-RADS 5-6 mostraron un mínimo de 6 hallazgos estructurales (tabla 3). Los hallazgos menos frecuentes fueron el signo del halo invertido (n=1, CO-RADS: 5), y la presencia de adenopatías hiliares que se interpretaron como no tumorales (n=1, CO-RADS: 6). No se detectó derrame pleural en ningún paciente.
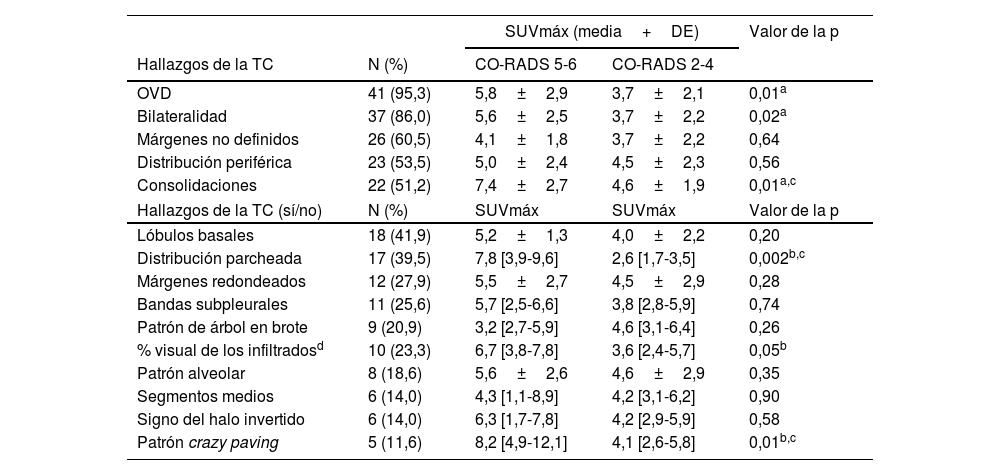
Asociación univariable entre la captación de [18F]FDG y los hallazgos estructurales individuales
| SUVmáx (media+DE) | Valor de la p | |||
|---|---|---|---|---|
| Hallazgos de la TC | N (%) | CO-RADS 5-6 | CO-RADS 2-4 | |
| OVD | 41 (95,3) | 5,8±2,9 | 3,7±2,1 | 0,01a |
| Bilateralidad | 37 (86,0) | 5,6±2,5 | 3,7±2,2 | 0,02a |
| Márgenes no definidos | 26 (60,5) | 4,1±1,8 | 3,7±2,2 | 0,64 |
| Distribución periférica | 23 (53,5) | 5,0±2,4 | 4,5±2,3 | 0,56 |
| Consolidaciones | 22 (51,2) | 7,4±2,7 | 4,6±1,9 | 0,01a,c |
| Hallazgos de la TC (sí/no) | N (%) | SUVmáx | SUVmáx | Valor de la p |
| Lóbulos basales | 18 (41,9) | 5,2±1,3 | 4,0±2,2 | 0,20 |
| Distribución parcheada | 17 (39,5) | 7,8 [3,9-9,6] | 2,6 [1,7-3,5] | 0,002b,c |
| Márgenes redondeados | 12 (27,9) | 5,5±2,7 | 4,5±2,9 | 0,28 |
| Bandas subpleurales | 11 (25,6) | 5,7 [2,5-6,6] | 3,8 [2,8-5,9] | 0,74 |
| Patrón de árbol en brote | 9 (20,9) | 3,2 [2,7-5,9] | 4,6 [3,1-6,4] | 0,26 |
| % visual de los infiltradosd | 10 (23,3) | 6,7 [3,8-7,8] | 3,6 [2,4-5,7] | 0,05b |
| Patrón alveolar | 8 (18,6) | 5,6±2,6 | 4,6±2,9 | 0,35 |
| Segmentos medios | 6 (14,0) | 4,3 [1,1-8,9] | 4,2 [3,1-6,2] | 0,90 |
| Signo del halo invertido | 6 (14,0) | 6,3 [1,7-7,8] | 4,2 [2,9-5,9] | 0,58 |
| Patrón crazy paving | 5 (11,6) | 8,2 [4,9-12,1] | 4,1 [2,6-5,8] | 0,01b,c |
Resultados del SUVmáx parenquimatoso medidos en pacientes con diferentes hallazgos en la TC pulmonar. Los resultados se presentan en relación con la clasificación de los grupos CO-RADS (puntuaciones: 5-6 vs. 2-4) o respecto a la presencia de cada hallazgo estructural (sí/no). Cada hallazgo individual de la TC se expresa como media+DE o mediana [IQR].
CO-RADS: Criterios de la clasificación de COVID-19 Reporting and Data System; DE: desviación estándar; FDG: fludeoxiglucosa; IQR: rango intercuartil; OVD: opacidades en vidrio deslustrado.
Categorías CO-RADS con los hallazgos de la TC en cada una de ellas
| Signos tomográficos en la PET/TC multimodal | Categoría CO-RADS | Mediana de los hallazgos de la TCa | ||||
|---|---|---|---|---|---|---|
| 2 (n=4) | 3 (n=8) | 4 (n=11) | 5 (n=12) | 6 (n=8) | ||
| OVD | 3 | 8 | 11 | 12 | 7 | 8 |
| Bilateralidad | 2 | 8 | 11 | 12 | 4 | 8 |
| Márgenes no definidos | 3 | 6 | 7 | 8 | 2 | 6 |
| Consolidaciones | 2 | 2 | 5 | 8 | 5 | 5 |
| Distribución periférica | 2 | 5 | 5 | 5 | 6 | 5 |
| Lóbulos basales | 2 | 4 | 4 | 4 | 4 | 4 |
| Bandas subpleurales | 0 | 0 | 4 | 4 | 3 | 3 |
| Distribución parcheada | 1 | 2 | 5 | 7 | 2 | 2 |
| Márgenes redondeados | 1 | 2 | 2 | 4 | 3 | 2 |
| Patrón de árbol en brote | 1 | 2 | 4 | 2 | 0 | 2 |
| Infiltrados extensos | 0 | 1 | 2 | 5 | 2 | 2 |
| Campo central | 0 | 3 | 0 | 2 | 1 | 1 |
| Patrón alveolar | 1 | 3 | 1 | 1 | 2 | 1 |
| Signo del halo invertido | 0 | 1 | 1 | 4 | 0 | 1 |
| Patrón crazy paving | 0 | 0 | 2 | 2 | 1 | 1 |
| Mediana de los pacientesb | 1 | 2 | 4 | 4 | 2 | |
CO-RADS: Criterios de la clasificación de COVID-19 Reporting and Data System.
Como se muestra en la tabla 2, las OVD, la bilateralidad y las consolidaciones mostraron los valores de SUVmáx más elevados (valores de la p de 0,01, 0,02 y 0,01, respectivamente) en aquellos pacientes con puntuaciones CO-RADS 5-6. La distribución parcheada y el patrón crazy paving también se asociaron a un mayor SUVmáx (valores de la p de 0,002 y 0,01). El SUVmáx pulmonar fue mayor en los pacientes con los infiltrados más extendidos, pero sin alcanzar significación estadística. No hubo diferencias en la captación de [18F]FDG asociada a otros hallazgos estructurales individuales.
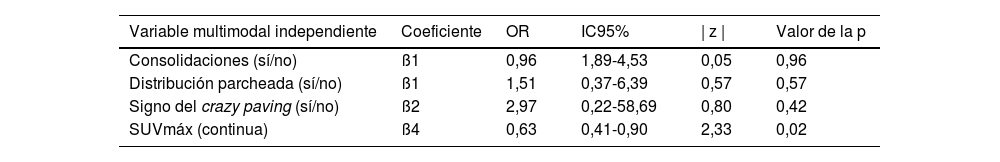
Análisis multivariante de la asociación entre el diagnóstico CO-RADS y las variables incluidas en el modeloEn la tabla 4 se resumen los resultados del análisis de regresión logística, incluyendo los hallazgos multimodales seleccionados como variables independientes. No se observó asociación estadística entre el diagnóstico CO-RADS y otras variables estructurales incluidas en el modelo, como fueron las consolidaciones (odds ratio=0,96; intervalo de confianza del 95%=1,89-4,53; p=0,96), la distribución parcheada de los infiltrados (odds ratio=1,51; intervalo de confianza del 95%=0,37-6,39; p=0,57) y el patrón en crazy paving(odds ratio=2,97; intervalo de confianza del 95%=0,22-58,69; p=0,42). Por el contrario, el SUVmáx pulmonar se asoció significativamente con un diagnóstico estructural positivo de neumonía por COVID-19 (odds ratio=0,64; intervalo de confianza del 95%=0,41-0,90; p=0,02). La curva ROC del modelo de regresión destinado a confirmar o descartar el diagnóstico estructural de neumonía por COVID-19 mostró un AUC de 0,77 (error estándar=0,072; p=0,003) (fig. 2).
Resultados del análisis multivariante. Se incluyeron los resultados seleccionados de la imagen multimodal en calidad de variables independientes para predecir el diagnóstico estructural de neumonía por COVID-19
| Variable multimodal independiente | Coeficiente | OR | IC95% | | z | | Valor de la p |
|---|---|---|---|---|---|
| Consolidaciones (sí/no) | ß1 | 0,96 | 1,89-4,53 | 0,05 | 0,96 |
| Distribución parcheada (sí/no) | ß1 | 1,51 | 0,37-6,39 | 0,57 | 0,57 |
| Signo del crazy paving (sí/no) | ß2 | 2,97 | 0,22-58,69 | 0,80 | 0,42 |
| SUVmáx (continua) | ß4 | 0,63 | 0,41-0,90 | 2,33 | 0,02 |
ß: coeficiente beta; IC95%: intervalo de confianza del 95%; OR: odds ratio (cociente de posibilidades).
En las figuras 3 y 4 se ilustran casos seleccionados, que muestran una combinación de diferentes hallazgos estructurales y de captación pulmonar parenquimatosa de [18F]FDG.
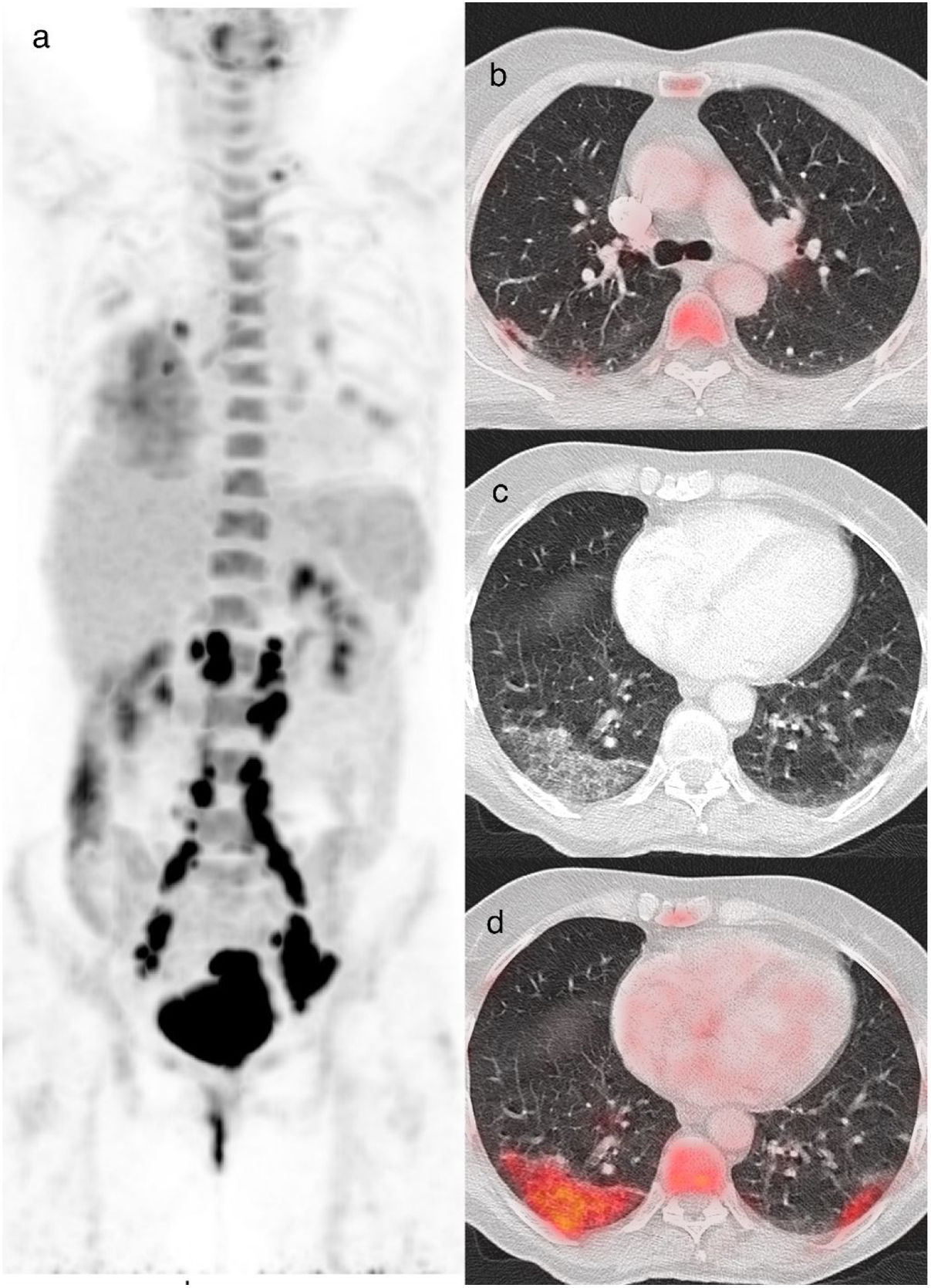
Mujer de 60 años diagnosticada de un carcinoma de cuello uterino. Se realizó una PET/TC para evaluar la afectación de los ganglios linfáticos. La imagen de proyección de máxima intensidad (a) muestra un aumento de la captación de la [18F]FDG en el cuello uterino y en adenopatías de localización supraclavicular izquierda e infradiafragmática, relacionadas ambas con su patología oncológica de base. También se visualiza captación del radiotrazador en pulmones y en adenopatías hiliares y subcarinales, hallazgos relacionados con patología infecciosa/inflamatoria. Los cortes axiales y de la TC mostraron una banda subpleural en el lóbulo superior derecho (b), un patrón en crazy paving periférico en el lóbulo inferior derecho, y un patrón de OVD bilateral (c), con aumento de la captación de [18F]FDG y un valor SUVmáx de 5,5 (d). La rRT-PCR fue positiva para COVID-19 (CO-RADS 6).
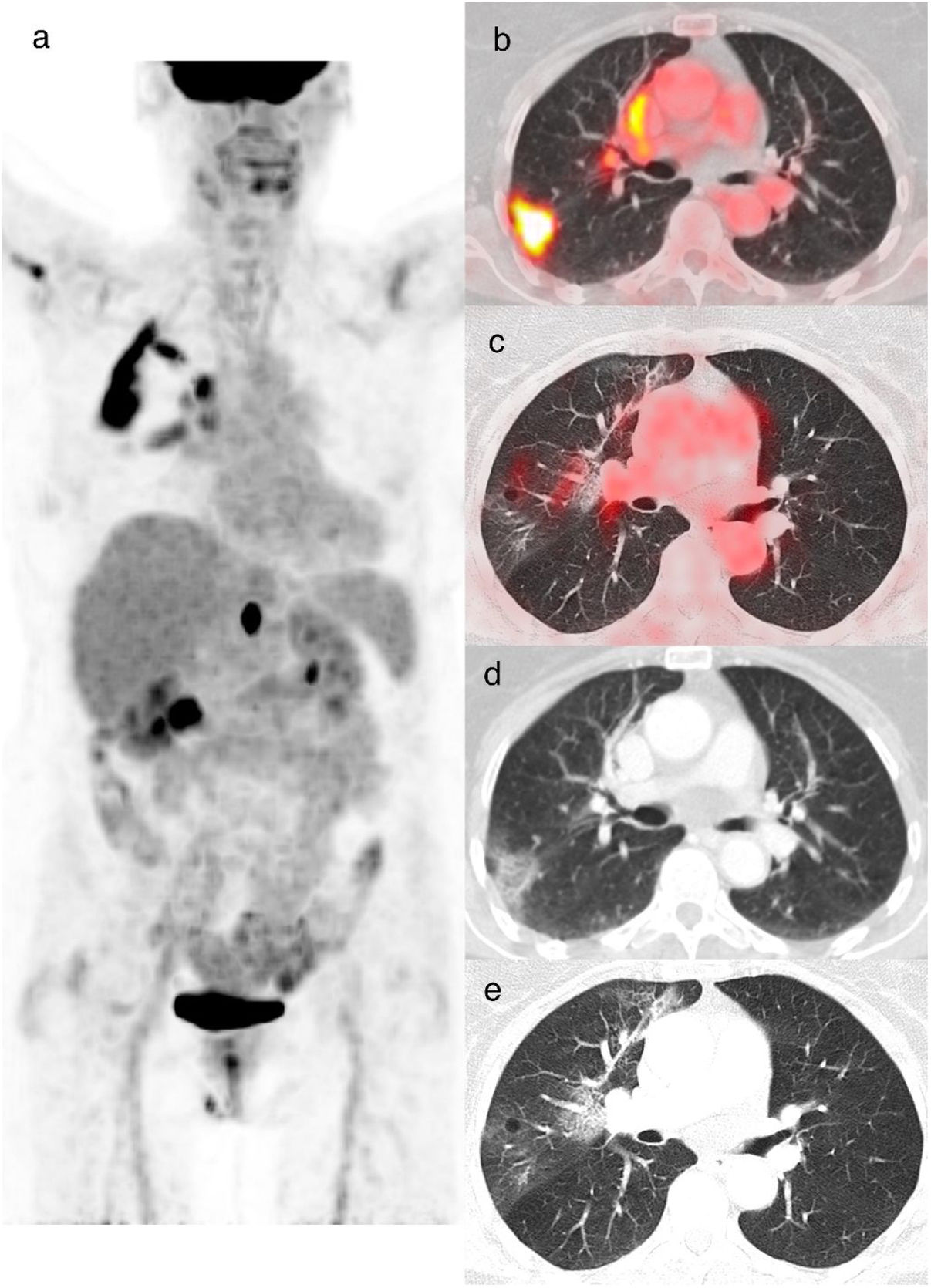
Mujer de 85 años con cáncer de colon. Se realizó una PET/TC para evaluación de respuesta al tratamiento. La imagen de proyección de máxima intensidad (a) muestra un foco de captación abdominal de la [18F]FDG en relación con una adenopatía retrocrural infiltrativa. También muestra un aumento de la captación del radiotrazador en el pulmón derecho. Los cortes axiales de fusión (b y c) y de la TC (d y e) muestran un aumento de la captación de [18F]FDG (SUVmáx 13,2) en las OVD periféricas del lóbulo superior derecho. El corte axial de la TC (e) muestra un patrón crazy paving periférico en el lóbulo superior derecho. La rRT-PCR para COVID-19 fue positiva (CO-RADS 6).
Hemos detectado hallazgos incidentales sugestivos de neumonía por COVID-19 en el 7,7% de los pacientes remitidos para la realización de una PET/TC. Esta proporción es similar a la tasa descrita en un metaanálisis reciente sobre hallazgos de la PET/TC con [18F]FDG (2,1-16,2%)5. Aunque algunas investigaciones se han centrado en el posible valor diagnóstico del SUVmáx pulmonar en la neumonía por COVID-19, hasta el presente no se ha evaluado en detalle el comportamiento metabólico de los diferentes cambios parenquimatosos producidos en el pulmón e integrados o no dentro de las categorías CO-RADS.
Como era de esperar, hemos detectado un solapamiento importante de signos en la TC de cada paciente, que fueron más evidentes en aquellos pacientes con hallazgos típicos en la TC o con neumonía por COVID-19 confirmada (el 85% de nuestros pacientes clasificados como CO-RADS 5-6 mostraron un mínimo de 6 hallazgos estructurales en la TC). Además, un SUVmáx pulmonar más elevado se asoció con algunos signos en la TC de pacientes con puntuaciones CO-RADS más elevadas, especialmente la OVD, la bilateralidad y la presencia de consolidaciones. Centrándonos en la neumonía por COVID-19, la manifestación radiológica descrita con mayor frecuencia es la presencia de OVD bilateral6.
El cambio metabólico hacia la glucólisis anaeróbica producido en las células inflamatorias activadas que sobreexpresan transportadores de la glucosa da lugar a un aumento en la captación de [18F]FDG7. Algunos estudios previos han revelado que el número de células T CD45+ y CD8+ presentes en los hallazgos del parénquima pulmonar se correlaciona de forma positiva con el SUVmáx8. La inflamación linfocítica perivascular con preservación de la luz de la vía respiratoria distal es la principal característica histopatológica observada en los estadios tanto iniciales como tardíos de la neumonía por SARS-CoV-29–12.
La evolución fisiopatológica y estructural de la neumonía por COVID-19 puede subdividirse en 4 estadios morfológicos principales. En primer lugar, la fase temprana (día 0-1) se caracteriza por la presencia de edema focal, la lesión epitelial incipiente y la capilaritis/endotelitis neutrofílica, a menudo combinada con fenómenos de microtrombosis. En los días 1-7 se desarrolla una segunda fase de lesión alveolar difusa (LAD) de carácter exudativo. En este estadio, los pacientes con insuficiencia respiratoria significativa presentan LAD con formación de membrana hialina y una hiperplasia de neumocitos de tipo 2, complicada de forma variable por sobreinfección. La presencia de OVD con engrosamiento reticular intersticial en la TC se asocia a este estadio intermedio de la LAD. A medida que la enfermedad progresa, la OVD puede desaparecer o hacerse más confluente y generalizada, llegando incluso a desarrollar una consolidación parenquimatosa significativa En esta situación, el patrón de consolidación se asocia principalmente a estadios tardíos de LAD, consistentes en la tercera fase organizativa (≥1 semana), y posteriormente con la fase de fibrosis tardía (semanas-meses). Aunque este esquema cronológico relata una progresión ordenada a través de los diferentes estadios, e incluso cuando la fase de fibrosis suele asociarse a la enfermedad grave de larga evolución, resulta llamativo constatar que a menudo coexisten diferentes manifestaciones de la LAD, lo que refleja la marcada heterogeneidad espacial y temporal asociada a la neumonía por COVID-1913–16.
Dado que el primer estadio morfológico de la neumonía COVID-19 se caracteriza por la presencia de un escaso número de elementos celulares (especialmente en las regiones intraalveolares llenas de líquido), parece coherente encontrar valores de SUVmáx más bajos en la PET/TC de los pacientes que sufren la infección pulmonar inicial. Durante los estadios morfológicos 2 y 3, que a su vez corresponderían a la presencia de OVD y de consolidación en la TC (especialmente observados en las categorías CO-RADS 3 a 5), el componente celular e inflamatorio se hace más prominente, dando lugar a valores de SUVmáx más elevados, como se ha observado en nuestros pacientes. Por último, durante el estadio morfológico 4, la destrucción del parénquima pulmonar y el desarrollo de fibrosis pulmonar de grado variable podrían explicar los valores SUVmáx más bajos obtenidos en la PET/TC (CO-RADS 1)3,4,14–16. Teniendo en cuenta que nuestra experiencia incluyó pacientes remitidos a la realización de una PET/TC durante el primer brote local de la pandemia, resultó difícil detectar y analizar esta fase metabólica tardía de la neumonía por COVID-19.
En cuanto al mencionado patrón crazy paving, que se presenta como septos interlobulares engrosados y/o líneas intralobulares superpuestas a un patrón de vidrio deslustrado subyacente, histopatológicamente corresponde a la LAD en fase exudativa (estadio 2), caracterizada por un engrosamiento de los septos alveolares junto con infiltración perivascular de naturaleza linfo-plasmocítica. Por otra parte, la distribución parcheada corresponde histológicamente a la presencia de lesión y trombosis vasculares (inflamación endotelial/microtrombos/microhemorragias), así como a LAD de carácter exudativo (estadios 1 y 2)17,18. Por lo tanto, el elevado componente celular inflamatorio existente se traduce en una elevada captación de [18F]FDG, observada en los pacientes de nuestro estudio que mostraban estos dos patrones descritos (crazy paving y la distribución parcheada).
Algunos investigadores han postulado que la captación de [18F]FDG en la neumonía por COVID-19 podría estar relacionada principalmente con la presencia de infiltración de neutrófilos observada en la autopsia de pacientes con sobreinfección bacteriana19. También se ha sugerido que estos cambios podrían estar relacionados fundamentalmente con la aparición habitual de neumonía bacteriana asociada a la ventilación mecánica. Creemos que la hipótesis de un escenario histopatológico que difiere notablemente de la típica inflamación linfocítica alrededor de vasos pulmonares, bronquiolos y dentro del espacio intersticial (predominantemente producida por células T CD8+ y CD4+) de la neumonía por SARS-CoV-210–12,20 debe someterse a su evaluación en las futuras investigaciones prospectivas.
La complejidad histopatológica de la neumonía por COVID-19 no se limita a una simple infiltración de células de naturaleza infecciosa e inflamatoria, sino que también puede ir acompañada de una lesión vascular variable, como la exudación y la trombosis capilares. Además, la variabilidad existente en el SUVmáx del parénquima pulmonar también podría verse influida no solamente por el tiempo transcurrido desde la infección, la cepa vírica y las comorbilidades del paciente, sino también por varios factores como son el peso del paciente, los artefactos producidos por el movimiento, los niveles de glucemia regional y sistémica, la extravasación de la dosis, la precisión en la calibración de la dosis y el intervalo transcurrido entre la inyección y la obtención de las imágenes. La amplia variabilidad y combinación de cambios pulmonares estructurales observados en nuestros pacientes, generalmente asociados a un estado inflamatorio sistémico de grado variable, podría justificar la heterogeneidad en los resultados obtenidos por parte de diferentes investigadores. Bahloul et al., por ejemplo, hallaron que los pacientes con neumonía por COVID-19 confirmada mostraban una mayor alteración en la TC pero una menor tasa de consolidación y de SUVmáx en comparación con los sujetos sin COVID-1921, mientras que Dietz et al. no hallaron correlación entre el estado inflamatorio con la evolución de la TC torácica o la evolución clínica adversa tras comparar los pacientes con COVID-19 que mostraban un SUVmáx ≥7 vs. unos valores <7, respectivamente, en relación con la valoración de hallazgos «inflamatorios» vs. «poco inflamatorios». En esta última investigación, los autores observaron que aquellos pacientes con COVID-19 que presentaron OVD o consolidación en la TC torácica inicial mostraban diferentes signos de inflamación pulmonar en el presunto pico de la fase inflamatoria, con una amplia variabilidad entre la afectación leve y extensa22.
Es importante aclarar que la presencia de adenopatías (definidas como aquellas con una dimensión del eje corto ≥10mm) se ha analizado exclusivamente en la TC, ya que las categorías CO-RADS se basan en los hallazgos de la TC y únicamente se observó en un paciente3. Este número sería mayor si hubiéramos tenido en cuenta la captación de radiotrazador en los ganglios linfáticos mediastínicos descrita en los pacientes con COVID-19 y sometidos a PET/TC, y que generalmente no se corresponde con un aumento de tamaño ganglionar en la TC22–27.
En relación con los pacientes oncológicos, es importante realizar un diagnóstico diferencial de la neumonía por COVID-19 con diversas enfermedades pulmonares de naturaleza inflamatoria/infecciosa y producidas por otros agentes de naturaleza vírica, bacteriana o fúngica, así como la neumonía infecciosa concomitante y otras menos frecuentes, enfermedades de etiología no infecciosa como son la vasculitis pulmonar, la dermatomiositis, la neumonía organizada y los cambios posterapéuticos relacionados con el proceso neoplásico, como la neumonitis por radiación o citostáticos, la linfangitis carcinomatosa o las lesiones tumorales secundarias o de nueva aparición. En los pacientes no oncológicos, esta diferenciación también es extremadamente importante para definir su adecuado tratamiento terapéutico. En ambos casos, es clínicamente relevante que los especialistas en medicina nuclear y en radiología presten una especial atención a los hallazgos incidentales sugestivos de neumonía por COVID-19 en los estudios PET/TC con [18F]FDG, especialmente en aquellas poblaciones de alto riesgo2.
Asumimos que nuestro estudio presenta algunas limitaciones. La primera se debe intrínsecamente a la reducida muestra de pacientes estudiada en un único centro de referencia. Lamentablemente, la práctica clínica durante la situación de emergencia de salud pública implicó que la rRT-PCR no estuviera disponible en muchos pacientes con hallazgos de PET/TC sugestivos de neumonía por COVID-19. Aunque el diagnóstico de neumonía por COVID-19 se basó en los resultados de investigaciones previas que demostraron un elevado rendimiento diagnóstico de la combinación de los hallazgos de TC con o sin confirmación molecular (categorías CO-RADS 6 o 5, respectivamente), nuestros resultados requieren su confirmación ulterior mediante investigaciones a mayor escala. Una muestra más amplia podría proporcionar mayor potencia al análisis ultivariante, y definir la predisposición potencial de los pacientes con enfermedades autoinmunes o inflamatorias (indicaciones no oncológicas). En segundo lugar, al desconocerse el tiempo transcurrido entre la infección y el estudio PET/TC con [18F]FDG, no fue posible determinar el impacto real de un diagnóstico precoz durante el curso de la infección, así como tampoco una interpretación más precisa de la actividad metabólica relacionada con algunos hallazgos pulmonares estructurales individuales. En tercer lugar, hubo un único examinador que interpretó las imágenes de TC, y no se evaluó la variabilidad interobservador en cada categoría CO-RADS. Por último, no se pudo estimar la magnitud de un sesgo asociado a la procedencia de los pacientes.
ConclusionesLa PET/TC con [18F]FDG constituyó una herramienta útil durante la detección incidental de hallazgos sugestivos de neumonía por COVID-19 en pacientes seleccionados sometidos a esta técnica de imagen. El hallazgo de un SUVmáx pulmonar elevado se asoció con diferentes hallazgos combinados de neumonía por COVID-19 en la TC, especialmente en aquellos casos que presentaron puntuaciones CO-RADS diagnósticas. Son necesarios más estudios para poder evaluar los beneficios potenciales de estos hallazgos multimodales en la predicción del pronóstico y la monitorización de la respuesta a nuevas intervenciones terapéuticas emergentes, especialmente en aquellas subpoblaciones de alto riesgo como son los pacientes oncológicos.
Autorización éticaEsta investigación fue aprobada por el Comité Ético de Investigación Clínica institucional (IRB n° 20/524-E) y se adscribió a la Declaración de Helsinki de 1964 y a sus modificaciones posteriores. Todos los pacientes incluidos en el estudio firmaron un consentimiento genérico antes de la realización de la PET/TC. Debido al diseño retrospectivo y real en el contexto del primer brote de pandemia de la COVID-19 en España, se renunció a la necesidad del consentimiento informado de forma individual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Diagrama de flujo del diseño observacional. *: Estudios PET/TC con radiotrazadores diferentes de la [18F]FDG y estudios cerebrales selectivos (PET cerebral funcional o tumoral). **: limitaciones técnicas secundarias a imágenes de la TC torácica subóptimas para obtener una adecuada interpretación experta de los hallazgos estructurales. Diagrama de flujo del diseño observacional. *: Estudios PET/TC con radiotrazadores diferentes de la [18F]FDG y estudios cerebrales selectivos (PET cerebral funcional o tumoral). **: limitaciones técnicas secundarias a imágenes de la TC torácica subóptimas para obtener una adecuada interpretación experta de los hallazgos estructurales.](https://static.elsevier.es/multimedia/2253654X/0000004200000006/v1_202311020910/S2253654X23000823/v1_202311020910/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Mujer de 60 años diagnosticada de un carcinoma de cuello uterino. Se realizó una PET/TC para evaluar la afectación de los ganglios linfáticos. La imagen de proyección de máxima intensidad (a) muestra un aumento de la captación de la [18F]FDG en el cuello uterino y en adenopatías de localización supraclavicular izquierda e infradiafragmática, relacionadas ambas con su patología oncológica de base. También se visualiza captación del radiotrazador en pulmones y en adenopatías hiliares y subcarinales, hallazgos relacionados con patología infecciosa/inflamatoria. Los cortes axiales y de la TC mostraron una banda subpleural en el lóbulo superior derecho (b), un patrón en crazy paving periférico en el lóbulo inferior derecho, y un patrón de OVD bilateral (c), con aumento de la captación de [18F]FDG y un valor SUVmáx de 5,5 (d). La rRT-PCR fue positiva para COVID-19 (CO-RADS 6). Mujer de 60 años diagnosticada de un carcinoma de cuello uterino. Se realizó una PET/TC para evaluar la afectación de los ganglios linfáticos. La imagen de proyección de máxima intensidad (a) muestra un aumento de la captación de la [18F]FDG en el cuello uterino y en adenopatías de localización supraclavicular izquierda e infradiafragmática, relacionadas ambas con su patología oncológica de base. También se visualiza captación del radiotrazador en pulmones y en adenopatías hiliares y subcarinales, hallazgos relacionados con patología infecciosa/inflamatoria. Los cortes axiales y de la TC mostraron una banda subpleural en el lóbulo superior derecho (b), un patrón en crazy paving periférico en el lóbulo inferior derecho, y un patrón de OVD bilateral (c), con aumento de la captación de [18F]FDG y un valor SUVmáx de 5,5 (d). La rRT-PCR fue positiva para COVID-19 (CO-RADS 6).](https://static.elsevier.es/multimedia/2253654X/0000004200000006/v1_202311020910/S2253654X23000823/v1_202311020910/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Mujer de 85 años con cáncer de colon. Se realizó una PET/TC para evaluación de respuesta al tratamiento. La imagen de proyección de máxima intensidad (a) muestra un foco de captación abdominal de la [18F]FDG en relación con una adenopatía retrocrural infiltrativa. También muestra un aumento de la captación del radiotrazador en el pulmón derecho. Los cortes axiales de fusión (b y c) y de la TC (d y e) muestran un aumento de la captación de [18F]FDG (SUVmáx 13,2) en las OVD periféricas del lóbulo superior derecho. El corte axial de la TC (e) muestra un patrón crazy paving periférico en el lóbulo superior derecho. La rRT-PCR para COVID-19 fue positiva (CO-RADS 6). Mujer de 85 años con cáncer de colon. Se realizó una PET/TC para evaluación de respuesta al tratamiento. La imagen de proyección de máxima intensidad (a) muestra un foco de captación abdominal de la [18F]FDG en relación con una adenopatía retrocrural infiltrativa. También muestra un aumento de la captación del radiotrazador en el pulmón derecho. Los cortes axiales de fusión (b y c) y de la TC (d y e) muestran un aumento de la captación de [18F]FDG (SUVmáx 13,2) en las OVD periféricas del lóbulo superior derecho. El corte axial de la TC (e) muestra un patrón crazy paving periférico en el lóbulo superior derecho. La rRT-PCR para COVID-19 fue positiva (CO-RADS 6).](https://static.elsevier.es/multimedia/2253654X/0000004200000006/v1_202311020910/S2253654X23000823/v1_202311020910/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
