Analizar la distribución corporal de la enfermedad Erdheim-Chester (ECD) y determinar la utilidad de la 2-[18F]FDG-PET/TC frente a otras técnicas de imagen. Asimismo, evaluar la agresividad y la extensión de la enfermedad según la presencia/ausencia de mutación BRAFV600E.
Material y métodosSe revisaron las 2-[18F]FDG-PET/TC de todos los pacientes diagnosticados con ECD entre 2008 y 2021: en total, 19 pacientes. Los territorios afectados se clasificaron como detectables por PET/TC o detectables solamente por otras técnicas de imagen (gammagrafía ósea, TC con contraste yodado o RM). Se realizó análisis descriptivo y correlación de la mutación BRAF con los órganos afectados y SUVmáx mediante la prueba t de Student.
ResultadosDe los 19 pacientes (14 hombres; edad media 60,3años), 11 presentaban la mutación BRAFV600E. Se detectaron un total de 127 territorios (64 órgano-sistemas) afectados utilizando las diferentes modalidades de imagen, de los cuales 112 fueron detectados por la PET/TC y 15 territorios adicionales fueron identificados únicamente por la RM cerebral y cardiaca. La presencia de mutación BRAFV600E se asoció con mayor afectación orgánica (p<0,05), sin diferencias en el SUVmáx (p>0,05).
ConclusiónLa 2-[18F]FDG-PET/TC es una prueba de alto rendimiento diagnóstico en pacientes con ECD, detectando la mayoría de los territorios afectados. La RM fue la única prueba de imagen con hallazgos adicionales en territorios con alta captación fisiológica de 2-[18F]FDG (cerebral y cardíaca). La presencia de mutación del BRAFV600E se correlacionó con mayor extensión de la enfermedad.
To analyze the body distribution of Erdheim-Chester disease (ECD) and determine the utility of 2-[18F]FDG PET/CT compared to other imaging techniques. Additionally, to assess the aggressiveness and extent of the disease based on the presence/absence of the BRAFV600E mutation.
Materials and methodsThe 2-[18F]FDG PET/CT scans of all patients diagnosed with ECD between 2008 and 2021 were reviewed, including 19 patients. The affected territories were classified as detectable by PET/CT or detectable only by other imaging techniques (bone scintigraphy, contrast-enhanced CT, or MRI). Descriptive analysis and correlation of the BRAF mutation with the affected organs and maximum SUV were performed using the Student's t-test.
ResultsOut of the 19 patients (14 males; mean age 60.3years), 11 had the BRAFV600E mutation. A total of 127 territories (64 organ-systems) affected were identified using different imaging modalities, of which 112 were detected by PET/CT, and an additional 15 territories were solely identified by cerebral and cardiac MRI. The presence of BRAFV600E mutation was associated with greater organ involvement (P<.05) without differences in SUVmax (P>.05).
Conclusion2-[18F]FDG PET/CT is a highly effective diagnostic tool in patients with ECD, detecting the majority of affected territories. MRI was the only imaging modality with additional findings in territories showing high physiological uptake of 2-[18F]FDG (cerebral and cardiac). The presence of the BRAFV600E mutation correlated with a higher extent of the disease.
La enfermedad de Erdheim-Chester (Erdheim-Chester Disease [ECD]) es una rara histiocitosis sistémica de células no-Langerhans que se caracteriza por la infiltración de células histiocíticas en el estroma de varios órganos, lo cual provoca inflamación, engrosamiento, aumento de la densidad y fibrosis en estos órganos. A pesar de haber sido descrita por primera vez en la literatura en 1930 por los patólogos William Chester y Jakob Erdheim, sigue siendo un desafío diagnóstico debido a la diversidad de sus manifestaciones clínicas y a la escasez de casos publicados a nivel mundial, con menos de 1.000 casos documentados hasta la fecha1,2.
Previo a los avances en la comprensión de la enfermedad, existía incertidumbre sobre si la ECD era un trastorno benigno o inflamatorio, o si tenía características malignas. Esto se debía en parte a las dificultades para determinar la clonalidad celular e identificar las mutaciones impulsoras. Sin embargo, en 2012 se realizó un importante hallazgo al descubrirse mutaciones y fusiones recurrentes de cinasas activadoras que afectan las vías de señalización MAPK (RAS-RAF-MEK-ERK) y PI3K-AKT en una gran proporción de pacientes con ECD3. Estos descubrimientos proporcionaron evidencia concluyente de que la ECD es un trastorno neoplásico clonal impulsado por la señalización constitutiva de MAPK en la mayoría de los casos, y también ofrecieron uno de los primeros objetivos para la terapia molecular en la histiocitosis4. Como resultado de este avance, la Organización Mundial de la Salud (OMS) ha incluido la ECD en la clasificación de neoplasias del tejido hematopoyético y linfoide (tabla 1)2.
Clasificación de la OMS de las neoplasias del tejido hematopoyético y linfoide. La ECD está incluida dentro de las neoplasias de histiocitos y células dendríticas y enfermedades relacionadas
| I | Neoplasias de células B |
| II | Neoplasias de células T |
| III | Linfoma de Hodgkin (enfermedad de Hodgkin) |
| IV | Enfermedades linfoproliferativas asociadas a inmunodeficiencia |
| V | Neoplasias de histiocitos y células dendríticas y enfermedades relacionadas |
| VI | Leucemias agudas y síndrome mielodisplásicos |
| VII | Enfermedades mieloproliferativas crónicas |
Se cree que los trastornos histiocíticos se originan a partir de las células fagocíticas mononucleares, como los macrófagos y las células dendríticas, también conocidas como histiocitos. Esta categoría de trastornos se ha subdividido en histiocitosis de células de Langerhans (HCL) e histiocitosis no-Langerhans (HCNL). La HCL recibe su nombre debido a la supuesta derivación de las células de Langerhans, que son células dendríticas especializadas que se encuentran en la piel y las mucosas. Por otro lado, se cree que las HCNL se originan a partir del linaje de los monocitos y los macrófagos5,6.
La mayoría de los pacientes con ECD presentan mutaciones somáticas (es decir, adquiridas y no hereditarias) en BRAF u otros componentes de la vía de señalización dependiente de la proteína cinasa de activación mitogénica (MAPK). Estudios recientes han demostrado que aproximadamente la mitad de los casos de ECD tienen la mutación BRAFV600, aunque es probable que la incidencia sea mayor cuando se utilizan técnicas más sensibles7-9. La presencia de la mutación BRAF activada conduce a un aumento en la proliferación y la supervivencia celular al activar la vía de señalización RAS/RAF/MEK/MAPK10. Los histiocitos en la ECD también muestran un perfil de expresión de citocinas y quimiocinas proinflamatorias que contribuyen al reclutamiento y a la activación de histiocitos adicionales11.
La presentación clínica de la ECD puede variar según la extensión y la distribución de los órganos afectados. La mayoría de los pacientes presentan compromiso óseo en el momento del diagnóstico, y la gran mayoría también muestran al menos un órgano de afectación extraósea. Es crucial determinar el grado de afectación de la ECD en cada paciente, por diversas razones. En primer lugar, la elección del tratamiento se basa en el fenotipo y la gravedad de la enfermedad, los cuales están influenciados por el patrón de afectación de los órgano-sistemas, en particular del sistema nervioso y cardiovascular12,13. En segundo lugar, los pacientes con ECD pueden experimentar una amplia gama de síntomas tanto generalizados como focalizados12,14. Sin embargo, a menudo tienen diagnósticos concomitantes que pueden causar síntomas de forma independiente, como enfermedades autoinmunes15 y otras neoplasias16. Por lo tanto, la identificación de los territorios afectados por la ECD es crucial para distinguir los síntomas de la enfermedad infiltrativa de aquellos que no son atribuibles a la ECD. Por último, la determinación de la extensión de la ECD puede influir en la elegibilidad para ensayos clínicos y proporcionar lesiones diana evaluables para evaluar la respuesta al tratamiento.
Actualmente, existe escasa evidencia sobre las imágenes diagnósticas óptimas para caracterizar la extensión de la enfermedad ECD sin tratamiento. Sin embargo, estudios en cohortes pequeñas sugieren que la tomografía por emisión de positrones/tomografía computarizada (PET/TC) con 2-[18F]FDG es una opción eficaz para evaluar la afectación orgánica en la ECD17-21. De hecho, el último consenso de la Sociedad Americana de Hematología establece que, aunque la gammagrafía ósea (GO) es la más sensible para detectar lesiones óseas, la PET/TC con 2-[18F]FDG es la prueba diagnóstica preferida debido a su capacidad para evaluar la afectación extraósea3. Además, estudios como el de Arnaud et al.22 han demostrado que la PET/TC con 2-[18F]FDG es muy útil en el seguimiento de los pacientes con ECD que están recibiendo tratamiento.
Por tanto, el objetivo de nuestro estudio fue doble. En primer lugar, describir la distribución de la afectación corporal y multisistémica en la ECD y comparar las imágenes obtenidas mediante la PET/TC con 2-[18F]FDG con otras pruebas de imagen, como la GO, la TC y la resonancia magnética (RM), para determinar cuál ofrece un mejor rendimiento diagnóstico. En segundo lugar, correlacionar la presencia o ausencia de la mutación BRAF (BRAFV600E o BRAFwt) con la afectación de los diferentes órganos y la intensidad de captación en la PET.
Material y métodosEl presente trabajo es un estudio observacional retrospectivo llevado a cabo en el servicio de Medicina Nuclear-PET (IDI) del Hospital Universitario de Bellvitge. Se incluyeron todos los pacientes remitidos desde el Servicio de Medicina Interna entre el año 2008 y finales de 2021 con un diagnóstico final anatomopatológico de ECD. Todos ellos habían sido sometidos a una exploración con 2-[18F]FDG PET/TC. Fueron incluidos tanto pacientes con sospecha o diagnóstico previo de ECD que fueron derivados para estadificación de la enfermedad, como pacientes en los que no existía sospecha de ECD en el momento de la derivación a nuestro servicio, y a los cuales se les diagnosticó de histiocitosis después de la exploración PET/TC. En total, se reclutaron 19 pacientes, evaluando siempre que fuera posible la imagen previa a cualquier tipo de tratamiento.
Se recopilaron datos demográficos y clínicos que incluyeron el sexo, la edad en el momento del diagnóstico de ECD, la presentación de síntomas al diagnóstico, el retraso diagnóstico (desde el primer síntoma hasta la verificación anatomopatológica) y la presencia o ausencia de la mutación BRAF (BRAFV600E o BRAFwt).
Se revisaron las imágenes de la GO, la TC con contraste yodado y la RM correspondientes a estos pacientes. Los territorios y órgano-sistemas afectados por la enfermedad se clasificaron en dos categorías: detectables con PET/TC y detectables solo por otras técnicas de imagen (GO/TC/RM).
Se llevó a cabo un análisis descriptivo y se utilizó la prueba t de Student para comparar el número de órganos afectados y los valores de SUVmáx entre los grupos de pacientes según la mutación en el gen BRAF.
Las imágenes de PET/TC se adquirieron utilizando los equipos Discovery ST y Discovery IQ (General Electric, Milwaukee, EE.UU.). Los pacientes ayunaron durante 4-6horas y, con niveles de glucemia inferiores a 10mMol/l, se administró una dosis de 2-[18F]FDG de 3-4MBq/kg, dependiendo del equipo de adquisición. Después de un intervalo de 60minutos se realizó una exploración de cuerpo entero desde el vértice hasta los pies, con los brazos por encima de la cabeza siempre que fue posible. Los parámetros de adquisición para la TC fueron 110keV, modulación del amperaje con un máximo de 80mA y un grosor de corte de 3,75mm para el equipo Discovery ST y 2,5mm para el Discovery IQ. Los parámetros de adquisición de la PET fueron 3D, 2,5minutos por campo en el torso y 1,5minutos por campo en las extremidades, con una matriz de 128×128 para el equipo Discovery ST y 256×256 para el Discovery IQ. Se utilizó la reconstrucción iterativa en el equipo ST y la tecnología Q.Clear en el equipo IQ. Ambos equipos contaban con la acreditación EARL (EANM-Research-Ltd).
Para el procesamiento de las imágenes se utilizó una estación de trabajo AW Server de GE Healthcare, y se cuantificó el valor de captación estandarizado máximo (SUVmáx). El SUVmáx se midió mediante la colocación de una región de interés tridimensional (VOI) dibujada semiautomáticamente sobre la lesión en las imágenes PET corregidas por atenuación.
Se revisaron los estudios de otras técnicas de imagen utilizadas en el proceso diagnóstico de la ECD. En total, se revisaron 13GO de cuerpo entero, 37TC con contraste yodado (8 de cráneo, 18 toracoabdominales, 3 de rodillas, 3 de órbitas, 2 de extremidades inferiores, entre otros) y 28RM (13 de cerebro, 7 cardíacas, 3 de órbita, 2 retroperitoneales, entre otras).
Se evaluó la afectación de varios órgano-sistemas mediante diversas técnicas de imagen. Dentro de cada órgano-sistema, se analizó la presencia de afectación de diferentes territorios específicos. Los órgano-sistemas evaluados incluyeron: sistema musculoesquelético (comprendió el territorio del esqueleto apendicular, huesos faciales y otros), sistema cardiovascular (afectación cardíaca y aórtica), sistema nervioso (cerebro/cerebelo, hipófisis, médula espinal y órbitas/espacio periorbitario), sistema respiratorio (senos paranasales, pulmón/pleura), sistema urinario (riñones/espacio perirrenal y retroperitoneo), sistema digestivo (mesenterio y hepatopancreático), sistema linfático (ganglios linfáticos) y sistema tegumentario.
Además, se realizó un análisis de la correlación entre la mutación BRAF, el número de órganos afectados y el SUVmáx de la lesión con mayor captación de radiotrazador, utilizando la prueba t de Student.
ResultadosDe los 19 pacientes incluidos, 14 eran hombres (edad media de 61años, rango 37-88) y 5 eran mujeres (edad media de 57años, rango 34-81). Se observó la mutación del gen BRAFV600E en 11 pacientes (tabla 2).
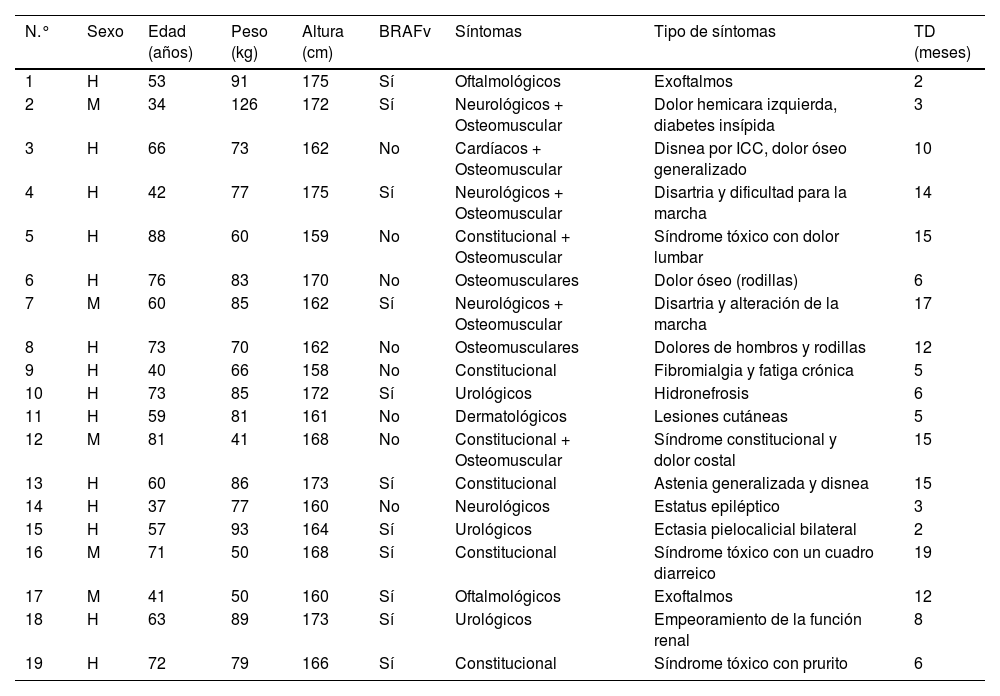
Resumen de las características demográficas, de la presencia de mutación BRAF, de la presentación clínica y del tiempo hasta el diagnóstico
| N.° | Sexo | Edad (años) | Peso (kg) | Altura (cm) | BRAFv | Síntomas | Tipo de síntomas | TD (meses) |
|---|---|---|---|---|---|---|---|---|
| 1 | H | 53 | 91 | 175 | Sí | Oftalmológicos | Exoftalmos | 2 |
| 2 | M | 34 | 126 | 172 | Sí | Neurológicos + Osteomuscular | Dolor hemicara izquierda, diabetes insípida | 3 |
| 3 | H | 66 | 73 | 162 | No | Cardíacos + Osteomuscular | Disnea por ICC, dolor óseo generalizado | 10 |
| 4 | H | 42 | 77 | 175 | Sí | Neurológicos + Osteomuscular | Disartria y dificultad para la marcha | 14 |
| 5 | H | 88 | 60 | 159 | No | Constitucional + Osteomuscular | Síndrome tóxico con dolor lumbar | 15 |
| 6 | H | 76 | 83 | 170 | No | Osteomusculares | Dolor óseo (rodillas) | 6 |
| 7 | M | 60 | 85 | 162 | Sí | Neurológicos + Osteomuscular | Disartria y alteración de la marcha | 17 |
| 8 | H | 73 | 70 | 162 | No | Osteomusculares | Dolores de hombros y rodillas | 12 |
| 9 | H | 40 | 66 | 158 | No | Constitucional | Fibromialgia y fatiga crónica | 5 |
| 10 | H | 73 | 85 | 172 | Sí | Urológicos | Hidronefrosis | 6 |
| 11 | H | 59 | 81 | 161 | No | Dermatológicos | Lesiones cutáneas | 5 |
| 12 | M | 81 | 41 | 168 | No | Constitucional + Osteomuscular | Síndrome constitucional y dolor costal | 15 |
| 13 | H | 60 | 86 | 173 | Sí | Constitucional | Astenia generalizada y disnea | 15 |
| 14 | H | 37 | 77 | 160 | No | Neurológicos | Estatus epiléptico | 3 |
| 15 | H | 57 | 93 | 164 | Sí | Urológicos | Ectasia pielocalicial bilateral | 2 |
| 16 | M | 71 | 50 | 168 | Sí | Constitucional | Síndrome tóxico con un cuadro diarreico | 19 |
| 17 | M | 41 | 50 | 160 | Sí | Oftalmológicos | Exoftalmos | 12 |
| 18 | H | 63 | 89 | 173 | Sí | Urológicos | Empeoramiento de la función renal | 8 |
| 19 | H | 72 | 79 | 166 | Sí | Constitucional | Síndrome tóxico con prurito | 6 |
BRAFv: presencia de mutación BRAFV600E; H: hombre; M: mujer; N.°: número del paciente (el orden de los pacientes es según la fecha del diagnóstico anatomopatológico); TD: tiempo hasta el diagnóstico (desde la aparición del primer síntoma hasta el diagnóstico anatomopatológico en meses).
Entre las presentaciones clínicas más frecuentes destaca el dolor osteomuscular, que estuvo presente en 8 pacientes (42%), siendo los dolores generalizados y el dolor en las rodillas los más comunes. El síndrome constitucional, caracterizado por pérdida de peso, anorexia y astenia, entre otros síntomas, se observó en 6 pacientes (32%). Los síntomas neurológicos, como la diabetes insípida, estuvieron presentes en 4 pacientes (21%), mientras que 3 pacientes (16%) presentaron síntomas urológicos. Los síntomas oftalmológicos se observaron en 2 pacientes (11%), mientras que los síntomas cardíacos y dermatológicos estuvieron presentes, cada uno de ellos, en un paciente (5% en ambos casos).
El tiempo promedio desde la aparición del primer síntoma hasta el diagnóstico fue de 9,2meses (rango 2-19meses). Los pacientes con el mayor retraso diagnóstico fueron aquellos que presentaban síntomas inespecíficos, como el síndrome constitucional, con un tiempo promedio hasta el diagnóstico de aproximadamente un año.
La adquisición de imágenes se llevó a cabo utilizando el Discovery IQ en 13 pacientes y el Discovery ST en 6 pacientes. Para los pacientes con sospecha clínica inicial de ECD (8 pacientes en total) se realizó una PET/TC de cuerpo completo con 2-[18F]FDG, que incluyó el cráneo y las extremidades inferiores. En los pacientes restantes, sin sospecha clínica inicial de ECD, se realizaron diferentes tipos de adquisiciones: en 7 pacientes se realizó un estudio de torso (desde la base del cráneo hasta los muslos), seguido de imágenes selectivas de las extremidades inferiores; en 3 pacientes se realizaron imágenes exclusivamente de torso, y en un paciente se realizó un estudio de torso e imágenes selectivas de cráneo. En 16 casos la PET/TC se realizó antes de recibir cualquier tratamiento para la ECD, mientras que en 3 casos se realizó después del inicio de quimioterapia/inmunoterapia, pero sin recibir inhibidores de la quinasa.
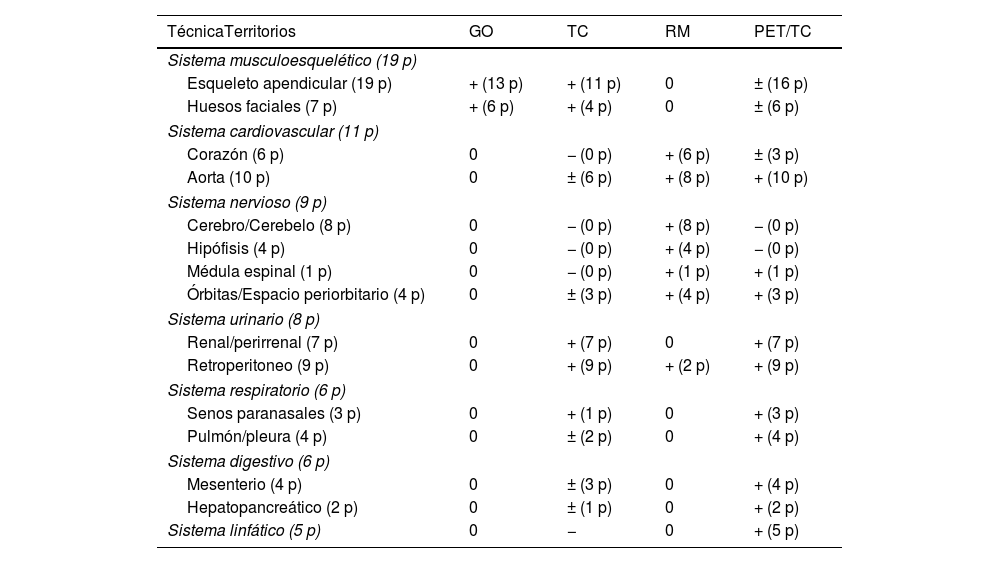
Mediante la 2-[18F]FDG-PET/TC se detectaron 112 territorios (59 órgano-sistemas) afectados, correspondientes al 88% del total de 127 territorios (64 órgano-sistemas) afectados objetivado en todas las pruebas de imagen, tanto metabólicas como anatómicas. La tabla 3 muestra las técnicas de imagen utilizadas durante el proceso diagnóstico y sus capacidades de detectar algunos de los territorios afectados. Las pruebas anatómicas que proporcionaron información adicional a la PET fueron la RM cerebral y la RM cardíaca, que detectaron 15 territorios (5 órgano-sistemas) adicionales. Es importante destacar que la TC con contraste yodado no aportó información adicional. Además, en la exploración física se detectó afectación cutánea en 5 pacientes, que no fue visible en las pruebas de imagen.
Capacidad de las técnicas de imágenes para detectar la afectación de los distintos órgano-sistemas
| TécnicaTerritorios | GO | TC | RM | PET/TC |
|---|---|---|---|---|
| Sistema musculoesquelético (19 p) | ||||
| Esqueleto apendicular (19 p) | + (13 p) | + (11 p) | 0 | ± (16 p) |
| Huesos faciales (7 p) | + (6 p) | + (4 p) | 0 | ± (6 p) |
| Sistema cardiovascular (11 p) | ||||
| Corazón (6 p) | 0 | − (0 p) | + (6 p) | ± (3 p) |
| Aorta (10 p) | 0 | ± (6 p) | + (8 p) | + (10 p) |
| Sistema nervioso (9 p) | ||||
| Cerebro/Cerebelo (8 p) | 0 | − (0 p) | + (8 p) | − (0 p) |
| Hipófisis (4 p) | 0 | − (0 p) | + (4 p) | − (0 p) |
| Médula espinal (1 p) | 0 | − (0 p) | + (1 p) | + (1 p) |
| Órbitas/Espacio periorbitario (4 p) | 0 | ± (3 p) | + (4 p) | + (3 p) |
| Sistema urinario (8 p) | ||||
| Renal/perirrenal (7 p) | 0 | + (7 p) | 0 | + (7 p) |
| Retroperitoneo (9 p) | 0 | + (9 p) | + (2 p) | + (9 p) |
| Sistema respiratorio (6 p) | ||||
| Senos paranasales (3 p) | 0 | + (1 p) | 0 | + (3 p) |
| Pulmón/pleura (4 p) | 0 | ± (2 p) | 0 | + (4 p) |
| Sistema digestivo (6 p) | ||||
| Mesenterio (4 p) | 0 | ± (3 p) | 0 | + (4 p) |
| Hepatopancreático (2 p) | 0 | ± (1 p) | 0 | + (2 p) |
| Sistema linfático (5 p) | 0 | − | 0 | + (5 p) |
Entre paréntesis indicamos el número de pacientes (p) con infiltración, detectados por las distintas técnicas de imagen.
+: la prueba ha sido capaz de detectar lesiones en este territorio; −: la prueba no ha sido capaz de detectar afectación en este territorio; ±: la prueba ha sido capaz de detectar afectación en algunos pacientes; 0: esta prueba de imagen no se ha realizado para la valoración de este territorio.
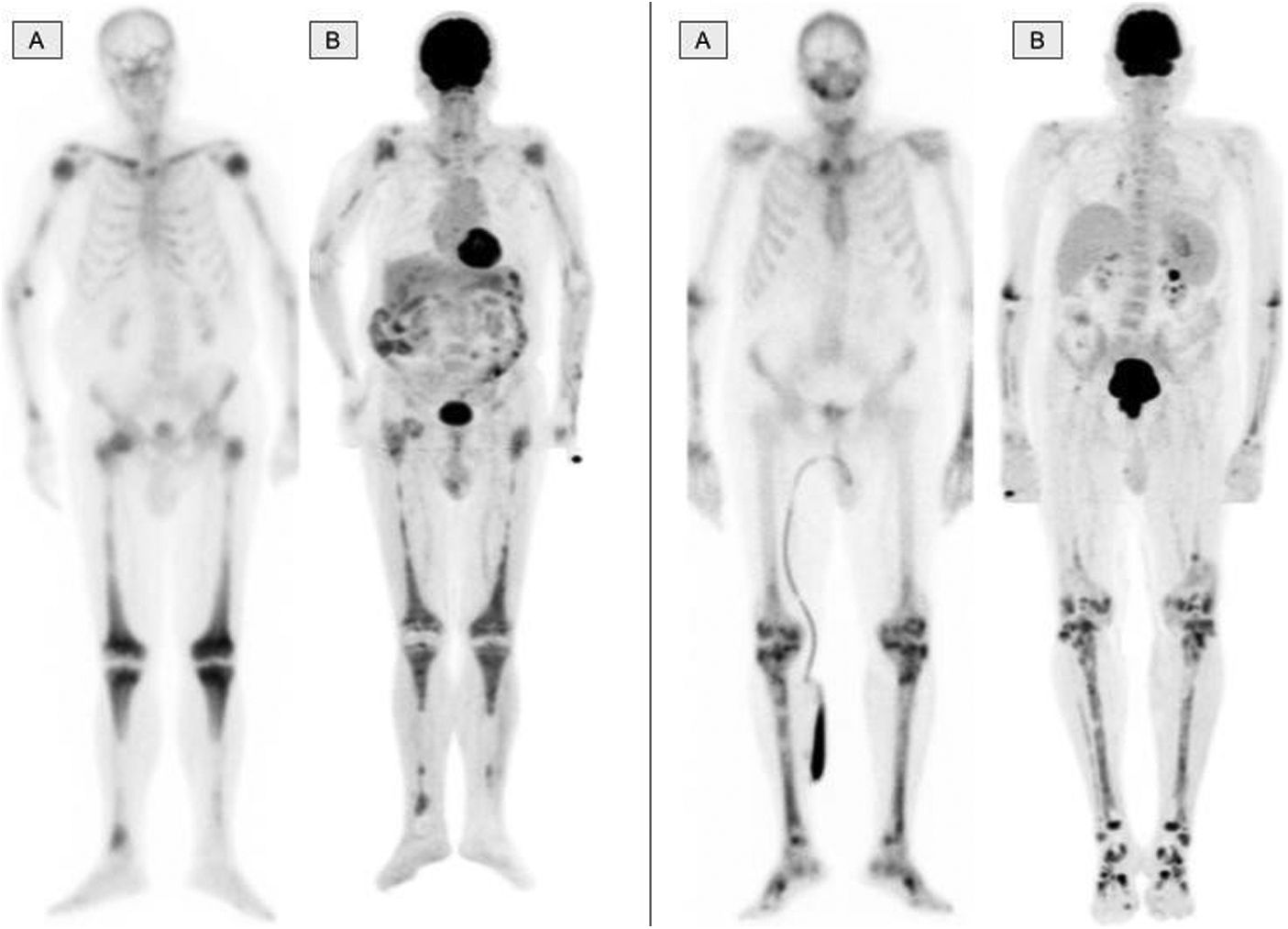
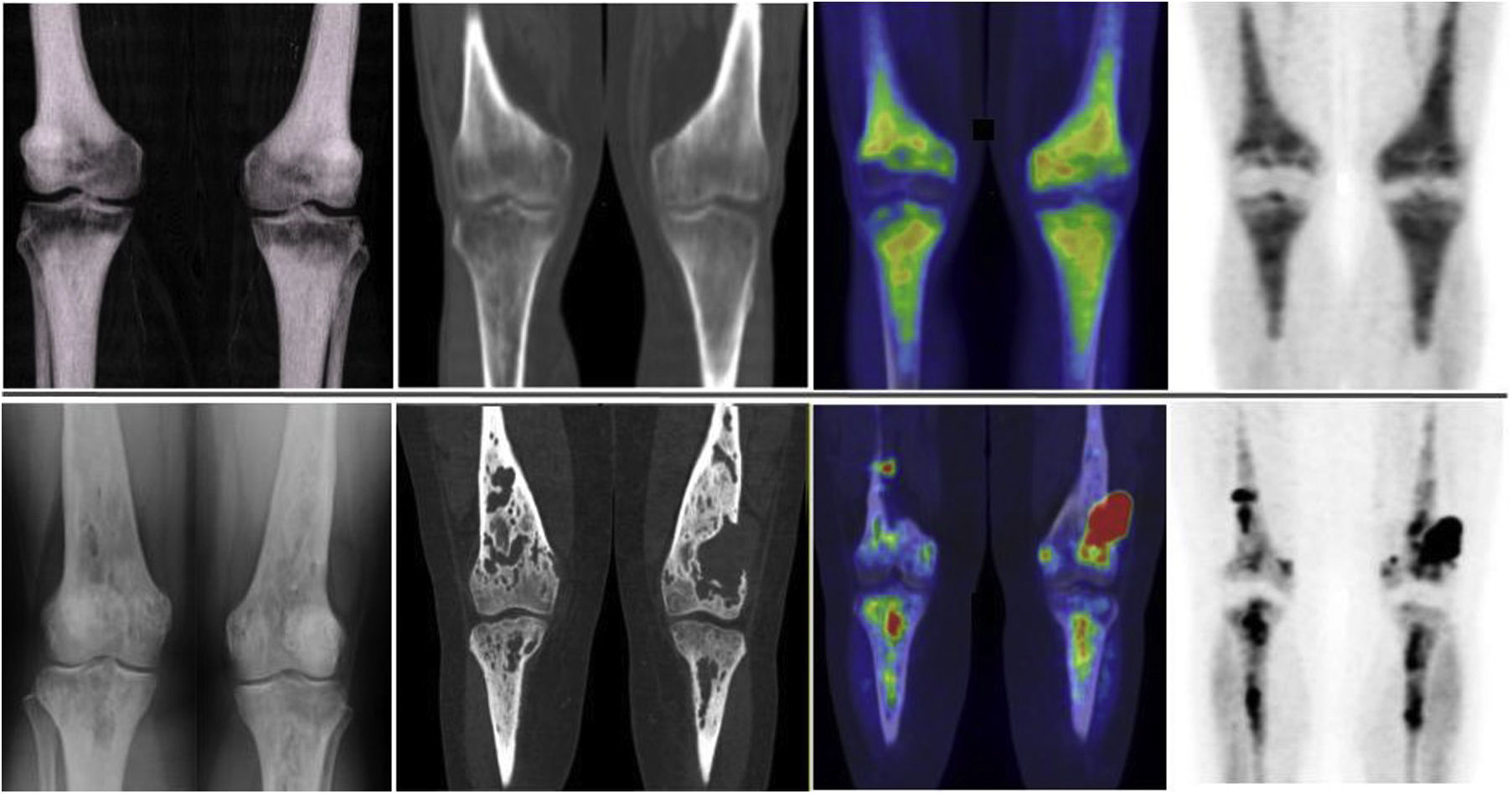
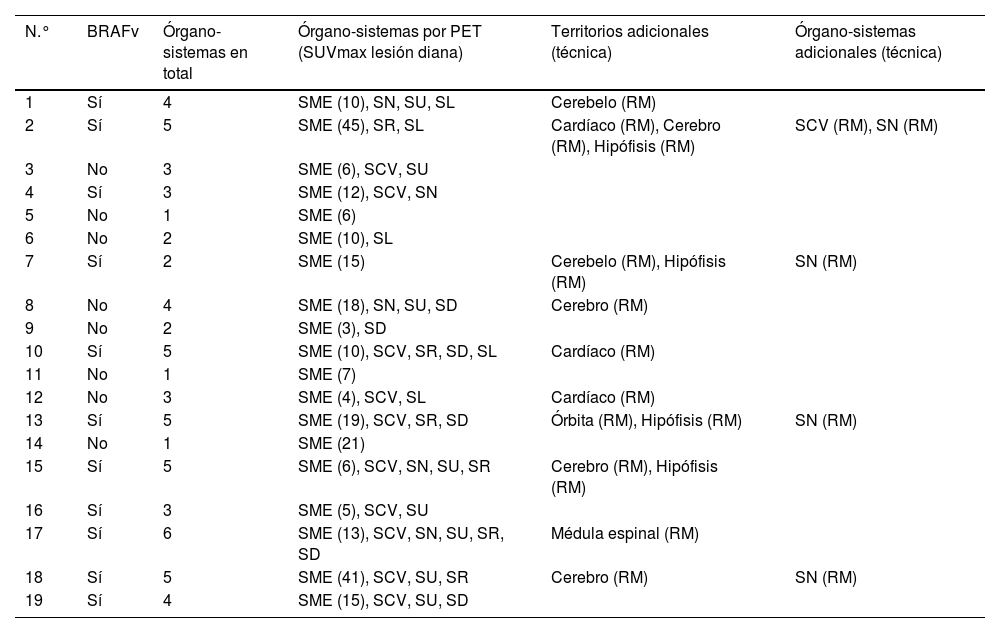
El sistema musculoesquelético estaba afectado en todos los pacientes. Un hallazgo constante en todos ellos fue la afectación bilateral y simétrica de los huesos largos de las extremidades inferiores, mientras que los huesos largos de las extremidades superiores solo presentaban afectación en 10 pacientes. Estos hallazgos fueron consistentes tanto en la GO como en la 2-[18F]FDG-PET/TC, como se muestra en la figura 1. La manifestación más típica y prácticamente patognomónica es la presencia de osteoesclerosis diafisaria y metafisaria simétrica en los fémures (metáfisis distal) y las tibias (metáfisis proximal), que se asocian con una mayor captación de bifosfonatos en la GO y un metabolismo glucídico intenso en la 2-[18F]FDG-PET. En etapas avanzadas, las lesiones escleróticas con captación homogénea evolucionan y se agregan componentes líticos, lo que resulta en una captación más heterogénea, como se muestra en la figura 2. Otros huesos frecuentemente afectados fueron los huesos faciales (fig. 3), observándose en 7 pacientes, específicamente en los huesos de la órbita, en el maxilar superior y en el inferior. Además, se detectaron lesiones en la calota craneal en 2 pacientes, especialmente en el hueso esfenoides y en el temporal, en la pelvis (huesos ilíacos) en 4 pacientes, y en un paciente en la clavícula.
Los hallazgos en la gammagrafía ósea (A) y en la imagen MIP (maximum intensity projection) de la 2-[18F]FDG-PET (B) en dos pacientes distintos donde puede observarse una similar distribución de los radiofármacos a nivel del esqueleto apendicular. La afectación de las regiones diafiso-metafisarias en la proximidad a las rodillas, como se observa en estos dos casos, es una imagen prácticamente patognomónica en los pacientes con ECD.
El hallazgo más frecuente es la afectación esclerótica hipermetabólica bilateral que involucra las regiones diafiso-metafisarias en proximidad a las rodillas. Estas lesiones escleróticas con captación homogénea del radiofármaco se asocian a lesiones líticas y captación más heterogénea en los estadios avanzados, como puede observarse en la imagen. En la primera línea de imágenes se ve la afectación típica en estadios iniciales y en la segunda línea se ven los estadios más avanzados. Las imágenes siguen el siguiente orden (desde la izquierda): radiografía simple de rodillas, corte coronal a nivel de las rodillas en la TC, fusión PET/TC y PET respectivamente.
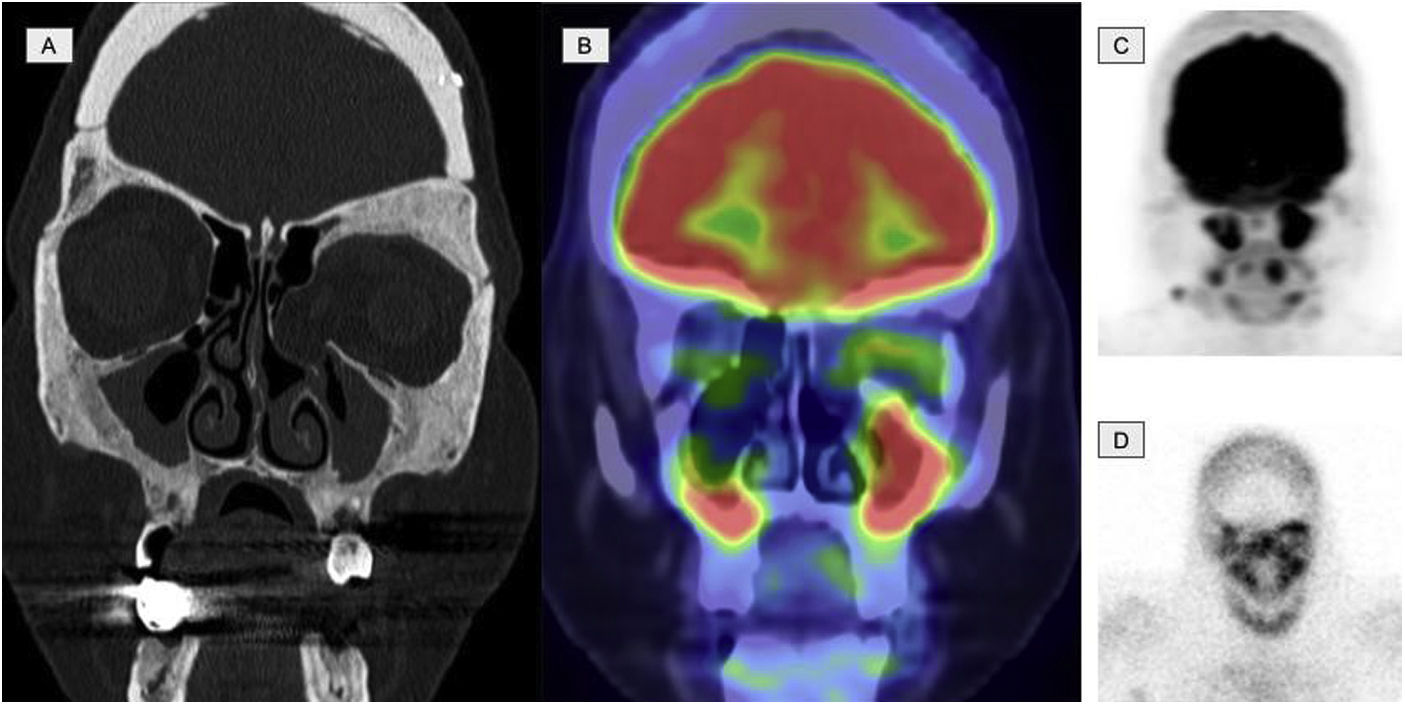
Imágenes de una paciente de 45 años diagnosticada de ECD. A)El corte coronal de la TC a nivel del macizo facial muestra una osteoesclerosis con engrosamiento de las paredes del seno frontal, esfenoidal y maxilar. B)El corte coronal de la 2-[18F]FDG-PET/TC muestra un hipermetabolismo a nivel de los senos paranasales con engrosamiento mucoso. C)La imagen MIP de la 2-[18F]FDG-PET craneal muestra actividad metabólica a nivel de los senos paranasales. D)La imagen planar de una gammagrafía ósea a nivel craneal muestra actividad osteogénica a nivel de los senos paranasales comparable con la imagenC.
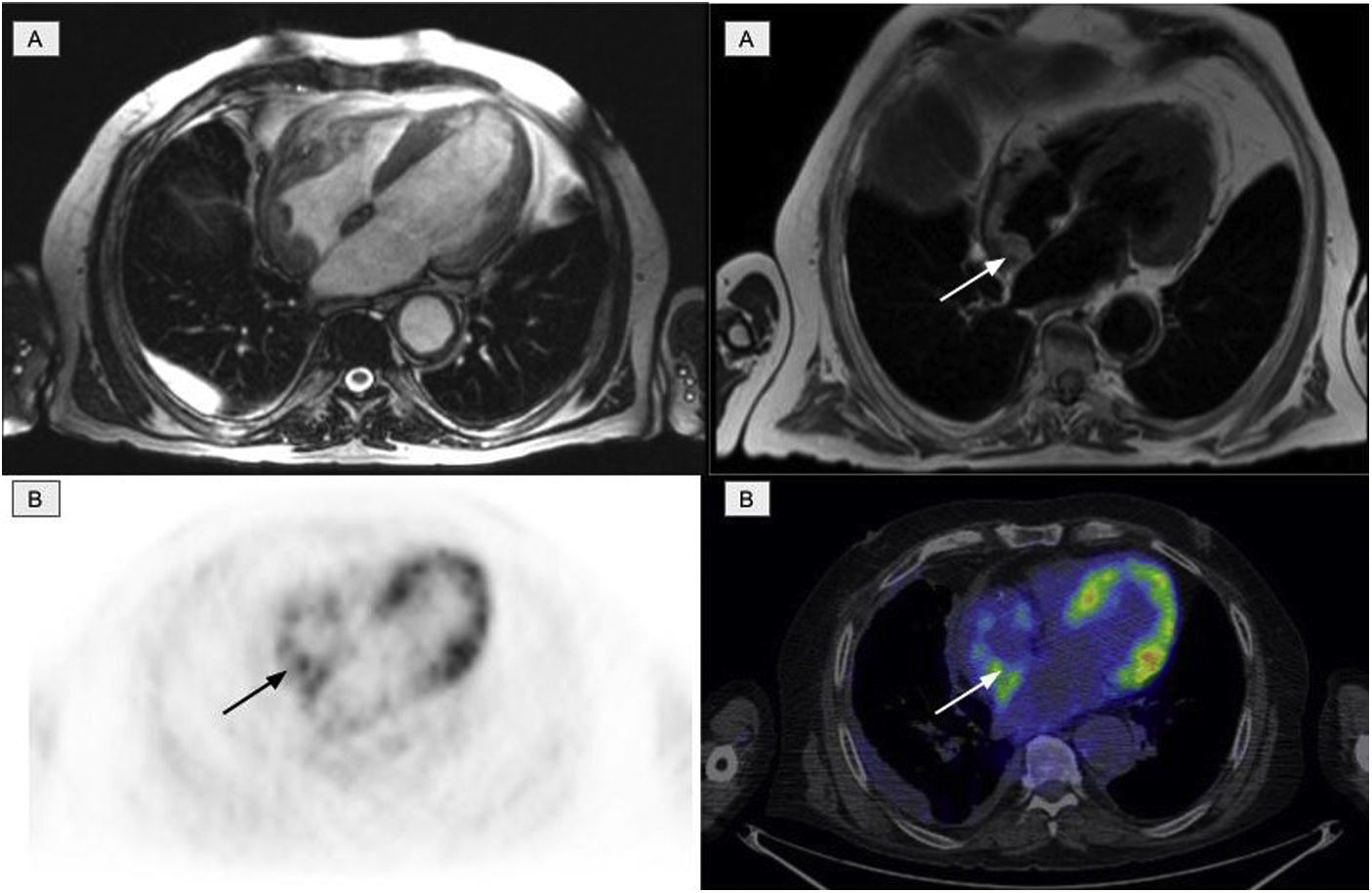
El segundo sistema más afectado fue el sistema cardiovascular, que estuvo presente en 11 pacientes. De estos, 10 pacientes presentaron afectación de la aorta (7 pacientes con aorta torácica, 1 paciente con aorta abdominal y 2 pacientes con afectación de ambas), manifestándose como un aumento de densidad periaórtica en las imágenes morfológicas, con una captación intensa en la 2-[18F]FDG. Se detectaron 6 pacientes con afectación cardíaca, de los cuales 3 fueron visualizados mediante PET (fig. 4). Los hallazgos más frecuentes incluyeron la presencia de masas/seudotumores miocárdicos, principalmente en las aurículas/ventrículos derechos, valvulopatías e infiltración del pericardio con presencia de derrame pericárdico.
Afectación cardíaca en forma de masa miocárdica en la aurícula derecha. A)Las imágenes de RM cardiaca identifican afectación de la aurícula derecha. B)Las imágenes de PET/TC muestran actividad fisiológica en el ventrículo izquierdo y aumento del metabolismo glucídico en la aurícula derecha, en correspondencia con la afectación cardiaca existente.
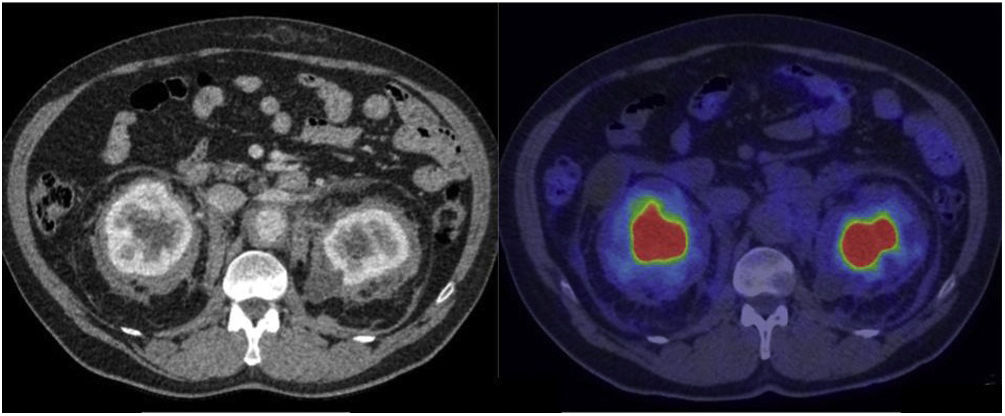
El tercer y cuarto órgano-sistemas más afectados fueron el sistema nervioso en 9 pacientes y el sistema urinario en 8 pacientes. En cuanto al sistema nervioso, y en concreto el sistema nervioso central (SNC), la RM demostró ser superior en términos de diagnóstico en comparación con la PET. Se detectó afectación de los hemisferios cerebrales en 6 pacientes y del cerebelo en 2 pacientes, mientras que la afectación de la hipófisis se detectó en 4 pacientes. La afectación de la médula espinal se detectó, tanto por PET como por RM, en 1 paciente. Se observó afectación de la órbita en 4 pacientes, presentando masas retrobulbares detectadas por PET en 3 pacientes y edema del nervio óptico detectado únicamente por RM en 1 paciente. En cuanto al sistema urinario, se observó afectación del retroperitoneo (sin incluir la aorta abdominal) en forma de fibrosis que incluía los uréteres proximales, lo que causó obstrucción y dilatación pielocalicial en varios pacientes, requiriendo en la mayoría de los casos derivación de la vía urinaria. La afectación renal/perirrenal se observó en 7 pacientes, de los cuales 4 presentaron la imagen característica de riñón peludo, que se manifiesta como una infiltración tisular simétrica, bilateral e irregular de la grasa del espacio perirrenal. En la TC, estas lesiones se presentan como bandas de contornos espiculados, hipodensas y homogéneas, con una captación variable en la 2-[18F]FDG (fig. 5).
Imágenes de TC con contraste y 2-[18F]FDG-PET/TC en las que se observa la afectación renal/pararrenal, con visualización del signo del riñón peludo. Este signo se refiere al anillo de tejido blando de infiltración perirrenal que se observa en los estudios de imágenes axiales en la ECD y se considera patognomónico de esta enfermedad. La descripción «peludo» se refiere al engrosamiento asociado de los tabiques perirrenales (tabiques de Kunin), que son bandas de tejido fibroso que se extienden entre la cápsula renal y la fascia perirrenal. La actividad metabólica en estas alteraciones es variable e incluso escasa, como en el caso que mostramos.
En la quinta, sexta y séptima posiciones se encuentran los sistemas respiratorio, digestivo y tegumentario, con 6 pacientes afectados en cada uno. Dentro del sistema respiratorio se incluyen los senos paranasales, los cuales mostraron afectación en 3 pacientes, presentando engrosamiento de las mucosas con actividad metabólica elevada. La afectación de la pleura y los pulmones se observó en 4 pacientes, manifestándose como engrosamiento de la pleura y las cisuras (generalmente bilateral y simétrico), derrame pleural, engrosamiento de los septos interlobares, presencia de pequeños nódulos centrilobulillares, consolidaciones parenquimatosas y opacidades en vidrio deslustrado. La captación de 2-[18F]FDG fue variable en estas lesiones, con captación pleural en todos los casos, mientras que los patrones micronodulares y los engrosamientos de los septos en ocasiones no mostraron actividad metabólica. En cuanto al sistema digestivo, la afectación se debió principalmente a la infiltración de la grasa mesentérica, presentando una imagen similar a la paniculitis mesentérica. Esta manifestación se caracterizó por un aumento de densidad o infiltración por un tejido de partes blandas en el tejido adiposo del mesenterio con actividad metabólica elevada. Por otro lado, la afectación cutánea se detectó en la exploración física, con xantelasmas, principalmente en los párpados, así como lesiones papulonodulares multifocales, pero no fue visible en la PET.
La evaluación del sistema linfático resultó más complicada mediante la PET, debido a la necesidad de realizar un diagnóstico diferencial entre adenopatías reactivas e infiltradas. Sin embargo, se identificó afectación en 5 pacientes.
La tabla 4 muestra la correlación entre la mutación BRAF y los diferentes órgano-sistemas afectados, junto con el valor máximo de captación de radiofármaco (SUVmáx) en la lesión con mayor afinidad por el radiofármaco. Entre los 11 pacientes con la mutación BRAFV600E se observó un promedio de 4,27 órgano-sistemas afectados (DE±1,19) y un SUVmáx medio de 17,5 (DE±13,5). Además, el 81% de ellos presentaban afectación del sistema cardiovascular, y el 64%, del sistema nervioso. Por otro lado, los 8 pacientes con BRAFwt tuvieron un promedio de 2,13 órgano-sistemas afectados (DE±1,13) y un SUVmáx medio de 9,4 (DE±6,6). En este grupo, el 25% mostraban afectación del sistema cardiovascular y solo el 13% presentaban afectación del sistema nervioso. La prueba t de Student para comparar el número de órganos afectados entre estos dos grupos mostró diferencias estadísticamente significativas, con un valor p de 0,001 (IC±95%: 1,01 a 3,29). Sin embargo, la prueba t de Student para comparar los valores de SUVmáx entre los dos grupos no mostró diferencias estadísticamente significativas, con un valor p de 0,1388 (IC±95%: −2,90 a 19,05).
Correlación de la mutación BRAFV600E con los órgano-sistemas afectados (detectados por PET u otras técnicas) y el SUVmáx del órgano-sistema con mayor avidez por el radiofármaco, entre paréntesis
| N.° | BRAFv | Órgano-sistemas en total | Órgano-sistemas por PET (SUVmax lesión diana) | Territorios adicionales (técnica) | Órgano-sistemas adicionales (técnica) |
|---|---|---|---|---|---|
| 1 | Sí | 4 | SME (10), SN, SU, SL | Cerebelo (RM) | |
| 2 | Sí | 5 | SME (45), SR, SL | Cardíaco (RM), Cerebro (RM), Hipófisis (RM) | SCV (RM), SN (RM) |
| 3 | No | 3 | SME (6), SCV, SU | ||
| 4 | Sí | 3 | SME (12), SCV, SN | ||
| 5 | No | 1 | SME (6) | ||
| 6 | No | 2 | SME (10), SL | ||
| 7 | Sí | 2 | SME (15) | Cerebelo (RM), Hipófisis (RM) | SN (RM) |
| 8 | No | 4 | SME (18), SN, SU, SD | Cerebro (RM) | |
| 9 | No | 2 | SME (3), SD | ||
| 10 | Sí | 5 | SME (10), SCV, SR, SD, SL | Cardíaco (RM) | |
| 11 | No | 1 | SME (7) | ||
| 12 | No | 3 | SME (4), SCV, SL | Cardíaco (RM) | |
| 13 | Sí | 5 | SME (19), SCV, SR, SD | Órbita (RM), Hipófisis (RM) | SN (RM) |
| 14 | No | 1 | SME (21) | ||
| 15 | Sí | 5 | SME (6), SCV, SN, SU, SR | Cerebro (RM), Hipófisis (RM) | |
| 16 | Sí | 3 | SME (5), SCV, SU | ||
| 17 | Sí | 6 | SME (13), SCV, SN, SU, SR, SD | Médula espinal (RM) | |
| 18 | Sí | 5 | SME (41), SCV, SU, SR | Cerebro (RM) | SN (RM) |
| 19 | Sí | 4 | SME (15), SCV, SU, SD |
BRAFv: presencia de mutación BRAFV600E; SCV: sistema cardiovascular; SD: sistema digestivo; SL: sistema linfático; SME: sistema musculoesquelético; SN: sistema nervioso; SR: sistema respiratorio; SU: sistema urinario.
La enfermedad de Erdheim-Chester es una enfermedad rara que puede presentar una amplia variedad de manifestaciones clínicas, dependiendo de la extensión y de la distribución de los órganos afectados. Según el último consenso de la ECD de la Sociedad Americana de Hematología, de 20213, se recomienda realizar un estudio de cuerpo entero con 2-[18F]FDG-PET/TC en todos los casos sospechosos de ECD. Esta técnica de imagen tiene alta sensibilidad para detectar la extensión de la enfermedad ósea y extraósea en un mismo estudio.
De acuerdo con la literatura disponible, la afectación ósea se observa en más del 95% de los casos de pacientes con ECD3; no obstante, el dolor en las extremidades inferiores está presente en cerca del 50% de las situaciones23. Estas estadísticas coinciden con los hallazgos en nuestra propia serie, donde se confirmó compromiso óseo en todos los pacientes y un 42% de ellos manifestaron dolor en dichas áreas. Las lesiones osteoblásticas, mal definidas, bilaterales y simétricas, de los huesos metafiso-diafisarios alrededor de las rodillas son prácticamente patognomónicas de la ECD, y se identifican en todos nuestros pacientes en los que se incluyó la valoración de los miembros inferiores, tanto en la GO como en la 2-[18F]FDG-PET/TC, de forma concordante. Por ello, en caso de que exista una sospecha clínica inicial de ECD es preciso realizar un estudio PET/TC de cuerpo completo, incluyendo miembros inferiores, por su mayor capacidad de detectar alteraciones sutiles y porque permite dirigir la biopsia con mayor exactitud24. No obstante, en caso de diagnosticar la enfermedad tras la realización de la 2-[18F]FDG-PET/TC con un protocolo de torso (de base de cráneo a tercio superior de miembros inferiores), sin realizar la adquisición de miembros inferiores, podríamos plantear la posibilidad de realizar un rastreo corporal total con GO para conocer la extensión de la enfermedad ósea, dada la concordancia observada en nuestra serie.
En aproximadamente la mitad de los pacientes se detecta la afectación del esqueleto axial8, sobre todo en forma de infiltración del macizo facial, en concordancia con nuestros resultados (47%). Por ello, debe evaluarse con precaución la totalidad de las estructuras óseas, en particular en la región facial y craneal, que en ocasiones se encuentra dificultada por la actividad fisiológica cerebral y por la actividad inflamatoria sinusal.
La identificación de la infiltración del sistema cardiovascular y el SNC es de crucial importancia, ya que se asocia a un mayor riesgo de morbimortalidad20. La actividad fisiológica de estos sistemas, con elevado consumo glucídico, dificulta la valoración mediante la 2-[18F]FDG-PET/TC. Por lo tanto, la prueba con mayor rendimiento diagnóstico en ambos territorios acostumbra a ser la RM, tal y como se deduce de nuestros resultados, donde la única prueba que superó a la PET fue la RM a nivel cerebral y cardiaco.
La afectación cardiovascular más frecuente es la aórtica, que aparece entre el 46 y el 62% de los pacientes14, y puede existir en cualquier tramo de la esta, así como en sus ramas principales. Normalmente es asintomática y no condiciona complicaciones severas23. En cambio, en un porcentaje nada despreciable de pacientes puede aparecer afectación cardíaca, en cualquiera de las capas9, siendo lo más frecuente la infiltración del pericardio con derrame pericárdico. Estas alteraciones en la imagen de PET/TC son visibles incluso sin frenación cardíaca, mientras que la afectación del resto de las capas cardíacas precisa una adecuada preparación de los pacientes con ayunos prolongados, dieta rica en ácidos grasos y baja en hidratos de carbono e incluso la administración de heparina sódica previa a la administración de la 2-[18F]FDG. Otro hallazgo frecuente y característico es la presencia de un seudotumor a nivel de la aurícula derecha (como en el paciente mostrado en la fig. 4), seguido de la infiltración del surco auriculoventricular. Cohen-Aubart et al.14 describieron la asociación significativa de la BRAFV600E y el seudotumor auricular en los pacientes con ECD, así como un riesgo incrementado de infiltración cardíaca y aórtica, y nuestros resultados así lo corroboran, por lo que en los pacientes con mutación BRAFV600E es prioritaria la evaluación cardiaca con RM y la frenación cardiaca para el estudio de 2-[18F]FDG-PET.
El metabolismo cerebral depende únicamente de un sustrato energético: la glucosa, por lo que la captación cerebral de 2-[18F]FDG es intensa y no es posible realizar una «frenación de captación». La ECD tiene predilección por el parénquima cerebral de la fosa posterior y por la médula espinal25, generando, entre otras, sintomatologías como deterioro cognitivo, demencia, ataxia cerebelosa, pérdida auditiva, dolor de cabeza y neuropatía periférica23. Sin embargo, también se puede asociar con afectación de la hipófisis, la duramadre, los senos faciales y la órbita. En este último caso la sintomatología más habitual suele ser el exoftalmos, que con frecuencia es bilateral, debido a la infiltración de las partes blandas del espacio retroorbitario14,23. La PET/TC es capaz de detectar afectación de los senos faciales, las órbitas y los espacios retroorbitarios, si bien se aconseja completar el estudio mediante una RM o una PET/RM, si existe sospecha clínica de afectación del SNC. Al igual que sucede con la afectación cardiaca, en nuestra serie se observa una asociación entre la existencia de la mutación BRAFV600E y la afectación en el SNC. Este hecho refuerza el mayor riesgo de agresividad que existe en los pacientes con ECD que presentan esta mutación14,15.
Resulta interesante destacar que, además de observar afectación de órganos de mayor riesgo (cerebral, cardiaca, o ambas), en nuestra serie los pacientes con BRAFV600E han mostrado mayor extensión de la enfermedad, siendo estos hallazgos estadísticamente significativos en comparación con pacientes con BRAFwt. Por lo tanto, los hallazgos de la 2-[18F]FDG PET/TC nos permitirían identificar a los pacientes en los que es obligatoria la valoración del gen BRAF (mutado/no mutado), ya que de esta manera podrían beneficiarse de terapias moleculares dirigidas.
A pesar de que la 2-[18F]FDG PET/TC proporcionó el mejor método diagnóstico para delimitar la extensión de la enfermedad, resulta fundamental la valoración del componente morfológico de la TC en el estudio híbrido, en particular a nivel pulmonar y renal. Si bien el signo de los riñones peludos (hairy kidney) es una de las manifestaciones más frecuentes y características en los pacientes con ECD21,26, no siempre muestran aumento del metabolismo, como sucede en algunos de nuestros pacientes. Por otro lado, en el caso de los pacientes con afectación retroperitoneal o del sistema urinario es preciso identificar a los pacientes que puedan evolucionar a hidronefrosis16,23,27, ya que podrían requerir la colocación, más o menos urgente, de catéteres de derivación de la vía urinaria (doble J).
Como limitaciones de nuestro estudio, es importante mencionar que se trata de un estudio retrospectivo observacional. La falta de sospecha clínica inicial de la ECD en algunos pacientes puede haber llevado a una variabilidad en la adquisición de imágenes, como la no inclusión de las extremidades o la falta de frenación cardíaca. Estos factores pueden sesgar la valoración de la extensión de la enfermedad tanto a nivel de las extremidades como a nivel cardíaco. Otro sesgo importante viene dado por la adquisición de los estudios en dos equipos diferentes, con distintos algoritmos de reconstrucción, que condiciona la variabilidad en los valores de SUVmáx evaluados. Además, se debe tener en cuenta que en tres pacientes se realizó el estudio 2-[18F]FDG-PET/TC después de haber iniciado el tratamiento, ya que el tratamiento puede haber alterado la distribución, pero sobre todo la intensidad de la captación de 2-[18F]FDG en los tejidos afectados. Es necesario realizar estudios prospectivos y controlados para confirmar y ampliar nuestros hallazgos.
Cómo perspectivas futuras, además del aumento de disponibilidad de la PET/TC, nos encontramos con la introducción de equipos PET/RM que permiten la adquisición simultánea de imágenes anatómicas de alta resolución espacial y temporal, junto con imágenes metabólicas. Con dicha técnica creemos que mejorará, en una sola exploración, la evaluación de la extensión de la enfermedad, especialmente en la afectación cardíaca y del SNC.
Por otro lado, el conocimiento de la mutación BRAFV600E, junto con la adecuada determinación de la extensión de la enfermedad mediante la PET, puede permitir la selección de pacientes de mayor riesgo y, por ende, la utilización de terapias personalizadas, con un impacto positivo en el pronóstico y en la respuesta al tratamiento de los pacientes con ECD.
En conclusión, la técnica de imagen con mayor rendimiento diagnóstico en pacientes con ECD es la 2-[18F]FDG PET/TC. Es crucial realizar la adquisición de imágenes de cuerpo completo (desde vértex hasta pies) para evaluar adecuadamente la extensión de la enfermedad, tanto a nivel óseo como en las áreas extraóseas. Es importante evaluar tanto el componente metabólico (PET) como el morfológico (TC) de las imágenes, ya que en ocasiones los hallazgos pueden tener una traducción glucídica limitada o estar cerca de órganos con alto metabolismo glucídico, como en áreas orbitarias y faciales. Ya que la alta actividad metabólica cerebral y cardíaca puede dificultar la detección de la enfermedad en estas localizaciones, resulta fundamental la preparación adecuada con frenación miocárdica, y es de vital importancia la evaluación cuidadosa de ambos territorios debido a su implicación en el pronóstico de los pacientes. Si hay sospecha de afectación en estas áreas que no se define claramente con la PET/TC, se recomienda realizar una resonancia magnética cardíaca y/o cerebral. En relación con los fenotipos BRAF en la ECD, se puede concluir que la presencia de esta mutación se asocia con una mayor extensión de la enfermedad identificada mediante la FDG-PET/TC, así como una mayor afectación de órganos de riesgo como el cerebro y el corazón. Esto sugiere una enfermedad más agresiva en pacientes con esta mutación.
FinanciaciónLos autores no recibieron apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Los hallazgos en la gammagrafía ósea (A) y en la imagen MIP (maximum intensity projection) de la 2-[18F]FDG-PET (B) en dos pacientes distintos donde puede observarse una similar distribución de los radiofármacos a nivel del esqueleto apendicular. La afectación de las regiones diafiso-metafisarias en la proximidad a las rodillas, como se observa en estos dos casos, es una imagen prácticamente patognomónica en los pacientes con ECD. Los hallazgos en la gammagrafía ósea (A) y en la imagen MIP (maximum intensity projection) de la 2-[18F]FDG-PET (B) en dos pacientes distintos donde puede observarse una similar distribución de los radiofármacos a nivel del esqueleto apendicular. La afectación de las regiones diafiso-metafisarias en la proximidad a las rodillas, como se observa en estos dos casos, es una imagen prácticamente patognomónica en los pacientes con ECD.](https://static.elsevier.es/multimedia/2253654X/0000004300000001/v1_202401120932/S2253654X23000987/v1_202401120932/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Imágenes de una paciente de 45 años diagnosticada de ECD. A)El corte coronal de la TC a nivel del macizo facial muestra una osteoesclerosis con engrosamiento de las paredes del seno frontal, esfenoidal y maxilar. B)El corte coronal de la 2-[18F]FDG-PET/TC muestra un hipermetabolismo a nivel de los senos paranasales con engrosamiento mucoso. C)La imagen MIP de la 2-[18F]FDG-PET craneal muestra actividad metabólica a nivel de los senos paranasales. D)La imagen planar de una gammagrafía ósea a nivel craneal muestra actividad osteogénica a nivel de los senos paranasales comparable con la imagenC. Imágenes de una paciente de 45 años diagnosticada de ECD. A)El corte coronal de la TC a nivel del macizo facial muestra una osteoesclerosis con engrosamiento de las paredes del seno frontal, esfenoidal y maxilar. B)El corte coronal de la 2-[18F]FDG-PET/TC muestra un hipermetabolismo a nivel de los senos paranasales con engrosamiento mucoso. C)La imagen MIP de la 2-[18F]FDG-PET craneal muestra actividad metabólica a nivel de los senos paranasales. D)La imagen planar de una gammagrafía ósea a nivel craneal muestra actividad osteogénica a nivel de los senos paranasales comparable con la imagenC.](https://static.elsevier.es/multimedia/2253654X/0000004300000001/v1_202401120932/S2253654X23000987/v1_202401120932/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Imágenes de TC con contraste y 2-[18F]FDG-PET/TC en las que se observa la afectación renal/pararrenal, con visualización del signo del riñón peludo. Este signo se refiere al anillo de tejido blando de infiltración perirrenal que se observa en los estudios de imágenes axiales en la ECD y se considera patognomónico de esta enfermedad. La descripción «peludo» se refiere al engrosamiento asociado de los tabiques perirrenales (tabiques de Kunin), que son bandas de tejido fibroso que se extienden entre la cápsula renal y la fascia perirrenal. La actividad metabólica en estas alteraciones es variable e incluso escasa, como en el caso que mostramos. Imágenes de TC con contraste y 2-[18F]FDG-PET/TC en las que se observa la afectación renal/pararrenal, con visualización del signo del riñón peludo. Este signo se refiere al anillo de tejido blando de infiltración perirrenal que se observa en los estudios de imágenes axiales en la ECD y se considera patognomónico de esta enfermedad. La descripción «peludo» se refiere al engrosamiento asociado de los tabiques perirrenales (tabiques de Kunin), que son bandas de tejido fibroso que se extienden entre la cápsula renal y la fascia perirrenal. La actividad metabólica en estas alteraciones es variable e incluso escasa, como en el caso que mostramos.](https://static.elsevier.es/multimedia/2253654X/0000004300000001/v1_202401120932/S2253654X23000987/v1_202401120932/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
