Los criterios STOPP/START son criterios explícitos basados en sistemas fisiológicos que resumen la evidencia sobre problemas de prescripción relevantes clínicamente relacionados con el uso de medicamentos potencialmente inapropiados (criterios STOPP) y con potenciales omisiones de prescripción (criterios START). Las dos versiones anteriores de los criterios STOPP/START se publicaron en 2008 y en 2015, y sus versiones en español, en 2009 y en 2015. En 2023 se acaba de publicar la versión3 de dichos criterios. El objetivo de este artículo es presentar la versión traducida al español, así como revisar la utilización y el impacto que ha tenido la versión2 del año 2015 en nuestro idioma. Se realizó una traducción del inglés al español por profesionales expertos y con alto nivel de inglés de la versión3 de los criterios STOPP/START, que incorporan la evidencia publicada desde abril de 2014 hasta marzo de 2022. Además, se hizo una revisión sistemática de las publicaciones que han usado la traducción española de la versión previa (versión2 de 2015) de los criterios STOPP/START. La nueva versión, presentada en este artículo, cuenta con 190 criterios STOPP/START (133 criterios STOPP y 57 criterios START), lo que supone un aumento del 40% en el número de criterios en comparación con la versión anterior. En la revisión se encontraron 37 estudios (21 observacionales, 11 de intervención y 5 de otro tipo) que han usado la versión española en lugar de la internacional.
La versión3 en español de los criterios STOPP/START es una lista explícita actualizada de medicamentos potencialmente inapropiados y posibles omisiones en la prescripción que tienen el objetivo de optimizar la medicación y minimizar las reacciones adversas a los medicamentos durante la revisión de la medicación en las personas mayores, en particular aquellas con multimorbilidad y polifarmacia. Con esta nueva versión se pretende dar una mayor difusión a los criterios originales dentro de la comunidad sanitaria hispanohablante. La versión2 española de los STOPP/START ha sido ampliamente utilizada, por lo que consideramos que la traducción al español ha ayudado a mejorar la farmacoterapia en pacientes mayores con polifarmacia y multimorbilidad en nuestro entorno lingüístico.
The STOPP/START criteria are explicit physiologic systems-based criteria that summarize evidence on clinically relevant prescribing problems related to the use of potentially inappropriate medications (STOPP criteria) and potential prescribing omissions (START criteria). The two previous versions of the STOPP/START criteria were published in 2008 and 2015, and their Spanish versions in 2009 and 2015. Version3 of these criteria has just been published in 2023. The aim of this article is to present the Spanish translated version, and to review the use and impact that version2 of 2015 has had in our language. A translation from English to Spanish was performed by expert professionals with a high level of English of version3 of the STOPP/START criteria, which incorporates the evidence published from April 2014 to March 2022. In addition, a systematic review of publications that have used the Spanish translation of the previous version (version2 of 2015) of the STOPP/START criteria was performed. The new version, presented in this article, has 190 STOPP/START criteria (133 STOPP criteria and 57 START criteria), which is a 40% increase in the number of criteria compared to the previous version. The review found 37 studies (21 observational, 11 interventional and 5 other) that used the Spanish version instead of the international version.
The Spanish version 3 of the STOPP/START criteria is an updated explicit list of potentially inappropriate medications and possible omissions in prescribing that aims to optimize medication and minimize adverse drug reactions during medication review in the elderly, particularly those with multimorbidity and polypharmacy. With this new version, the original criteria are intended to be more widely disseminated within the Spanish-speaking healthcare community. The Spanish version2 of the STOPP/START has been widely used, so we consider that the translation into Spanish has helped to improve pharmacotherapy in older patients with polypharmacy and multimorbidity in our linguistic environment.
En la población de edad avanzada, con multimorbilidad, fragilidad y polifarmacia, la prescripción inapropiada de medicamentos (PIM) constituye un problema de gran relevancia, ya que puede deteriorar la salud, la función y la calidad de vida, por aparición de efectos adversos, interacciones medicamentosas o falta de eficacia, así como incrementar la utilización de recursos y costes sociales y sanitarios1-4. Se ha descrito que el 10-30% de los ingresos hospitalarios en pacientes mayores se deben a un problema relacionado con la medicación, siendo muchos de ellos prevenibles1,5.
El uso adecuado de los medicamentos consiste en su utilización en aquellas situaciones en las que tienen evidencia para su uso, en una indicación concreta, adecuados a la situación del paciente, bien tolerados y coste-efectivos. Por ello, se considera que existe una PIM cuando el riesgo de sufrir eventos adversos es superior al beneficio clínico, existiendo alternativas terapéuticas más seguras y eficaces. La PIM engloba tanto la prescripción potencialmente inapropiada (PPI), es decir el uso incorrecto de medicamentos, por dosis, duración inadecuada o duplicidad, interacciones farmacológicas, como la prescripción potencialmente inapropiada por omisión (PPO) de medicamentos indicados6.
Existen diferentes estrategias para optimizar la farmacoterapia y disminuir o evitar la polifarmacia en el paciente mayor, y entre ellas se encuentra la revisión de la medicación crónica de forma periódica, con la detección de PIM y la resolución de todos aquellos problemas relacionados con la medicación que causan eventos adversos7,8. Desde la aparición de los primeros criterios de Beers en el año 1991, han ido publicándose diferentes criterios explícitos, que resumen la evidencia respecto a la PPI y a la desprescripción de fármacos innecesarios. Los criterios STOPP/START aportaron también la PPO, recomendando la indicación de determinados medicamentos según las diferentes situaciones clínicas de los pacientes mayores9,10.
Los criterios explícitos son una herramienta de fácil aplicación, que ayudan a la revisión de la medicación de una forma reglada y homogénea a los profesionales sanitarios responsables de la farmacoterapia del paciente mayor. Por ello, se han incorporado como una herramienta imprescindible para la revisión de medicación, que ha mostrado reducir polifarmacia, eventos adversos y utilización de recursos sanitarios2,4,11-13.
ObjetivoEl objetivo de este artículo es presentar la versión3 de los STOPP/START traducida al español y revisar la utilización y el impacto que ha tenido la versión2 del 2015 en nuestro idioma.
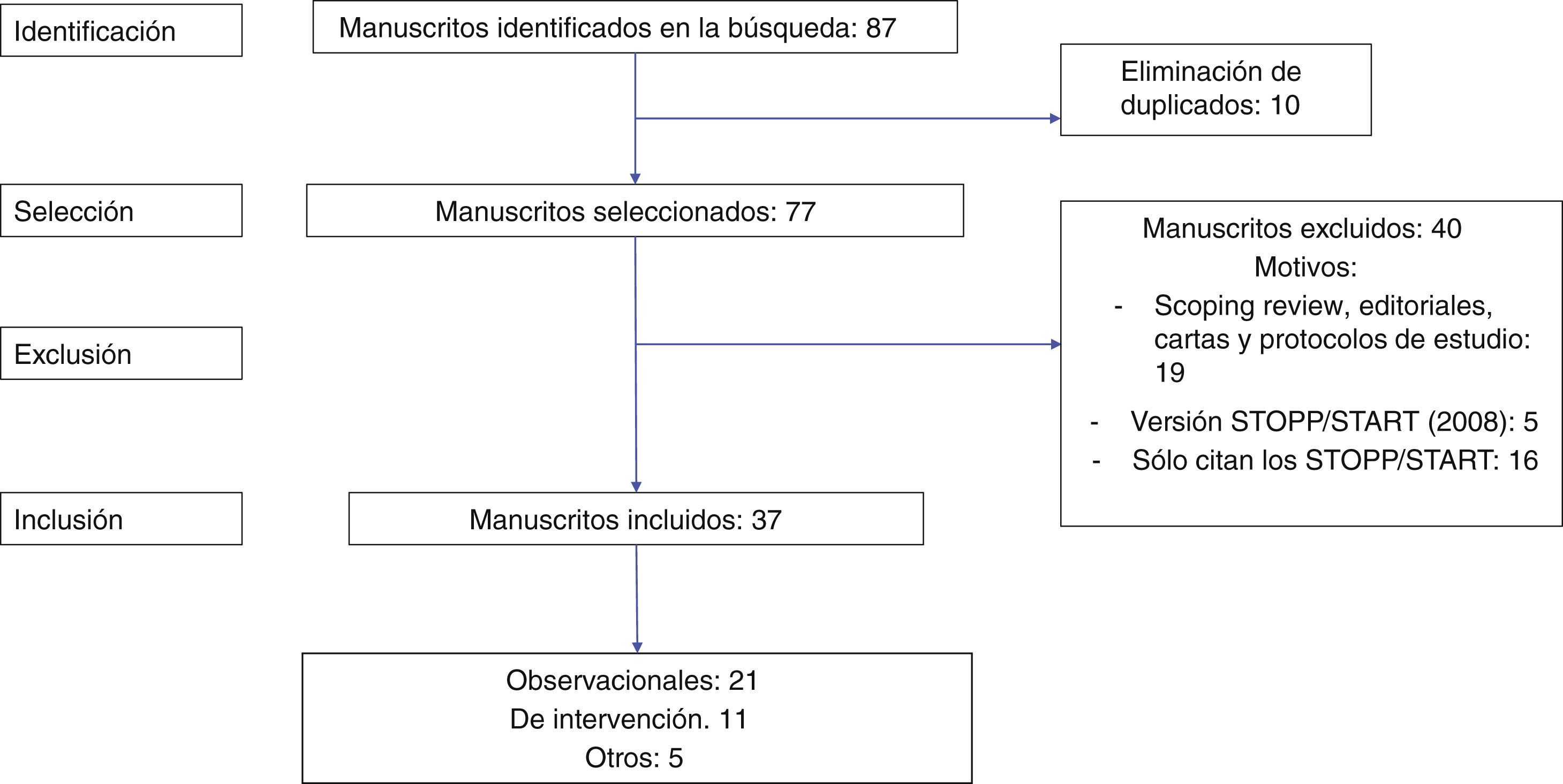
La versión 2 (2015) de los criterios STOPP/START en españolNuestro equipo ha traducido al español las dos versiones previas de los criterios STOPP/START, con la idea de que su traducción pueda facilitar su implementación en medios sanitarios menos familiarizados con el idioma inglés9,10. Con la finalidad de valorar la utilidad de la segunda versión española de los STOPP/START, realizamos una búsqueda sistemática en las bases de datos Pubmed, Scopus y WOS hasta diciembre de 2022 de todas las publicaciones en las que se citaron los criterios STOPP/START versión2 española10. En la figura 1 se recoge el proceso de revisión. Se encontraron finalmente 77 artículos. Se descartaron 40 que, aunque en la bibliografía referenciaban los criterios, no los utilizaban para medir las PIM o con finalidad similar, sino que los citaban por otras razones o utilizaban en realidad la primera versión de los STOPP/START del 2008. También se excluyeron las revisiones narrativas o de alcance, editoriales, cartas y protocolos de estudio. De los estudios incluidos, 11 eran de intervención14-24 (tabla 1), 21 observacionales25-45 (tabla 2) y 5 eran otro tipo de estudios, entre los que se encuentran un consenso de expertos46, otras listas de PIM desarrolladas a partir de los STOPP/START (como la traducción al portugués de dichos criterios, el diseño y la validación de los criterios cubanos de medicación inapropiada, de los criterios turcos (TIME) y de la traducción de los STOPP-Frail al castellano (STOPP-Pal)47-50 (tabla 3). (La información más completa relativa a todos estos estudios se adjunta como material suplementario.)
Estudios de intervención
| Ámbito | Autor, año | Objetivo principal relacionado con PPI (S/N) | Tipo de estudio | Comparación de STOPP/START con otros criterios de PPI | STOPP/START (general o selección de grupo específico) | Edad media/mediana final (años) (SD/min-max) | N.° de pacientes/residentes | Conclusión |
|---|---|---|---|---|---|---|---|---|
| Atención primaria | Gené Huguet L et al., 201814 | N | Prospectivo. Ensayo clínico aleatorizado | N | General | 84,5 (SD: 3,5) | 173 | Una intervención de atención primaria multifactorial e interdisciplinar centrada en el ejercicio físico, la nutrición, la revisión de la polifarmacia y la evaluación social evitó la fragilidad en pacientes mayores prefrágiles y mejoró la capacidad funcional, la calidad de vida y la adherencia a la dieta mediterránea |
| Gené Huguet L et al., 202215 | N | Retrospectivo. Seguimiento, estudio de cohortes de pacientes de un ensayo clínico | N | General | 88,5 (SD: 3,3) | 135 | Una intervención multifactorial e interdisciplinar realizada en atención primaria previno la fragilidad en mayores prefrágiles a los 36 meses de seguimiento. Aunque el grupo intervención estaba agrupado en grupos de riesgo clínico de mayor grado y por tanto presentaba mayor morbilidad, el coste era inferior al del grupo control | |
| Martínez-Sotelo J et al., 202116 | S | Prospectivo. Ensayo clínico controlado aleatorizado por clústeres | Criterios implícitos | General | 77,52 (SD: 6,73); 77,19 (SD: 7,13) | 549 (42 cluster) | La revisión por el farmacéutico disminuye el número de PPI y los costes. No se han encontrado diferencias estadísticamente significativas en las variables de utilización de recursos y mortalidad | |
| Hospital | Caro Teller JM et al., 201817 | S | Prospectivo | Beers, Priscus | Selección | 82,71 (SD: 5,31) | 5.416 | La inclusión de un seguimiento farmacoterapéutico promueve cambios en la prescripción de PPI |
| Marín-Gorricho R et al., 202218 | S | Cuasi-experimental | N | General | 87,7 (SD: 6,1) | 218 | Durante el ingreso hospitalario, la detección de PPI y PRM del tratamiento crónico por el farmacéutico, y en colaboración con el médico del paciente, ayuda a disminuir la prevalencia de PPI y PRM | |
| Residencia | Gomez-Cortijo R et al., 202019 | S | Retrospectivo | N | General | 82,6 (SD: 7,3) | 247 | La evaluación geriátrica integral y el uso de STOPP/START pueden reducir significativamente la prevalencia de PPI entre los pacientes de un CSS. Sin embargo, la fragilidad, la multimorbilidad y las metas funcionales se tendrían en cuenta en la adecuación de la prescripción |
| Hernandez-Martin J et al., 202220 | N | Descriptivo. Implantación de un programa | N | General | − | − | La implantación de programas de atención farmacéutica especializada a CSS desde los servicios de farmacia consigue reducir costes directos en medicamentos. Sin embargo, los proyectos deben dotarse de presupuesto para poder contar con personal y material suficiente para poder desarrollar una atención farmacéutica integral de calidad centrada en la persona y mejorar la seguridad en el paciente institucionalizado | |
| Moreno Perulero ML et al., 201621 | S | Prospectivo. Estudio piloto | Recomendaciones recogidas en GPC y criterios implícitos | General | 83,9 (SD: 7,66) | 332 | La revisión de tratamientos permite reducir la PPI y la intervención no tuvo impacto negativo en los residentes | |
| Farmacia comunitaria | Bellver Monzo O et al., 201822 | S | Prospectivo | N | General | Hombres: 78,9 (SD: 6,0) Mujeres: 76,9 (SD: 6,2) | 88 | La prevalencia de los criterios STOPP fue similar a otros estudios. La de los criterios START, menor. La entrevista permite descartar falsas PPI |
| Hospital y continuidad asistencial | Garay-Bravo C et al., 201823 | S | Prospectivo | N | Solo criterios STOPP | 83,2 (SD: 5) | 4.571 | La intervención coordinada de farmacólogos y psiquiatras en el ámbito hospitalario, y la comunicación entre estos profesionales y los equipos de atención primaria, pueden reducir la prescripción inadecuada de psicofármacos |
| Farmacia comunitaria y 1 residencia | Mud Castello F et al., 201824 | N | Prospectivo, transversal | N | General | 82,9 (SD: 8,1) | 31 | Con la revisión de la medicación el farmacéutico comunitario ayudó al médico a optimizar la farmacoterapia de los pacientes |
CSS: centro sociosanitario; GPC: guías de práctica clínica; N: no; PPI: prescripción potencialmente inadecuada; PPO: prescripción inadecuada por omisión; PRM: problema relacionado con la medicación; S: sí; SD: standard deviation (desviación estándar); START: screening tool to alert to right treatment; STOPP: screening tool of older persons’ potentially inappropiate prescriptions; UCE: unidad de corta estancia.
Estudios observacionales
| Ámbito | Autor, año | Objetivo principal relacionado con PPI/PPO (S/N) | Tipo de estudio | Comparación de STOPP/START con otros criterios de PPI | Edad media/mediana final (SD/min-max/IQR) | N.° de pacientes | Conclusión |
|---|---|---|---|---|---|---|---|
| Atención primaria | Díaz-Gonzalez A et al., 201825 | N | Transversal | N | 83 (77-87) | 86 | Los criterios STOPP/START son útiles para analizar la PPI en pacientes mayores pluripatológicos, que sigue siendo elevada. Hay un cambio cualitativo y mayor capacidad de detección de PPI con los nuevos criterios (2015) |
| Herrera Preval Y et al., 202126 * | S | Concordancia | Criterios cubanos de PPI | 75,3 | 152 | Los STOPP/START y los criterios cubanos son útiles en detectar PPI | |
| Lopez-Rodriguez JA et al., 202027 | S | Transversal | Beers (2015 y 2019), STOPP/START (2008 Y 2014) y MAI | 69,7 (SD: 2,7) | 593 | La prevalencia de PPI es elevada y de acuerdo a lo publicado: MAI detecta mayor PPI que los criterios explícitos, pero su aplicación es más compleja | |
| Palchik V et al., 202029 * | S | Prospectivo | N | 60-64: 10 pacientes; 65-69: 16; 70-74:9; 75-79:6; > 80: 9 | 50 | Los criterios STOPP/START han sido incluidos como ayuda a la toma de decisiones durante el seguimiento farmacoterapéutico de los pacientes | |
| Ramírez Pérez AR et al., 202128 * | N | Retrospectivo | N | 75,33 (SD: 9,64) | 1.584 | La prevalencia de polifarmacia fue muy elevada. La aplicación de los criterios STOPP/START pueden mejorar la calidad de la prescripción | |
| Rivera Plaza L., 201830 | S | Transversal | N | 82,32 (SD: 4,84) | 273 | No se ha encontrado que una elevada PPI se correlacione con una baja adherencia | |
| Rodriguez-Blanco R et al., 201931 | S | Transversal | N | 75,4 (SD: 7,4) | 378 | Elevada PPI. Los criterios STOPP/START son útiles en atención primaria | |
| Rogero-Blanco E et al., 202032 | S | Transversal | Beers (2015) | 69,7 (SD: 2,7) | 593 | Hay una alta prevalencia de PPI en pacientes mayores detectada por sistema de soporte a la decisión clínica electrónica con polifarmacia y multimorbilidad. Los sistemas de soporte a la decisión clínica electrónica pueden ser de gran ayuda para los médicos de atención primaria | |
| Hospital | Guo X et al., 202233 * | S | Transversal | N | 75,2 (SD: 6,7) | 500 | La multimorbilidad y la polifarmacia fueron muy prevalentes en pacientes mayores con fibrilación auricular en China. También se observó una alta prevalencia de PPI. Por lo tanto, se debe prestar mucha más atención al grave problema de salud en la población mayor |
| Ortiz Urena, AM et al., 201834 * | S | Retrospectivo | Beers (2015) e IPET (2002) | 80 (65-102) | 388 | Los criterios Beers son la herramienta que permite mayor identificación de PPI, debido al tipo de información que es posible obtener, su construcción concisa y su practicidad a la hora de ser aplicada | |
| Pardo-Cabello AJ et al., 201835 | S | Retrospectivo. Transversal | N | 82 (76-86) | 275 | Las PPI son frecuentes entre los pacientes dados de alta en medicina interna. El número de fármacos prescritos fue asociado a PPI, y las benzodiacepinas fueron los fármacos más implicados. La PPI incrementa los costes | |
| Pardo-Cabello AJ et al., 202236 | S | Retrospectivo | N | 82 (76-86) | 270 | El número de fármacos al alta con criterios STOPP incrementa el riesgo de hospitalización y puede asociarse, aunque no estadísticamente significativo, con una mayor mortalidad | |
| Rodriguez del Río E et al., 201837 | S | Retrospectivo | N | 84 (SD: 5) | 179 | La presencia de PPI sí se relaciona con eventos adversos, concretamente con pacientes con patologías cardiovasculares y neuropsiquiátricas | |
| Residencia | Da costa FA et al., 201638 * | S | Transversal | Beers (2008, 2012) | 84,7 (SD: 6,35) | 161 | Se identificó una cantidad elevada de PPI y PPO, lo que indica que hay margen para mejorar la calidad de la atención. La variación en la prevalencia indica que la elección cuidadosa de la herramienta es un requisito previo para participar en la revisión de medicamentos. El uso de los criterios STOPP/START permitió un enfoque más holístico de la calidad de la prescripción en los mayores, destacando los bajos niveles de prevención del riesgo cardiovascular y el abuso de fármacos psicotropos, además de los errores del sistema que en gran medida se pueden prevenir mediante la prescripción electrónica y la generación de alertas |
| Diaz Planelles I et al., 202141 | S | Retrospectivo | N | 78,91-80,37; 78,80-80,16; 78,63-80,19 | 2.251 | Se detectó una elevada prevalencia de PPO en pacientes institucionalizados, y esta prevalencia se mantuvo durante los 3 años del estudio | |
| Marín-Gorricho R et al., 201740 | S | Transversal | N | 85,2 (SD: 7,9) | 103 | Los criterios STOPP/START son una herramienta útil para evitar PPI. Un programa de adecuación de la medicación por un equipo multidisciplinar podría reportar beneficios para la salud en este sector | |
| Ramírez Pérez AR et al., 202139 * | S | Transversal. Retrospectivo | N | 79,06 (SD: 11,35) | 117 | Los mayores polimedicados institucionalizados tienen prescripciones de grupos/fármacos de uso frecuente que se relacionan con errores de prescripción, que expone polifarmacia inadecuada y complejidad farmacoterapéutica con posible amenaza a la calidad de vida del mayor institucionalizado | |
| Unidad de continuidad asistencial | Guerro-Prado M et al., 201742 | S | Prospectivo | Beers | 83,7 (61-98) | 85 | Se deberían realizar intervenciones formativas y desarrollar asistencias informáticas que ayuden a evitar los PRM más prevalentes |
| Unidades de cuidado integral continuo | Candeias C et al., 202143 * | S | Retrospectivo | N | 81,6 (SD: 7,4) | 161 | Los PPI y PPO fueron altamente prevalentes en pacientes con cuidados postagudos y prolongados en unidades de cuidado continuo integral. Por lo tanto, los criterios STOPP/START podrían ser una herramienta eficaz para mejorar la calidad de la prescripción y los resultados clínicos en estos pacientes frágiles mayores |
| Mixtos | Delgado-Silveira E et al., 201844 | S | Prospectivo | Juicio clínico farmacéutico | 84,6 (IQR 10) | 338 | Se detectó un gran número de PPI en pacientes institucionalizados y hospitalizados con pluripatología. La inclusión de un farmacéutico en el equipo multidisciplinar facilitó la detección de PPI, especialmente en pacientes institucionalizados y grandes polimedicados que no eran detectados por criterios explícitos STOPP/START |
| Ortega Lopez IL et al., 201945 * | S | Transversal | Beers (2015) | 74,9 (60-96) | 632 | Existe un elevado uso de PPI en los mayores, lo cual puede constituir una expresión de la limitada atención a las necesidades de salud relativas al uso de medicamentos en estos pacientes |
N: no; PPI: prescripción potencialmente inadecuada; PPO: prescripción inadecuada por omisión; PRM: problema relacionado con la medicación; S: sí; SD: standard deviation (desviación estándar); START: screening tool to alert to right treatment; STOPP: screening tool of older persons’ potentially inappropiate prescriptions.
a Internacionales.
Otros estudios
| Autor | Objetivo | Tipo de estudio | Ámbito (hospitalizado, atención primaria, residencial) | Resultados más relevantes | Conclusión | País del estudio |
|---|---|---|---|---|---|---|
| Monteiro L et al., 202247 | Consta de 4 fases. Fase 1: traducción y adaptación al portugués de los STOPP/START versión 2 española. Fase 2: validación de la lista en pacientes. Fase 3 y 4: estudio de fiabilidad y concordancia entre evaluadores | Fase 2: 334 pacientes > 65 años fueron aleatorizados y seguidos por 3 MAP | Atención primaria | Obtención de una lista STOPP/START traducida al portugués. Kappa de 0,7 para los STOPP y de 0,6 para los START | Los autores concluyen que es una buena herramienta y fácil de usar | Portugal |
| Ortega Lopez IL et al., 201748 | Diseñar y validar los criterios de medicación PPI en el anciano, adaptados al entorno sociosanitario de Cuba | Investigación cualitativa, en la cual los criterios cubanos se basaron en los STOPP/START y fueron validados por medio de la metodología Delphi, por un comité de expertos (especialistas en medicina geriátrica y clínica de diferentes zonas geográficas del país), y se les calculó la consistencia interna mediante el coeficiente alfa de Cronbach | Residencial | Los criterios quedaron estructurados en tres listas: 1) medicación PPI, medicamento indicado no prescripto, cuando no existe contraindicación para su uso; 2) medicación PPI independiente del diagnóstico o la condición clínica; 3) medicación PI dependiente del diagnóstico o la condición clínica | Se demostró la validez del contenido y la adecuada consistencia interna de los criterios diseñados para la identificación de medicación potencialmente inapropiada en el anciano | Cuba |
| Agüera-Ortiz L et al., 202146 | Recopilar opiniones de expertos sobre la demencia y el manejo de pacientes deprimidos para reducir la heterogeneidad en la práctica diaria | Consenso de expertos, prospectivo, multicéntrico, 2 rondas Delphi modificado | Las opciones farmacológicas eficaces y bien toleradas para la depresión comórbida del Parkinson fueron inhibidores selectivos de la recaptación de serotonina (especialmente sertralina), inhibidores de la recaptación de serotonina y norepinefrina de acción dual (venlafaxina, desvenlafaxina y duloxetina), multimodales (vortioxetina, bupropión, mirtazapina y tianeptina), y agonistas dopaminérgicos antiparkinsonianos (pramipexol, ropinirol y rotigotina). Los antidepresivos tricíclicos y la combinación de inhibidores de la monoaminooxidasa tipo B con fármacos serotoninérgicos tienen efectos secundarios graves en estos pacientes y, por lo tanto, no deben prescribirse | Los resultados presentados aquí son una guía útil de diagnóstico y manejo del paciente para otros médicos y presenta consideraciones importantes para mejorar el futuro diseño de ensayos de medicamentos | España | |
| Bahat G et al., 202049 | Los criterios turcos de uso inapropiado de medicamentos en ancianos (TIME) se planificaron para satisfacer esta necesidad | Desarrollo de un cuestionario: En la fase 1, se combinaron los conjuntos fáciles de usar: STOPP/START versión 2 y CRIME. Se invitó a expertos nacionales compuestos por geriatras y no geriatras a revisar y comentar. En la fase 2 se llevó a cabo una revisión exhaustiva de la literatura y se realizaron revisiones, omisiones y adiciones basadas en referencias. Se agregaron explicaciones a algunos criterios para mejorar la aplicación en la práctica. En la fase 3, todos los miembros del grupo de trabajo revisaron los criterios/explicaciones y acordaron el contenido final | Se introdujeron un total de 153 criterios de TIEMPO compuestos por 112 criterios de TIME para detener y 41 criterios de TIME para inicio | Los criterios TIME son una herramienta de detección actualizada que se diferencia de las herramientas útiles actuales por el estudio interactivo de expertos de geriatría y no geriatría, la inclusión de explicaciones prácticas para algunos criterios y por su origen en Europa del Este. El estudio TIME reconoce respetuosamente sus raíces en los criterios STOPP/START y CRIME. Se necesitan estudios para determinar si conduciría a mejoras en la salud de los adultos mayores | Turquía | |
| Delgado-Silveira E et al., 201950 | Se propone una nueva herramienta, STOPP-Pal, dirigida específicamente a mejorar la prescripción en personas que reciben cuidados paliativos | Se seleccionó un equipo de 25 expertos, se llevó a cabo una técnica de consenso Delphi y se invitó a los expertos a que ofrecieran sugerencias. Se analizó la evidencia de cada fármaco o grupo farmacológico | Médicos especialistas en geriatría y cuidados paliativos y farmacéuticos hospitalarios con experiencia en farmacoterapia geriátrica han realizado una traducción directa de estos criterios que ha sido revisada por cada uno de los miembros del equipo, acordando por consenso la redacción de aquellos en los que hubiera controversia o discrepancia. Se alcanzó consenso en 27 criterios | En este artículo se presenta la versión traducida al castellano de los STOPP-Frail, que pasará a llamarse STOPP-Pal para evitar confusiones con el concepto de fragilidad más utilizado | España |
Los estudios de intervención (tabla 1) se centran en su mayoría en valorar el efecto de la intervención del farmacéutico en la disminución de PIM tras la aceptación de las recomendaciones por parte del médico prescriptor. En dos estudios se miden los costes y la utilización de recursos sanitarios15,16, y en uno de ellos se revisa la repercusión de una intervención multifactorial, en la que se incluye la revisión de la PIM, en la fragilidad a los 36meses14,15.
En los estudios observacionales (tabla 2) predominan los transversales, que miden la prevalencia de PIM en distintos entornos sanitarios. Además, hay dos estudios de cohortes, uno con seguimiento en los dos años posteriores al alta hospitalaria, que permitió medir el impacto de la PIM en la mortalidad y en los ingresos hospitalarios36, y otro que encontró una asociación entre la presencia de PIM tras el alta de una unidad de corta estancia con la aparición de eventos adversos a los 30 y 180días, concretamente en pacientes con patología cardiovascular y neuropsiquiátrica37.
La población objeto de los estudios fue mayoritariamente mayor de 65años, siendo la edad media más frecuente alrededor de los 80años, y aunque la mayoría eran personas polimedicadas, este no era siempre criterio de inclusión.
Respecto al ámbito sanitario de los estudios, la mayoría se realizaron en atención primaria, con 8 estudios observacionales y 3 de intervención, seguidos del entorno hospitalario y residencial.
En relación con los criterios de PIM utilizados, se aplicaron los STOPP/START como criterios únicos en 21 estudios (13 estudios observacionales y 8 de intervención), pero en 8 se aplicaron también otros criterios explícitos, siendo los más frecuentes los criterios de Beers de 2015. En algunos estudios se utilizaron tanto criterios explícitos como implícitos, tal y como se recoge en las tablas 1 y 2.
En 28 estudios se aplicaron todos los criterios STOPP/START, es decir, se midió la PIM considerando todos los ítems recogidos en dichos criterios. Algunos trabajos solamente aplicaron parte de los criterios, como Palchik et al., que seleccionaron 17 criterios STOPP y 7 START29, Garay-Bravo et al. y López-Rodríguez et al., que solo utilizaron los criterios STOPP23,27; concretamente, Garay Bravo aplicó los criterios STOPP relativos a psicofármacos23. Así mismo, el estudio realizado por Díaz Planelles et al. solo utilizó los criterios START41. Finalmente, en el trabajo realizado por Caro Teller et al. se utilizó una selección de criterios, pero sin especificar cuáles exactamente17.
En la mayoría de los estudios se detectó una prevalencia de PIM bastante elevada, oscilando entre el 41,5% del estudio de Pardo-Cabello et al.35 y el 97,4% de Herrera Preval et al.26. En general la prevalencia fue mayor para los criterios STOPP que para los START.
En los criterios STOPP, los más prevalentes fueron A1 (medicamentos sin indicación) y D5 (benzodiazepinas con una duración superior a 4semanas). En los START, los más frecuentemente identificados fueron los criterios A4 (antihipertensivos cuando la presión arterial sistólica sea >160mmHg y/o la presión arterial diastólica sea >90mmHg) y A5 (estatinas con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica, salvo que el paciente esté en situación de final de vida o su edad sea mayor de 85años).
Los grupos farmacológicos y fármacos más implicados en las PIM detectadas por los STOPP/START han sido: fármacos que actúan en el sistema nervioso central, en el sistema cardiovascular (beta-bloqueantes, diuréticos de alto techo, IECA, digoxina, estatinas), antiagregantes plaquetarios, anticoagulantes orales, inhibidores de la bomba de protones, antidiabéticos orales, vitaminaD y calcio, vacuna antineumocócica, laxantes, sistema musculoesquelético (AINE) y anticolinérgicos.
La mayor parte de los estudios se han realizado por autores españoles, aunque también han utilizado los criterios STOPP/START en Argentina, China, Costa Rica, Cuba, Portugal y Turquía29,33,34,45,47-49. Llama la atención el hecho de que algunos países no hispanohablantes hayan utilizado la versión en español en lugar de la versión en inglés; en Portugal podría ser por la cercanía geográfica y por la mayor similitud del idioma portugués y español, pero en el caso de China y de Turquía no podemos explicar el motivo que llevó a los autores a utilizar la versión en español.
Una nueva versión: los criterios STOPP/START 3Los criterios explícitos de prescripción deben revisarse y actualizarse periódicamente, ya que el avance del conocimiento y la evidencia actual pueden obligar a modificarlos o a ampliarlos. En esta ocasión, un grupo de expertos europeos (en las dos versiones anteriores los criterios fueron elaborados por profesionales irlandeses) revisó los criterios de la versión2 de los STOPP/START para determinar si seguían siendo válidos y estaban actualizados de acuerdo con la evidencia disponible y realizó también una revisión exhaustiva de toda la literatura publicada (a fecha 31 de marzo de 2022) con el fin de proponer nuevos criterios. Se eliminaron dos criterios STOPP y un criterio START de la versión2 (STOPP C2 y H7 y START B1), se realizó un proceso de validación Delphi con los nuevos criterios propuestos y se elaboró una versión actualizada, la versión3 de los criterios STOPP/START, que ha sido recientemente publicada51. La versión 3 de los criterios STOPP/START ha aumentado de forma considerable el número de recomendaciones, con un total de 190 criterios (133 STOPP y 57 START), frente a los 114 criterios de la versión2. El número de criterios STOPP ha crecido de forma significativa en todos los sistemas fisiológicos excepto en el aparato respiratorio y musculoesquelético. Los criterios START también han aumentado, excepto en los sistemas respiratorio y endocrino. Además, se han creado dos nuevas categorías START, no existentes en las versiones anteriores, sobre coagulación y sistema renal.
En las tablas 4 y 5 se recogen respectivamente la versión3 española de los criterios STOPP y de los START. Al igual que en otras versiones anteriores, los diferentes criterios se han agrupado en su mayoría por sistemas fisiológicos. En los criterios STOPP, en la secciónA aparecen los criterios sin indicación; en la secciónK, los fármacos que incrementan el riesgo de caídas, y en la secciónM, los fármacos con carga anticolinérgica (tabla 4). En los criterios START también se incluye en la secciónA un criterio de medicamentos indicados (tabla 5).
Versión española de los criterios STOPP (Screening Tool of Older Persons’ Prescriptions) versión 3
| Las siguientes prescripciones son potencialmente inapropiadas en pacientes mayores de 65 años: |
| Sección A. Indicación de la medicación |
| 1. Cualquier medicamento prescrito sin una indicación clínica basada en la evidencia |
| 2. Cualquier medicamento prescrito con una duración superior a la recomendada, cuando la duración del tratamiento está bien definida |
| 3. Cualquier prescripción concomitante de dos fármacos de la misma clase para su uso diario y regular (con excepción de las prescripciones a demanda) como dos AINE, ISRS, diuréticos de asa, IECA, anticoagulantes, neurolépticos, opioides (debe optimizarse la monoterapia con un único fármaco de esa clase antes de considerar uno nuevo) |
| Sección B. Sistema cardiovascular |
| 1. Digoxina para la insuficiencia cardíaca con función sistólica ventricular conservada (no hay evidencia clara de su beneficio) |
| 2. Verapamilo o diltiazem en la insuficiencia cardíaca grado III o IV de la NYHA (pueden empeorar la insuficiencia cardíaca con fracción de eyección reducida) |
| 3. Betabloqueantes en combinación con verapamilo o diltiazem (riesgo de bloqueo cardíaco) |
| 4. Fármacos para el control de la frecuencia cardíaca (betabloqueantes, verapamilo, diltiazem o digoxina) con bradicardia (< 50 lpm) o con bloqueo cardíaco de segundo grado o bloqueo cardíaco completo (riesgo de hipotensión grave o asistolia) |
| 5. Betabloqueantes en monoterapia para la hipertensión arterial no complicada (no asociada a angina de pecho, aneurismas aórticos u otras patologías donde los betabloqueantes están indicados), ya que no hay evidencia sólida de su eficacia |
| 6. Amiodarona como tratamiento antiarrítmico de primera línea en las taquiarritmias supraventriculares (mayor riesgo de efectos secundarios graves que los betabloqueantes, digoxina, verapamilo o diltiazem) |
| 7. Diuréticos de asa como tratamiento de primera línea de la hipertensión, salvo que exista insuficiencia cardíaca concomitante que requiera tratamiento diurético (falta de datos para esta indicación; existen alternativas más seguras y efectivas) |
| 8. Diuréticos de asa para los edemas maleolares sin evidencia clínica, bioquímica o radiológica de insuficiencia cardíaca, insuficiencia hepática, síndrome nefrótico o insuficiencia renal (la elevación de los miembros inferiores y/o las medias de compresión son generalmente más apropiadas) |
| 9. Diuréticos tiazídicos en presencia de hipopotasemia (potasio sérico <3,0 mmol/l), hiponatremia (sodio sérico <130 mmol/l) o hipercalcemia (calcio sérico corregido >2,65 mmol/l) significativas, o con antecedentes de gota (las tiazidas pueden producir hipopotasemia, hiponatremia, hipercalcemia y gota) |
| 10. Diuréticos de asa para el tratamiento de la hipertensión cuando existe incontinencia urinaria (pueden empeorar la incontinencia) |
| 11. Antihipertensivos de acción central como metildopa, clonidina, moxonidina, rilmenidina o guanfacina, salvo que exista intolerancia o falta de eficacia con otros antihipertensivos (los antihipertensivos de acción central son generalmente peor tolerados por los mayores que por los jóvenes) |
| 12. Inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA-II) en pacientes con hiperpotasemia (potasio sérico >5,5 mmol/l) |
| 13. Antagonistas de la aldosterona (p. ej., espironolactona, eplerenona) junto con otros fármacos que puedan aumentar los niveles de potasio (p.ej., IECA, ARA-II, amilorida, triamtereno) sin monitorizar el potasio sérico (riesgo de hiperpotasemia grave >6,0 mmol/l; el potasio sérico debería monitorizarse periódicamente, al menos cada 6 meses) |
| 14. Inhibidores de la fosfodiesterasa 5 (p.ej., sildenafilo, taladafilo, vardenafilo) en la insuficiencia cardíaca grave con hipotensión (presión arterial sistólica <90mmHg) o asociados al tratamiento de la angina de pecho con nitratos (riesgo de colapso cardiovascular) |
| 15. Medicamentos que prolongan el intervalo QT corregido (QTc=QT/RR) en pacientes con QTc previamente prolongado (>450ms en hombres y >470ms en mujeres), incluyendo quinolonas, macrólidos, ondansetrón, citalopram (dosis >20mg/día), escitalopram (dosis >10mg/día), antidepresivos tricíclicos, litio, haloperidol, digoxina, antiarrítmicos de los grupos Ia y III, tizanidina, fenotiazinas, astemizol, mirabegrón (riesgo de arritmias ventriculares potencialmente mortales) |
| 16. Estatinas como prevención primaria de eventos cardiovasculares en ≥85años y fragilidad establecida con una esperanza de vida menor a 3años (falta evidencia de su eficacia) |
| 17. AINE sistémicos (no tópicos) a largo plazo si hay antecedentes de enfermedad coronaria, cerebrovascular o vascular periférica (mayor riesgo de trombosis) |
| 18. Antipsicóticos a largo plazo si hay antecedentes de enfermedad coronaria, cerebrovascular o vascular periférica (mayor riesgo de trombosis) |
| 19. AINE o corticoides sistémicos en presencia de insuficiencia cardíaca que requiera el uso de diuréticos de asa (riesgo de descompensación de insuficiencia cardíaca) |
| 20. Antihipertensivos en la estenosis aórtica grave sintomática excepto los inhibidores del sistema renina-angiotensina (riesgo de hipotensión grave y síncopes) |
| 21. Digoxina como tratamiento de primera línea para el control de la frecuencia cardíaca a largo plazo (>3meses) en la fibrilación auricular (mayor mortalidad; son preferibles los betabloqueantes cardioselectivos) |
| Sección C. Antiagregantes/anticoagulantes |
| 1. Acido acetilsalicílico (AAS) en tratamiento crónico a dosis superiores a 100mg al día (aumento del riesgo de sangrado sin evidencia de mayor eficacia) |
| 2. Antiagregantes, antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en presencia de un riesgo significativo de sangrado (p.ej., hipertensión grave no controlada, diátesis hemorrágicas, sangrado reciente espontáneo significativo) (alto riesgo de sangrado) |
| 3. AAS más clopidogrel para la prevención secundaria del ictus durante más de 4 semanas, salvo que el paciente tenga un stent coronario implantado en los 12 meses previos, un síndrome coronario agudo o una estenosis carotídea grave sintomática (no hay evidencia de beneficios a largo plazo frente al clopidogrel en monoterapia) |
| 4. Antiagregantes junto con antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en pacientes con fibrilación auricular crónica, salvo que el paciente tenga un stent coronario o una estenosis coronaria de alto grado (>50%) objetivada por coronariografía (el antiagregante no aporta beneficios) |
| 5. Antiagregantes junto con antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en pacientes con enfermedad coronaria, cerebrovascular o arterial periférica estables sin una clara indicación de anticoagulación (el tratamiento combinado no aporta beneficios) |
| 6. Ticlopidina en cualquier circunstancia (clopidogrel y prasugrel tienen eficacia similar, evidencia más sólida y menos efectos secundarios) |
| 7. Antiagregantes como alternativa a los antagonistas de la vitaminaK, los inhibidores directos de la trombina o los inhibidores directos del factorXa para la prevención del ictus en pacientes con fibrilación auricular crónica (no hay evidencia de eficacia) |
| 8. Antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa para un primer episodio de trombosis venosa profunda durante >6meses sin que persistan los factores desencadenantes ya que no se han demostrado beneficios |
| 9. Antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa para un primer episodio de tromboembolismo pulmonar durante >6meses sin que persistan los factores desencadenantes ya que no se han demostrado beneficios |
| 10. AINE junto con antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa (riesgo de hemorragia digestiva grave) |
| 11. Antagonistas de la vitaminaK como anticoagulantes de primera línea en la fibrilación auricular, salvo en presencia de prótesis valvular cardíaca metálica, estenosis mitral moderada-grave o TFGe <15ml/min/1,73m2 (los inhibidores directos de la trombina y los inhibidores del factorXa son igual de eficaces y más seguros que los antagonistas de la vitaminaK) |
| 12. Inhibidores selectivos de la recaptación de la serotonina en combinación con antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en pacientes con antecedentes de sangrado grave (mayor riesgo de sangrado debido a los efectos antiagregantes de los ISRS) |
| 13. Inhibidores directos de la trombina (p.ej., dabigatrán) en combinación con diltiazem o verapamilo (aumento del riesgo de sangrado) |
| 14. Apixabán, dabigatrán, edoxabán o rivaroxabán en combinación con fármacos inhibidores de la glucoproteínaP (p.ej., amiodarona, azitromicina, carvedilol, ciclosporina, dronedarona, itraconazol, ketoconazol (sistémico), macrólidos, quinina, ranolazina, tamoxifeno, ticagrelor, verapamilo) ya que aumenta el riesgo de sangrado |
| 15. Estrógenos o andrógenos sistémicos con antecedentes de tromboembolismo venoso (aumento del riesgo de recurrencia) |
| 16. AAS en prevención primaria de enfermedades cardiovasculares |
| Sección D. Sistema nervioso central |
| 1. Antidepresivos tricíclicos en presencia de demencia, glaucoma de ángulo estrecho, trastornos de la conducción cardíaca, prostatismo, estreñimiento crónico, caídas recientes o antecedentes de retención urinaria (riesgo de empeoramiento de estas enfermedades) |
| 2. Inicio de un antidepresivo tricíclico como tratamiento antidepresivo de primera línea (mayor riesgo de efectos secundarios con ATC que con ISRS o ISRN) |
| 3. Inhibidores de la recaptación de serotonina/noradrenalina (p.ej., venlafaxina, duloxetina) en presencia de hipertensión grave (presión arterial sistólica >180mmHg ±presión arterial diastólica >105mmHg) (riesgo de empeoramiento de la hipertensión) |
| 4. Neurolépticos con efectos antimuscarínicos/anticolinérgicos moderados-potentes (acepromazina, clorpromazina, clozapina, flupentixol, flufenazina, levomepromazina, olanzapina, pipotiazina, promazina, tioridazina) con antecedentes de prostatismo o retención urinaria (alto riesgo de retención urinaria) |
| 5. Neurolépticos para los síntomas conductuales y psicológicos de la demencia sin ajustes de dosis ni revisión de la medicación en más de 3meses (mayor riesgo de efectos secundarios extrapiramidales, empeoramiento cognitivo crónico y morbimortalidad cardiovascular) |
| 6. Inhibidores de la recaptación de serotonina (ISRS) en presencia de hiponatremia significativa concurrente o reciente (sodio sérico <130mmol/l) (riesgo de precipitar o exacerbar una hiponatremia) |
| 7. Inhibidores de la recaptación de serotonina (ISRS) en presencia de sangrado significativo concurrente o reciente (riesgo de precipitar o exacerbar hemorragias por sus efectos antiagregantes) |
| 8. Benzodiacepinas durante ≥4 semanas (no hay indicación para tratamientos más prolongados; riesgo de sedación, confusión, pérdida de equilibrio, caídas, accidentes de tráfico; todas las benzodiacepinas deberían suspenderse de forma gradual si el tratamiento ha superado las 2semanas, ya que al suspenderse de forma brusca existe riesgo de síndrome de abstinencia) |
| 9. Benzodiacepinas para la agitación o los síntomas psicóticos de la demencia (sin evidencia de eficacia) |
| 10. Benzodiacepinas para el insomnio durante ≥2semanas (alto riesgo de dependencia, mayor riesgo de caídas, fracturas y accidentes de tráfico) |
| 11. Hipnóticos-Z (zolpidem, zopiclona, zaleplon) para el insomnio durante ≥2semanas (mayor riesgo de caídas, fracturas) |
| 12. Neurolépticos (salvo clozapina y quetiapina) en pacientes con parkinsonismo o demencia por cuerpos de Lewy (riesgo de efectos extrapiramidales graves) |
| 13. Anticolinérgicos/antimuscarínicos (biperideno, orfenadrina, prociclidina, trihexifenidilo) para tratar los efectos secundarios extrapiramidales de los neurolépticos (riesgo de toxicidad anticolinérgica) |
| 14. Fármacos con efectos anticolinérgicos/antimuscarínicos potentes en pacientes con delirium o demencia (riesgo de empeoramiento cognitivo)a |
| a Son fármacos con efectos anticolinérgicos/antimuscarínicos potentes prescritos frecuentemente los ATC (p.ej., amitriptilina, doxepina, imipramina, nortriptilina), algunos antipsicóticos (clorpromazina, clozapina, tioridazina), antihistamínicos de primera generación (p.ej., difenhidramina, clorfeniramina), algunos antiespasmódicos vesicales (p.ej., tolterodina, oxibutinina), hioscina, prociclidina, benzatropina, tizanidina |
| 15. Neurolépticos antipsicóticos en pacientes con síntomas conductuales y psicológicos de la demencia (SCPD) durante más de 12 semanas salvo que estos sean graves y no respondan a otros tratamientos (aumento del riesgo de ictus e infarto de miocardio) |
| 16. Neurolépticos antipsicóticos como hipnóticos, salvo que el trastorno del sueño se deba a psicosis o SCPD (riesgo de confusión, hipotensión, efectos secundarios extrapiramidales, caídas) |
| 17. Inhibidores de la acetilcolinesterasa con antecedentes de bradicardia persistente (<60lpm), bloqueo cardíaco o síncopes recurrentes de etiología no explicada (riesgo de trastornos de la conducción, síncope o lesiones) |
| 18. Inhibidores de la acetilcolinesterasa junto con fármacos que reducen la frecuencia cardíaca, como betabloqueantes, digoxina, diltiazem, verapamilo (riesgo de trastornos de la conducción, síncope o lesiones) |
| 19. Memantina en pacientes con epilepsia conocida previa o actual (aumento del riesgo de crisis epilépticas) |
| 20. Nootrópicos en demencia, incluyendo Gingko biloba, piracetam, pramiracetam, fenilpiracetam, aniracetam, fosfatidilserina, modafinilo, L-teanina, ácidos grasos omega-3, Panax ginseng, rodiola, creatina (sin evidencia de eficacia) |
| 21. Fenotiazinas como tratamiento de primera línea de la psicosis o síntomas no cognitivos de la demencia, ya que existen alternativas más seguras y eficaces (las fenotiazinas son sedantes, tienen importante toxicidad antimuscarínica en mayores, salvo la proclorperazina en náuseas/vómitos/vértigo, la clorpromazina para control del hipo persistente y la levomepromazina como antiemético en cuidados paliativos) |
| 22. Levodopa o agonistas dopaminérgicos para el temblor esencial benigno (sin evidencia de eficacia) |
| 23. Levodopa o agonistas dopaminérgicos para tratar los efectos secundarios extrapiramidales de los neurolépticos o el parkinsonismo por fármacos (para evitar una cascada de prescripción potencialmente inapropiada) |
| 24. Antihistamínicos de primera generación como tratamiento de primera línea de la alergia o el prurito (actualmente están disponibles antihistamínicos más seguros, menos tóxicos y con menos efectos secundarios) |
| 25. Antihistamínicos de primera generación para el insomnio (alto riesgo de efectos secundarios; los hipnóticos-Z son más seguros y adecuados para el tratamiento a corto plazo) |
| Sección E. Sistema renal |
| Los siguientes medicamentos son potencialmente inapropiados en personas mayores con enfermedad renal aguda o crónica por debajo de determinados umbrales de TFGe (consultar fichas técnicas de los medicamentos y las farmacopeas locales): |
| 1. Digoxina en tratamiento a largo plazo (>90días) a dosis mantenidas ≥125μg/día con TFGe <30ml/min/1,73m2 (riesgo de intoxicación digitálica si no se monitorizan los niveles plasmáticos) |
| 2. Inhibidores directos de la trombina (p.ej., dabigatrán) con TFGe <30ml/min/1,73m2 (riesgo de sangrado) |
| 3. Inhibidores del factor Xa (p.ej., rivaroxabán, apixabán, edoxabán) con TFGe <15ml/min/1,73m2 (riesgo de sangrado) |
| 4. AINE con TFGe <50ml/min/1,73m2 (riesgo de deterioro de la función renal) |
| 5. Colchicina con TFGe <10ml/min/1,73m2 (riesgo de toxicidad por colchicina) |
| 6. Metformina con TFGe <30ml/min/1,73m2 (riesgo de acidosis láctica) |
| 7. Antagonistas de la aldosterona (p.ej., espironolactona, eplerenona) con TFGe <30ml/min/1,73m2 (riesgo de hiperpotasemia grave) |
| 8. Nitrofurantoína con TFGe <45ml/min/1,73m2 (riesgo de toxicidad por nitrofurantoína) |
| 9. Bisfosfonatos con TFGe <30ml/min/1,73m2 (mayor riesgo de insuficiencia renal aguda) |
| 10. Metotrexato con TFGe <30ml/min/1,73m2 |
| Sección F. Sistema gastrointestinal |
| 1. Proclorperazina o metoclopramida en presencia de parkinsonismo (riesgo de empeoramiento de los síntomas parkinsonianos) |
| 2. Inhibidores de la bomba de protones para la enfermedad ulcerosa péptica o esofagitis péptica no complicada a dosis terapéuticas plenas durante >8semanas (normalmente está indicada la reducción de la dosis, la retirada o el tratamiento de mantenimiento con antagonistas H2) |
| 3. Medicamentos que suelen causar estreñimiento (p.ej., antimuscarínicos/anticolinérgicos, hierro oral, opioides, verapamilo, antiácidos con aluminio) en pacientes con estreñimiento crónico cuando existan alternativas que no estriñan (riesgo de exacerbar el estreñimiento) |
| 4. Hierro oral a dosis elementales superiores a 200mg/día (p.ej., hierro fumarato >600mg/día, hierro sulfato >600mg/día, hierro gluconato >1.800mg/día; no hay evidencia de mayor absorción por encima de estas dosis) |
| 5. Corticosteroides con antecedentes de enfermedad ulcerosa péptica o esofagitis erosiva (riesgo de reaparición de la enfermedad ulcerosa salvo con uso simultáneo de un IBP) |
| 6. Antiagregantes o anticoagulantes con antecedentes de ectasia vascular antral gástrica (EVAG, «estómago en sandía») (riesgo de sangrado digestivo grave) |
| 7. Neurolépticos en presencia de disfagia (aumento del riesgo de neumonía aspirativa) |
| 8. Acetato de megestrol como orexígeno (aumento del riesgo de trombosis y mortalidad sin eficacia demostrada) |
| Sección G. Sistema respiratorio |
| 1. Teofilina como monoterapia para la EPOC (existen alternativas más seguras y efectivas; riesgo de efectos adversos por el estrecho margen terapéutico) |
| 2. Corticosteroides sistémicos en lugar de corticosteroides inhalados para el tratamiento de mantenimiento de la EPOC moderada-grave (exposición innecesaria a los efectos secundarios a largo plazo de los corticosteroides sistémicos; existen alternativas inhaladas más efectivas) |
| 3. Broncodilatadores antimuscarínicos de acción larga (LAMA) (p.ej., tiotropio, aclidinio, umeclidinio, glicopirronio) con antecedentes de glaucoma de ángulo estrecho (pueden exacerbar el glaucoma) u obstrucción del tracto urinario inferior (pueden causar retención urinaria) |
| 4. Benzodiacepinas con insuficiencia respiratoria aguda o crónica (p.ej., pO2 <60mmHg ±pCO2 >50mmHg; riesgo de exacerbación de la insuficiencia respiratoria) |
| Sección H. Sistema musculoesquelético |
| 1. Antiinflamatorios no esteroideos (AINE), exceptuando los inhibidores selectivos de la COX-2, con antecedentes de enfermedad ulcerosa péptica o hemorragia digestiva, salvo con el uso simultáneo de un IBP o un antagonista H2 (riesgo de reaparición de la enfermedad ulcerosa) |
| 2. AINE en presencia de hipertensión grave mantenida (p.ej., presión arterial sistólica >170mmHg y/o presión arterial diastólica mantenida >100mm/Hg habitualmente) (riesgo de empeoramiento de la hipertensión) |
| 3. AINE a largo plazo (>3 meses) para el tratamiento sintomático del dolor de la artrosis cuando no se ha probado el paracetamol (los analgésicos simples son preferibles, normalmente igual de efectivos para el tratamiento del dolor) |
| 4. Corticosteroides a largo plazo (>3 meses) como monoterapia para la artritis reumatoide (riesgo de efectos secundarios sistémicos de los corticosteroides) |
| 5. Corticosteroides (salvo inyecciones intraarticulares periódicas para el dolor monoarticular) para la artrosis (riesgo de efectos secundarios sistémicos de los corticosteroides) |
| 6. AINE o colchicina a largo plazo (>3 meses) para el tratamiento crónico de la gota cuando no existe contraindicación para los inhibidores de la xantina-oxidasa (p.ej., alopurinol, febuxostat) (los inhibidores de la xantina-oxidasa son los fármacos profilácticos de primera elección en la gota) |
| 7. AINE en combinación con corticosteroides para el tratamiento de la artritis/enfermedades reumatológicas de cualquier clase (mayor riesgo de enfermedad ulcerosa péptica) |
| 8. Bifosfonatos orales en pacientes con antecedentes de enfermedades digestivas altas (p.ej., disfagia, esofagitis, gastritis, duodenitis, enfermedad ulcerosa péptica o hemorragia digestiva alta) (riesgo de reaparición/exacerbación de esofagitis, úlcera esofágica o estenosis esofágica) |
| 9. Opioides a largo plazo para el tratamiento de la artrosis (sin evidencia de eficacia, aumentan el riesgo de efectos secundarios graves) |
| Sección I. Sistema urogenital |
| 1. Fármacos antimuscarínicos sistémicos en presencia de demencia o deterioro cognitivo crónico (aumentan el riesgo de confusión y de agitación) |
| 2. Fármacos antimuscarínicos sistémicos en presencia de glaucoma de ángulo estrecho (riesgo de exacerbación) |
| 3. Fármacos antimuscarínicos sistémicos para el tratamiento de síntomas urinarios en hiperplasia benigna de próstata y volumen residual posmiccional >200ml (sin clara eficacia y con mayor riesgo de retención urinaria en hombres mayores) |
| 4. Fármacos antimuscarínicos sistémicos en presencia de estreñimiento (riesgo de empeoramiento del estreñimiento) |
| 5. Bloqueantes alfa-1-adrenérgicos (exceptuando la silodosina) (p.ej., alfuzosina, doxazosina, indoramina, tamsulosina, terazosina) en presencia de hipotensión ortostática sintomática o antecedentes de síncope (riesgo de desencadenar síncopes de repetición) |
| 6. Mirabegrón en presencia de hipertensión lábil o grave (riesgo de empeoramiento de la hipertensión) |
| 7. Duloxetina en presencia de urgencia urinaria o la incontinencia urinaria por urgencia (está indicada en la incontinencia urinaria de esfuerzo, no en la urgencia urinaria o la incontinencia urinaria por urgencia) |
| 8. Antibióticos para el tratamiento de la bacteriuria asintomática (no está indicado su tratamiento) |
| Sección J. Sistema endocrino |
| 1. Sulfonilureas de vida media larga (p.ej., glibenclamida, clorpropamida, glimepirida) para la diabetes mellitus tipo2 (riesgo de hipoglucemia prolongada) |
| 2. Tiazolidindionas (p.ej., rosiglitazona, pioglitazona) en pacientes con insuficiencia cardíaca (riesgo de descompensación de insuficiencia cardíaca) |
| 3. Betabloqueantes no cardioselectivos en pacientes con diabetes mellitus con frecuentes episodios de hipoglucemia (riesgo de enmascaramiento de los síntomas de hipoglucemia) |
| 4. Inhibidores del cotransportador sodio-glucosa tipo2 (iSGLT2) (p.ej., canagliflozina, dapagliflozina, empagliflozina, ertugliflozina) en presencia de hipotensión sintomática (riesgo de exacerbación de la hipotensión) |
| 5. Estrógenos sistémicos con antecedentes de cáncer de mama (aumento del riesgo de recurrencia) |
| 6. Estrógenos sistémicos con antecedentes de tromboembolismo venoso (aumento del riesgo de recurrencia) |
| 7. Terapia hormonal sustitutiva (estrógenos con progestágenos) con antecedentes de enfermedad coronaria, cerebrovascular o arterial periférica (aumento del riesgo de trombosis arterial aguda) |
| 8. Estrógenos sistémicos sin progestágenos en mujeres con útero intacto (riesgo de cáncer de endometrio) |
| 9. Levotiroxina para el hipotiroidismo subclínico (T4 libre normal con TSH elevada, pero <10μU/l) (sin evidencia de beneficio, riesgo de tirotoxicosis iatrogénica) |
| 10. Análogos de la vasopresina (p.ej., desmopresina, vasopresina) para la incontinencia urinaria o la poliaquiuria (riesgo de hiponatremia sintomática) |
| Sección K. Fármacos que aumentan de forma predecible el riesgo de caídas en personas mayores |
| 1. Benzodiacepinas en pacientes con caídas de repetición (pueden reducir el nivel de conciencia y deteriorar el equilibrio) |
| 2. Neurolépticos en pacientes con caídas recurrentes (pueden causar parkinsonismo) |
| 3. Vasodilatadores en pacientes con caídas de repetición con hipotensión postural persistente (descenso de la presión arterial sistólica ≥20mmHg y/o descenso de la presión arterial diastólica ≥10mmHg) (riesgo de síncopes, caídas) |
| 4. Hipnóticos-Z (p.ej., zopiclona, zolpidem, zaleplon) en pacientes con caídas de repetición (pueden causar sedación diurna prolongada, ataxia) |
| 5. Antiepilépticos en pacientes con caídas de repetición (pueden reducir el nivel de conciencia, pueden deteriorar la función del cerebelo) |
| 6. Antihistamínicos de primera generación en pacientes con caídas de repetición (pueden reducir el nivel de conciencia) |
| 7. Opioides en pacientes con caídas de repetición (pueden reducir el nivel de conciencia) |
| 8. Antidepresivos en pacientes con caídas de repetición (pueden reducir el nivel de conciencia) |
| 9. Bloqueantes alfa-1-adrenérgicos como antihipertensivos en pacientes con caídas de repetición (pueden causar hipotensión ortostática) |
| 10. Bloqueantes alfa-1-adrenérgicos (exceptuando la silodosina) para los síntomas prostáticos obstructivos en pacientes con caídas de repetición (pueden causar hipotensión ortostática) |
| 11. Antihipertensivos de acción central (pueden reducir el nivel de conciencia y pueden causar hipotensión ortostática) |
| 12. Antimuscarínicos para el tratamiento de la vejiga hiperactiva o la incontinencia urinaria de urgencia (pueden reducir el nivel de conciencia) |
| Sección L. Analgésicos |
| 1. Opioides potentes orales o transdérmicos (morfina, oxicodona, fentanilo, buprenorfina, diamorfina, metadona, tramadol, petidina, pentazocina) como tratamiento de primera línea para el dolor leve (inobservancia de la escala analgésica de la OMS; no se ha usado paracetamol o AINE como tratamiento de primera línea) |
| 2. Opioides en uso habitual (no a demanda) sin asociar laxantes (riesgo de estreñimiento grave) |
| 3. Opioides de acción prolongada sin opioides de acción rápida para el dolor irruptivo moderado o grave (riesgo de falta de control del dolor severo) |
| 4. Parche de lidocaína tópica para el tratamiento del dolor crónico de la artrosis (sin clara evidencia de eficacia) |
| 5. Gabapentinoides (p.ej., gabapentina, pregabalina) para el tratamiento del dolor no neuropático (sin evidencia de eficacia) |
| 6. Paracetamol a dosis ≥3g/día en pacientes malnutridos (p.ej. IMC <18) o hepatopatía crónica (riesgo de hepatotoxicidad) |
| Sección M. Carga antimuscarínica/anticolinérgica |
| 1. Uso concomitante de dos o más fármacos con propiedades antimuscarínicas/anticolinérgicas (p.ej., antiespasmódicos vesicales, antiespasmódicos intestinales, antidepresivos tricíclicos, antihistamínicos de primera generación, neurolépticos) (riesgo de aumento de la toxicidad antimuscarínica/anticolinérgica) |
Versión española de los criterios START (Screening Tool to Alert to Right Treatment) versión 3
| Sección A. Medicamentos indicados |
| Cuando un medicamento está claramente indicado y se considera adecuado en un determinado contexto clínico sin que exista una contraindicación, debe iniciarse según las instrucciones de su ficha técnica en cuanto a su dosis y a la duración |
| Sección B. Sistema cardiovascular |
| 1. Antihipertensivos cuando la presión arterial sistólica sea habitualmente >140mmHg y/o la presión arterial diastólica sea habitualmente >90mmHg, salvo en pacientes con fragilidad moderada o grave en los que el límite para el tratamiento es de una presión arterial sistólica >150mmHg y/o una presión arterial diastólica >90mmHg |
| 2. Estatinas con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica, salvo en pacientes en situación de final de vida o en pacientes con fragilidad moderada o grave |
| 3. IECA en la cardiopatía isquémica |
| 4. Betabloqueantes en la cardiopatía isquémica sintomática |
| 5. IECA en la insuficiencia cardíaca con fracción de eyección reducida |
| 6. Betabloqueantes cardioselectivos (bisoprolol, nebivolol, metoprolol o carvedilol) en la insuficiencia cardíaca estable con fracción de eyección reducida |
| 7. Antagonistas de la aldosterona (espironolactona, eplerenona) en la insuficiencia cardíaca sin deterioro grave de la función renal (TFGe >30ml/min/m2) |
| 8. Inhibidores del cotransportador sodio-glucosa tipo2 (canaglifozina, dapagliflozina, empagliflozina, ertuglifozina) en la insuficiencia cardíaca sintomática con fracción de eyección reducida o preservada, independientemente de si el paciente es o no diabético |
| 9. Sacubitrilo/valsartán en la insuficiencia cardíaca con fracción de eyección reducida sintomática pese al tratamiento a dosis óptimas de IECA o ARA-II (siendo reemplazado el IECA o el ARA-II por el sacubitrilo/valsartán) |
| 10. Betabloqueantes en la fibrilación auricular crónica con mal control de la frecuencia cardíaca |
| 11. Hierro intravenoso en la insuficiencia cardíaca sintomática con fracción de eyección reducida y déficit de hierro |
| Sección C. Antiagregantes/anticoagulantes |
| 1. Antagonistas de la vitaminaK, inhibidores directos de la trombina o inhibidores del factorXa en la fibrilación auricular crónica o paroxística |
| 2. Antiagregantes (AAS, clopidogrel, prasugrel o ticagrelor) si hay antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica |
| Sección D. Sistema nervioso central |
| 1. Levodopa o un agonista dopaminérgico en la enfermedad de Parkinson idiopática con deterioro funcional y discapacidad |
| 2. Antidepresivos no tricíclicos en la depresión mayor |
| 3. Inhibidores de la acetilcolinesterasa (donepezilo, rivastigmina, galantamina) en la enfermedad de Alzheimer leve-moderada |
| 4. Rivastigmina en la demencia por cuerpos de Lewy o la demencia asociada a la enfermedad de Parkinson |
| 5. Inhibidores selectivos de la recaptación de serotonina (o ISRN o pregabalina si los ISRS están contraindicados) para la ansiedad grave persistente que interfiere con la independencia funcional y la calidad de vida |
| 6. Agonistas dopaminérgicos (ropinirol, pramipexol o rotigotina) para el síndrome de piernas inquietas, una vez se han descartado como causas la deficiencia de hierro y la enfermedad renal crónica grave (TFGe <30ml/min/m2) |
| 7. Propranolol para el temblor esencial con deterioro funcional y discapacidad secundarias |
| Sección E. Sistema renal |
| 1. Suplementación con 1-alfa-hidroxicolecalciferol o calcitriol en la enfermedad renal crónica grave (TFGe <30ml/min/m2) con hipocalcemia (calcio sérico corregido <2,10mmol/l) e hiperparatiroidismo secundario asociado |
| 2. Quelantes del fósforo en la enfermedad renal crónica grave (TFGe <30ml/min/m2) si la concentración de fósforo sérico es >1,76mmol/l (5,5mg/dl) de forma persistente a pesar de una correcta adherencia a la dieta de protección renal |
| 3. Análogos de la eritropoyetina en la enfermedad renal crónica grave (TFGe <30ml/min/m2) con anemia sintomática no atribuible a déficits hemáticos o de hierro para alcanzar una concentración de hemoglobina de 10,0-12,0g/dl |
| 4. IECA o ARA-II en la enfermedad renal crónica con proteinuria (excreción urinaria de albúmina >300mg/24h) |
| Sección F. Sistema gastrointestinal |
| 1. Inhibidores de la bomba de protones en la enfermedad por reflujo gastroesofágico grave o en la estenosis péptica esofágica que precise dilatación |
| 2. Inhibidores de la bomba de protones si se inicia AAS a dosis bajas y hay antecedentes de úlcera péptica o esofagitis por reflujo |
| 3. Inhibidores de la bomba de protones en los tratamientos con AINE de corta (<2semanas) o larga (>2semanas) duración |
| 4. Suplementos de fibra (p.ej., salvado, ispaghula, metilcelulosa, sterculia) en la diverticulosis con antecedentes de estreñimiento |
| 5. Laxantes osmóticos (p.ej., lactulosa, macrogol, sorbitol) en estreñimiento crónico persistente idiopático o secundario benigno |
| 6. Probióticos de forma concomitante con los antibióticos en pacientes que no estén inmunocomprometidos o gravemente deteriorados, para la prevención de la diarrea por Clostridioides difficile |
| 7. Tratamiento erradicador de Helicobacter pylori en la enfermedad ulcerosa péptica activa asociada a esta bacteria |
| Sección G. Sistema respiratorio |
| 1. Antimuscarínicos de acción larga (LAMA, p.ej., tiotropio, aclidinio, umeclidinio, glicopirronio) o agonistas beta-2 de acción larga (LABA, p.ej., bambuterol, formoterol, indacaterol, olodaterol, salmeterol) para la EPOC sintomática estadio GOLD1 o2 y el asma crónica |
| 2. Corticosteroides inhalados pautados (p.ej., beclometasona, budesonida, ciclesonida, fluticasona, mometasona) para el asma moderado-grave o EPOC estadio GOLD3 o4, con FEV1 <50% del valor predicho y exacerbaciones de repetición que requieran corticosteroides orales |
| 3. Oxigenoterapia domiciliaria continua en la hipoxemia crónica bien documentada (pO2 <60mmHg o SatO2 <89%) |
| Sección H. Sistema musculoesquelético |
| 1. Fármacos antirreumáticos modificadores en la enfermedad en la artritis reumatoide crónica activa incapacitante |
| 2. Bisfosfonatos y vitaminaD y calcio en pacientes que reciben corticosteroides orales a largo plazo para la prevención de la osteoporosis inducida por corticosteroides |
| 3. VitaminaD en pacientes con osteoporosis conocida y/o fracturas por fragilidad previas y/o densidad mineral ósea con T <−2,5 en uno o múltiples puntos |
| 4. Antirresortivos o anabolizantes óseos (p.ej., bifosfonatos, teriparatida, denosumab) en pacientes con osteoporosis conocida (densidad mineral ósea con T <−2,5 en uno o múltiples puntos) y/o fracturas por fragilidad previas y/o cuando no existan contraindicaciones farmacológicas o clínicas para su uso, como, por ejemplo, una mala esperanza de vida a un año |
| 5. Suplementos de vitaminaD en pacientes mayores con déficit confirmado de 25-hidroxicolecalciferol (<20μg/l, <50 nmol/l) que no salen de casa, sufren caídas o tienen osteopenia (densidad mineral ósea con T<−1,0 y >−2,5 en uno o múltiples puntos) |
| 6. Antirresortivos tras la retirada del denosumab después de al menos dos dosis (existe un efecto rebote en forma de aumento de marcadores bioquímicos de remodelado óseo, pérdida de densidad mineral ósea y un mayor riesgo de fracturas vertebrales tras la retirada de denosumab) |
| 7. Antirresortivos tras la retirada de un tratamiento antiosteoporótico con teriparatida/ abaloparatida |
| 8. Inhibidores de la xantina oxidasa (p.ej., alopurinol, febuxostat) en pacientes con antecedentes de episodios de gota recurrentes |
| 9. Suplementos de ácido fólico en pacientes que toman metotrexato |
| Sección I. Sistema genitourinario |
| 1. Bloqueantes selectivos alfa-1-adrenérgicos (p.ej., tamsulosina, silodosina) para los síntomas de la hiperplasia benigna de próstata cuando la prostatectomía no se considera necesaria, adecuada o segura |
| 2. Inhibidores de la 5-alfa reductasa (p.ej., finasterida, dutasterida) para los síntomas de la hiperplasia benigna de próstata cuando la prostatectomía no se considera necesaria, adecuada o segura |
| 3. Estrógenos tópicos vaginales o pesario con estrógenos en la vaginitis atrófica sintomática |
| 4. Estrógenos tópicos vaginales o pesario con estrógenos en mujeres con infecciones urinarias recurrentes |
| 5. Inhibidores de la fosfodiesterasa 5 (avanafilo, sildenafilo, taladafilo, vardenafilo) para la disfunción eréctil persistente que cause sufrimiento |
| Sección J. Sistema endocrino |
| 1. IECA (ARA-II si no se toleran los IECA) en la diabetes con evidencia de enfermedad renal (proteinuria en una tira reactiva o microalbuminuria [>30mg/24horas]) salvo en presencia de enfermedad renal crónica grave (TFGe <30ml/min/m2) |
| Sección K. Analgésicos |
| 1. Opioides potentes en el dolor moderado-grave no artrósico, cuando el paracetamol, los AINE o los opioides de baja potencia no son suficientes para la gravedad del dolor o se han mostrado ineficaces |
| 2. Laxantes en pacientes que reciben opioides de forma regular (cuando el uso no es a demanda) |
| 3. Parche de lidocaína tópica al 5% para el dolor neuropático localizado (p.ej., neuralgia postherpética) |
| Sección L. Vacunas |
| 1. Vacuna anual contra la gripe estacional |
| 2. Vacuna antineumocócica al menos en una ocasión, según las guías nacionales |
| 3. Vacuna contra el virus varicela-zoster, según las guías nacionales |
| 4. Vacuna contra el SARS-CoV-2, según las guías nacionales |
La traducción de los criterios del inglés al español se ha hecho por profesionales expertos en la materia (un médico y un farmacéutico) y con alto nivel de inglés. Posteriormente, la versión traducida fue revisada por un médico bilingüe.
ConclusiónLa versión 3 en español de los criterios STOPP/START es una lista explícita actualizada de medicamentos potencialmente inapropiados y posibles omisiones en la prescripción que tienen el objetivo de optimizar la medicación y minimizar las reacciones adversas a los medicamentos durante la revisión de la medicación en las personas mayores, en particular aquellas con multimorbilidad y polifarmacia. Con esta nueva versión se pretende dar una mayor difusión a los criterios originales dentro la comunidad sanitaria hispanohablante. La versión2 española de los STOPP/START ha sido ampliamente utilizada, por lo que consideramos que la traducción al español ha ayudado a mejorar la farmacoterapia en pacientes mayores con polifarmacia y multimorbilidad en nuestro entorno lingüístico.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.