Las high mobility group box 1 protein (HMGB1, «proteínas de alta movilidad del grupo 1») son proteínas nucleares no histonas cuyos niveles se han documentado elevados en ciertas enfermedades autoinmunes, como el lupus eritematoso sistémico (LES). Igualmente, los pacientes con LES presentan una mayor prevalencia de anticuerpos anti-HMGB1 comparados con individuos sanos, al mismo tiempo que se han relacionado sus niveles con una mayor actividad de la enfermedad. En este artículo se revisará la participación de estas proteínas en la inmunología y se abordará la evidencia que sustenta su importancia clínica en el LES.
Materiales y métodosSe realizó una revisión narrativa basada en la búsqueda de la literatura hasta octubre de 2018, de artículos que describieran la función, estructura, prevalencia e importancia de las HMGB1 en diferentes manifestaciones del LES, así como artículos que hayan estudiado la presencia de las HMGB1 o sus anticuerpos en pacientes con LES u otras enfermedades autoinmunes.
ResultadosSe encontraron un total de 69 artículos. Con base en ellos definimos la estructura y funciones de las HMBG1, incluyendo su papel como citocina liberada por células inmunes en procesos inflamatorios y en necrosis. Adicionalmente, describimos sus funciones en la fagocitosis y NETosis, que genera implicaciones en enfermedades autoinmunes, principalmente en el LES.
ConclusiónLas proteínas HMGB1 y los anticuerpos anti-HMGB1 se encuentran elevados en suero de pacientes con LES comparados con individuos sanos o con formas no severas de la enfermedad, evidenciando que estas pueden comportarse como un biomarcador de actividad de la enfermedad.
The high mobility group box 1 proteins (HMGB1) are non-histone nuclear proteins with elevated levels having been reported in certain autoimmune diseases, such as systemic lupus erythematosus (SLE). Likewise, patients with SLE have a higher prevalence of anti-HMGB1 antibodies compared to healthy individuals. Furthermore, its levels have also been associated with a greater activity of the disease. In this article, the participation of proteins of this group in immunology will be reviewed, and the evidence supporting their clinical importance in SLE will be addressed.
Materials and methodsA narrative review was carried out based on a search of the literature up to October 2018 of articles describing the function, structure, prevalence and importance of HMGB1 in different manifestations of SLE. Articles that have studied the presence of HMGB1 and/or its antibodies in patients with SLE or other autoimmune diseases were also reviewed.
ResultsA total of 69 articles were found. Based on them, the structure and functions of HMBG1 were defined, including its role as a cytokine released by immune cells in inflammatory processes and necrosis. Additionally, a description is presented of its functions in phagocytosis and NETosis, which play a role in autoimmune diseases, and mainly in SLE.
ConclusionHMGB1 proteins and anti-HMGB1 antibodies are elevated in the serum of patients with SLE compared with healthy individuals or with non-severe forms of the disease, suggesting their role as potential biomarkers of disease activity.
El lupus eritematoso sistémico (LES) es el prototipo de las enfermedades sistémicas autoinmunes y se caracteriza por manifestaciones clínicas que varían en gravedad desde una enfermedad leve de la piel y las articulaciones hasta afecciones más severas, como el compromiso renal, neurológico y pulmonar, que, en algunos casos, pueden llevar a la muerte; todo esto, asociado a hallazgos serológicos de autoinmunidad, siendo la presencia de anticuerpos antinucleares, anti-ADN de doble cadena y anti-Sm los más relevantes1. La patogénesis del LES sigue siendo desconocida en su totalidad y se ha asumido que tiene un origen multifactorial, en donde se demuestra que factores genéticos, ambientales, hormonales, epigenéticos e inmunorreguladores convergen entre sí para el desarrollo de esta enfermedad2.
En los últimos años se ha demostrado que las alteraciones en el aclaramiento de las células apoptóticas son uno de los factores de mayor importancia en la fisiopatología del LES, ya que se ha comprobado que la acumulación de los cuerpos apoptóticos es una de las herramientas clave para el inicio y posterior desarrollo del LES3,4. En modelos murinos, al igual que en humanos, se ha verificado que la deficiencia de proteínas como el factor del complemento C1q y la proteína amiloide P sérica, que están involucradas en la opsonización y, a su vez, en la fagocitosis y el aclaramiento de las células apoptóticas, resultan en el desarrollo de características lúpicas como producción de autoanticuerpos y glomerulonefritis proliferativa5,6. De igual manera, en humanos se ha evidenciado una acumulación de células apoptóticas, como son los niveles altos de linfocitos T apoptóticos, al igual que neutrófilos en sangre periférica7,8. Por otra parte, también se observan células linfocíticas apoptóticas en los nódulos linfáticos de los pacientes con LES9. En este contexto, las células apoptóticas que no se eliminan se convierten en células que van a perder la integridad de su membrana, provocando así la liberación de estructuras intracelulares que pueden actuar como autoantígenos3. Un ejemplo de esto son los nucleosomas, que unidos a las high mobility group box 1 proteins (HMGB1, «proteínas de alta movilidad del grupo 1»), inducen no solo respuestas inmunes, sino también inflamatorias que son relevantes para la patogénesis del LES10. En esta revisión narrativa se hará una descripción de las funciones de las HMGB1 y se discutirá su rol en la patogénesis del LES.
MétodosMétodos de búsqueda de la literaturaSe realizó una revisión narrativa basada en artículos hasta octubre del 2018. Entre las bases de datos consultadas se encuentran: SciELO, Clinical Trials, Clinics Review Articles, Academic Search Ultimate, Medline, Embase y Google Scholar. Durante la búsqueda se incluyeron artículos escritos en inglés y español. Al llevar a cabo la búsqueda en Medline, esta se hizo a través de PubMed por medio de los términos MeSH: HMGB1; antibodies; systemic lupus erythematosus; antigen; autoimmunity. Posteriormente se enlazaron con el conector booleano AND.
Selección de artículos y extracción de informaciónAl finalizar la búsqueda, estos fueron guardados en una base de datos construida en Excel. De esta forma se excluyeron artículos duplicados y se inició el proceso de selección de aquellos relevantes para esta publicación. Aquellos artículos que incluyeran las palabras clave en el título o en el resumen fueron tenidos en cuenta. Se revisó que cada artículo cumpliera con los criterios de inclusión y, finalmente, se realizó un consenso entre todos los autores para unificar y revisar la base de datos.
Criterios de inclusión- -
Tipos de estudio: estudios de cohorte, casos y controles, estudios aleatorizados y no aleatorizados, revisiones de tema y estudios experimentales.
- -
Tipo de población: pacientes adultos con LES y a quienes se les haya analizado la presencia de las proteínas HMGB1 o sus anticuerpos.
- -
Intervención: estudios que describieran la función, la estructura, la prevalencia y la importancia de las HMGB1 en diferentes manifestaciones del LES.
- -
Artículos sin acceso a texto completo.
- -
Reportes de caso.
- -
Artículos duplicados.
Tras la búsqueda inicial, se encontraron 69 artículos, la mayoría en Medline y Google Scholar. Al realizar la exclusión de aquellos artículos a los que no se tenía acceso completo y de los duplicados, quedaron un total de 67, que fueron incluidos.
A continuación, se realizará una descripción de los aspectos más relevantes hallados en la revisión de la literatura.
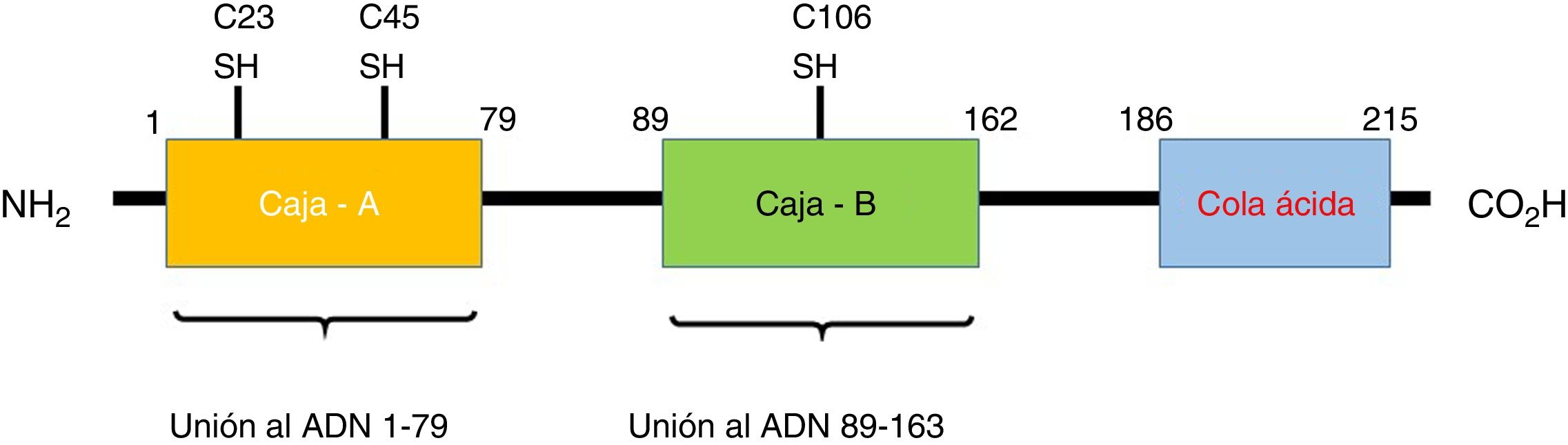
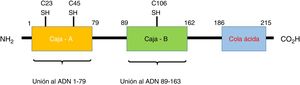
¿Qué son las proteínas HMGB1?Las HMGB1, también conocidas como anfoterina, son miembros de la familia de las proteínas no-histonas conocidas como HMG, que se encuentran localizadas en el núcleo de las células eucarióticas11,12. Estas proteínas se unen a varios tipos de ADN, como el ADN bicatenario (ADNds), el ADN monocatenario, el ADN distorsionado y los nucleosomas, participando en la regulación transcripcional por 3 mecanismos: el primero es su unión a los nucleosomas, comportándose como un fluidizador de la cromatina, lo que facilita la remodelación del nucleosoma; el segundo consiste en generar la flexión del sitio promotor del ADN aumentando la afinidad de la proteína de unión a TATA, lo que permite que la selección de factores como TFIIB o TFIIA (esenciales para el reconocimiento de la ADN polimerasa ii) sea más eficiente; por último, el tercer mecanismo consiste en la capacidad de las HMGB1 para establecer una interacción de proteína-proteína con factores de transcripción específicos (como p53, p73 y NF-kB, entre otros). Una vez unido, las HMGB1 pueden doblar el ADN y estabilizar la proteína asociada en su objetivo o promover la selección de otras proteínas13. Por otra parte, es codificada en el cromosoma humano 13q12-13 y consta de 3 dominios distintos: la caja A, la caja B y una cola C-terminal ácida. Esta última contiene un tramo de aproximadamente 30 residuos continuos de ácido glutámico y aspártico14. La caja A funciona como antagonista competitivo de HMGB1 y tiene la capacidad de inhibir la actividad de otra molécula de HMGB1. Tanto la caja A como la B son importantes para sus funciones de unión al ADN anteriormente descritas y están cargadas positivamente, mientras que la cola C-terminal está cargada negativamente, dando a la molécula una carga bipolar15,16. En la figura 1 se detalla la estructura de las HMGB1.
Estructura de la HMGB1. La proteína HMGB1 humana tiene 215 residuos de aminoácidos y está compuesta por 3 dominios: una caja A, una caja B y una cola ácida en el extremo carboxilo terminal. Hay 3 residuos de cisteína sensibles a la redox en las posiciones 23, 45 y 106, que regulan la función de las HMGB1 en respuesta al estrés oxidativo. Los dominios de unión al receptor RAGE se encuentran en la posición 150-183 y los de unión a los TLR están entre el residuo 80-108 (no mostrados en la imagen).
Igualmente, se ha demostrado que las HMGB1 pueden ser liberadas al ambiente extracelular, donde actúan de diferentes maneras. Una de las mejores caracterizadas es su papel como patrón molecular asociado a daño, que es liberado de forma pasiva por células que mueren por necrosis o apoptosis inmunogénica (como NETosis), pero no por apoptosis fisiológica, siendo reconocida por receptores tipo Toll (TLR) 2 y 4 activando una respuesta inflamatoria17,18. A su vez, estas proteínas pueden ser secretadas de forma activa por algunos tipos de células inmunológicas como los macrófagos, las células dendríticas y los linfocitos natural killer, en respuesta a una infección, una lesión tisular u otro estímulo inflamatorio18. En 1999, Wang et al. descubrieron la capacidad del macrófago de secretar HMGB1 como mediador tardío de inflamación y sepsis, observando su liberación posterior al pico de mediadores proinflamatorios como son el factor de necrosis tumoral (TNF) y la IL-1, denotando el papel de estas proteínas como mediador tardío de estas condiciones que pudiera indicar severidad de la misma19–21. Como se ha descrito hasta aquí, las HMGB1 son reconocidas ahora como citocinas porque median la respuesta inflamatoria sistémica (seleccionando y facilitando la activación de macrófagos y otras células inflamatorias, estimula la producción de IL-6 y TNF), se secretan por células inmunes activadas, activan la respuesta inflamatoria prototípica en las células inmunes y endoteliales y, por último, transducen señales celulares a través de los receptores TLR y el receptor for advanced glycation end products (RAGE, «receptor para productos finales de glucosilación avanzada»), siendo, hasta ahora, los principales receptores activados por las HMGB1. La señalización a través de RAGE conduce a la activación de la vía del factor nuclear-κB, así como a la transducción de señales a través de la cinasa regulada por señal extracelular (ERK) y p38, que promueve la producción de citocinas inflamatorias (TNF, IL-6 e interferón gamma [IFN-γ]). Por otra parte, la activación de TLR2 y TLR4 dependiente de HMGB1 conduce a la activación del factor nuclear κB a través de un mecanismo dependiente de la proteína de diferenciación mieloide 88 (MyD88). No obstante, existe un gran interés en determinar otro tipo de receptores activados por esta citocina que permita ampliar el conocimiento de estas moléculas como mediadores de inflamación18.
Expresión y secreción celular de HMGB1Las HMGB1 son expresadas por casi todas las células, exceptuando aquellas que carecen de núcleo, como los eritrocitos y algunas células intestinales. Cabe resaltar que se trata de proteínas que se encuentran exclusivamente en el núcleo. Como se mencionó anteriormente, estas proteínas pueden ser liberadas de 2 formas al espacio extracelular: activa, por células inmunológicas (como los macrófagos) ante un estímulo inflamatorio cumpliendo el rol de citocina, y pasiva, por células que sufren necrosis liberando proteínas intracelulares como las HMGB122.
La secreción activa de las HMGB1 por las células inmunes como los macrófagos y las células dendríticas es controlada por un proceso de acetilación previo que consiste en 2 pasos22. El primero, es el movimiento de las HMGB1 fuera del núcleo, para lo cual requieren de la acetilación en la mayoría de los 43 residuos de cisteína distribuidos por toda la molécula en el núcleo, evitando la interacción entre las proteínas y el complejo de proteína importadora del núcleo y, así, impedir su retorno al mismo. Sin embargo, aún no es del todo conocido el mecanismo por el cual una célula inmune activada induce la acetilación de las HMGB1 para su secreción. El segundo proceso consiste en la migración de las HMGB1 citosólicas y acetiladas a las vesículas secretoras citoplasmáticas para su posterior liberación al espacio extracelular23–25. La expresión del ARNm que codifica para las HMGB1 está regulada positivamente por ciertas citocinas como IFN-γ, TNF y factor transformante del crecimiento beta, lo cual se ha demostrado en líneas celulares de macrófagos THP-1 cultivadas y en monocitos de sangre periférica humana. Igualmente, estos factores también inducen la redistribución intracelular y la secreción de las proteínas HMGB126,27.
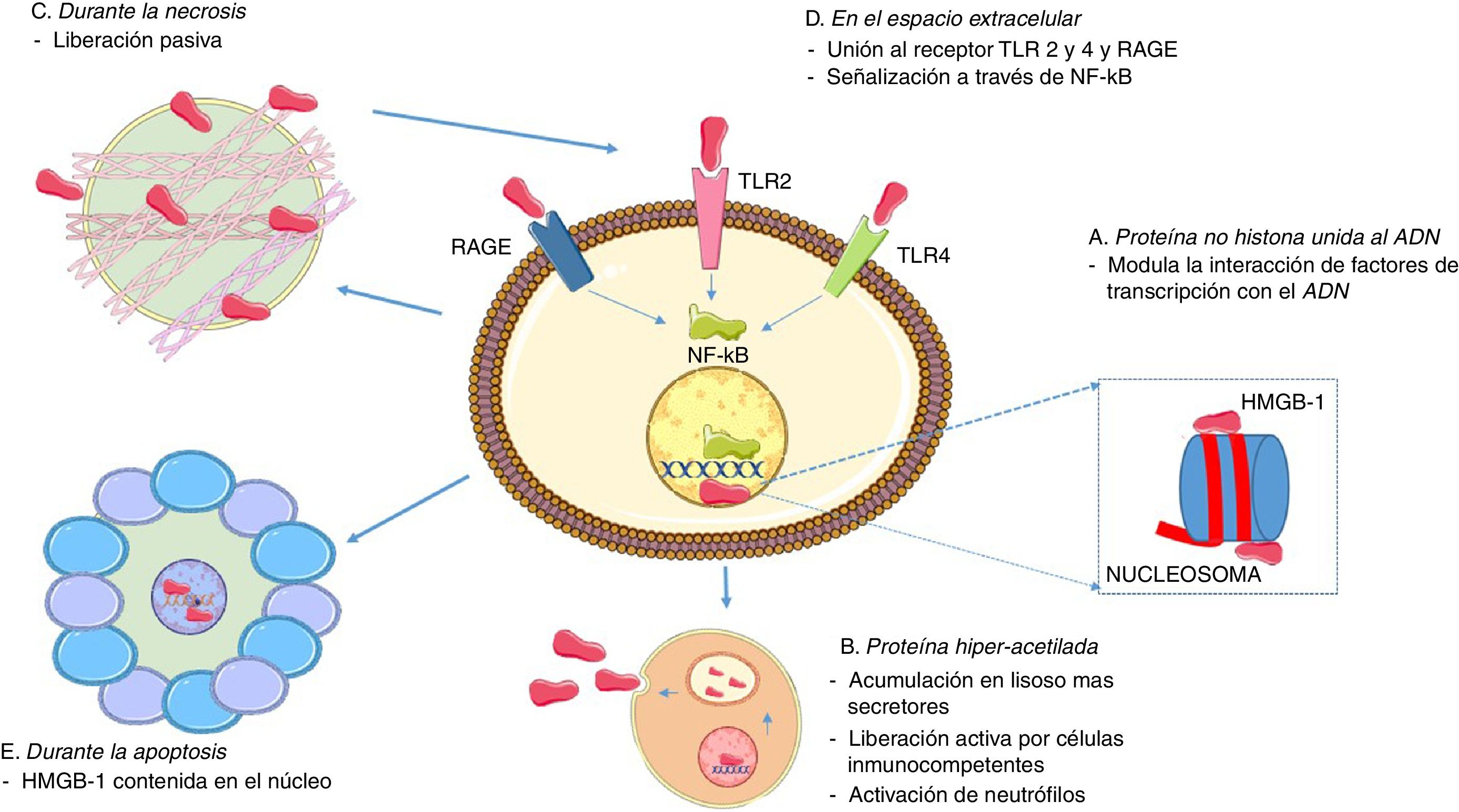
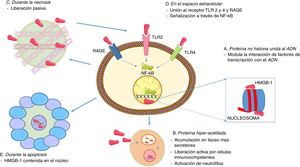
En torno al papel de las HMGB1 como citocina, esta no depende únicamente de su liberación activa por medio de células inmunes, debido a que las HMGB1 normalmente están ligadas a la cromatina, por lo que si una célula se vuelve necrótica, entonces las HMGB1 se difunden en el espacio extracelular de forma pasiva22. Es importante destacar que esto no ocurre cuando las células mueren por apoptosis, dado que las HMGB1 se unen al ADN cruciforme (estructuras de ADN formadas por repeticiones invertidas reforzadas por el super enrollamiento del ADN), que se forma después de la escisión del ADN (por medio de la topoisomerasa ii) en intervalos nucleosómicos o a proteínas hipoacetiladas dentro del núcleo de células apoptóticas28. Esta distinción entre modos de muerte celular podría ser la base de las diferentes capacidades de las células necróticas y las células apoptóticas para activar una respuesta inflamatoria. En la figura 2 se resumen las funciones intranucleares y extranucleares asociadas a las HMGB1, así como sus formas de liberación.
Funciones asociadas a la HMGB1. A. En el núcleo, las HMGB1 están asociadas de forma suelta y transitoria con los nucleosomas y son importantes para el control de la transcripción del ADN y para la interacción con la matriz nuclear. B. Secreción activa de las HMGB1 a través de células inmunocompetentes, como macrófagos y células dendríticas, después de la activación por productos bacterianos, como endotoxinas y citocinas proinflamatorias; para su secreción se necesita la acumulación de HMGB1 hiperacetiladas en lisosomas secretores, la fusión con la membrana celular y su posterior liberación en el espacio extracelular. C. Durante la necrosis, las HMGB1 se secretan de forma pasiva, generando procesos inflamatorios. D. Cuando están presentes en el líquido extracelular, las señales HMGB1 a través de RAGE y TLR 2 y 4 conducen a la activación de señales de supervivencia y activación que involucran al factor nuclear-κB (NF-κB). E. Durante la apoptosis, las HMGB1 se secuestran en el núcleo y se evita su liberación.
Se ha evidenciado que las HMGB1 pueden formar complejos al unirse a moléculas como la quimiocina CXCL12, el lipopolisacárido, la IL-1, secuencias CpG, ADNds y nucleosomas3. Esta característica incrementa la respuesta de los macrófagos hasta 100 veces al formar complejos con lipopolisacáridos y Pam3CSK4, que es una lipoproteína triacilada sintética; de esta forma, induce la producción de citocinas vía TLR4 al unirse con el lipopolisacárido y, vía TLR-2, con Pam3CSK429,30. Además, las HMGB1 son un componente esencial de los complejos inmunes que contienen ADN, capaces de estimular la producción de citocinas a través de una ruta TLR9-MyD88 que implica el receptor multivalente RAGE29. Asimismo, la unión de las HMGB1 a los motivos CpG de clase A aumenta considerablemente la producción de citocinas mediante TLR9 y RAGE. Por otra parte, ciertas enfermedades autoinmunes son mediadas por la formación de inmunocomplejos que participan en el daño y la mediación de la respuesta inflamatoria local de ciertos órganos. Como ejemplo de estas, el LES es una enfermedad autoinmune donde el daño de órganos, como el riñón, es mediado por inmunocomplejos1. También, se ha encontrado que complejos inmunes con ADN y HMGB1 pueden inducir la producción de autoanticuerpos anti-ADNds en pacientes con LES30. De igual forma, es probable que los complejos formados por las HMGB1 tengan un rol en la fisiopatología de la nefritis lúpica (NL), ya que se ha evidenciado que los pacientes con dicha complicación presentan una expresión incrementada de las HMGB1 respecto a otras enfermedades renales, comportándose, de este modo, como un mediador proinflamatorio en el daño renal inducido por autoanticuerpos en pacientes con NL31.
Por otra parte, se ha evidenciado que estimulando células endoteliales con complejos inmunes en pacientes con LES, se aumenta la producción de citocinas proinflamatorias como la IL-6 y la IL-8. Además, RAGE, VCAM-1 e ICAM-1 mostraron una mayor expresión en la superficie celular de las células endoteliales en presencia de los complejos inmunes. Estos efectos podrían ser bloqueados agregando la caja A inhibitoria de las HMGB1 o RAGE soluble, lo que indica que las HMGB1 juegan un papel importante en la mediación de la inflamación endotelial32. De esta forma se evidencia que, dependiendo de las células efectoras y otros componentes que estén presentes, las HMGB1 ejercen un papel regulador sobre los complejos inmunes.
HMGB1 y su papel en la fagocitosisLa fagocitosis es un proceso inmunológico en el que células de la respuesta inmune innata, macrófagos y neutrófilos fagocitan o «ingieren» microorganismos, además de detritos celulares generados a través de mecanismos como la apoptosis y la necrosis (en estos casos también se conoce a este proceso como eferocitosis y necroptosis, respectivamente). En ambas situaciones, su papel es fundamental en la resolución de la inflamación33. De igual manera, la perturbación en la eferocitosis de los restos apoptóticos se ha implicado en la patogénesis del LES, lo que conduce a una necrosis celular secundaria y a la exposición del contenido intracelular al tejido circundante, que a su vez puede inducir una respuesta inflamatoria34. Adicionalmente, moléculas séricas como los factores del complemento son importantes en la fagocitosis y se encuentran disminuidos en pacientes con LES35. Se ha descrito que las HMGB1 son un factor que puede contribuir a disminuir la fagocitosis mediante diversos mecanismos36,37. Durante la apoptosis, las moléculas de fosfatidilserina que se encuentran en el interior de la célula se expresan en la membrana citoplasmática y sirven como señales de «ingestión», siendo reconocidas por un amplio número de receptores en la membrana de los fagocitos, como las integrinas, lo que permite la identificación y la eliminación de las células apoptóticas38. Las HMGB1 pueden unirse a la fosfatidilserina presente en la superficie de neutrófilos apoptóticos, inhibiendo una de las señales más importantes para que el macrófago fagocite esta célula36. Lo anterior se demostró in vitro, donde macrófagos previamente incubados con las HMGB1 muestran una capacidad disminuida para fagocitar neutrófilos apoptóticos, ya que las HMGB1 compiten por la unión a la integrina αvβ3 con el factor de crecimiento epidérmico globular de la grasa de la leche 8, que se comporta como una opsonina, impidiendo de este modo el reconocimiento y la eliminación de neutrófilos apoptóticos39. En efecto, recientes estudios han demostrado la participación del receptor RAGE como potenciador de la fagocitosis a través de su interacción con la fosfatidilserina40. Del mismo modo, macrófagos con deficiencia de RAGE tienen una capacidad disminuida para fagocitar. El efecto inhibidor de las HMGB1 sobre la fagocitosis se atribuyó a la cola C-terminal, ya que, al eliminarla, este efecto se reduce considerablemente e igualmente pierde la capacidad de unirse a RAGE, lo que potenciaría su efecto inhibitorio en la fagocitosis37.
Además del efecto extracelular que tienen las HMGB1 en la inhibición de la fagocitosis, se ha demostrado en modelos experimentales su rol a nivel intracelular como inhibidor de la fagocitosis mediante su interacción con el complejo de cinasa de adhesión focal (FAK) y Src cinasa (FAK/Src), el cual participa en la señalización intracelular que permite la fagocitosis41. Concretamente, Banerjee et al. demostraron la unión de las HMGB1 con la cinasa Src del complejo FAK/Src, impidiendo su interacción con FAK y, a su vez, bloqueando la cascada intracelular, lo que resulta en la inhibición del proceso de fagocitosis42. Los macrófagos activados por la vía clásica (M1) presentan un perfil proinflamatorio con actividad fagocítica y producción de citocinas proinflamatorias como IL-1 o IL-12, mientras que los macrófagos activados por la vía alternativa (M2) presentan un perfil antiinflamatorio, demostrado por una producción de citocinas antiinflamatorias como la IL-10 y el factor transformante del crecimiento beta; actualmente se conoce que las HMGB1 tienen la capacidad de inducir la diferenciación de los macrófagos M2 hacia un perfil M1, influyendo negativamente en la fagocitosis de células apoptóticas. Este último proceso podría contribuir a explicar por qué los monocitos circulantes de pacientes con LES muestran un mayor fenotipo M1 (inflamatorio), en comparación con los de las personas sanas43.
HMGB1 y NETosisLa NETosis es un mecanismo de defensa del neutrófilo que tiene como objetivo inmovilizar y destruir los microorganismos que son demasiados grandes para fagocitar. El proceso consiste en la formación de trampas extracelulares conocidas como NET, que contienen componentes intracelulares de los neutrófilos tales como péptidos antimicrobianos, histonas, nucleosomas, especies reactivas de oxígeno, enzimas como la mieloperoxidasa, el péptido antimicrobiano LL-37 y las HMGB1, entre otros, encerrados por una malla de ADN, lo que permite inmovilizar y destruir el microorganismo, generando a su vez la muerte del neutrófilo. En los últimos años este mecanismo de defensa se ha implicado en la fisiopatología del LES, pues se ha visto que este tipo de muerte celular de los neutrófilos permite servir como fuente de autoantígenos para la formación de autoanticuerpos debido a un deficiente aclaramiento de los cuerpos apoptóticos3,44–46.
Normalmente, las NET se degradan por la DNasa-1 en la circulación, pero la capacidad de reducirlas disminuye en los pacientes con LES y se asocia con la actividad de la enfermedad47. El proceso de NETosis es generado por diferentes estímulos, tales como patógenos, citocinas proinflamatorias, plaquetas activadas, células endoteliales, anticuerpos anticitoplasma de neutrófilos y complejos inmunes. Como referencia, se ha observado en diversos estudios que cualquier alteración en la expresión y la regulación de los elementos involucrados en la NETosis facilita el desarrollo del LES, siendo de particular interés que las HMGB1 promueven la continua inducción de las NET a través de mecanismos dependientes de TLR2 y TLR4, por ejemplo, por la inducción de la liberación de citocinas proinflamatorias3,48. Así mismo, Garcia-Romo et al. confirmaron que en el LES, las HMGB1 se elevan durante el proceso de NETosis49, proceso en el que también se ha visto involucrada la NADPH oxidasa50. Otro de los efectos de la NETosis es la estimulación de células dendríticas plasmacitoides para producir interferón tipo i (IFN-α), que tiene un papel importante en la patogénesis del LES45,46.
HMBG1 en enfermedades autoinmunesHMGB1 en pacientes con LESDado que las HMGB1 se encuentran elevadas en el LES, existe un interés particular en determinar el rol que pueda tener esta citocina en la patogénesis de la enfermedad y, a su vez, utilizar los anticuerpos anti-HMGB1 como marcadores de actividad y severidad de la enfermedad, así como la posibilidad de convertir esta vía en un blanco terapéutico. A continuación, se describirá la evidencia que sustenta esta premisa4,51–54.
Las HMGB1 pueden servir como un autoantígeno, lo que lleva a la producción de anticuerpos anti-HMGB155–57. Estos anticuerpos se describieron por primera vez como un tipo de anticuerpo anticitoplasma de neutrófilos de patrón «perinuclear» en la colitis ulcerativa55. Sin embargo, posteriormente se demostró su prevalencia en otros tipos de enfermedades autoinmunes como el LES, en donde se ha determinado que la presencia de estos anti-HMGB1 se correlaciona con los niveles séricos de HMGB1 y, a su vez, con la actividad de la enfermedad, cuantificada por medio del Índice de Actividad del Lupus Eritematoso Sistémico, mientras que la relación es inversa con los niveles séricos de las proteínas del complemento C3 y C451–53,56. De igual manera, se ha demostrado que las HMGB1 potencian la producción de anticuerpos antinucleares que reconocen nucleosomas y ADNds10,30. También, se ha observado que las HMGB1 unidas a los inmunocomplejos que contienen ADN inducen la producción de IFN-α por las células dendríticas plasmocitoides y la activación de las células B autorreactivas, contribuyendo a la patogénesis del LES29.
Por otra parte, se ha realizado el mapeo de epítopos de los anticuerpos anti-HMGB1, que ha evidenciado que la mayoría de estos reaccionaron contra la caja A de las proteínas56, lo que indica que estos anticuerpos no cumplen función neutralizante, al dirigirse contra una región antagónica. En contraste, en modelos murinos de otras enfermedades en las que los anticuerpos anti-HMGB1 no están presentes, como la sepsis, la administración de la caja A, con su efecto antagónico sobre los niveles de HMGB1, es beneficiosa en los desenlaces clínicos58.
Por último, el estado redox cumple un papel importante en la funcionalidad de las HMGB1. Sin embargo, no son muchos los estudios que han trabajado con la detección del estado redox de las HMGB1 en muestras de sueros de pacientes con LES. Una de estas investigaciones con una muestra pequeña de pacientes demostró que la HMGB1 oxidada está presente en los sueros de estos pacientes59. En este punto, son necesarios estudios con mayores series de pacientes con el fin de definir qué isoformas de HMGB1 están presentes en el suero de los pacientes con LES y así poder realizar una asociación clínica con la presencia de estas proteínas.
HMGB1 en nefritis lúpicaAl comparar el suero de pacientes con LES con y sin compromiso renal, los niveles séricos de HMGB1 son más altos en los primeros, pudiendo indicar que existe un rol de esta proteína en el desarrollo de la NL52,53. Además, se ha encontrado la presencia citoplasmática y extracelular de las HMGB1 en las biopsias de riñón de pacientes con NL54,60. No obstante, la HMGB1 es detectada en la orina de pacientes con dicha afectación, pero no en controles, y se correlacionó positivamente con los niveles séricos, además de la proteinuria y la puntuación en el Índice de Actividad del Lupus Eritematoso Sistémico, e inversamente con los niveles de complemento C360. Según lo anterior, es posible que las HMGB1 puedan servir como marcadores de actividad y severidad del LES; particularmente, de compromiso renal. Sin embargo, se necesitan más estudios que confirmen esta asociación.
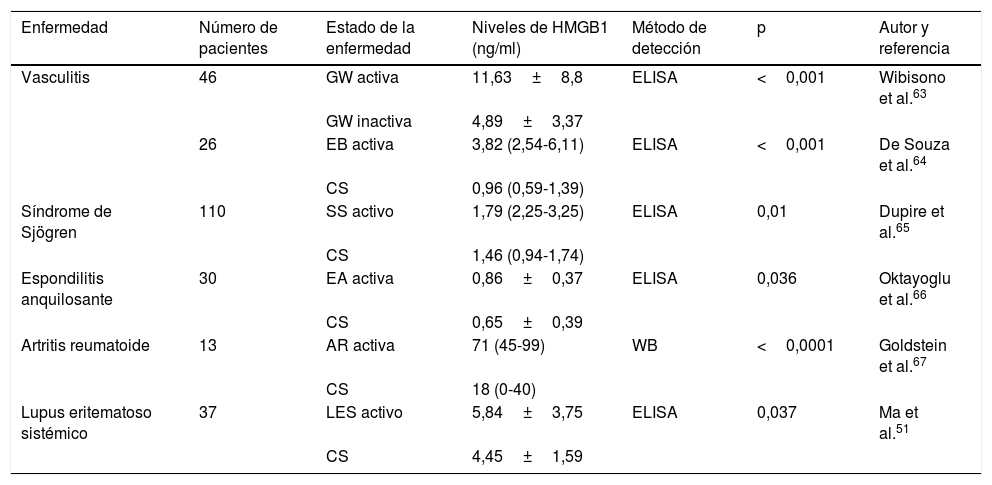
HMGB1 en otras enfermedades autoinmunesLas HMGB1 pueden encontrarse elevadas en otras enfermedades autoinmunes como la artritis reumatoide, el síndrome de Sjögren y ciertos tipos de vasculitis, aunque el papel que puedan cumplir no es claro53,54,61. Un estudio reciente encontró que los pacientes con síndrome antifosfolípido presentaron niveles séricos significativamente aumentados de HMGB1, RAGE y TNF-α, en comparación con los controles sanos. Lo anterior apoya la actividad proinflamatoria de HMGB1 en diferentes enfermedades autoinmunes distintas al LES62. En la tabla 1 se muestran los niveles séricos de HMBG1 encontrados en otras enfermedades reumáticas.
Niveles séricos de HMGB1 en diferentes enfermedades reumáticas
| Enfermedad | Número de pacientes | Estado de la enfermedad | Niveles de HMGB1 (ng/ml) | Método de detección | p | Autor y referencia |
|---|---|---|---|---|---|---|
| Vasculitis | 46 | GW activa | 11,63±8,8 | ELISA | <0,001 | Wibisono et al.63 |
| GW inactiva | 4,89±3,37 | |||||
| 26 | EB activa | 3,82 (2,54-6,11) | ELISA | <0,001 | De Souza et al.64 | |
| CS | 0,96 (0,59-1,39) | |||||
| Síndrome de Sjögren | 110 | SS activo | 1,79 (2,25-3,25) | ELISA | 0,01 | Dupire et al.65 |
| CS | 1,46 (0,94-1,74) | |||||
| Espondilitis anquilosante | 30 | EA activa | 0,86±0,37 | ELISA | 0,036 | Oktayoglu et al.66 |
| CS | 0,65±0,39 | |||||
| Artritis reumatoide | 13 | AR activa | 71 (45-99) | WB | <0,0001 | Goldstein et al.67 |
| CS | 18 (0-40) | |||||
| Lupus eritematoso sistémico | 37 | LES activo | 5,84±3,75 | ELISA | 0,037 | Ma et al.51 |
| CS | 4,45±1,59 |
AR: artritis reumatoide; CS: controles sanos; EA: espondilitis anquilosante; EB: enfermedad de Behçet; GW: granulomatosis de Wegener; HMGB1: proteínas de alta movilidad del grupo 1; LES: lupus eritematoso sistémico; SS: síndrome de Sjögren; WB: Western blot.
Los niveles de HMGB1 aparecen como media±desviación estándar o mediana (rango).
Las HMGB1 son proteínas que cumplen una función importante como mediadores tardíos de inflamación. Así como en otras enfermedades reumáticas, en el suero de pacientes con LES se ha demostrado la presencia elevada de las HMGB1 y de los anti-HMGB1 comparada con pacientes sin LES, de igual forma en el suero, orina y biopsias renales de pacientes con NL los niveles de HMGB1 son mayores. Estos hallazgos, junto con el rol de las HMGB1 en la inflamación, deja preguntas como: ¿es posible utilizarlas como un biomarcador de actividad de la enfermedad? o ¿podrían postularse como blancos terapéuticos de futuros tratamientos? Hasta el momento se requiere de más evidencia que permita responder a estas preguntas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.