La esclerosis sistémica (ES) es una enfermedad autoinmune sistémica en la que las manifestaciones gastrointestinales son una complicación frecuente. El compromiso gastrointestinal está presente hasta en 90% de los pacientes. Las áreas más afectadas son el esófago y el tracto anorrectal. El reflujo, la pirosis y la dismotilidad son las principales causas de malestar gastrointestinal. La función anorrectal alterada puede presentarse temprano en el curso de la ES y es un factor importante en el desarrollo de incontinencia fecal. Las recomendaciones actuales para tratar los trastornos gastrointestinales en la ES incluyen el uso de inhibidores de la bomba de protones, procinéticos y de antibióticos en forma rotativa. Esta revisión discute los mecanismos fisiopatológicos propuestos, la presentación clínica, las diferentes técnicas de diagnóstico y el manejo actual del compromiso de cada sección del tracto gastrointestinal en la ES.
Systemic sclerosis (SSc) is a systemic autoimmune disease where gastrointestinal manifestations are a frequent complication. Gastrointestinal involvement is present in up to 90% of patients. The most affected area are the esophagus and the anorectal tract. Reflux, heartburn and dysmotility are the leading causes of gastrointestinal discomfort. Disordered anorectal function can occur early in the course of SSc and is an important factor in the development of faecal incontinence. Current recommendations to treat gastrointestinal disorders in SSc include the use of proton pump inhibitors, prokinetics and rotating antibiotics. This review discusses the proposed pathophysiological mechanisms, the clinical presentation, the different diagnostic techniques and the current management in each section of the gastrointestinal tract involvement in SSc.
El compromiso del tracto gastrointestinal (TGI) es común en los pacientes con Esclerosis Sistémica (ES), afectando hasta al 90% de los pacientes1-4, y siendo una causa importante de morbimortalidad por la enfermdad5.
Al igual que otras complicaciones de la enfermedad, en la ES se presenta una disfunción de la microcirculación, del sistema inmune y de los mecanismos de control de la fibrosis en el TGI. El esófago es el área más afectada del TGI en la ES y la disfagia y la enfermedad por reflujo gastroesofágico son las principales manifestaciones6,7. El compromiso gástrico es menos frecuente, aunque puede ser responsable del retardo en el vaciamiento gástrico y de la ectasia vascular antral gástrica8-11. El compromiso intestinal, aunque por lo general es asintomático, puede poner en peligro la vida. El intestino delgado puede presentar estasis intestinal y estar propenso a un sobrecrecimiento bacteriano que causa diarrea severa, dolor abdominal y pérdida de peso. El compromiso del colon puede causar un estreñimiento severo12,13. El área anorrectal puede verse afectada en más del 50% de los pacientes, causando un gran impacto en la calidad de vida14. La presencia de colangitis biliar primaria (CBP) es relativamente frecuente en los pacientes con ES (7-17%), especialmente en la esclerosis sistémica cutánea limitada (EScl)15,16.
El instrumento del Consorcio de Ensayos Clínicos sobre Esclerodermia de la Universidad de California en Los Ángeles relativo al Tracto Gastrointestinal 2.0 (UCLA GIT 2.0) se puede utilizar para evaluar la presencia y la severidad de los síntomas gastrointestinales en pacientes con ES, así como su impacto en la calidad de vida. Este instrumento ha sido validado y los propios pacientes reportan sus síntomas a través de 34 preguntas agrupadas en siete subgrupos: reflujo, distensión abdominal, diarrea, manchado de la ropa con materia fecal, estreñimiento, bienestar emocional y funcionamiento social, calificados de acuerdo con la severidad17.
No existen ensayos clínicos aleatorizados específicos para evaluar las diferentes terapias para el manejo de las complicaciones del TGI en los pacientes con ES, y la mayoría de las opciones de tratamiento se basan en la evidencia en otras enfermedades o en recomendaciones de expertos.
En este manuscrito revisamos el conocimiento reciente de la patogénesis, las manifestaciones clínicas, los exámenes y los tratamientos que se utilizan para manejar las diferentes manifestaciones gastrointestinales en la ES.
MétodosMétodos de búsqueda de literaturaSe llevó a cabo una investigación bibliográfica hasta junio de 2019 en las bases de datos MEDLINE, EMBASE y Cochrane Library para encontrar estudios que cumplieran los criterios de inclusión.
La investigación en Medline se hizo a través de Pubmed utilizando los términos MeSH: systemic, orofacial sclerosis, microstomia, xerostomia, periodontal disease, dysmotility, gastroesophageal reflux disease, esophageal dysphagia, Barret esophagus, esophageal adenocarcinoma, gastroparesis, watermelon stomach, intestinal dysmotility, constipation, diarrhea, intestinal bacterial overgrowth, intestinal pseudo-obstruction, intestinal cystoid pneumatosis, diverticulosis, primary biliary cholangitis, autoimmune hepatitis, pancreatic insufficiency, fecal incontinence, rectal prolapse.
Solamente se incluyeron artículos publicados en inglés.
Selección de artículos y extracción de la informaciónLos artículos seleccionados se guardaron en una base de datos; inicialmente, se tuvieron en cuenta aquellos artículos que tenían las palabras clave incluidas en el resumen o en el título. Posteriormente, se descartaron los artículos que no cumplían con los criterios de inclusión, y se celebró un comité entre los autores para unificar la base de datos y escoger aquellos artículos que eran relevantes para esta revisión.
Criterios de inclusiónPara la selección de los estudios se tuvo en cuenta que estos cumplieran los siguientes criterios de inclusión en términos del tipo de estudio, población e intervención.
- •
Tipos de estudio: para la inclusión se consideraron los metaanálisis, revisiones sistemáticas (RS) de ensayos clínicos aleatorizados (ECA), ECA, estudios de cohorte prospectivos y retrospectivos, así como protocolos institucionales. No se utilizó como criterio que los estudios tuvieran un tiempo mínimo de seguimiento o un tamaño de muestra mínimo.
- •
Tipo de población: pacientes mayores de 18 años con ES y compromiso gastrointestinal.
- •
Intervención: estudios que describen la afección gastrointestinal, explicando la fisiopatología, la clínica, las técnicas de diagnóstico, el pronóstico, el tratamiento y las complicaciones.
- •
Artículos sin acceso al texto completo.
- •
Artículos duplicados
- •
Estudios que no fueron realizados en humanos
Al final de la investigación, un total de 2101 artículos fueron analizados por los investigadores. Después de excluir los artículos duplicados, los artículos sin acceso al texto completo o los estudios no realizados en humanos, obtuvimos un total de 148 artículos. La tabla 1 resume las complicaciones del TGI en la ES y el enfoque que encontramos en la literatura.
Complicaciones del compromiso gastrointestinal en ES
| Localización | Manifestación | Evaluación | Intervención inicial | Intervención posterior |
|---|---|---|---|---|
| Cavidad oral10-70% | Microstomía | Evaluación clínica | Medidas higienicodietéticas | Ejercicios de rehabilitación |
| Xerostomía | Estudio del Síndrome Seco (exámenes de imagenología, pruebas inmunológicas, patología) | Hidratación, saliva artificial | Agonistas colinérgicos | |
| Caries y Enfermedad Periodontal | Evaluación clínica | Consulta temprana con el odontólogo | ||
| Compromiso óseo | Exámenes de imagenología | Control con Cirugía Maxilofacial | ||
| Esófago80-90% | Disfagia | Manometría esofágica | Medidas higienico-dietéticasProcinéticos: metoclopramida, domperidona, cisaprida, octreotida, eritromicina, baclofeno, buspirona | IgIV |
| ERGE | EndoscopiaMonitorización del pHManometría esofágicaCápsula endoscópicaEstudio del vaciamiento gástrico | Medidas higienicodietéticasIBPAntagonistas de los receptores H2 en la nocheProcinéticos | Técnicas quirúrgicas | |
| Estenosis | - Endoscopia | - Tratar la ERGE | - Dilatación endoscópica | |
| Esófago de Barrett | Vigilancia regular, endoscopia con biopsia | - Ablación por radiofrecuencia- Terapia fotodinámica | Resección endoscópica | |
| EPI | Pruebas de función respiratoria y DLCOTomografía computarizada del tórax de alta resolución | Manejo específico para ES y EPI | ||
| Estómago10-50% | Gastroparesia | GammagrafíaCápsula endoscópica | Medidas higienico-dietéticasProcinéticos | |
| EVAG | Endoscopia | Terapia de soporte: suplementos de hierro, transfusiones de sangreAblación endoscópica con laserFotocoagulación con Argón plasmaLigadura endoscópica con Banda | Antrectomía | |
| Intestino delgado40-88% | CIPO | Radiografía de abdomen simpleTC del abdomenManometría del intestino delgadoGammagrafía | Reposo intestinal, líquidos intravenososProcinéticos | |
| SBID | CoprocultivoPruebas de alientoCultivo del aspirado yeyunal | Antibióticos cíclicosProbióticos | ||
| Pneumatosis cystoides intestinalis | Radiografía de abdomen simple | Observación vigilante, oxígeno, antibióticos | Cirugía | |
| Colon20-50% | Dismotilidad y estreñimiento | Radiografía de abdomen simpleTC del abdomenManometría del intestino delgadoGammagrafía | DietaLaxantes estimulantes | Procinéticos |
| Diverticulosis | ColonoscopiaRadiografía de abdomen simple | Antibióticos si hay diverticulitis | Cirugía | |
| Anorrectal50-70% | Incontinencia fecalProlapso rectal | Manometría anorrectalEcografía endoanalRM rectal | Solidificar las heces con agentes engrosantes | BiorretroalimentaciónEstimulación del nervio sacroCirugía |
| Hígado2-17% | Colangitis biliar primaria | Pruebas de función hepática: ANA, AAM, anti-gp210, anti-sp 100Ecografía abdominalBiopsia hepática | Consulta con hepatólogoÁcido ursodesoxicólico | CorticosteroidesSulindacoTrasplante de hígado |
| Páncreas | Insuficiencia pancreática | Pruebas de función pancreática | - Enzimas pancreáticas |
AAM: anticuerpos antimitocondriales; ANA: anticuerpos antinucleares; DLCO: apacidad de difusión del monóxido de carbono; ERGE: Enfermedad por reflujo gastroesofágico; ES: Esclerosis sistémica; EPI: enfermedad pulmonar intersticial; EVAG: ectasia vascular antral gástrica; IgIV: inmunoglobulinas intravenosas; POIC: seudoobstrucción intestinal crónica; SBID: sobrecrecimiento bacteriano del intestino delgado.
La cavidad oral se ve afectada en 10-70% de los pacientes con ES18. Las complicaciones más frecuentes son externas a la cavidad oral, tales como microstomía y microquilia, ambas presentes en 50-80% de los csos19-21.
La microstomía es causada principalmente por fibrosis de los tejidos periorales y produce una reducción de la apertura bucal22. Ocasionalmente puede afectar el habla o la masticación y predisponer a enfermedades periodontales21. Cuando se observa en las etapas tempranas, se recomiendan los ejercicios de estiramiento de la boca, masajes, y la técnica de Kabat (ejercicios de estimulación muscular facial)23 de manera regular para mantener el beneficio24.
La xerostomía se presenta en 30-68% de los pacientes19,20 y la enfermedad superpuesta con el síndrome de Sjögren puede aparecer hasta en un 23% de los casos25. La sequedad de la boca favorece el desarrollo de caries dental, alteraciones del gusto, atrofia e infecciones de la boca21,26. Para reducir los síntomas se recomienda la ingesta de pequeñas cantidades de agua y el uso de enjuagues bucales con saliva artificial20,21. En la microstomía de la enfermedad periodontal están implicados el aumento de la distancia interincisal27,28 y una higiene oral defectuosa. Es recomendable realizar exámenes periódicos por odontólogos con experiencia en ES28. Otras complicaciones menos frecuentes son el compromiso del hueso mandibular o la presencia de artropatía temporomandibular29,30. Se ha encontrado un mayor riesgo de carcinoma escamocelular de la lengua en los pacientes con ES31.
EsófagoEl compromiso esofágico es la afectación más frecuente del TGI, presente hasta en 90% de los casos6,7,32,33, y ha sido descrito más comúnmente en la ESlc4. Los mecanismos patológicos propuestos son: daño vascular con hipoperfusión e isquemia22, daño neurológico causado por los cambios microvasculares de los vasa vasorum y compromiso nervioso debido al infiltrado inflamatorio y/o fibrótico24,34. Estos cambios causan disfunción de la motilidad esofágica, principalmente en la parte inferior35. También se ha descrito un componente neurológico autoinmune en las manifestaciones gastrointestinales27,28, y se ha postulado la participación de los anticuerpos antimuscarínicos contra el receptor 3 de acetilcolina36-38 mediante la inhibición de la contractilidad de los músculos lisos39. Se ha encontrado una disminución de la amplitud de la contractilidad y una baja presión de reposo del esfínter esofágico inferior40,41, que se traducen en síntomas como disfagia, tos, pirosis, regurgitación o dispepsia39,42.
La disfagia esofágica está presente en 4,3% de los pacientes con ES43, afectando la masticación. Si existe una disfagia exclusiva para sólidos, es aconsejable descartar una causa obstructiva como una estenosis esofágica44. La presencia de estenosis esofágica, candidiasis esofágica, tratamiento inmunosupresor y supresión ácida crónica debida a inhibidores de la bomba de protones (IBP) se ha asociado con la presencia de disfagia en la ES45.
La enfermedad por reflujo gastroesofágico (ERGE) se presenta hasta en 70% de los pacientes1,46-51 y es una manifestación clínica frecuente a nivel esofágico52,53. Debido a la disminución de la presión en el esfínter esofágico inferior (EEI), el número de episodios de reflujo aumenta y junto con la menor capacidad de motilidad del esófago, el ácido gástrico permanece más tiempo en el esófago y puede pasar a la tráquea y a la faringe54. La neutralización del ácido gástrico por la saliva es reducida e incompleta, empeorada por el síndrome seco orofaringeo55.
Las complicaciones que han sido asociadas con la ERGE son: estenosis esofágica (30%), esófago de Barrett (37%), tos, broncoespasmo o laringoespasmo48,56-60.
Además, el compromiso esofágico puede contribuir al desarrollo de enfermedad pulmonar intersticial (EPI)61,62. Una revisión retrospectiva con más de 400 pacientes con ES mostró que un mayor diámetro esofágico se correlacionó con reducciones de los valores funcionales pulmonares44,62. Otro estudio identificó niveles similares de pepsina en los fluidos bronquiales y gástricos en los pacientes con ES63. Se ha sugerido la monitorización del pH como un factor pronóstico en los pacientes con ES con EPI64.
Es recomendable hacer una evaluación esofágica en todos los pacientes con ES, siendo la manometría, la monitorización del pH y la endoscopia los procedimientos más útiles42. La manometría esofágica es esencial para el diagnóstico de dismotilidad esofágica65, especialmente en las etapas iniciales. La manometría de alta resolución permite hacer una mejor evaluación de todo el esófago66-69, sin embargo, esta técnica aún no está validada65; la monitorización del pH esofágico, con o sin impedancia, permite detectar el reflujo gastroesofágico. Se ha observado una monitorización anormal del pH hasta en 85% de los pacientes con ES46,70,71, pero en la práctica clínica solo se utiliza en los pacientes con síntomas de reflujo resistente42. La endoscopia es la mejor herramienta para evaluar la disfagia o identificar la presencia de ERGE y sus complicaciones. El esófago de Barrett es causado por ERGE crónica, y requiere controles endoscópicos periódicos debido a la presencia de una lesión de la mucosa esofágica normal y su reemplazo por mucosa metaplásica29. La presencia de mucosa metaplásica es un factor de riesgo relevante para adenocarcinoma de esófago.
Otras herramientas de diagnóstico menos útiles son la gammagrafía, las imágenes por resonancia magnética; el esofagograma con bario o la cápsula endoscópica65,72.
Las primeras medidas para el tratamiento del compromiso esofágico en la ES se basan en recomendaciones higienico-dietéticas como el consumo de alimentos blandos en pequeñas cantidades; la ingesta de abundantes líquidos; evitar ciertas sustancias como alcohol, cafeína, especias, entre otras; levantar la cabecera de la cama o comer aproximadamente 2–3 horas antes de acostarse32,73. No existen ensayos clínicos aleatorizados que hayan encontrado evidencia de las diferentes opciones farmacológicas para tratar las complicaciones esofágicas en los pacientes con ES. Para tratar la ERGE se recomienda el uso de IBP74 y estos pueden ser útiles para la prevención de úlceras y estenosis esofágica44,75. Se ha visto una disminución del adenocarcinoma de esófago en los pacientes sometidos a tratamiento con IBP76. Los antagonistas de los receptores H2 (anti-H2) estarían indicados en los casos refractarios a los IBP77.
El uso de procinéticos puede aliviar diferentes trastornos de la motilidad (disfagia, ERGE, distensión abdominal, seudoobstrucción, saciedad temprana)74. La cisaprida (agonista de los receptores 5-HT4 y antagonista de los receptores 5-HT3) puede mejorar la motilidad gástrica y esofágica, pero también causa una disminución del tono del esfínter esofágico inferior y de la motilidad del intestino delgado78-81. Se ha demostrado que la domperidona (antagonista de los receptores D2) en asociación con los IBP es útil para disminuir la severidad de los síntomas de motilidad82. La metoclopramida ha mostrado un aumento del tono del esfínter esofágico inferior en pacientes con ES y también mejora la motilidad83-85. La prucaloprida (agonista 5-HT4) demostró una mejoría de la motilidad en una serie de pacientes con ES86. Otras alternativas son la buspirona y el baclofeno que pueden mejorar la ERGE al aumentar el tono del esfínter inferior e intensificar las contracciones esofágicas72. De acuerdo con las últimas recomendaciones del Grupo Europeo de Ensayos e Investigación sobre Esclerodermia (EUSTAR) se sugiere el uso de procinéticos para los trastornos de motilidad sintomáticos en los pacientes con ES74. Respecto al uso de terapias inmunomoduladoras, hay un estudio observacional con el uso de inmunoglobulinas intravenosas en pacientes con ES y enfermedad del TGI, evidenciando una disminución de la frecuencia y la intensidad de los síntomas de la ERGE87.
Algunos pacientes con ERGE refractaria al tratamiento médico requieren técnicas invasivas tales como esofagectomía, fundoplicatura, o derivación en Y de Roux29. Los pacientes con estenosis esofágica pueden beneficiarse de las dilataciones endoscópicas29.
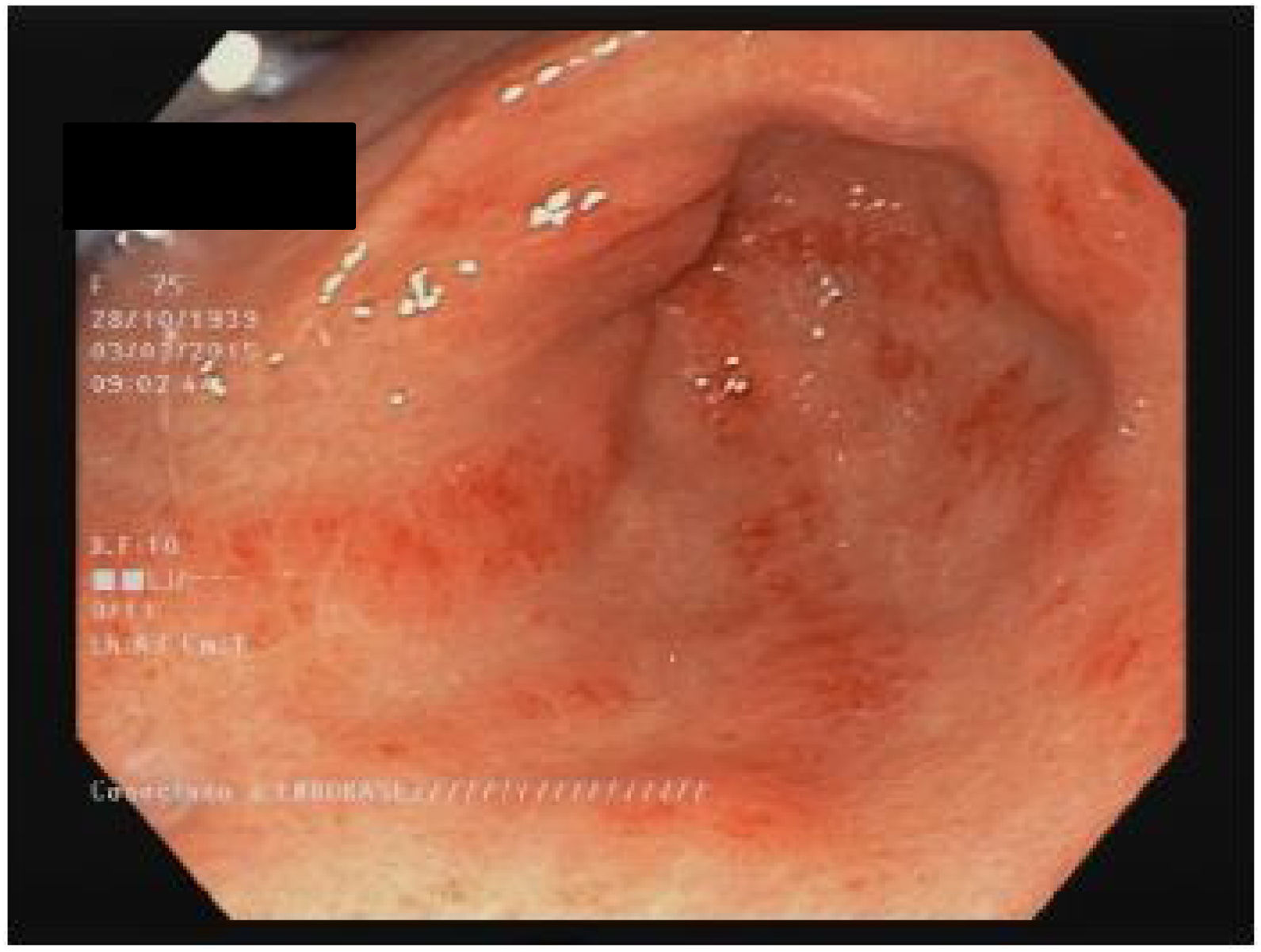
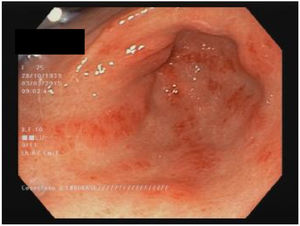
EstómagoAlrededor del 50% de los pacientes con ES tienen compromiso estomacal13,60. Las manifestaciones más frecuentes son el retardo en el vaciamiento gástrico y la ectasia vascular antral gástrica (EVAG o estómago en sandía; fig. 1)8,10,88. Aunque se desconoce el mecanismo específico de la enfermedad gástrica, se han propuesto como posibles causas el daño microvascular, un compromiso del sistema nervioso periférico y la disfunción miogénica41. La gastroparesia puede afectar al 10-80% de los pacientes3,8,14,48,61,89,90.
Las manifestaciones clínicas presentes son dolor/distensión abdominal, hinchazón, y más comúnmente, saciedad temprana y náuseas postprandiales91. La severidad de los síntomas no se correlaciona con el grado de compromiso92,93.
La gammagrafía es el examen recomendado para evaluar la motilidad a ese nivel91 y la píldora endoscópica puede ser útil en los pacientes que no toleran la gammagrafía72. En la ES, el retardo en el vaciamiento de los líquidos se correlaciona con saciedad temprana y anorexia72. Otras herramientas de diagnóstico son: las pruebas del aliento, manometría esofágica-gastrointestinal, tomografía computarizada por emisión de fotón único (SPECT, por sus siglas en inglés) o resonancia magnética gástrica94-96.
El tratamiento con medidas higienico-dietéticas y el evitar medicamentos que afectan el tránsito intestinal tales como opioides o neurolépticos72 son las primeras medidas sugeridas. La metoclopramida (antagonista de los receptores D2 y agonista de 5-HT4) es el fármaco de primera línea para la gastroparesia91. Se ha demostrado que la metoclopramida mejora las náuseas y la distensión posprandial en los pacientes con ES83,84. Se puede considerar la cisaprida y la domperidona en algunos casos72. En los pacientes refractarios, se ha demostrado que los macrólidos como la eritromicina mejoran el vaciamiento gástrico de sólidos97,98 pero pueden reducir el tránsito del intestino delgado y alterar el intervalo QT99. La buspirona (agonista de los receptores 5-HT1a) puede producir alivio de la dispepsia funcional, pero también produce una disminución del vaciamiento gástrico de los líquidos72. La levosulpirida (antagonista de receptores D2) parece disminuir el tiempo de llenado gástrico. En estudios con pacientes sin ES, la levosulpirida ha demostrado superioridad sobre la metroclopramida o la domperidona72. La prucoloprida (agonista de los receptores 5-HT4) mejora la motilidad del duodeno y disminuye los efectos de gastroparesia86. Se ha demostrado que la grelina (una neurohormona secretada por el estómago y el intestino delgado) mejora el vaciamiento gástrico en los pacientes con gastroparesia con o sin ES72,100. El uso de terapias antieméticas (ondansetrón, prometazina, meclizina o cannabinoides) para mejorar la gastroparesia no es raro. En los casos severos se pueden considerar procedimientos más invasivos como inyecciones de bótox e implantes de estimuladores gástricos72.
La EVAG se encuentra hasta en 22,3% de los pacientes88. La EVAG probablemente se produce debido a una alteración del componente microvascular de la ES8,101. Un estudio reciente encontró una mayor presencia de EVAG en los pacientes con diagnóstico temprano de ES y en los pacientes del subgrupo difuso (ESdc)10. También se publicó una asociación negativa con anticuerpos antitopoisomerasa (ATA)102 y anti-U1-ribonucleoproteina88. La asociación de la EVAG con otros autoanticuerpos es objeto de controversia103. Las principales manifestaciones clínicas incluyen anemia por deficiencia de hierro o hemorragia gastrointestinal alta103. Cabe señalar la recomendación de descartar la presencia de ES en los pacientes con EVAG88,101. El diagnóstico se hace por endoscopia, que muestra múltiples ectasias vasculares pequeñas confluentes con orientación longitudinal desde los pliegues del antro hasta el píloro104. El tratamiento inicial es una terapia de apoyo con suplementos de hierro o transfusiones de glóbulos rojos. Si la terapia conservadora falla, se requerirá terapia endoscópica con ablación laser, fotocoagulación con argón plasma o ligadura endoscópica con banda, especialmente para los pacientes con sangrado relacionado con EVAG44. La antrectomía está reservada únicamente para los casos graves105.
Intestino delgadoLas complicaciones del intestino delgado en la ES son frecuentes y el duodeno es el más afectado (40-88%)106. Se cree que las alteraciones del intestino delgado son el resultado de lesiones histológicas progresivas similares a las de otros órganos en la ES. Sjögren propuso una progresión del daño basada en el compromiso vascular (grado 0), deterioro neurogénico (grado 1) y disfunción miogénica (grado 2) con reemplazo del músculo liso normal por fibrosis colágena y atrofia41. La dismotilidad del intestino delgado se debe a cambios neuropáticos y miopáticos por isquemia vascular y causa daño en los nervios, atrofia del músculo liso y finalmente fibrosis106. Esto contribuye al sobrecrecimiento bacteriano en el intestino delgado (SBID)107.
La seudoobstrucción intestinal crónica (POIC) se caracteriza por un mal funcionamiento de la motilidad gastrointestinal con síntomas y signos de obstrucción intestinal aguda y crónica en ausencia de oclusión mecánica108. La POIC por lo general es secundaria a atonía, dilatación y retraso en el tránsito dentro del intestino delgado, también puede ocurrir perforación debido a fibrosis serosa con pérdida de adherencia de la pared en la capa muscular101. Pueden desarrollarse divertículos yeyunales debido a protrusión de la pared intestinal101. Los rayos x pueden indicar su presencia y el contraste baritado muestra asas intestinales dilatadas y acumulación de alimentos55. Otros métodos de diagnóstico alternativos son la gammagrafía, la cápsula endoscópica o la enterografía107.
Para evitar las manifestaciones del intestino delgado es muy importante que los pacientes con ES mantengan una ingesta adecuada de líquidos y eviten los laxantes y los alimentos ricos en fibra, ya que estos pueden empeorar los síntomas29. En caso de dismotilidad del intestino delgado y POIC, el empleo de procinéticos también puede ser de utilidad. La octreotida y la cisaprida favorecen la motilidad duodenal81,109. La octreotida en combinación con eritromicina mejora el dolor abdominal y las náuseas109, pero su uso prolongado puede favorecer la aparición de colelitiasis y perforación intestinal110.
La presencia del SBID ocurre en 43-60% de los pacientes con ES y puede ocasionar náuseas, vómito, diarrea, distensión abdominal, hinchazón y signos relacionaos con malabsorción (pérdida de peso, esteatorrea, déficit de vitaminas)111. La severidad del SBID se puede correlacionar con la sintomatología107,112,113. El estándar de oro para el diagnóstico es el cultivo del aspirado yeyunal114, pero en la práctica clínica se utilizan otros análisis como la prueba de aliento para hidrógeno o metano115. El uso intermitente o rotativo de antibióticos puede ser de utilidad112,113.
La pneumatosis cystoides intestinalis se caracteriza por múltiples quistes con contenido de aire en la pared intestinal debido a la elevación de las presiones intraluminales causada por sobrecrecimiento bacteriano111. Es un hallazgo radiográfico raro con imágenes quísticas radiolúcidas debido a la presencia de aire en la submucosa o en la subserosa, para lo cual se recomienda un manejo conservador. Además, puede producir un neumoperitoneo en caso de ruptura13,116,117.
ColonEl compromiso del intestino grueso (20-50%) generalmente es asintomático118, pero la presencia de afectación cardiaca, pulmonar, renal o cutánea está relacionada con la presencia de síntomas colónicos13.
Los síntomas del intestino grueso probablemente son causados por una inflamación de la pared intestinal que produce atrofia muscular, fibrosis y dismotilidad. La hipomotilidad del colon puede ocasionar un retraso en el tiempo de tránsito intestinal y estreñimiento con un aumento del sobrecrecimiento bacteriano que puede producir diarrea malabsortiva119,120. La diverticulosis presenta un riesgo de ulceración e infección debido a la retención fecal, y durante la evolución de la enfermedad la pared intestinal se vuelve rígida, ocasionando una falsa resolución del divertículo121.
La seudoobstrucción crónica del intestino grueso es una complicación rara que se expresa en forma de náuseas, vómito, distensión y cambios en el ritmo deposicional, recomendándose un manejo conservador; la estimulación eléctrica o la cirugía deben ser utilizadas como último recurso terapéutico para la POIC13,120,121. En caso de estreñimiento de aparición reciente en pacientes con ES, son necesarios los estudios endoscópicos o de imágenes diagnósticas para excluir malignidad, estenosis, diverticulosis y otras enfermedades del colon120. El manejo es sintomático29,120 utilizando laxantes estimulantes77,122, además de otros fármacos que ayudan a tratar el estreñimiento como la metoclopramida, la domperidona y la prucaloprida99,122,123.
AnorrectalLos síntomas anorrectales se presentan en 50-70% de los pacientes y afectan al esfínter anal interno (EAI) produciendo incontinencia fecal, estreñimiento y prolapso rectal124. El compromiso del EAI puede deberse a una patología primaria de los músculos o neuronas o ser secundario a isquemia/inflamación de la pared anorrectal7,125. La disminución del reflejo inhibitorio anorrectal es una evidencia adicional de deterioro de los nervio periféricos en ES126. El estreñimiento y el prolapso rectal se producen a medida que la enfermedad progresa causando alteraciones en la relajación y restricción en la distensión127. Los estudios manométricos muestran una inhibición del reflejo anorrectal y presiones de compresión normales128, la ecografía endoanal o la resonancia magnética rectal también pueden evaluar la integridad y las anomalías estructurales129,130. Las recomendaciones dietéticas pueden mejorar la motilidad intestinal y la integridad del EAI, incluyendo la incontinencia fecal; los antidiarreicos pueden ser útiles, pero deben usarse con cuidado ya que pueden exacerbar el estreñimiento e inducir un prolapso rectal13. La estimulación del nervio sacro mejora los síntomas, pero no hay evidencia a largo plazo122.
HígadoLa enfermedad hepática en ES es rara (1,5% de los pacientes) y la CBP es la afectación más frecuente44. De hecho, la ES es la enfermedad autoinmune sistémica que más se asocia con CBP (7-17%)131. La ESlc está más asociada132-135, al igual que la presencia de anticuerpos anticentrómero (AAC)136,137. Los anticuerpos antimitocondriales (AAM) están presentes hasta en un 94% de los pacientes con CBP asociada a ES32,138,139. Se ha observado la presencia de AAM hasta en 13 y 3% de los pacientes con ESlc y ESdc, respectivamente, sin presentar una clara relación con CBP subyacente29.
Los pacientes son por lo general asintomáticos y el diagnóstico se hace por una elevación inexplicada de la fosfatasa alcalina hepática y la presencia de AAM140. Los anticuerpos anti-gp210 y anti-sp100 aumentan la sensibilidad hasta el 100%29. La biopsia hepática solo es necesaria para el diagnóstico cuando no hay anticuerpos específicos para CBP29.
El ácido ursodesoxicólico (AUDC) sigue siendo el tratamiento de elección para la CBP, y se recomienda el trasplante de hígado en pacientes con la enfermedad en etapa tardía. Se ha demostrado que la prednisona y la budesonida mejoran la histología en una etapa temprana, pero no hay estudios a largo plazo. El sulindaco y el benzofibrato mejoran la función hepática en grupos limitados de pacientes con una respuesta incompleta al AUDC140. Los pacientes con CBP y ES han mostrado una progresión más lenta en comparación con los pacientes con CBP aislada141. En los pacientes con ES y CBP se recomienda la monitorización cada uno o dos años con pruebas de función hepática141. La hepatitis autoinmune es rara y por lo general se asocia con una ESlc142,143. Otras enfermedades hepáticas relacionadas con la ES son: hiperplasia nodular regenerativa, hipertensión portal idiopática, rotura espontánea del hígado, infarto hepático masivo y obstrucción del conducto hepático relacionada con vasculitis144.
PáncreasLa enfermedad pancreática en ES es rara y a veces se puede confundir con SBID32,145. En caso de sospecha de SBID, se debe descartar una insuficiencia pancreática si no hay respuesta después de iniciar los antibióticos146. También se han reportado casos de necrosis pancreática, pancreatitis aguda hemorrágica y pancreatitis crónica147.
ConclusionesEl compromiso gastrointestinal es común en la ES y puede afectar a todo el tracto digestivo. El esófago es el área más comprometida. Pueden aparecer diversas manifestaciones clínicas, las cuales tienen un gran impacto en la calidad de vida de los pacientes. Se recomienda la evaluación del esófago por manometría en todos los pacientes con ES y el uso de otras herramientas para determinar el compromiso gastrointestinal depende de las diferentes manifestaciones clínicas que presentan los pacientes. El manejo se basa en medidas higienico-dietéticas, así como en el tratamiento de los diferentes síntomas. Es importante identificar la afección gastrointestinal para prevenir complicaciones a largo plazo, así como para excluir las causas de los síntomas no relacionados con la ES.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.