La esclerosis sistémica es una enfermedad autoinmune generalizada que se caracteriza por vasculopatía, inflamación, depósito de colágeno y fibrosis en la piel y órganos internos. Las complicaciones renales son comunes y con un amplio espectro e incluyen crisis renal esclerodérmica, función renal anormal, proteinuria, enfermedad vascular renal crónica, daño renal por fármacos nefrotóxicos, nefropatía por oxalato de calcio, glomerulonefritis y vasculitis asociadas a anticuerpos contra el citoplasma de los neutrófilos. La alteración renal permanece siendo una causa importante de morbilidad y mortalidad en la esclerodermia. El objetivo de esta revisión narrativa es describir las complicaciones renales de esta enfermedad.
Systemic sclerosis (SSc) is a systemic autoimmune disease characterized by vasculopathy, inflammation, collagen deposits and fibrosis in the skin and internal organs. Renal complications are common in SSc. The spectrum of renal complications in systemic sclerosis includes scleroderma renal crisis (SRC), abnormal renal function, proteinuria, renal chronic vascular disease, kidney injury from nephrotoxic drugs, oxalate calcium nephropathy, glomerulonephritis and vasculitis associated to anti-neutrophil cytoplasmic antibody. Renal involvement remains an important cause of morbidity and mortality in scleroderma. The objective of this review is to describe the renal complications of scleroderma.
La esclerosis sistémica (ES) es una enfermedad autoinmune sistémica caracterizada por vasculopatía, inflamación, depósitos de colágeno y fibrosis en la piel y en órganos internos tales como el corazón, los pulmones, el tracto gastrointestinal y los riñones1-3. Las complicaciones renales son comunes en la ES4. La enfermedad renal crónica (ERC) puede ocurrir, paro también se encuentra hipertensión arterial, función renal anormal o proteinuria hasta en 60% de los pacientes5. Además, entre el 5 y el 15% de los pacientes presentan crisis renal esclerodérmica (CRE), que es la complicación más grave de la ES1. Antes del advenimiento de los inhibidores de la enzima convertidora de la angiotensina (IECA), la supervivencia de la CRE a corto plazo era inferior al 10%6. La CRE se define como la nueva aparición de hipertensión arterial acelerada o de insuficiencia renal oligúrica rápidamente progresiva durante la ES7.
El objetivo de esta revisión es describir las complicaciones renales de la esclerodermia. Se hizo una revisión de la literatura en las siguientes bases de datos: Medline (plataforma PubMed®), Library Science Database (plataforma ProQuest®), EMBASE (plataforma ProQuest®), con los términos de búsqueda en inglés: scleroderma, systemic sclerosis, systemic scleroderma, scleroderma renal, limited scleroderma, diffuse scleroderma, limited systemic scleroderma. Las búsquedas se realizaron hasta abril de 2019.
Crisis renal esclerodérmicaLa CRE por lo general se presenta con hipertensión arterial severa a menudo descrita como acelerada o maligna, e insuficiencia renal aguda (IRA). Es una de las complicaciones más graves de la ES, ocurriendo aproximadamente en 5-15% de los casos, de los cuales el 2% se presenta en la variedad localizada (ESlc) y el 12% en la difusa (ESdc)8. Por otra parte, la hipertensión arterial no maligna sin uremia y anomalías en la orina o uremia leve atribuible a otros factores, en ausencia de CRE, son comunes en la ES y no deben confundirse con la CRE9.
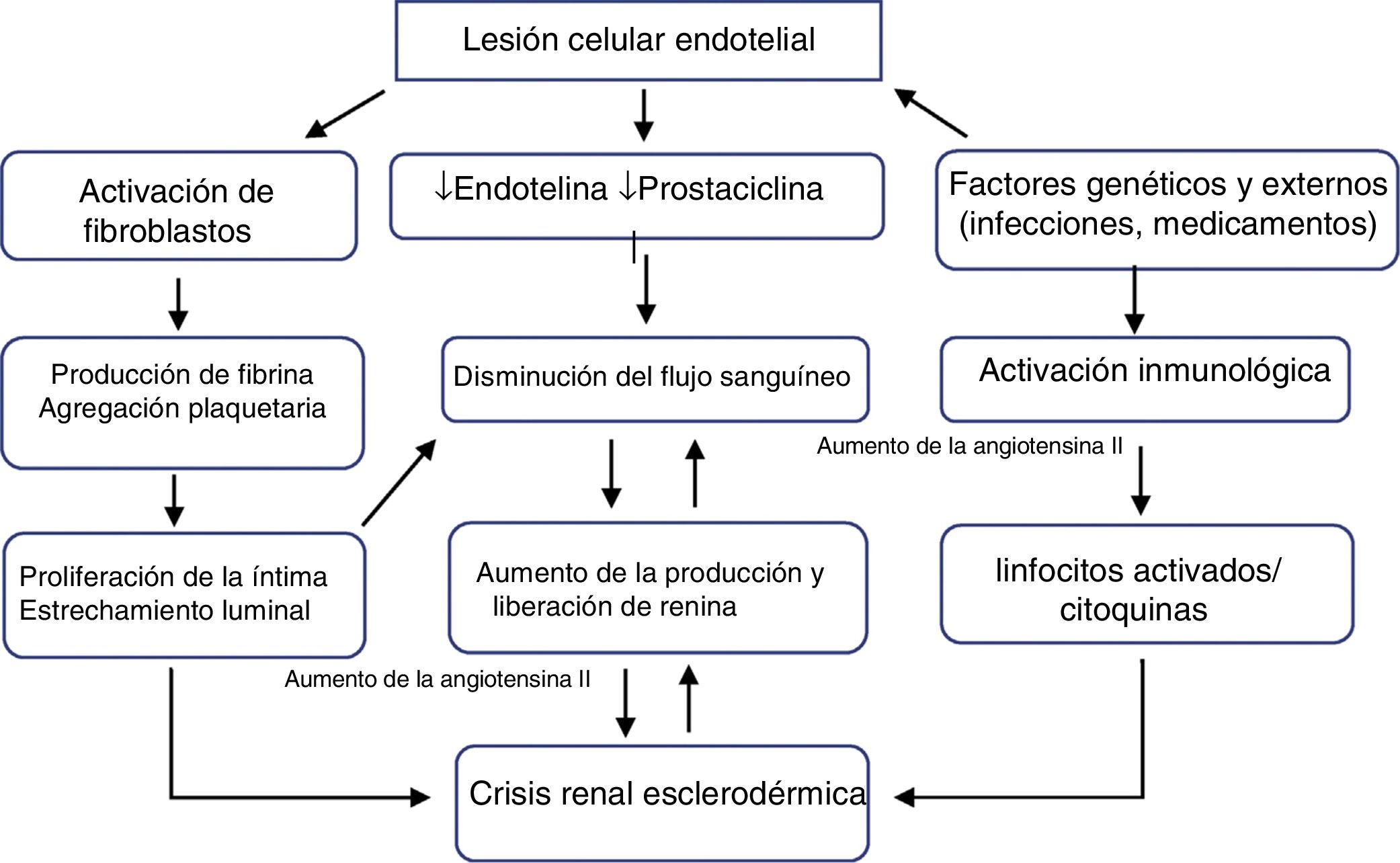
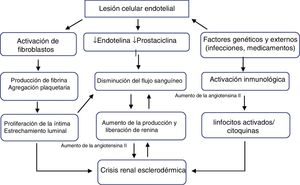
FisiopatologíaEl proceso primario es la lesión de las células endoteliales, que produce engrosamiento de la íntima y proliferación de arterias arqueadas e interlobulares. El engrosamiento anormal de las paredes de los vasos permite la agregación y adhesión de las plaquetas. La liberación de factores plaquetarios aumenta la permeabilidad vascular y puede participar en la producción de un aumento de la deposición de colágeno y fibrina que contribuyen al estrechamiento luminal (fig. 1). Estos vasos arteriales estrechados generan una disminución de la perfusión renal, particularmente del flujo sanguíneo cortical, que sumada al vasoespasmo episódico denominado «el fenómeno de Raynaud renal», demostrado en los primeros estudios clásicos de Cannon et al.10, disminuye la perfusión del aparato yuxtaglomerular, generando su hiperplasia11, y promoviendo una marcada liberación de renina plasmática, con activación del sistema renina-angiotensina-aldosterona y producción de angiotensina ii que es un potente vasoconstrictor directo del músculo liso vascular, induciendo hipertensión maligna e insuficiencia renal rápidamente progresiva12.
La evidencia reciente mostró que diferentes fragmentos derivados de la matriz extracelular desempeñan un papel en el proceso de remodelación vascular, ya que está estrictamente relacionado con la apoptosis de las células endoteliales13. También se ha demostrado que el aumento de los niveles de endotelina-114, moléculas de adhesión vascular solubles y E-selectina soluble15 se asocia con la crisis renal.
Aunque se sospechaba que factores hormonales como las catecolaminas, las cininas y las prostaglandinas están involucrados en la patogénesis, solo unos pocos datos respaldan esta hipótesis, sugiriendo que la fisiopatología de la crisis renal se debe principalmente a la disfunción de los factores que controlan la circulación renal16, de modo que la CRE es el resultado de situaciones en las que el flujo sanguíneo renal está comprometido como en la disfunción cardíaca17,18, el embarazo y alteraciones del volumen y el flujo sanguíneo19.
Medicamentos como los corticoesteroides han estado implicados durante años en el desarrollo de la CRE20. Una revisión sistemática21 encontró una fuerte asociación entre altas dosis de prednisona y crisis renal, pero no se conoce la relación fisiopatológica exacta, aunque se sabe que hay un deterioro de la función endotelial e inhibición de la producción de prostaciclina, lo que aumenta la actividad de la enzima convertidora de angiotensina.
Los pacientes con mayor probabilidad de recibir esteroides son aquellos con enfermedad inflamatoria temprana que tienen un mayor riesgo de presentar CRE. La severidad de la enfermedad y las intervenciones concomitantes pueden ser confusas. Pero se recomienda actuar con precaución al comenzar los corticoesteroides, especialmente a dosis altas y en pacientes con esclerodermia difusa temprana. Otros medicamentos que causan vasoespasmo y que se han asociado con crisis renales son la ciclosporina22 y el tacrolimus23.
Predictores de crisis renal esclerodérmicaLos factores predictivos de una futura CRE incluyen el compromiso difuso de la piel, enfermedad temprana con síntomas durante menos de cuatro años, progresión rápida del engrosamiento de la piel, presencia de anticuerpos anti-ARN polimerasa iii, nuevos eventos cardíacos (derrame pericárdico, insuficiencia cardíaca congestiva o arritmias), anemia de inicio reciente y una historia de altas dosis de corticoesteroides (más de 15 mg de prednisona diarios)7, como el principal factor modificable10,24. Las razones de probabilidad (odds ratio) para el desarrollo de CRE asociadas con exposición a corticosteroides en los últimos uno o tres meses se han estimado en 24 (IC 95% 3,0-193,8) y 17 (IC 95% 2,1-144,0), respectivamente25. Por el contrario, la historia de hipertensión arterial no suele asociarse con el desarrollo de CRE26.
Manifestaciones clínicasLa CRE se caracteriza por el inicio agudo de hipertensión arterial severa, a menudo descrita como acelerada o maligna con IRA13. Los pacientes presentan características que se ven en la hipertensión acelerada por cualquier causa: cefalea, retinopatía hipertensiva con visión borrosa, u otros síntomas encefalopáticos, incluyendo convulsiones. Otras manifestaciones clínicas son la anemia hemolítica microangiopática (aproximadamente 50% de los casos), insuficiencia cardíaca, edema pulmonar (debido a un aumento de la postcarga) y oliguria que puede dar lugar a retención de sal y agua. La presencia de pericarditis, miocarditis y arritmias condiciona un peor pronóstico27. Cerca del 10% de estos pacientes pueden tener una presión arterial normal. Sin embargo, la presión arterial es probablemente alta en comparación con su presión arterial basal28. Además, se ha estimado que en 20% de los pacientes, la CRE precede al diagnóstico de ES29.
Las anomalías de laboratorio frecuentes incluyen un aumento de la creatinina sérica (aunque en los individuos con creatinina basal baja, los niveles séricos pueden permanecer en el rango normal de referencia), anemia hemolítica microangiopática, trombocitopenia (por lo general no menos de 50.000/mm3), y altos niveles de renina (30-40 veces más alta que la normal). El uroanálisis puede mostrar hematuria microscópica y cilindros granulosos con proteinuria en rango no nefrótico (por lo general menos de 1 g/24 h)2,30.
HistopatologíaMacroscópicaA menudo están presentes múltiples hemorragias petequiales sobre la superficie de los riñones afectados. El corte seccional revela infartos pequeños en forma de cuña y focos de necrosis cortical. Estos cambios son inespecíficos y se pueden observar en otros trastornos microangiopáticos trombóticos, síndrome urémico hemolítico, púrpura trombocitopénica trombótica, hipertensión maligna idiopática o en asociación con algunos medicamentos31.
MicroscópicaLas manifestaciones histológicas pueden variar durante el curso de la enfermedad y los cambios vasculares tempranos se pueden manifestar como exceso de material mixoide en la íntima, trombosis o necrosis fibrinoide. Más tarde se desarrollan lesiones «en piel de cebolla», mientras que la esclerosis fibroíntima, con o sin fibrosis de la adventicia, puede ser la única manifestación de daño crónico o el resultado de episodios previos de IRA32. A menudo se desarrollan cambios glomerulares agudos como resultado de la lesión vascular y la reducción de la perfusión renal. Los cambios glomerulares primarios están relacionados con la lesión endotelial glomerular y pueden manifestarse como edema endotelial y trombosis capilar glomerular, aunque esta última es relativamente poco frecuente33. En contraste con el síndrome urémico hemolítico y la púrpura trombocitopénica trombótica, los cambios primarios de los vasos pequeños predominan sobre las alteraciones glomerulares34. Los trombos en los vasos pequeños superan a los trombos glomerulares, mientras que en el síndrome urémico hemolítico y la microangiopatía trombótica se encuentra lo contrario35.
InmunofluorescenciaSe puede observar una tinción no específica para inmunoglobulina M y C3. La tinción de fibrinógeno puede estar presente en los glomérulos y las arterias asociadas con necrosis fibrinoide o microangiopatía trombótica aguda36.
Microscopía electrónicaHay edema endotelial y expansión de la lámina rara interna. La duplicación de la membrana basal glomerular con interposición celular está presente en las etapas crónicas36.
PronósticoEl uso de los IECA ha cambiado dramáticamente la supervivencia de los pacientes con CRE, ya que antes del uso de estos medicamentos los pacientes casi siempre fallecían y solo un 10% sobrevivía el primer año7. Un estudio que incluyó 145 pacientes tratados con un inhibidor de la ECA encontró que 89 pacientes (61%) tuvieron buenos resultados que se definieron como no requerir diálisis o solo requerir diálisis temporal, 55 (38%) no requirieron diálisis y 34 (23%) requirieron diálisis transitoria; 56 (38%) pacientes experimentaron malos desenlaces, 28 (19%) sobrevivieron con diálisis y 28 (19%) fallecieron en los primeros seis meses27.
Los factores asociados con un mal desenlace son la edad avanzada, sexo masculino, insuficiencia cardíaca congestiva, presión arterial controlada en forma inadecuada y un nivel inicial de creatinina sérica mayor a 270 mmol/L37. La exposición a la prednisona al inicio de la CRE se asoció con un aumento significativo del riesgo de muerte. Hudson et al. estimaron un riesgo de muerte 4% mayor por cada miligramo de prednisona recibido por el paciente38. El tratamiento oportuno y apropiado es esencial para evitar la diálisis y mejora significativamente el pronóstico de estos pacientes39.
El pronóstico de la CRE normotensiva es peor que en pacientes hipertensos con altas tasas de mortalidad e insuficiencia renal. La ausencia de hipertensión arterial es un mensaje de alerta en la crisis renal, ya que puede retardar el diagnóstico y el tratamiento, dando lugar a una progresión de la enfermedad40.
Trasplante renalLa enfermedad renal terminal se puede desarrollar hasta en 45-55% de los pacientes, incluso cuando la CRE es reconocida y tratada rápidamente29,41,42. El trasplante renal es una opción razonable para estos pacientes y puede ofrecer una ventaja de supervivencia sobre la diálisis crónica43. Los pacientes con enfermedad renal terminal debida a CRE tienen una peor supervivencia en comparación con los pacientes con otras patologías. El registro ANZDATA informó que solo el 10% de estos pacientes pudieron interrumpir la diálisis después de un período promedio de 14 meses43.
Existen reportes de recurrencia de CRE en trasplantes de riñón (estimada en alrededor del 20-50%) de donantes cadavéricos o vivos, incluyendo gemelos44. El trasplante renal con aloinjerto se puede asociar con la aparición temprana de insuficiencia renal debida a CRE, que puede ser anunciada por algunos marcadores de empeoramiento de la esclerodermia tales como engrosamiento progresivo de la piel, anemia y complicaciones cardíacas2.
Otras complicaciones renales en esclerodermiaEn 50% de los pacientes asintomáticos se encontraron marcadores clínicos sugestivos de enfermedad renal, tales como proteinuria, elevación de la creatinina e hipertensión arterial. También se encontró enfermedad vascular renal crónica, daño renal por medicamentos nefrotóxicos (incluyendo la ciclosporina y la D-penicilamina), nefropatía por oxalato de calcio, glomerulonefritis y vasculitis asociada a anticuerpos anticitoplasma de neutrófilos (tabla 1)5,13.
Características clave de las complicaciones renales de la esclerodermia
| - Crisis renal esclerodérmica: por lo general se presenta con hipertensión arterial severa que suele describirse como acelerada o maligna, y daño renal agudo. |
| - Nefropatía por oxalato de calcio: se asocia comúnmente con enfermedades que afectan la absorción en el intestino delgado. |
| - Hipertensión arterial aislada: puede ser una complicación o una comorbilidad. |
| - Glomerulonefritis y vasculitis asociadas con anticuerpos anticitoplasma de neutrófilos: a diferencia de la CRE, esta manifestación se desarrolla en pacientes con ESlc prolongada. |
| - Enfermedad renal crónica: parece tener un pronóstico benigno en la ESdc. |
| - Enfermedad renal asociada a la penicilamina: 20% de los pacientes con ES tratados con D-penicilamina. |
| - Reducción de la reserva funcional renal: se correlaciona con las manifestaciones vasculopáticas y el pronóstico en la esclerodermia. |
| - Proteinuria aislada: detectada en aproximadamente un tercio de los pacientes con ES. |
La nefropatía por oxalato en ES es una causa de lesión tubular renal aguda que se asocia comúnmente con situaciones que afectan la absorción en el intestino delgado45-47. La fisiopatología común requiere una malabsorción crónica de las grasas de la dieta en el intestino delgado, con una absorción colónica relativamente conservada. El aumento de los ácidos grasos luminales en el intestino delgado desplaza el calcio del oxalato dejándolo libre para ser absorbido fácilmente a nivel del colon. Este oxalato es filtrado posteriormente en el glomérulo e intercambiado en los túbulos proximales, se precipita, e induce una mayor inflamación o necrosis de las células epiteliales tubulares48-50.
El pronóstico es malo en los pacientes que desarrollan nefropatía por oxalato; sin embargo, la duración de la lesión renal, el grado de enfermedad intestinal, y el estado funcional y nutricional de los pacientes también definen los desenlaces clínicos. El reconocimiento temprano de los pacientes en riesgo es crítico ya que el establecimiento de una dieta baja en oxalato puede ayudar a prevenir esta complicación. Las funciones del uso temprano de agentes procinéticos, antibióticos para el SBID (sobrecrecimiento bacteriano en el intestino delgado), suplementos de calcio y magnesio y probióticos todavía están por definirse en futuros estudios prospectivos de pacientes en riesgo con esclerosis sistémica45.
Hipertensión arterial aisladaLos pacientes con ES también presentan hipertensión arterial asociada. No está claro si la hipertensión es una comorbilidad o una manifestación de vasculopatía renal. En un estudio que incluyó a 561 pacientes con ES (de los cuales el 60% tenía ESlc) y una duración media de la enfermedad de 10,9 ± 8,8 años, 23% de quienes tenían una función renal normal y 43% de aquellos que tenían una función renal anormal al inicio del estudio, presentaron hipertensión después de más de dos años de seguimiento. En contraste, en la cohorte de la Universidad de Pittsburgh, solo el 12% de los 675 pacientes con ESdc, a quienes se les hizo seguimiento entre 1972 y 1993, tenían hipertensión51. La mitad de estos pacientes desarrollaron hipertensión en un promedio de 6,9 años antes de ser diagnosticados con ES, mientras que los demás pacientes desarrollaron hipertensión en un promedio de 4,7 años después del diagnóstico de ES; sin embargo, el 61% de estos pacientes recibieron glucocorticoides antes de la aparición de la hipertensión, lo que sugiere que este tratamiento podría ocasionar hipertensión. Por lo tanto, en estos estudios no hay evidencia de que la hipertensión per se esté asociada con el desarrollo de la CRE1.
Glomerulonefritis asociada a anticuerpos anticitoplasma de neutrófilos en esclerodermiaA diferencia de la CRE, esta manifestación se desarrolla en pacientes con ESlc prolongada. No se conoce la prevalencia, pero se han reportado aproximadamente 40 casos en la literatura en inglés52-57. La vasculitis asociada a ANCA (VAA) en el contexto de la ES es más frecuente en la quinta y sexta década de la vida (edad promedio 57 años, rango 19-82) y la proporción hombre mujer es 1:4, similar a la distribución general por sexos en pacientes con ES. La duración promedio de la ES hasta el inicio de la vasculitis asociada con ANCA es de aproximadamente nueve años. La mayoría de los pacientes sufrían de la variante difusa (57%), mientras que aproximadamente 38% tenían la variante limitada.
Se ha postulado que la vasculopatía esclerodérmica exacerba la interacción de los anticuerpos anticitoplasma de neutrófilos (ANCA) con el endotelio cercano al polo vascular y la consecuente activación de neutrófilos en el glomérulo5.
Típicamente, los pacientes presentan glomerulonefritis crescéntica, insuficiencia renal progresiva, hipertensión leve y proteinuria. Además, se ha reportado hemorragia pulmonar asociada24.
En algunos casos se identifica la reactividad clásica contra la proteinasa-3 (PR3) o la mieloperoxidasa (MPO), mientras que en otros, la reactividad atípica de los ANCA se demuestra únicamente mediante tinción con inmunofluorescencia55. Se ha sugerido que se deben realizar pruebas de ANCA en todos los pacientes con sospecha de CRE, ya que la vasculitis puede ser un diagnóstico diferencial importante para la CRE normotensiva56.
Estudios sobre la incidencia de anticuerpos ANCA en pacientes no seleccionados con ES han demostrado que es de 0-12%, pero en estos pacientes tanto la MPO como la PR3 se pueden identificar mediante ELISA57. Hasta el 13% de los pacientes con ES fueron positivos para MPO por ELISA, pero fueron negativos para ANCA por inmunofluorescencia. La manifestación clínica más frecuente (83%) de la VAA fue la glomerulonefritis rápidamente progresiva (GNRP), 28% sufrieron de hemorragia alveolar, 13% de vasculitis necrosante que dio lugar a isquemia de extremidades y 10% de erupción cutánea vasculítica57. De manera similar a la vasculitis asociada con ANCA en los pacientes con esclerodermia, esta complicación requiere terapia con altas dosis de esteroides del tipo de la metilprednisolona, 500-1.000 mg intravenosos diarios por tres dosis, seguida de prednisona oral 1 mg/kg/día (máximo 80 mg), con una reducción progresiva hasta suspenderla en 3-4 meses, más ciclofosfamida a una dosis de 15 mg/kg (máximo 1,2 g) cada dos semanas para los tres primeros pulsos, seguida de infusiones cada tres semanas para los siguientes 3-6 pulsos. En algunos casos refractarios se agregó la plasmaféresis. Hay informes de casos que sugieren la efectividad del rituximab para la glomerulonefritis asociada con ANCA en la esclerodermia57.
Proteinuria aisladaLa excreción urinaria de albúmina es por lo general reconocida como un marcador de daño vascular renal y un predictor de morbimortalidad cardiovascular independiente de otras comorbilidades, tales como diabetes e hipertensión58. La albuminuria o proteinuria clínicamente relevante se detecta en casi un tercio de los pacientes con ES e indica no solo enfermedad vascular renal, sino también enfermedad vascular sistémica que se asocia con una mayor morbimortalidad. Se presentó microalbuminuria y proteinuria tubular en 50 (45%) de 112 pacientes evaluados, pero muchos de estos pacientes tenían insuficiencia renal, por lo tanto, no se encontró asociación entre la función renal y la proteinuria microscópica29. Se requieren estudios adicionales para determinar si la intervención, por ejemplo con inhibidores de la ECA, mejora los desenlaces1.
Reducción de la tasa de filtración glomerularEn un estudio longitudinal canadiense en más de 400 pacientes con ES seguido de una mediana de dos años con medición de la función mediante la tasa de filtración glomerular (TFG), se observó una ligera disminución asociada con comorbilidades tales como hipertensión y diabetes mellitus, comparable a la de la población general. La reducción de la TFG no parece ser progresiva en la mayoría de los pacientes con ES y no predice el inicio de la CRE51.
Enfermedad renal crónica en esclerodermiaLos pacientes sin crisis renal previa pueden presentar una reduplicación de fibras elásticas, glomérulos esclerosados, atrofia tubular y fibrosis intersticial, lo que probablemente refleja cambios crónicos en la esclerodermia. Kingdon et al. mostraron una reducción de la TFG en casos de esclerosis sistémica sin crisis renal59. La enfermedad renal crónica, por lo tanto, parece tener un pronóstico benigno en la ESdc. Es probable que existan otras causas de insuficiencia renal en los casos de ES, incluyendo las causas prerrenales (asociadas con compromiso arterial pulmonar y cardíaco) y medicamentos29. Aunque la D-penicilamina rara vez se utiliza en ES en la actualidad, aproximadamente 20% de los pacientes desarrollan glomerulonefritis membranosa y proteinuria que mejoran con la suspensión de la medicación. Sin embargo, en los casos severos se requieren esteroides, plasmaféresis e inmunosupresión. De acuerdo a los casos reportados en la literatura, esta complicación tiene una tasa de mortalidad de aproximadamente 40%5.
Reducción de la reserva funcional renalEn 21 pacientes con ES se describió una marcada reducción de la reserva funcional renal (RFR) comparada con los controles sanos (1,9 ± 18,6% vs. 34,8 ± 13,9%, p < 0,00)60. En un estudio posterior de 28 pacientes con ES, 13 de 19 pacientes con RFR de menos del 10% al inicio del estudio experimentaron una disminución de la depuración de creatinina mayor de 2 mL/min/1,73 m2 por año en cinco años de seguimiento, con una depuración final de creatinina de menos de 70 mL/min/1,73 m2 en ocho pacientes. Diez pacientes desarrollaron hipertensión sistémica (grado 1 o 2) y dos desarrollaron albuminuria. Ningún paciente con RFR basal normal (n = 9) desarrolló proteinuria o hipertensión60.
Tratamiento de la crisis renal esclerodérmicaFavor de remitirse a una sección específica del suplemento dedicada a este tema.
ConclusiónLa enfermedad renal es una causa importante de morbimortalidad en la ES. A pesar de que la CRE ha sido una de las complicaciones más temidas de la esclerodermia, es posible que se presenten muchas otras afecciones renales diferentes incluyendo función renal anormal, enfermedad vascular renal crónica, lesión renal por medicamentos nefrotóxicos, nefropatía por oxalato de calcio, glomerulonefritis y vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.