El ajo en México es uno de los cultivos de hortalizas más rentables, más del 83% de esta superficie es aportada por los estados de Zacatecas, Guanajuato, Sonora, Puebla, Baja California y Aguascalientes.
La pudrición basal ocasionada por Fusarium spp. se encuentra ampliamente distribuida a nivel mundial; esta enfermedad se ha convertido en una limitante en zonas productoras de cebolla y ajo, no solo en México, sino también en otros países, En México, se ha informado la presencia de Fusarium oxysporum en plantas en Guanajuato y en semillas de ajo en Aguascalientes. En el estado de Morelos se ha reportado la presencia de Fusarium culmorum en cultivares de cebolla. Asimismo, en Aguascalientes se tienen antecedentes de otras especies como Fusarium proliferatum, Fusarium verticillioides, Fusarium solani y Fusarium acuminatum. Para este trabajo se planteó como objetivo identificar las especies de Fusarium encontradas en los estados de Zacatecas, Guanajuato y Aguascalientes, y evaluar su patogenicidad. Se realizaron recolectas de plantas con síntomas de la enfermedad en los estados antes mencionados. De los muestreos realizados se identificaron las especies F. oxysporum, F. proliferatum, F. verticillioides, F. solani y F. acuminatum; las cepas de Aguascalientes identificadas como AGS1A (F. oxysporum), AGS1B (F. oxysporum) y AGSY-10 (F. acuminatum) fueron las que presentaron bajo condiciones de invernadero un mayor índice de severidad.
Garlic in Mexico is one of the most profitable vegetable crops, grown in almost 5,451ha; out of which more than 83% are located in Zacatecas, Guanajuato, Sonora, Puebla, Baja California and Aguascalientes.
Blossom-end rot caused by Fusarium spp is widely distributed worldwide and has been a limiting factor in onion and garlic production regions, not only in Mexico but also in other countries. The presence of Fusarium oxysporum has been reported in Guanajuato and Aguascalientes. Fusarium culmorum has been reported in onion cultivars of Morelos; and Fusarium proliferatum, Fusarium verticillioides, Fusarium solani and Fusarium acuminatum have been previously reported in Aguascalientes. The goal of this work was identifying the Fusarium species found in Zacatecas, Guanajuato and Aguascalientes, to assess their pathogenicity. Plants with disease symptoms were collected from hereinabove mentioned States. The samples resulted in the identification of: F. oxysporum, F. proliferatum, F. verticillioides, F. solani and F. acuminatum species; out of which Aguascalientes AGS1A (F. oxysporum), AGS1B (F. oxysporum) and AGSY-10 (F. acuminatum) strains showed higher severity under greenhouse conditions.
El ajo en México es uno de los cultivos de hortalizas más rentables, existen aproximadamente 5.451 de ha cultivadas; más del 83% de esta superficie es aportada por los estados de Zacatecas, Guanajuato, Sonora, Puebla, Baja California y Aguascalientes23. México se ubica como el vigésimo segundo país productor de ajo10.
Entre las principales enfermedades de origen fúngico que causan daños de importancia económica al cultivo se destacan la pudrición blanca (ocasionada por Sclerotium cepivorum Berk); sin embargo, también se presentan enfermedades causadas por cepas de Botrytis spp., Sclerotium rolsfii, Penicillium spp. y Fusarium spp.27; esta última ha tenido mayor incidencia durante los últimos años26.
Fusarium es un género que cuenta con especies patogénicas y especializadas, responsables de enfermedades en cultivos específicos14. La pudrición basal ocasionada por Fusarium spp. se encuentra ampliamente distribuida a nivel mundial y se ha convertido en una limitante en zonas productoras de cebolla y ajo13. Los muestreos en parcelas cultivadas con ajo perla y ajo morado permitieron concluir que Fusarium spp. fue el agente causal de la pudrición basal. Esta afección se manifiesta con coloraciones café en las puntas de las hojas, las que se van tornando rojizas o púrpuras cuando el patógeno logra extenderse hasta la base de las hojas. También puede haber enanismo en la planta, los bulbos esponjosos y tallos de consistencia blanda y raíces con coloraciones de color café a rojo26. Algunas de las sintomatologías antes mencionadas han sido reportadas en plantas infectadas con Fusarium oxysporum, Fusarium proliferatum, Fusarium culmorum, Fusarium solani y Fusarium acuminatum en Estados Unidos, Turquía, Venezuela, Uruguay, Países Bajos, Japón, Serbia, España y México3,4,6,9,11,15,17,19,21,25. La pudrición basal del bulbo de cebolla (agente causal: F. oxysporum f. sp. cepae) y del ajo (agente causal: F. culmorum)24 pueden manifestarse en forma de daños por damping-off o una reducción en la germinación de la semilla6; los daños causados pueden llevar a una merma de rendimientos del 40%24.
En muestreos de semillas de ajo originarias de Aguascalientes, México, Ochoa et al.19 identificaron morfológica y molecularmente —mediante ITS— F. oxysporum, F. solani, F. acuminatum y F. verticillioides, mas no se evaluó la patogenicidad de las cepas encontradas. Para este trabajo se plantearon como objetivos identificar las especies de Fusarium halladas en los estados de Zacatecas, Guanajuato y Aguascalientes, así como evaluar la patogenicidad de cada una de las especies encontradas.
Materiales y métodosMuestreoLa recolecta del material se realizó en los estados de Zacatecas, Guanajuato y Aguascalientes; en este último se realizó en el mes de enero del 2013 y en los 2 primeros en marzo de ese año (tabla 1). Se recolectaron de cada una de las parcelas 12 plantas con síntomas de la enfermedad y 3 aparentemente sanas, para descartar que existieran plantas asintomáticas.
Origen de las muestras
| Número de localidad | Estado | Municipio | Coordenadas | |
|---|---|---|---|---|
| Norte | Este | |||
| 1 | Zacatecas | Veta Grande | 22° 53’ 383 | 102° 25’ 304 |
| 2 | Zacatecas | Guadalupe 1 | 22° 56’ 526 | 102° 21’ 593 |
| 3 | Zacatecas | Guadalupe 2 | 23° 00’ 057 | 102° 19’ 060 |
| 4 | Zacatecas | Villa de Cos 1 | 23° 00’ 556 | 102° 18’ 384 |
| 5 | Zacatecas | Villa de Cos 2 | 23° 10’ 657 | 102° 25’ 627 |
| 6 | Zacatecas | Panuco | 23° 02’ 626 | 102° 27’ 085 |
| 7 | Zacatecas | Fresnillo | 23° 08’ 913 | 102° 43’ 126 |
| 8 | Zacatecas | Calera 1 | 23° 06’ 413 | 102° 39’ 503 |
| 9 | Zacatecas | Calera 2 | 22° 57’ 725 | 102° 43’ 405 |
| 10 | Zacatecas | Gral. Enrique Estrada | 23° 02’ 770 | 102° 42’ 256 |
| 11 | Guanajuato | Comonfot | 20° 42’ 232 | 100° 49’ 981 |
| 12 | Guanajuato | Celaya | 20° 34’ 839 | 100° 49’ 400 |
| 13 | Guanajuato | Cortazar 1 | 20° 26’ 972 | 101° 00’ 732 |
| 14 | Guanajuato | Cortazar 2 | 20° 27’ 871 | 100° 59’ 220 |
| 15 | Aguascalientes | Rincón de Romos | 22° 14’ 071 | 102° 17’ 135 |
| 16 | Aguascalientes | Rincón de Romos | 22° 12’ 098 | 102° 15’ 977 |
| 17 | Aguascalientes | Rincón de Romos | 22° 13’ 235 | 102° 15’ 439 |
Se realizaron pequeños cortes de la zona de avance de la infección, donde el patógeno podría encontrarse en activo desarrollo (raíces con tejido con coloración café o rojiza), el material muestreado se desinfectó con hipoclorito sodio al 1% durante 3 min, se enjuagó en 3 ocasiones con agua destilada estéril y se sembró en placas de Petri con medio PDA (Bioxon®) adicionado con ácido láctico (200μl de ácido láctico al 85%). Las placas fueron incubadas a 27±2°C durante 7 días. Los cultivos puros en PDA fueron incubados a 27±2°C.
Identificación a nivel de géneroEsta se basó en la estructura y la composición de las conidias, las fiálides y las clamidosporas descriptas en las claves de Barnett y Hunter2, y Nelson et al.18.
Obtención de cultivos monoconidialesLuego de la identificación a nivel de género, se elaboraron cultivos monoconidiales con una suspensión de conidios, que fue dispersada en placas con medio PDA. A las 24h, 4 conidios germinados fueron transferidos a PDA. Las colonias monoconidiales fueron transferidas al medio de cultivo Spezieller Nährstoffmmarmer agar (SNA, 1g de KH2PO4, 1g de KNO3, 0,5g de MgSO4·7H2O, 0,5g de KCl, 0,2g de glucosa, 0,2g de sacarosa y 20g de agar en un litro de agua destilada) y mantenidas para su conservación bajo las condiciones antes mencionadas. A partir de estas colonias se llevó a cabo la identificación de especies.
Identificación a nivel de especieSe realizó a partir de las colonias obtenidas en las placas de SNA mediante la observación de sus características microscópicas. La identificación se basó en lo indicado por el manual de laboratorio de Leslie y Summerell14.
Identificación molecularLa extracción de ADN se realizó mediante el método de Doyle y Doyle modificado8. Se raspó el micelio de Fusarium spp. de una caja de Petri con medio de cultivo papa dextrosa agar. Se pesaron 0,2g de micelio, que se maceraron con una varilla esmerilada con 500μl de regulador de extracción (Tris-HCl pH 8, 100mM; EDTA pH 8,5, 50mM; NaCl 50mM y SDS 2%), se agitó en un vórtex durante 30 s y se dejó reposar en hielo 15min. Se agregaron luego 500μl de cloroformo-alcohol isoamílico (24:1) y se agitó en un vórtex; posteriormente se centrifugó a 12.000rpm durante 15min, se recuperó la fase acuosa en un tubo nuevo y se le adicionó el mismo volumen de isopropanol, se dejó reposar por 15min en hielo para posteriormente centrifugar a 12.000rpm durante 10min. Se desechó el sobrenadante y se recuperó la pastilla, la cual fue resuspendida en 50μl de agua desionizada estéril. Se agregaron 10μl de ARNasa y se incubó a 37°C durante 1h. Finalmente se determinó la concentración de ADN y se diluyó hasta obtener la concentración adecuada para la reacción de PCR.
Se utilizaron iniciadores específicos para cada una de las especies de Fusarium identificadas morfológicamente; los iniciadores para F. oxysporum fueron CLOX1 (5′-GCAAAGCATCAGACCACTATAACTC-3′) y CLOX2 (5′-TTGTCAGTAACTGGACGTTGGTACT-3′)12, para F. acuminatum fueron FACF (5′- GGGATATCGGGCCTCA-3′) y FACR (5′-GGGATATCGGCAAGATCG-3′)1, para F. verticillioides se emplearon los iniciadores VERT 1 y VERT2 (5′-GTCAGAATCCATGCCAGAACG-3′ y 5′-CACCCGCAGCAATCCATCAG-3′, respectivamente)6, mientras que para F. proliferatum se empleó PRO1 (5′-CTTTCCGCCAAGTTTCTTC-3′)22 y en el caso de F. solani se emplearon los primers TEF-Fs4f (5′-ATCGGCCACGTCGACTCT-3′) y TEF-Fs4r (5′-GGCGTCTGTTGATTGTTAGC-3′), bajo las condiciones señaladas por Mohammad et al.16. Las PCR se realizaron en el termociclador modelo MaxyGen (Axygen®/EE. UU.).
Pruebas de patogenicidad en invernaderoLa producción de plantas en invernadero se llevó acabó en el Centro de Ciencias Agropecuarias de la Universidad Autónoma de Aguascalientes; semillas de ajo variedad Ensenada fueron desinfectadas con hipoclorito de sodio (3%) durante 3min y se enjuagaron 3 veces con agua destilada estéril. Luego fueron sembradas en bolsas con sustrato estéril, 4 plantas por tratamiento. Los tratamientos consistieron en 12 cepas del estado de Guanajuato, 10 del estado de Aguascalientes, 12 del estado de Zacatecas y un testigo que fue inoculado con agua destilada estéril bajo condiciones controladas; al estudio se incluyó la cepa AGS Y-10, la cual fue aislada en semillas de ajo procedentes del estado de Aguascalientes por la Dra. Yisa María Ochoa Fuentes de la Universidad Autónoma Agraria Antonio Narro, la cual fue usada para comparar la patogenicidad de la cepa ZAC119A. Estas cepas fueron seleccionadas aleatoriamente para representar a cada una de las especies encontradas en los 3 estados de México en estudio. En la tabla 2 se muestra una lista de las cepas empleadas.
Cepas empleadas en la prueba de patogenicidad en invernadero
| Estado | Cepaa | Especie |
|---|---|---|
| Zacatecas | ZAC 1A | F. proliferatum |
| Zacatecas | ZAC 21B | F. proliferatum |
| Zacatecas | ZAC54A | F. proliferatum |
| Zacatecas | ZAC 124A | F. verticillioides |
| Zacatecas | ZAC75 A-2 | F. verticillioides |
| Zacatecas | ZAC 43B | F. verticillioides |
| Zacatecas | ZAC13A | F. oxysporum |
| Zacatecas | ZAC54B | F. oxysporum |
| Zacatecas | ZAC66C | F. oxysporum |
| Zacatecas | ZAC52A | F. solani |
| Zacatecas | ZAC23A | F. acuminatum |
| Zacatecas | ZAC119A | F. acuminatum |
| Guanajuato | GTO 13 A-1 | F. proliferatum |
| Guanajuato | GTO 10 A-2 | F. proliferatum |
| Guanajuato | GTO 1 B-1 | F. proliferatum |
| Guanajuato | GTO 1A | F. verticillioides |
| Guanajuato | GTO 10B | F. verticillioides |
| Guanajuato | GTO 58A | F. verticillioides |
| Guanajuato | GTO 1D | F. oxysporum |
| Guanajuato | GTO6B | F. oxysporum |
| Guanajuato | GTO 2D | F. oxysporum |
| Guanajuato | GTO 37B | F. solani |
| Guanajuato | GTO 12A | F. solani |
| Guanajuato | GTO 54A | F. solani |
| Aguascalientes | AGS 4C | F. proliferatum |
| Aguascalientes | AGS 9 A-1 | F. proliferatum |
| Aguascalientes | AGS 8A | F. proliferatum |
| Aguascalientes | AGS 31 B-1 | F. verticillioides |
| Aguascalientes | AGS 32 B-2 | F. verticillioides |
| Aguascalientes | AGS 8B | F. verticillioides |
| Aguascalientes | AGS 1A | F. oxysporum |
| Aguascalientes | AGS 4A | F. oxysporum |
| Aguascalientes | AGS 1B | F. oxysporum |
| Aguascalientes | AGS 8 C-1 | F. solani |
| Aguascalientes | AGS Y-10b | F. acuminatum |
La preparación del inóculo se realizó de la siguiente manera: al micelio de las diferentes cepas se les agregó 50ml de agua destilada estéril y se licuó, posteriormente se ajustó la suspensión de conidias a una concentración de 106 conidias/ml, esto se realizó con la ayuda de un hematocitómetro.
Inoculación de las plantasLa inoculación se llevó a cabo cuando las plantas presentaron 3 hojas completamente abiertas, cada planta fue tratada alrededor del cuello (la zona donde cambia de color blanco a verde) y dicho inóculo fue cubierto con sustrato estéril, al testigo se le adicionó agua destilada estéril.
Se evaluó la reacción cada 24 h después de la inoculación, con la finalidad de describir la severidad de la enfermedad se recurrió a la escala utilizada por Velásquez y Medina26, la cual consistió en 3 puntos: punto 1, planta sana; punto 3, planta con hojas amarillas o rojas, puntas púrpuras y/o daño en el cuello de la planta, y punto 5, planta muerta. Los resultados fueron sujetos a un análisis de varianza para determinar los efectos de los aislados y se realizó una comparación de medias de Tukey al 0,05.
ResultadosIdentificación morfológicaDe los muestras se pudieron recuperar 147 cepas del género Fusarium, entre las cuales se logró identificar cinco especies: 1) F. acuminatum, que presentó macroconidias grandes y delgadas con 3 septos; su célula apical era cónica, estrecha y elongada, la célula basal con forma de pie, pero no tan prominente como las de otras especies relacionadas, además presentó cadenas largas o grupos de clamidosporas; 2) F. oxysporum, esta presentó micelio de coloración blanco-violeta o coloraciones en el agar violetas, rosadas, amarillas, marrones y, en algunos casos, no mostró pigmentación en el agar. Conidios en falsas cabezas, con monofialides cortas, abundantes microconidias elípticas compuestas por una o 2 células, macroconidias con la célula apical cónica y en algunas ocasiones se observó una especie de gancho, y la célula basal en forma de pie o en ocasiones pobremente desarrollada y la célula apical redondeada y de 3 a 4 septos, con clamidosporas de textura lisa; 3) F. solani exhibió coloraciones blancas, crema y café en el micelio y pigmentaciones de color crema, rosadas y marrón, conidios en falsas cabezas, con monofialides largas, microconidias ovaladas a elípticas constituidas por una o 2 células, macroconidias con la célula basal y la célula apical redondeadas, de 3 a 4 septos; también se observó la presencia de clamidosporas con apariencia lisa o rugosa en forma individual o en pares; 4) F. proliferatum presentó micelio en una gama de colores del blanco-violeta, con coloraciones moradas en el agar, además mostró largas cadenas de conidias en monofialides y polifialides, las microconidias exhibieron forma de mazo con la base aplanada y en algunas ocasiones se presentaron en forma de pera; además de presentarse en falsas cabezas, y 5) F. verticillioides, cuyo micelio presentó coloraciones blancas con amarillo y/o moradas; con pigmentaciones amarrillas o moradas en el agar, microconidias en falsas cabezas y en largas cadenas de conidias en monofialides, en ocasiones se observó la presencia de hifas hinchadas con una apariencia similar a las clamidosporas2,7,14,19.
La especie encontrada con mayor frecuencia fue F. oxysporum (36,05%), le siguió F. proliferatum (34,01%), F. verticillioides y F. solani, con 22,45% y 6,12%; respectivamente, y la menos frecuente fue F. acuminatum con un 1,36%.
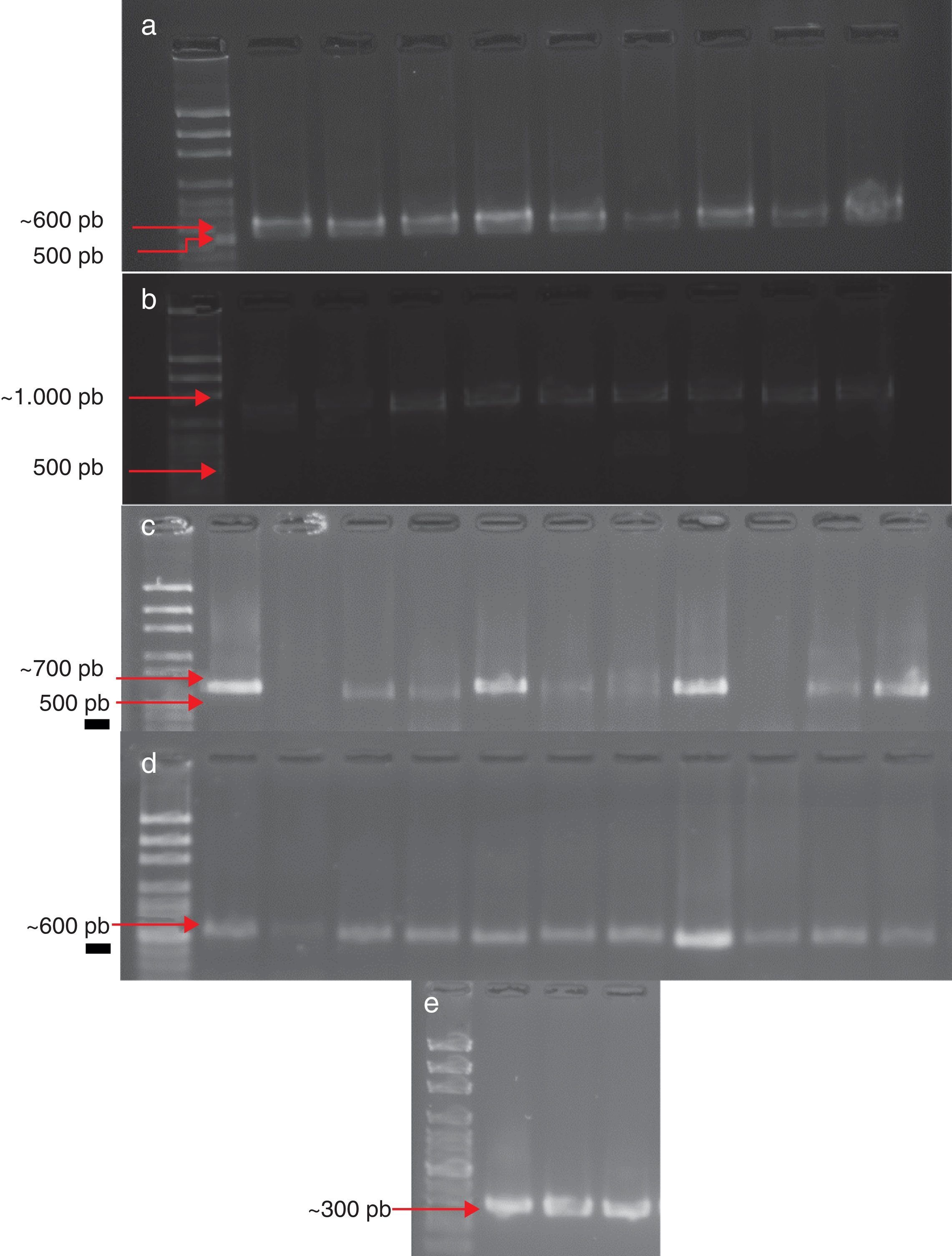
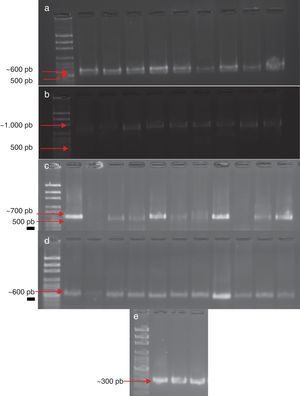
Identificación molecularDe las 147 cepas obtenidas, 53 se alinearon con los iniciadores CLOX 1 y CLOX 2 para F. oxysporum; estas dieron un producto de ∼600 pb; 50 cepas con los iniciadores PRO1 y PRO2 para F. proliferatum, con un producto de ∼600 pb; 33 cepas se identificaron como F. verticillioides con los iniciadores VERT 1 y VERT 2, con un producto de amplificación de entre 900-1.000 pb; 2 cepas se alinearon con los iniciadores FACF y FACR para F. acuminatum, dando como resultado un producto ∼300 pb, y 10 cepas se identificaron como F. solani, con un producto ∼700 pb (fig. 1).
Pruebas de patogenicidadEl análisis de varianza de los índices de severidad indicó que existe diferencia significativa (0,0439), con un coeficiente de variación de 51,56; las cepas AGS1A (F. oxysporum), AGS1B (F. oxysporum) y AGSY-10 (F. acuminatum) fueron las que manifestaron mayor severidad (tabla 3), mientras que el resto de las cepas evaluadas no mostraron diferencia significativa, a excepción del testigo, que presentó diferencia significativa con el resto de las plantas en la prueba. Las primeras plantas en mostrar síntomas característicos de la enfermedad fueron las inoculadas con las cepas GTO54A (F. solani) y AGS1B (F. oxysporum); cabe mencionar que esta última fue una de las cepas que expresó mayor patogenicidad.
Comparación de medias del índice de severidad de los aislados de Fusarium spp
| Cepa | Media | Agrupamientoa | |
|---|---|---|---|
| AGS1A | 3,5 | a | |
| AGS1B | 3,5 | a | |
| AGSY-10 | 3,5 | a | |
| ZAC75A-2 | 3,0 | a | b |
| AGS4A | 3,0 | a | b |
| GTO12A | 3,0 | a | b |
| GTO6B | 3,0 | a | b |
| AGS8B | 3,0 | a | b |
| GTO1B-1 | 3,0 | a | b |
| GTO1D | 3,0 | a | b |
| AGS31B-1 | 3,0 | a | b |
| ZAC52A | 3,0 | a | b |
| ZAC23A | 3,0 | a | b |
| ZAC54B | 3,0 | a | b |
| GT010B | 2,25 | a | b |
| GTO13A-1 | 2,25 | a | b |
| AGS8C-1 | 2,25 | a | b |
| GTO10A-2 | 2,25 | a | b |
| GTO2D | 2,25 | a | b |
| GTO37B | 2,25 | a | b |
| ZAC21B | 2,25 | a | b |
| AGS4C | 2,25 | a | b |
| ZAC66C | 2,25 | a | b |
| GTO1A | 2,25 | a | b |
| ZAC199A | 2,25 | a | b |
| AGS9A-1 | 2,25 | a | b |
| ZAC54A | 2,25 | a | b |
| GTO58A | 2,25 | a | b |
| ZAC124A | 2,25 | a | b |
| AGS8A | 1,5 | a | b |
| ZAC43B | 1,5 | a | b |
| ZAC1A | 1,5 | a | b |
| GTO54A | 1,5 | a | b |
| ZAC13A | 1,5 | a | b |
| AGS32B-2 | 0,75 | a | b |
| TEST | 0 | a | b |
Las especies obtenidas en este estudio habían sido reportadas anteriormente por Ochoa et al.19,20 en semillas de ajo en el estado de Aguascalientes.
Identificación molecularLa identificación morfológica fue ratificada mediante PCR empleando primers específicos para cada especie. Se obtuvieron las bandas esperadas con los pesos descritos en la literatura12,16,22, a excepción de F. verticillioides, de la cual se obtuvieron bandas de ∼1.000 pb, lo que resulta superior a lo reportado6, y de F. acuminatum, de la cual se obtuvieron bandas de ∼300 pb, tamaño inferior a lo esperado de acuerdo con lo que informaba la literatura1.
La frecuencia con la que fueron encontradas las diferentes especies de Fusarium coincide con lo comunicado por Dissanayake et al.6 y Rabiei-Motlagh et al.22, quienes hallaron a F. oxysporum como el agente de mayor incidencia en cultivos de cebolla en Irán y Japón, además estos autores informaron la presencia de F. solani, F. proliferatum y F. verticillioides. Sin embargo, Stankovic et al.25 documentan que fue F. proliferatum la especie predominante en cultivos de ajo y cebolla en Serbia, y que con menor frecuencia aislaron F. oxysporum, F. solani, F. acuminatum y F. equiseti. Montes et al.17 comunicaron la presencia de F. culmorum en cultivares de cebolla en el estado de Morelos, México; cabe recalcar que esta especie no fue encontrada en los muestreos realizados en este trabajo.
Pruebas de patogenicidadTodas las plantas inoculadas comenzaron a mostrar síntomas a los 15 días de la inoculación, como coloraciones café iniciando por la punta de las hojas, las cuales comenzaron a tornarse rojizas a moradas; en el punto de inoculación algunas plantas mostraron una coloración morada y los tallos presentaron consistencia blanda5,26.
La comparación de medias de los índices de severidad otorgados en las pruebas de patogenicidad demuestran que hay variación patogénica entre los diversos aislados de la misma especie y dentro de la misma localidad, lo cual puede estar relacionado con la capacidad de la especie para generar los síntomas de la enfermedad de acuerdo a la variedad del hospedero25. Esto concuerda con lo reportado por Dissanayake et al.6, quienes señalan a algunos aislados de F. oxysporum como los agentes con mayor índice de severidad. Estos autores a su vez reportan aislados de F. oxysporum, F. verticillioides y F. solani con menor capacidad patogénica.
Los resultados de la investigación señalan que AGSY-10 fue una de las cepas que mostró mayor patogenicidad, siendo esta cepa más patogénica que la cepa aislada en este estudio (ZAC119A); cabe mencionar que Stankovic et al.25 aislaron de cebolla y ajo las siguientes especies: F. proliferatum, F. oxysporum, F. solani y F. acuminatum, pero solo evaluaron la patogenicidad de las cepas identificadas como F. proliferatum.
En este trabajo se identificaron morfológicamente y molecularmente las especies F. oxysporum, F. proliferatum, F. verticillioides, F. solani y F. acuminatum, esta última se halló solo en los estados de Zacatecas y Aguascalientes. Las cepas que mostraron mayor patogenicidad fueron AGS1A y AGS1B, pertenecientes a la especie F. oxysporum.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.