Debido a la gran problemática mundial de la resistencia bacteriana a los antibióticos, es necesaria la búsqueda continua de nuevas moléculas con características antimicrobianas. Este estudio evaluó el efecto antibacteriano y antifúngico de un extracto hexánico proveniente de la raíz de Salvia apiana. Los extractos de salvia a las concentraciones de 27; 13,5; 6,8 y 3,4mg/ml causaron inhibición del crecimiento de Staphylococcus aureus, Streptococcus pyogenes, Enterococcus faecalis y Candida albicans. Sin embargo, no presentaron efecto significativo sobre Escherichia coli y Candida tropicalis al compararse con los valores del vehículo en las valoraciones de difusión en pozo. Se demostró que S. apiana tiene un efecto antimicrobiano significativo sobre patógenos de gran importancia clínica, lo que abre el campo para continuar evaluando a esta lamiácea en vistas a su posible empleo en el futuro como un agente terapéutico.
Due to the great global concern regarding bacterial resistance to antibiotics, an ongoing search for new molecules having antibacterial activity is necessary. This study evaluated the antibacterial and anticandidal effects of a hexane extract from the root of Salvia apiana. Salvia extracts at concentrations of 27, 13.5, 6.8 and 3.4mg/ml caused growth inhibition of Staphylococcus aureus, Streptococcus pyogenes, Enterococcus faecalis and Candida albicans. However, no significant effect was observed on Escherichia coli and Candida tropicalis in comparison to vehicle. It was here demonstrated for the first time that Salvia apiana has an important antimicrobial effect on human pathogens of great clinical value, thus opening the field to continue the evaluation of this lamiaceous plant for its future use as a therapeutic agent.
La resistencia bacteriana a los antibióticos es una amenaza importante para la salud pública mundial, situación que se agrava por la carencia del desarrollo de nuevos agentes antimicrobianos15. En México, el uso indiscriminado de antibióticos es identificado como uno de los factores que contribuyen a la aparición de la resistencia a los antimicrobianos1. Recientemente, esta situación llevó al establecimiento de la venta de antibióticos por farmacias única y exclusivamente mediante la exhibición de receta médica13. Sin embargo, esta medida por sí sola no evita la aparición de resistencia bacteriana, ya que depende de muchos otros factores de acuerdo con estudios realizados en México y con lo observado en España1,15.
Debido a esta problemática regional, nacional y mundial, se ha puesto especial atención a compuestos biológicamente activos extraídos de diversas especies de plantas tradicionales empleadas en la medicina herbal como una posible alternativa para el manejo de problemas infecciosos12.
México tiene una amplia variedad de plantas. Presenta alrededor de 25.000 especies registradas y aproximadamente unas 30.000 no descritas12. Salvia es un género importante de plantas que comprende aproximadamente 900 especies de la familia Lamiaceae, de las cuales algunas especies se cultivan alrededor del mundo para su empleo en la medicina herbal o como aditivos en productos alimenticios9. Varias especies de Salvia han demostrado algún grado de efecto antibacteriano y antifúngico. Sin embargo, Salvia apiana, especie nativa de California, no ha sido valorada en este sentido6,14.
El objetivo del presente estudio fue evaluar el potencial efecto antibacteriano y antimicótico in vitro de S. apiana frente a algunos patógenos de importancia clínica.
Las raíces de S. apiana fueron recolectadas en 2012 en la localidad de San Antonio de las Minas (Ensenada, Baja California, México) por un taxónomo experimentado. El material colectado fue lavado de inmediato y secado a temperatura ambiente, para continuar posteriormente con el proceso de extracción.
El material seco fue triturado para obtener trozos de aproximadamente 5cm de largo por 1cm de ancho y 5mm de espesor. Después, 301g de este material fueron sometidos a maceración etanólica (95%) durante 48h. El solvente del macerado fue luego eliminado a presión reducida en un rotavapor (modelo R-210, BÜCHI Labortechnik AG, Flawil, Suiza), con lo que se obtuvo al final 16,4g de extracto crudo y seco. Todo el extracto fue disuelto en 410ml de una solución de metanol:agua (2:3), continuando con su partición en n-hexano. Finalmente, el extracto hexánico fue llevado a sequedad bajo presión reducida.
Se utilizaron cepas bacterianas gram positivas de colección (Staphylococcus aureus ATCC 25923 y Streptococcus pyogenes ATCC 19615) y una cepa de Enterococcus faecalis obtenida del laboratorio de microbiología de un hospital local. Se utilizó también un microorganismo gram-negativo: Escherichia coli ATCC 25922. Por otra parte, se obtuvieron 2 levaduras (Candida albicans y Candida tropicalis) del laboratorio de microbiología de la Facultad de Odontología Mexicali de la Universidad Autónoma de Baja California.
Se empleó agar tripteína de soja preparado siguiendo las indicaciones del fabricante (Sigma-Aldrich, St. Louis, MO, EE. UU.). Bajo condiciones de esterilidad, el medio fundido y a una temperatura entre los 45°C y los 50°C fue colocado en placas de Petri y después estas placas fueron llevadas a temperatura ambiente, para su posterior empleo en la evaluación microbiológica. Se empleó CHROMagar CANDIDA BD BBL MEX 1-LOTE 4315788 como medio de cultivo para C. albicans y C. tropicalis; dicho medio ya venía preparado en placas de Petri por el fabricante.
Primeramente, el extracto hexánico de S. apiana (RSAH) se redisolvió en dimetilsulfóxido (DMSO) y se obtuvo una solución de 27mg/ml, a partir de la cual se prepararon las diluciones subsiguientes: 27; 13,5; 6,75 y 3,37 μg/10μl; dichas soluciones fueron usadas en los experimentos bajo la denominación de 2, 3, 4 y 5, respectivamente. Posteriormente, se prepararon suspensiones de los microorganismos que se iban a evaluar; estas tuvieron una turbiedad de 0,5 (bacterias) o 1,0 (levaduras) en la escala de McFarland. Estas suspensiones fueron diseminadas en cajas de Petri empleando hisopo estéril. En una misma caja de Petri fueron realizados 5 pozos de 5mm, uno central y 4 más siguiendo los puntos cardinales, cada uno de estos ubicados a 2cm del pozo central. El pozo central siempre fue ocupado por 10μl del vehículo, mientras que 10μl de las soluciones 2, 3, 4 o 5 fueron colocados en los diferentes pozos circundantes. Las cajas de Petri fueron luego incubadas a 37°C durante 24h. Trascurrido este tiempo, se midió el diámetro de los halos de inhibición.
Los datos se presentan como las medias de los halos de inhibición, cada uno con su respectivo error estándar (n=3). Los datos de cada microorganismo fueron evaluados usando un análisis de varianza (ANOVA) de un factor. En los casos en que se observó diferencia estadística con la prueba mencionada, se empleó una posprueba de Tukey para identificar entre qué grupos estaba tal diferencia, considerando una p<0,05. Para este análisis se empleó el paquete estadístico GraphPad Prism 5 (San Diego, CA, EE. UU.).
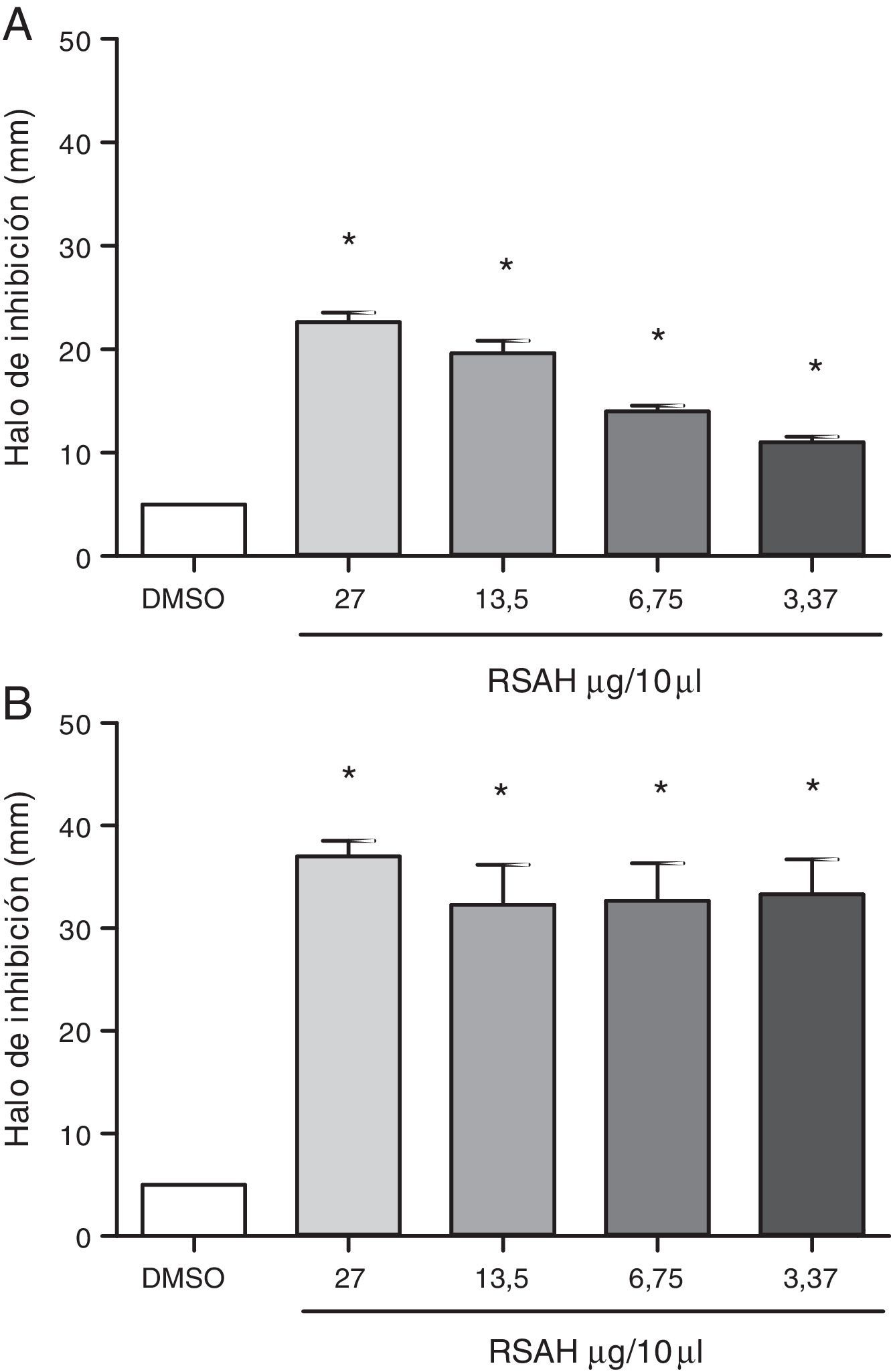
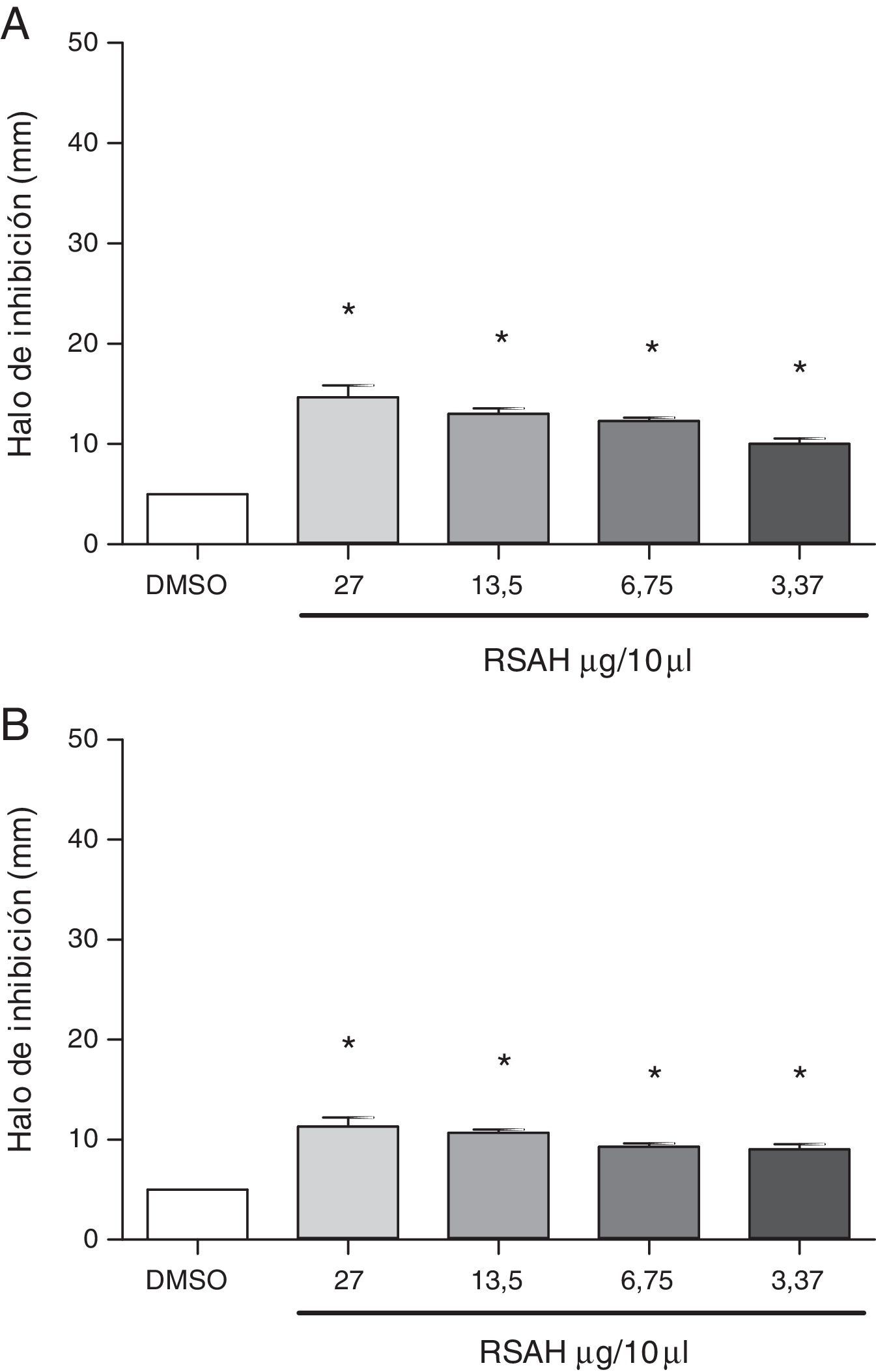
Todas las concentraciones del extracto RSAH inhibieron significativamente el desarrollo de las bacterias gram positivas al compararse con el vehículo. Los resultados muestran halos de inhibición de 10 a 24mm, de 28 a 40mm y de 9 a 17mm frente a S. aureus (figura 1A), S. pyogenes (figura 1B) y E. faecalis (figura 2A), respectivamente, con un efecto dependiente de la dosis excepto en el caso de S. pyogenes. De esta manera, se evidencia el efecto antibacteriano de S. apiana contra estos microorganismos en coincidencia con los halos de 0 hasta 16mm producidos por otras especies de Salvia, como son Salvia palaestina, Salvia ceratophylla, Salvia multicaulis, Salvia syriaca, Salvia officinalis, Salvia lavandulifolia, Salvia sclarea y Salvia triloba8,11.
Es importante mencionar que la cepa clínica de E. faecalis presentó sensibilidad a ampicilina, gentamicina, linezolid, levofloxacina, norfloxacina, nitrofurantoína, estreptomicina y vancomicina, y resistencia solo a tetraciclina. Un patrón similar se observó en cepas obtenidas de pacientes en hospitales del área metropolitana de la Ciudad de México2.
En este estudio, S. apiana demostró una gran actividad antibacteriana contra S. pyogenes, incluso a las concentraciones del extracto más bajas; esto marca una diferencia con los escasos efectos registrados a las concentraciones altas con extractos de S. palaestina, S. ceratophylla, S. multicaulis y S. syriaca frente a la misma especie de estreptococo8. La única diferencia entre ambas evaluaciones es que en ese estudio se empleó agar Mueller-Hinton, mientras que nosotros utilizamos agar tripteína de soja; ambos ensayos emplearon los medios de cultivo sin suplementación de sangre bajo un período de incubación a 37°C de 24 h8.
Cabe señalar que el Clinical and Laboratory Standards Institute (CLSI) recomienda que las pruebas de sensibilidad de Streptococcus spp. a los antimicrobianos sean realizadas con agar Mueller-Hinton suplementado con 5% de sangre de carnero y a una temperatura de incubación de 35±2°C durante 20 a 24 h4. Por lo tanto, las evaluaciones de la sensibilidad de S. pyogenes frente a Salvia tienen la limitación de que han sido realizadas en condiciones de crecimiento no óptimas para el estreptococo.
Un dato interesante es que el crecimiento de la bacteria gram-negativa (E. coli ATCC 25922) no se vio modificado por el extracto RSAH si se compara con el efecto que tuvo el vehículo (ausencia de variación en el halo de inhibición, p>0,05). Esta falta de actividad frente a E. coli contrasta con los halos de inhibición de 7,9 a 20mm reportados para otras especies de Salvia, como S. palaestina, S. ceratophylla, S. multicaulis, S. syriaca, S. officinalis, S. lavandulifolia, S. sclarea y S. triloba8,11. De la misma manera, S. apiana en otros estudios no demostró una actividad larvicida apropiada en mosquitos vectores de patógenos de valor clínico6,9. Estas observaciones indican que S. apiana presenta un espectro muy específico de actividad antimicrobiana.
Por otra parte, el extracto RSAH produjo un aumento significativo en el halo de inhibición de C. albicans en comparación con el vehículo. En la figura 2B se observa un efecto antimicótico dependiente de la dosis, con halos de inhibición que van desde 8mm hasta 13mm. Estos resultados concuerdan con los efectos antifúngicos reportados para S. officinalis, cuyos extractos produjeron halos de inhibición de 0 a 31,5mm. Es importante mencionar que el efecto antimicótico mostrado por S. apiana en el presente estudio fue observado incluso en las concentraciones más bajas que se evaluaron en los ensayos microbiológicos, a diferencia de lo comunicado para S. officinalis14. Por otra parte, el crecimiento de C. tropicalis no presentó modificaciones importantes por la presencia del extracto (0-40% de aumento en el halo comparado con el vehículo, p>0,05). Esta insensibilidad fúngica concuerda con la actividad nula de Salvia potentillifolia frente a este microorganismo, ya informada3.
Es bien sabido que los terpenoides aislados de los brotes y raíces del genero Salvia presentan una considerable actividad antimicrobiana6. Por ejemplo, en S. officinalis esta actividad es atribuida a la presencia de cineol, tujona y alcanfor7. El daño a la integridad de la membrana celular, la actividad antimetabolito y la lisis celular son los mecanismos descritos en vinculación con los efectos antibacterianos y antifúngicos de este tipo de compuestos3,5.
Estos compuestos han mostrado actividad antibacteriana y antimicótica en investigaciones previas. Las diferencias observadas en los efectos de S. apiana comparados con los de otras lamiáceas se deben probablemente a la distinta composición química y abundancia de los componentes del extracto, los cuales dependen a su vez de la especie y del ambiente ecológico, entre otros factores5.
Para los ensayos microbiológicos se emplearon cepas de S. aureus, S. pyogenes, E. faecalis, E. coli, C. albicans y C. tropicalis, que son patógenos humanos de gran importancia clínica debido a que causan una amplia variedad de enfermedades infecciosas; se pueden mencionar entre ellas endocarditis, síndrome de shock tóxico, infección del tracto urinario, septicemia, estomatitis bucal y candidiasis8,14.
El método de difusión en pozo ha demostrado una correlación apropiada con el método de referencia en microdilución descrito por el Comité Nacional para Estándares del Laboratorio Clínico (NCCLS, por sus siglas en inglés, actualmente CLSI), haciéndolo una alternativa válida para evaluar la sensibilidad de Candida spp. frente a diversos fármacos antifúngicos10. Sin embargo, se requieren más ensayos bacteriológicos para dar continuidad a la evaluación de la actividad antimicrobiana y de esta manera confirmar lo observado en este trabajo. Nuestros hallazgos abren el campo para la realización de más estudios con esta especie de lamiácea, que no había sido considerada hasta este momento para su posible uso terapéutico frente a patógenos de importancia clínica.
Por primera vez se reporta la actividad antibacteriana y antifúngica in vitro de un extracto (hexánico) de la raíz de S. apiana frente a patógenos de relevancia clínica como son S. aureus, S. pyogenes, E. faecalis y C. albicans; se demuestra un efecto inhibitorio incluso a bajas concentraciones del extracto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEste estudio fue parcialmente financiado por la SEP a través del Apoyo a la Incorporación de Nuevos PTC, Folio asignado al Profesor: UABC-PTC-490; número de oficio de la Carta de Liberación: DSA/103.5/15/6766.