Listeria monocytogenes es un patógeno oportunista de transmisión alimentaria. Puede resistir condiciones de estrés adaptándose mediante la producción de biofilms, lo que representa un grave problema para la industria alimentaria. Se clasifica en 14 serotipos, aunque solo cuatro (1/2a, 1/2b, 1/2c y 4b) son la causa del 89 al 98% de los casos de listeriosis en todo el mundo. El objetivo del presente estudio fue detectar y serotipificar aislamientos de L.monocytogenes obtenidos de distintas matrices de alimentos provenientes de plantas de procesamiento de Argentina. Se analizaron 1.832 muestras (cárnicos, alimentos listos para consumo, helados, alimentos lácteos y vegetales congelados) en el período 2016-2021, en las que se detectaron 226 aislamientos compatibles con L.monocytogenes (tasa de detección: 12,34%). A su vez, se realizaron muestreos ambientales y de superficies en las plantas procesadoras de alimentos listos para consumo, embutidos y lácteos, y se detectó contaminación ambiental con L.monocytogenes en numerosos puntos críticos del procesamiento, con un 22,7% de positividad. El análisis molecular de serogrupos detectó como mayoritario al serogrupo IIb, con un 66,5% (n=107), seguidos de los serogrupos IIc (n=36; 22,3%), IIa (n=9; 5,6%) y IVb (n=9; 5,6%). A su vez, el serogrupo mayoritariamente aislado en los monitoreos ambientales fue el IIb. Este trabajo, el primero en Argentina en abarcar una gran cantidad de matrices alimentarias, resalta la importancia de la detección y la serotipificación de L.monocytogenes para la toma de medidas accionables y la identificación de brotes.
Listeria monocytogenes is an opportunistic foodborne pathogen. It can resist stress conditions by adapting through the production of biofilms, which represents a serious problem for the food industry. It is classified into 14 serotypes, although only four (1/2a, 1/2b, 1/2c, and 4b) account for 89.0-98.0% of listeriosis cases worldwide. The objective of this study was to detect and serotype L.monocytogenes isolated from different food matrices from processing plants in Argentina. In the period 2016-2021, 1832 samples (meat, ready-to-eat foods, ice cream, dairy foods, and frozen vegetables) were analyzed, of which 226 (12.34%) isolates compatible with L.monocytogenes were detected. At the same time, environmental and surface samplings were performed in processing plants for ready-to-eat foods, sausages and dairy products, where environmental contamination with L.monocytogenes was detected in numerous critical points of the process, yielding a positivity rate of 22.7%. The molecular analysis of serogroups was performed, where it was observed that serogroup IIb was the most frequent with 66.5% (n=107), and in descending order IIc with 22.3% (n=36), and IIa (n=9) and IVb (n=9) with 5.6%. The serogroup mostly isolated in environmental monitoring was IIb. This work highlights the importance of the detection and serotyping of L.monocytogenes for taking actionable measures and identifying outbreaks, and is the first study in Argentina to describe an extensive study in food matrices.
Listeria monocytogenes es un patógeno oportunista que se transmite a través de alimentos y es resistente a condiciones de estrés como congelación, secado, acidez y frío, a las cuales se adapta mediante la producción de biofilms13. Esta característica representa un grave problema para la industria alimentaria por la dificultad en el control de las plantas de procesado32. Debido a esto es que las industrias ejecutan planes de monitoreo ambiental, mediante los cuales pretenden garantizar la seguridad de los alimentos elaborados31.
La listeriosis está asociada a una pequeña subpoblación de esta especie bacteriana y se da, principalmente, en algunos individuos predispuestos. La forma clínica más habitual es la listeriosis gastrointestinal no invasiva y se encuentra vinculada con los brotes de toxiinfección alimentaria50. Los pacientes pueden ser portadores asintomáticos o presentar síntomas que suelen autolimitarse1. La listeriosis invasiva se produce cuando una infección inicial del tejido intestinal deriva en la invasión de otras partes del organismo. Los órganos que se infectan más habitualmente son el útero grávido, el sistema nervioso central y la sangre26.
Los alimentos más frecuentemente involucrados en los brotes de esta enfermedad son los alimentos listos para consumo (ready-to-eat [RTE])2, productos cárnicos10, lácteos elaborados con leche sin pasteurizar20, vegetales crudos y congelados19 y pescados crudos y ahumados44. La contaminación de alimentos con L.monocytogenes es frecuente, por lo que la exposición de la población suele ser habitual.
En la actualidad, se conoce que existen catorce serovariedades de L. monocytogenes: 1/2a, 1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e, 4h y 718. Sin embargo, cuatro de ellas (1/2a, 1/2b, 1/2c y 4b) se han aislado en aproximadamente el 98% de los casos humanos y animales18. De esto se desprende que no todas las cepas de L.monocytogenes tienen igual capacidad de causar enfermedad en humanos. Algunas caracterizaciones fenotípicas y genotípicas sugieren que el serotipo 4b ha sido responsable de los brotes más importantes de listeriosis transmitida por alimentos, mientras que, en ambientes de industrias y en alimentos, se han aislado con mayor frecuencia los serotipos 1/2a y 1/2b35.
Por las condiciones socioeconómicas y sanitarias de la región, se estima que, en América Latina, la frecuencia y la letalidad asociadas a la enfermedad son elevadas en comparación con las de países centrales. En Argentina, la listeriosis es de reciente notificación obligatoria y se cuenta con pocos datos sobre su prevalencia; asimismo, se desconoce si existe una subnotificación de la enfermedad y el real impacto en la salud pública28,33. Debido a las características únicas de la listeriosis, la vigilancia epidemiológica tradicional conlleva dificultades para su detección temprana3.
Se necesita conocer el real impacto de este patógeno y de la enfermedad que ocasiona en términos de salud pública, teniendo en cuenta que los alimentos son la principal fuente de transmisión a los seres humanos. El objetivo de esta investigación fue detectar y serotipificar L.monocytogenes en matrices de alimentos y sus entornos de producción de distintas zonas productivas de Argentina.
Materiales y métodosDurante el período 2016-2021, se realizó la búsqueda de Listeria spp. y Listeria monocytogenes en 1.832 muestras alimentarias mediante la norma ISO 11290 vigente22. Con el fin de controlar la calidad para consumo nacional y de exportación, se analizaron la totalidad de las muestras ingresadas a un laboratorio de la Ciudad de Buenos Aires. Las matrices analizadas comprendieron las siguientes categorías: alimentos cárnicos, alimentos RTE, aderezos, alimentos farináceos-cereales, lácteos, alimentos azucarados, helados y vegetales congelados (tabla 1). La toma de muestra fue realizada por los responsables de calidad de los distintos establecimientos que procesan y manufacturan alimentos (frigoríficos, compañías procesadoras de carne, supermercados, comedores y otros expendedores de alimentos). El equipo de trabajo del laboratorio mandó las indicaciones para la correcta toma y el envío de las muestras, que incluyeron el envío en bolsa estéril de las muestras refrigeradas (4 a 8°C) y una cantidad mínima de 100g. Los aislamientos de L.monocytogenes obtenidos se conservaron en congelador a −70°C para la posterior realización de PCR de serogrupos.
Número de muestras totales y positivas y de aislamientos analizados por PCR múltiple para serogrupos, según matriz
| Categorías | Características | n total | n positivas | PCR serogrupos |
|---|---|---|---|---|
| Cárnicos | Rebozados de pollo; carne bovina cruda; chacinados; embutidos; carne cocida y de pescado | 873 | 154 | 97 |
| RTE | Sándwiches; derivados de embutidos y chacinados con queso; empanadas de queso; hamburguesas y empanadas de pollo | 300 | 48 | 43 |
| Aderezos | Mayonesa; mayonesa vegana; salsa césar, barbacoa, honeymustard y vinagreta | 176 | 0 | 0 |
| Alimentos farináceos | Cereales y galletitas de chocolate rellenas | 10 | 0 | 0 |
| Lácteos | Queso y mozzarella feteada | 35 | 5 | 4 |
| Alimentos azucarados | Chocolate repostero para cobertura | 5 | 0 | 0 |
| Helados | Helados de crema | 375 | 16 | 15 |
| Vegetales congelados | Brócoli | 58 | 3 | 2 |
| Total | − | 1.832 | 226 | 161 |
De cada bolsa estéril se tomó una alícuota de muestra de 25g (±2,5g), a la que se le adicionó caldo Half Fraser (HFB; Biokar, Zac de Ther, Francia) en una dilución 1:10. Las muestras se incubaron durante 25h (±1h) a 30°C (±1°C). Luego, 0,1ml (±0,02ml) del caldo HFB se transfirió a 10ml (±0,5ml) de caldo Fraser (FB; Biokar, Zac de Ther, Francia) y se incubó a 37°C (±1°C) por 24h (±2h). Posteriormente se tomó una ansada de ambos enriquecimientos y se estrió sobre una placa de agar cromogénico, según Ottaviani y Agosti (ALOA), y de agar PALCAM. El agar ALOA se incubó a 37°C (±1° C) y el agar PALCAM a 35°C (±1°C), ambos por 48h (±2h). Las colonias presuntivas de L.monocytogenes en ALOA mostraron un color verde azulado y estaban rodeadas de un halo opaco. En el agar PALCAM, las colonias características del género Listeria spp. mostraron color gris y se encontraban rodeadas de halos de color marrón oscuro. Para confirmar la especie, se evaluó la producción de hemólisis, la fermentación de los hidratos de carbono L-rhamnosa y D-xylosa y se realizó la prueba de CAMP.
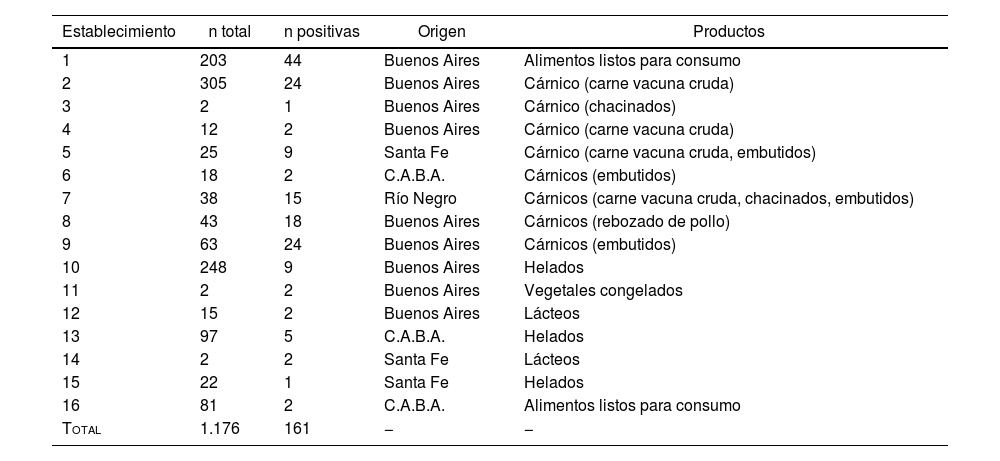
La tipificación molecular para la identificación de serovares de L.monocytogenes se realizó en los aislamientos provenientes de 16 establecimientos argentinos en donde se procesa una amplia variedad de matrices (tabla 2).
Número de muestras totales y positivas y distribución y tipo de producción por establecimiento
| Establecimiento | n total | n positivas | Origen | Productos |
|---|---|---|---|---|
| 1 | 203 | 44 | Buenos Aires | Alimentos listos para consumo |
| 2 | 305 | 24 | Buenos Aires | Cárnico (carne vacuna cruda) |
| 3 | 2 | 1 | Buenos Aires | Cárnico (chacinados) |
| 4 | 12 | 2 | Buenos Aires | Cárnico (carne vacuna cruda) |
| 5 | 25 | 9 | Santa Fe | Cárnico (carne vacuna cruda, embutidos) |
| 6 | 18 | 2 | C.A.B.A. | Cárnicos (embutidos) |
| 7 | 38 | 15 | Río Negro | Cárnicos (carne vacuna cruda, chacinados, embutidos) |
| 8 | 43 | 18 | Buenos Aires | Cárnicos (rebozado de pollo) |
| 9 | 63 | 24 | Buenos Aires | Cárnicos (embutidos) |
| 10 | 248 | 9 | Buenos Aires | Helados |
| 11 | 2 | 2 | Buenos Aires | Vegetales congelados |
| 12 | 15 | 2 | Buenos Aires | Lácteos |
| 13 | 97 | 5 | C.A.B.A. | Helados |
| 14 | 2 | 2 | Santa Fe | Lácteos |
| 15 | 22 | 1 | Santa Fe | Helados |
| 16 | 81 | 2 | C.A.B.A. | Alimentos listos para consumo |
| Total | 1.176 | 161 | − | − |
Los responsables de las plantas procesadoras de alimentos RTE, de embutidos y de lácteos realizaron, en paralelo y periódicamente, monitoreos ambientales y de superficies de sus establecimientos para confirmar o descartar la presencia de L.monocytogenes en el ambiente (n=282). Para este fin, utilizando esponjas e hisopos (Whirl-pak® sampling bag 120ml e hisopos de recogida de muestras 3M 10ml), se tomaron muestras en los puntos más críticos: utensilios empleados en las etapas de procesamiento, máquinas feteadoras de fiambres, bachas y cortinas de cocina, puertas de ingreso/egreso, rejillas y canaletas, empaquetadoras, troneras peladoras, cámaras y superficies de contacto con el alimento, entre otros. Dichas muestras se remitieron al laboratorio en bolsa estéril y refrigerada (4 a 8°C).
La preparación del templado, los cebadores utilizados, el procedimiento de PCR múltiple, el posterior ciclado y la visualización en gel de agarosa se realizó de acuerdo a lo descripto por Doumith et al.16, con mínimas modificaciones. A partir de una cepa de L.monocytogenes, se realizó una suspensión en tubo de microcentrífuga estéril con 50μl de buffer de lisis. La mezcla se calentó durante 15minutos a 100°C. Luego de que se enfriara, se agregaron 100μl de agua calidad PCR. Se utilizaron los siguientes reactivos y concentraciones finales para la ejecución de la PCR: buffer Green 1X (1,5mMmg); dNTPS (0,3mM); cebadores lmo0737-F y R (0,03μM), lmo1118-F y R (0,7μM), ORF2819-F y R (0,1μM), ORF2110-F y R (0,1μM), Prs-F y R (0,02μM) y GoTaq® (5U/μl) (tabla 3). El volumen final de la reacción fue de 50μl y el termociclador empleado fue de marca GENE-UP® (bioMérieux, Francia). La corrida electroforética se visualizó en gel de agarosa al 2,5% revelado con bromuro de etidio (0,5μg/ml). Aquellas condiciones modificadas fueron verificadas en el laboratorio utilizando cepas caracterizadas en investigaciones nacionales ya publicadas28,29,40. Mediante esta técnica, se identificaron cuatro serogrupos moleculares: serogrupo IIa (incluye serotipos 1/2a, 3a), serogrupo IIb (incluye serotipos 1/2b, 3b y 7), serogrupo IIc (incluye serotipos 1/2c y 3c) y serogrupo IVb (incluye serotipos 4b, 4d y 4e).
Detalle de los procedimientos de PCR
| Blanco | Cebadores | Tamaño amplificado (pb) |
|---|---|---|
| lmo0737 | F: 5’-AGGGCTTCAAGGACTTACCC-3’R: 5’-ACGATTTCTGCTTGCCATTC-3’ | 691 |
| lmo1118 | F: 5’-AGGGGTCTTAAATCCTGGAA-3’R: 5’-CGGCTTGTTCGGCATACTTA-3 | 906 |
| ORF2819 | F: 5’- AGCAAAATGCCAAAACTCGT-3’R: 5’-CATCACTAAAGCCTCCCATTG-3’ | 471 |
| ORF2110 | F: 5’ AGTGGACAATTGATTGGTGAA-3’R: 5’-CATCCATCCCTTACTTTGGAC-3’ | 597 |
| prs | F: 5’ GCTGAAGAGATTGCGAAAGAAG-3’R: 5’-CAAAGAAACCTTGGATTTGCGG-3’ | 370 |
La listeriosis es un problema relevante en todo el mundo por su alta tasa de morbimortalidad, razón por la cual la vigilancia de L.monocytogenes en alimentos es de suma importancia para la evaluación de los riesgos y el impacto de este patógeno en la salud pública9. Si bien se estima que en Argentina la prevalencia de L.monocytogenes en muestras de alimentos varía entre el 1 y el 10%3, se cree que este dato podría estar subestimado o subreportado debido a la dificultad en las búsquedas microbiológicas, la falta de sospecha de la presencia de agente por parte de las industrias productoras de alimentos y la ineficacia de los sistemas de reporte6,41. Esta situación se ve reflejada en la actual investigación, donde se observó que, de un total de 1.832 muestras, se obtuvieron 226 aislamientos compatibles con L.monocytogenes, que representa una positividad del 12,33% en matrices alimentarias.
La epidemiología de L.monocytogenes difiere según las partes del mundo, las distintas zonas urbanas de un mismo país y los hábitos de consumo de la población. A su vez las herramientas microbiológicas disponibles y los esfuerzos de los sistemas de vigilancia en detectar al patógeno son claves para conocer mejor la epidemiología de la enfermedad. El porcentaje de positividad en esta investigación, si bien fue más alto que el estimado para nuestra región, es menor del 20%, valor propuesto por investigaciones realizadas en China sobre alimentos crudos de mercados minoristas47. Un valor comparable se ha documentado en Chile, donde L.monocytogenes estuvo presente en el 10% de las 2.647 muestras de alimento analizadas (principalmente, de carnes y RTE)42. Según lo expuesto, podría comprobarse la hipótesis de que existe una probable subestimación de datos con respecto a las prevalencias publicadas, tanto en otras partes del mundo como por los organismos de reporte argentinos.
Teniendo en cuenta la cantidad de aislamientos compatibles con L.monocytogenes en cada una de las matrices, la positividad presentó el siguiente orden decreciente: cárnicos (n=154; 68,1%), RTE (n=48; 21,2%), helados (n=16; 7,1%), lácteos (n=5; 2,2%) y vegetales congelados (n=3; 1,3%). Todas estas matrices se encuentran enmarcadas en la legislación argentina vigente, que exige la ausencia de este patógeno en 25g de muestra, excepto la categoría helados, la que, hasta el momento, carece de dicha exigencia12.
Se serotipificaron 161 aislamientos compatibles con L.monocytogenes provenientes de 16 establecimientos de distintas zonas productivas del país. Se detectó que el serogrupo mayoritario fue el IIb (n=107; 66,5%), con frecuencias más bajas le siguieron el IIc (n=36; 22,4%), y, por último, el IIa y el IVb (n=9; 5,6% cada uno). Si bien la PCR múltiple propuesta no distingue entre los serovares 3a, 3b, 3c, 4a, 4c, 4e, 4d, 4h y 7, estos son muy poco frecuentes en los alimentos y rara vez se han detectado en listeriosis humana16.
En comercios minoristas e industrias de alimentos del Uruguay, Braga et al.7 encontraron como mayoritario al serotipo 1/2b y señalaron que esto podría deberse a que dicho serotipo permanece viable durante períodos prolongados. Por otro lado, en Chile, un informe de Paduro et al.38 muestra a los serotipos 4b (40%) y 1/2a (31,2%) como los más frecuentemente detectados en muestras de alimentos y entre aislamientos clínicos. Por otra parte, tanto Wu et al.47 en productos crudos como Yu et al.48 en productos de comercios minoristas en China describieron que el serotipo mayoritario fue el 1/2a, con el 45,2%, seguido del 1/2b, con el 30,6%, del 1/2c, con el 16,1%, y, por último, del 4b, con el 5,2%.
Teniendo en cuenta lo detectado en distintas partes del mundo y lo observado en la presente investigación, el serogrupo mayoritariamente aislado es variable según la región geográfica27, la matriz4 y el establecimiento28, y esto se encuentra estrechamente relacionado con la capacidad de L.monocytogenes para adherirse a superficies y elementos de trabajo y persistir en estos, y para resistir a los sanitizantes34. En relación con esto, en esta investigación se detectaron 64 aislamientos compatibles con L.monocytogenes (22,7%) provenientes de 282 muestras correspondientes a monitoreos ambientales en plantas elaboradoras de alimentos listos para consumo, embutidos y lácteos. Además, la serotipificación de todos los aislamientos de L.monocytogenes obtenidos (matrices alimentarias y monitoreos ambientales) indicó como preponderante al serogrupoIIb. Esto refuerza la idea de que existiría una contaminación de los alimentos en los establecimientos y a lo largo de la cadena productiva, lo cual se relacionaría directamente con las superficies y los instrumentos de trabajo contaminados y con la escasez de buenas prácticas de manufactura.
Los productos cárnicos se consideran una de las principales fuentes de transmisión de L.monocytogenes, y se debe destacar que la alta prevalencia en carne y derivados sugiere que la contaminación, probablemente, ocurra durante el procesamiento. Se detectó que el porcentaje de positividad fue del 68,1%. La subcategoría de carne bovina cruda representó un 14% de la positividad de los productos cárnicos, a diferencia de lo estimado por Liu et al.27 en China, quienes documentaron una prevalencia del 8,5%. Se observó, además, que el 85,3% de los aislamientos correspondió al serogrupoIIb (n=29), luego al IIc (n=4; 11,8%) y al IIa (n=1; 2,9%).
En otra investigación efectuada en la región en carne picada cruda, se observó la siguiente distribución de serotipos: 1/2c, 57,6%; 1/2b, 18,7%; 4b, 12,9%; 1/2a, 6,5%, y 4a/4c, 4,3%)28. Las razones de esta diferencia podrían radicar en la matriz de estudio y en los proveedores involucrados en el abastecimiento de la carne cruda. Esto último toma relevancia si tenemos en cuenta que la gran mayoría de las contaminaciones en los alimentos estudiados se relacionaron íntimamente con las condiciones sanitarias de los establecimientos.
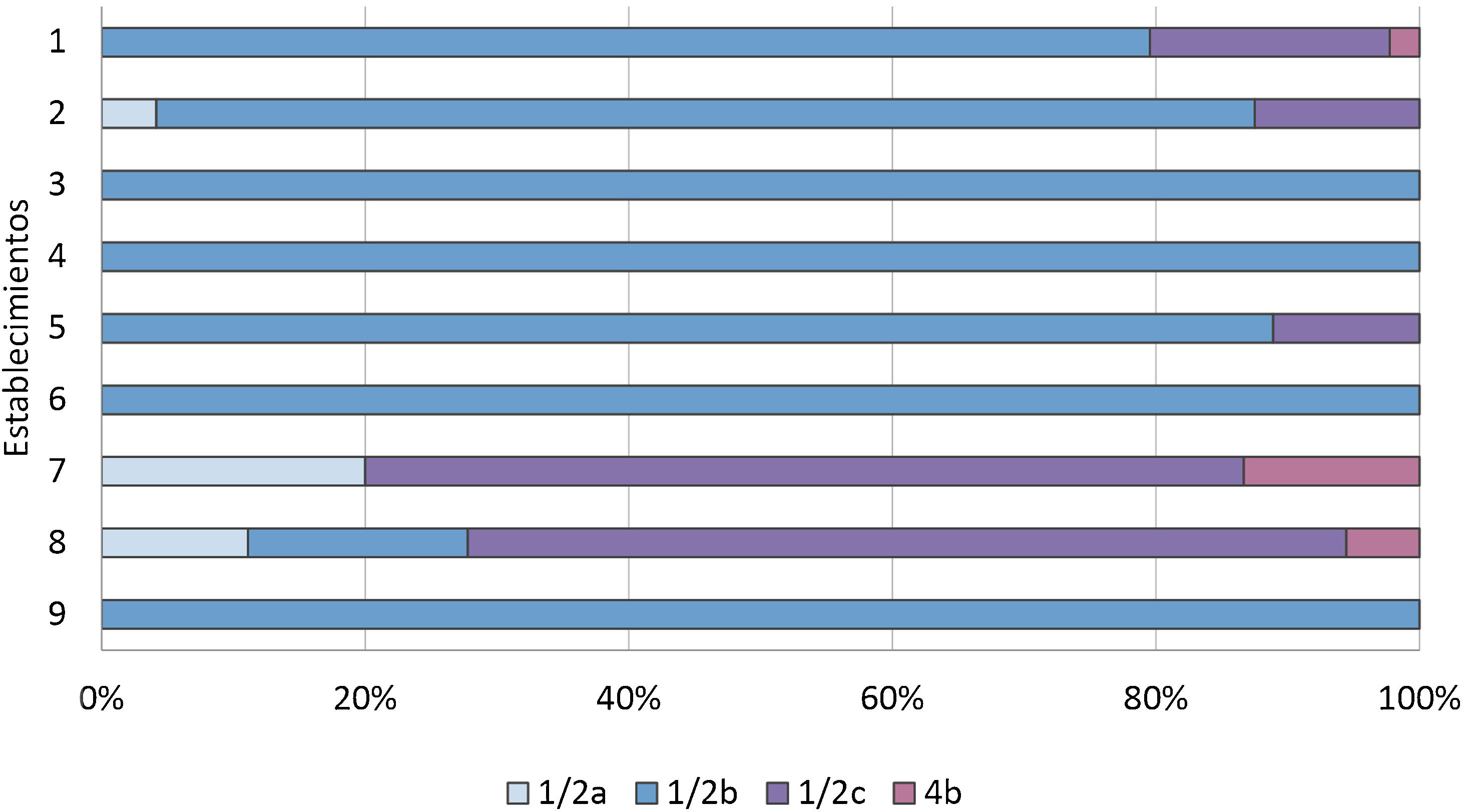
Otro de los principales vehículos de Listeria son las aves de corral, que pueden propagar este microorganismo al medioambiente. L.monocytogenes se ha informado en diferentes productos avícolas, crudos y cocidos24. En esta investigación se observó un 40,4% de positividad en rebozados de pollo, resultado comparable con el de Schäfer et al.43, quienes informaron una tasa de contaminación en muestras de muslo de pollo del 44,19%. Además, se detectó como serogrupo mayoritario en este tipo de muestras el IIc (n=12; 66,7%), seguido del IIb (n=3; 16,7%), del IIa (n=2; 11,1%) y del IVb (n=1; 5,6%). Estos resultados difieren de los que informan otros investigadores: en algunos casos, el serotipo 1/2b fue el más frecuentemente hallado49, y en otros fue el 4b el serotipo predominante en productos avícolas17. Por otro lado, se detectó diversidad de serogrupos provenientes de un mismo establecimiento productor de rebozados de pollo (establecimiento8), lo que podría implicar que el proveedor de materias primas no sería uno solo (fig. 1).
Proporción de serogrupos identificados en matrices cárnicas según establecimientos (expresado en porcentaje). Establecimiento 1 (n=35IIb, n=8IIc, n=1IVb); Establecimiento 2 (n=1IIa, n=20IIb, n=3IIc); Establecimiento 3 (n=1IIb); Establecimiento 4 (n=2IIb); Establecimiento 5 (n=8IIb, n=1IIc); Establecimiento 6 (n=2); Establecimiento 7 (n=3IIa, n=10IIc, n=2IVb); Establecimiento 8 (n=2IIa, n=3IIb, n=12IIc, n=1IVb); Establecimiento 9 (n=24IIb).
La subcategoría de chacinados arrojó un porcentaje de positividad del 18,5% y el serogrupo mayoritariamente hallado fue el IIc (n=8; 61,5%), seguido del IIb (n=3; 23,1%) y del IIa (n=2; 15,4%). Para algunos investigadores, el procesamiento y la producción de chacinados en sí ha demostrado ser una causa importante de contaminación39.
En la subcategoría de embutidos, detectamos una tasa de positividad de L.monocytogenes del 27%, porcentaje comparable con los datos surgidos de investigaciones previas como las de De Cesare et al.15 y Mureddu et al.37, con prevalencias del 28,2% y del 31,5%, respectivamente. En esta matriz detectamos principalmente al serogrupo IIb (n=27; 84,4%), al IIc (n=2; 6,25%), al IVb (n=2; 6,25%) y al IIa (n=1; 3,1%). Este resultado difiere del reportado por Mureddu et al.37, ya que en ese estudio fue el serotipo 1/2c el más prevalente (43%), seguido de los serotipos 1/2a (40%), 4b (8,6%) y 1/2b (8,6%). A pesar de nuestro hallazgo, en un análisis sobre consumo de embutidos fermentados y riesgo de listeriosis en Argentina se concluyó que la protección que otorga el actual criterio microbiológico argentino para los embutidos fermentados y la paleta de cerdo curada en seco garantiza la inocuidad de estos productos8.
El consumo de productos RTE se encuentra en crecimiento debido al estilo de vida de los ciudadanos23. En la presente investigación se detectó un 21,2% de L.monocytogenes en esta matriz, porcentaje mayor que el observado por Szymczak et al.45, que fue del 13,5%. Además, el serogrupo mayoritario fue el IIb (n=32; 74,4%), seguido por el IIc (n=10; 23,3%) y por el IVb (n=1; 2,3%). El serogrupo IIb se encuentra asociado a la mayoría de los brotes de enfermedades transmitidas por los alimentos y es un grave problema de salud pública23,46.
Es importante destacar que la categoría helados presentó un porcentaje de positividad del 7,01% y el serogrupo IIb fue el mayoritario (n=11; 73,3%), seguido del IVb (n=4; 26,6%). Teniendo en cuenta que la legislación argentina no exige la búsqueda de L.monocytogenes en helados, y destacando la particularidad de este patógeno de resistir a bajas temperaturas9 y de persistir mediante la formación de biopelículas en este tipo de matrices y sus entornos de producción21, se considera que es de vital importancia poner foco en esta categoría. Existen precedentes de brotes asociados al consumo de helados contaminados con L.monocytogenes en muchas partes del mundo5,11,36. Debido a la forma de consumo, haber detectado al serogrupo IIb en helados (27%) y productos lácteos (25%) expone un grave problema para la salud de la comunidad.
Otras industrias que pueden verse afectadas por L.monocytogenes son aquellas productoras de vegetales congelados, debido a que estos alimentos no están sometidos a tratamientos térmicos diseñados para la eliminación del patógeno del producto final19. En la presente investigación se obtuvo un porcentaje de positividad de L.monocytogenes en vegetales congelados del 1,3%; los serogrupos detectados fueron el IIa (n=1) y el IIb (n=1), en iguales proporciones (tabla suplementaria 1).
Considerando que el serogrupo IIb de L.monocytogenes fue el mayoritariamente aislado en nuestra investigación, independientemente de la matriz y el establecimiento involucrado, cobra fuerza la idea de que este serogrupo podría presentar cierta ventaja evolutiva que favorecería su instalación en los ambientes de producción25. Asimismo, se hipotetiza que ciertas serovariedades de L.monocytogenes podrían causar contaminación persistente y aumentar el riesgo de contaminación del producto final14. En esta investigación pudimos detectar que en los establecimientos en donde se procesa una mayor cantidad de matrices (establecimientos5 y7) hubo mayor variabilidad de serogrupos, lo que podría indicar que el abastecimiento de materias primas fue de diferentes orígenes, lo que, sumado a las características únicas de este patógeno en cuanto a persistencia en los ambientes e insumos, da como resultado un amplio abanico de serogrupos (fig. 1). Además, los resultados de los monitoreos ambientales que acompañaron a parte de estas matrices y que fueron analizados en el mismo laboratorio corroboran dicha persistencia en diversidad de superficies, así como la resistencia a agentes sanitizantes y la contaminación cruzada entre los alimentos cuando se utilizan las mismas máquinas y espacios sin una efectiva descontaminación previa.
Actualmente, tanto en Argentina como en Estados Unidos y en la Unión Europea se considera a todas las cepas de L.monocytogenes potencialmente patógenas. Los avances futuros en la asociación de determinados marcadores de virulencia con los diferentes grupos genéticos permitirán mejorar la evaluación de riesgos de la enfermedad que causa este microorganismo, teniendo en cuenta no solo la definición de la especie sino también la de los subtipos virulentos30. Identificar la subespecie de L.monocytogenes entre las cepas que producen listeriosis es primordial para controlar y prevenir la enfermedad.
ConclusionesLos antecedentes con respecto al patógeno Listeria monocytogenes en nuestro país son escasos; esta es la primera investigación que involucra diversidad de matrices y orígenes. Este estudio presenta vital relevancia, sienta precedente en el país y destaca la necesidad de profundizar las políticas públicas de control y refuerzo de la vigilancia epidemiológica en Argentina. La implementación y la difusión de las buenas prácticas de control en las industrias productoras de alimentos, conjuntamente con la educación del personal responsable y la vigilancia de L.monocytogenes, contribuirán al control de este patógeno y de la enfermedad que produce.
FinanciaciónLa presente investigación ha sido completamente financiada por Stamboulian Servicios de Salud.
Conflictos de interesesLas autoras declaran que no presentan ningún conflicto de intereses.
Este estudio se realizó en los Laboratorios de Higiene y Seguridad Alimentaria y Ambiental, Stamboulian Servicios de Salud, cuyo apoyo es muy reconocido.