Objetivo: Describir la prevalencia y las características clínicas de la hiperfosfatasemia transitoria (HT) en una cohorte de lactantes y preescolares sanos.
Métodos: Realizamos un análisis secundario de los datos de lactantes y preescolares sanos incluidos en un estudio de la epidemiología de la deficiencia de vitamina D. Entre 2005 y 2007, reclutamos a niños entre 8 y 24 meses de edad durante las visitas de puericultura en una consulta pediátrica urbana de asistencia primaria. A la inclusión recogimos datos de las características sociodemográficas y clínicas.
Medimos las concentraciones séricas de la fosfatasa alcalina (PA), la 25-hidroxivitamina D, la hormona paratifoidea (PTH), el calcio, el magnesio y el fósforo. Asignamos a los participantes a una de 3 categorías según la concentración sérica de PA: normal (PA 110-400 U/l), intermedia (PA > 400 a 1.000 U/l) e HT (PA > 1.000 U/l). Utilizamos el test exacto de Fisher y el análisis de la variancia para evaluar las diferencias de las características entre los 3 grupos.
Resultados: Nueve (2,8%) de los 316 niños tuvieron una concentración de PA > 1.000 U/l (media 2.165 U/l). Dieciséis niños (5,1%) tuvieron una concentración sérica intermedia de PA (media 544 U/l).
La media de las puntuaciones z del peso respecto a la edad, la talla respecto a la edad y el peso respecto a la talla fue similar en los 3 grupos de PA. Comparados con los 291 niños sin HT, los niños de los grupos de PA intermedia y HT tuvieron unas concentraciones séricas medias similares de 25-hidroxivitamina D, PTH, calcio, magnesio y fósforo.
Conclusiones: La HT parece ser una situación relativamente frecuente en los lactantes y preescolares sanos. La HT no se asoció con las medidas antropométricas, el estado de la vitamina D, la PTH o los minerales séricos. El reconocimiento de esta situación benigna es importante para evitar investigaciones innecesarias.
La hiperfosfatasemia transitoria (HT) es una situación caracterizada por un aumento temporal de la fosfatasa alcalina (PA) sérica en ausencia de enfermedad ósea o hepática. Los rasgos característicos de la HT definidos por Kraut et al1 son: edad de presentación < 5 años; ausencia de otras pruebas de enfermedad ósea o hepática en la exploración física o los análisis de laboratorio; aumento de las isoenzimas PA óseas y hepáticas, y regreso a la normalidad de la concentración sérica de PA antes de 4 meses.
No todos los casos publicados cumplen esta definición, y no se conoce bien la epidemiología de la HT. La mayoría de los estudios publicados corresponde a revisiones retrospectivas de la historia clínica de los pacientes evaluados por síntomas o alteraciones médicas específicas2-4, a menudo en centros de asistencia terciaria5-7. El único estudio prospectivo, realizado en 1966 sobre lactantes y preescolares finlandeses, publicó una incidencia de HT del 1,5%8. Algunos autores han propuesto factores de riesgo asociados con la HT, como el antecedente de una infección viral2,4, el fracaso de crecimiento2,4 o cambios recientes en el estado de vitamina D7. Sin embargo, estos factores de riesgo fueron identificados a partir de datos retrospectivos, habitualmente sin grupo de control, lo que plantea la posibilidad de que un sesgo de selección pudiera explicar los hallazgos.
El objetivo de nuestro estudio fue describir la prevalencia y las características clínicas de la HT en una cohorte de lactantes y preescolares sanos incluidos prospectivamente. Supusimos que la estación de la presentación (un posible marcador de la infección viral), las medidas antropométricas del niño y su estado de vitamina D podrían asociarse con la prevalencia de la HT.
PACIENTES Y MÉTODOSParticipantes en el estudioLa inclusión en el estudio se realizó entre octubre de 2005 y junio de 2007, y se ha descrito con anterioridad8. En pocas palabras, realizamos un análisis secundario de los datos de los niños de 8 a 24 meses de edad incluidos prospectivamente en un estudio de la epidemiología de la deficiencia de vitamina D. Los niños fueron elegibles para el estudio si acudieron al Children’s Hospital Primary Care Center, una consulta urbana de asistencia primaria, para una visita de puericultura en la que se planeó una extracción de sangre de rutina. Excluimos a los niños con enfermedad crónica o que utilizaron medicamentos que alteran el metabolismo óseo.
De los 380 participantes incluidos en el estudio principal excluimos los análisis de 44 niños con deficiencia de vitamina D9 (25-hidroxivitamina D sérica ≤20 ng/ml), porque esta deficiencia pudo provocar un hiperparatiroidismo con aumento asociado de secreción de PA. Otros 15 niños no se sometieron a la determinación de la PA sérica por falta de muestra. Por lo tanto, la muestra final fue de 316 niños. Los padres o tutores de todos los participantes otorgaron el consentimiento informado a su inclusión. El comité de Ética del Children’s Hospital de Boston aprobó el protocolo del estudio.
Recogida de datosEn la entrevista inicial recogimos datos de la edad, el sexo, el peso y la talla del niño y de la raza/etnia y la escolarización alcanzada por la madre. Mediante los patrones nacionales de referencia calculamos las puntuaciones z de la talla respecto a la edad, el peso respecto a la edad y el peso respecto a la talla10. El laboratorio clínico del Children’s Hospital midió las concentraciones séricas de PA, calcio, magnesio y fósforo mediante una determinación en un analizador múltiple (Roche Diagnostics, Indianápolis, IN). Los laboratorios ARUP (Salt Lake City, UT) midieron la concentración sérica de 25-hidroxivitamina D mediante una determinación quimioluminiscente (Liasion [Dia-Sorin Inc., Stillwater, MN]). Los valores de PTH intacta se midieron mediante un inmunoensayo de quimioluminiscencia en 2 puntos (Nichols Institute, San Clemente, CA). Las muestras fueron analizadas en varias determinaciones. Los coeficientes de variación de la interdeterminación fueron del 5,4% al 7,0% para la PTH, 8,6% al 10,0% para la 25-hidroxivitamina D, 0,67% para la PA y del 1,5% al 2,22% para los cationes9.
Nos pusimos en comunicación con el pediatra de asistencia primaria de cada uno de los participantes con HT para solicitar un seguimiento de la concentración sérica de PA. Recogimos los datos de la situación médica y de los valores de laboratorio de seguimiento de la historia clínica electrónica.
Asignamos a los participantes en una de 3 categorías según sus concentraciones séricas de PA: normal (PA 110-400 U/l), intermedia (PA > 400 a 1.000 U/l) y alta (PA > 1.000 U/l). Definimos la HT como una concentración sérica de PA > 1.000 U/l6 (grupo de PA elevada).
Análisis estadísticoComparamos las diferencias de las características maternas y del niño entre los 3 grupos de PA mediante el test exacto de Fisher para las variables categóricas y el análisis unilateral de la variancia para las variables continuas. Definimos la presentación durante el otoño y el invierno por la fecha de inclusión entre los meses de octubre y marzo9. Respecto a las medidas antropométricas comparamos las diferencias de las puntuaciones z medias del peso respecto a la edad, la talla respecto a la edad y el peso respecto a la talla; también comparamos la proporción de niños de cada grupo de PA con puntuaciones z inferiores a –2,0, una definición habitual del fracaso de crecimiento11. Realizamos to-dos los análisis con SAS 9.1 (SAS Institute, Inc., Cary, NC).
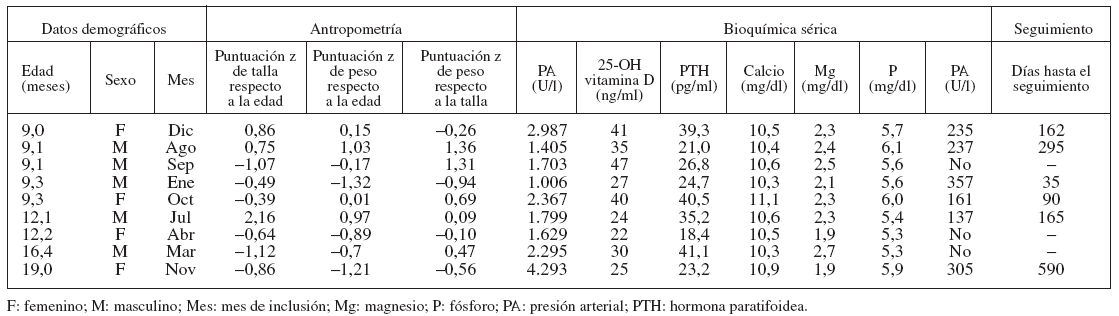
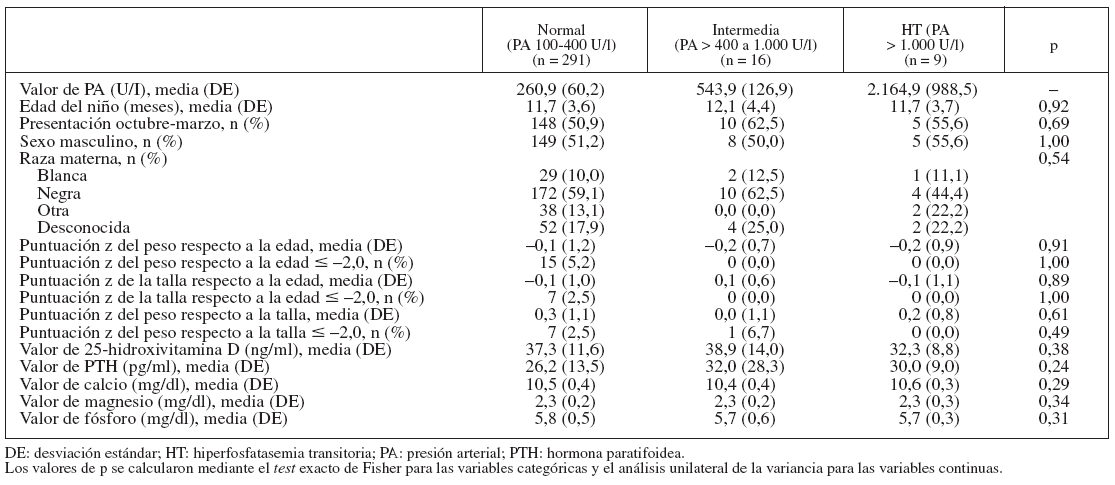
RESULTADOSLas tablas 1 y 2 muestran las características de los 3 grupos de PA. Nueve (2,8%) de los 316 niños tuvieron HT, con una concentración sérica de PA > 1.000 U/l (límites 1.006-4.293 U/l). Dieciséis niños (5,1%) tuvieron una concentración sérica intermedia de PA, con un valor medio de 544 U/l (límites 423-825 U/l). La edad de los niños con HT osciló entre 9,0 y 19,0 meses. La raza/etnia y la escolarización de la madre fueron similares en los 3 grupos.
TABLA 1. Características descriptivas de 9 pacientes con HT (PA sérica > 1.000 U/l)
TABLA 2. Comparación de las características basales en los grupos de PA normal, intermedia y HT
La media de las puntuaciones z de la talla respecto a la edad, el peso respecto a la edad y el peso respecto a la talla no difirió según la concentración sérica de PA. Ninguno de los participantes del grupo HT, y sólo un niño del grupo intermedio de PA, tuvo una puntuación z del peso respecto a la talla inferior a –2,0, comparado con 7 niños (2,5%) en el grupo de PA normal. Ninguno de los niños de los grupos de PA intermedia o de HT tuvo una puntuación z del peso respecto a la edad o la talla respecto a la edad inferior a –2,0. La media de la concentración de 25-hidroxivitamina D, calcio, magnesio y fósforo fue similar en los grupos de PA normal, intermedia y HT.
En el grupo de HT, 6 de 9 niños (67%) tenían antecedente de síntomas de las vías respiratorias altas (n = 3), exantema (n = 2) o diarrea (n = 1) en el mes anterior al diagnóstico de HT. La proporción de niños incluidos en los meses otoñales e invernales (octubre a marzo) de los grupos de PA intermedio (62,5%) y de HT (55,6%) fue ligeramente mayor que en el grupo de PA normal (50,9%), aunque estas diferencias no fueron estadísticamente significativas (p = 0,69).
Confirmamos que la concentración sérica de PA de seguimiento fue normal en 6 de los 9 niños con HT. El menor intervalo hasta el regreso a un valor normal de PA fue de 35 días.
ANÁLISISEn esta cohorte de lactantes y preescolares sanos incluidos prospectivamente encontramos una prevalencia de HT del 2,8%. La incidencia de la HT en la infancia puede superar el 2,8%, como indica la prevalencia del 5,1% de un aumento intermedio de la PA sérica entre 400 y 1.000 U/l. Este grupo de PA intermedia puede representar a los niños con una HT en desarrollo o en resolución. Nuestros datos indican que la HT es una situación relativamente frecuente; el reconocimiento de esta situación es importante para evitar investigaciones innecesarias.
El único estudio que estimó la frecuencia de HT en lactantes y preescolares sanos incluyó a 260 lactantes finlandeses nacidos en 1963 en un ensayo de suplemento con vitamina D, siguiéndolos prospectivamente hasta los 15 meses de edad8. Se midió la PA sérica de cada participante en 3 momentos: de 2 a 4, de 4 a 7 y de 11 a 15 meses de edad. El estudio informó de una sustancial pérdida de seguimiento: de los 260 lactantes observados entre 2 y 4 meses de edad, 186 (71,5%) acudieron al seguimiento a los 4 a 7 meses de edad y 85 (32,6%) al de 11 a 15 meses de edad. El número de nuevos casos de HT detectados en cada momento fue 3 (1,2%) de 260 entre los 2 y 4 meses de edad, 2 (1,1%) de 186 entre los 4 y 7 meses de edad y 3 (3,5%) de 85 entre los 11 y 15 meses de edad. La incidencia global de HT fue del 1,5%; aunque la sustancial pérdida de seguimiento y la ausencia de datos entre los 7 y 11 meses indican que el estudio pudo infravalorar la verdadera incidencia de HT en esta cohorte.
Otros dos pequeños estudios prospectivos de 20 a 50 niños ingresados en el hospital no pudieron detectar casos de HT4,12; el pequeño tamaño de la muestra de estos informes pudo conducir a un error de muestreo. Los niños de < 2 años de edad parecen congregar la mayoría de los casos publicados4, y tanto nuestro estudio como el finlandés se restringieron a niños de < 2 años de edad. Nuestros hallazgos probablemente infravaloraron la prevalencia de HT en niños de hasta 5 años de edad, definida por Kraut et al1. Además, se ha informado de HT en niños de más de 5 años de edad y, en raras ocasiones, en los adultos13-15.
Las estimaciones de prevalencia también dependen del aumento de la PA utilizado para definir la HT. Como en un informe reciente6, definimos la HT como una concentración sérica de PA > 1.000 U/l, valor correspondiente a 2,5 veces el límite superior de referencia en relación con la edad; también identificamos un grupo de PA intermedia, con una concentración sérica entre 400 y 1.000 U/l. El estudio finlandés de lactantes y preescolares definió la HT como una concentración sérica de PA > 20 unidades de Bessey, Lowry y Block8 (límites 2535 unidades). Las diferencias metodológicas en la determinación de PA impidieron la comparación directa de nuestra definición de HT con la utilizada en el estudio finlandés16. Muchos informes no describen una definición a priori de la HT, pero los casos publicados la identificaron como una concentración sérica de PA superior al doble del límite superior de referencia respecto a la edad4,5. En la mayoría de los estudios no queda claro si no se detectó o no se informó de los niños con concentración sérica de PA inferior al doble del límite superior de referencia en relación con la edad. Si el grupo de PA intermedia identificado en nuestro estudio representa a los niños con HT en desarrollo o en resolución, los estudios que excluyeron a este grupo infravaloraron la prevalencia de la HT.
Nuestros hallazgos no apoyan la asociación entre fracaso de crecimiento y HT, como proponen varios informes retrospectivos2,4,17. Es difícil comparar los estudios, porque la mayoría no define la expresión “fracaso de crecimiento” mediante criterios antropométricos objetivos, sino que la basan en diagnósticos clínicos habitual-mente poco definidos2,4,17. Observamos que las medidas antropométricas de los niños, confrontadas con los datos de referencia nacionales estadounidenses, no difieren entre los niños con valores normales, intermedios o elevados de PA. Nuestros hallazgos concuerdan con un estudio de observación sobre 40 niños checoeslovacos que mostraron una media normal de la puntuación z del peso respecto a la edad (–0,65) y de la talla respecto a la edad (–0,84) en el momento del diagnóstico de la HT18. Suponemos que la asociación antes publicada del fracaso de crecimiento con el riesgo de HT puede explicarse en parte por un sesgo de selección, por la probabilidad de que los niños con fracaso de crecimiento se sometan a análisis de sangre.
La teoría de la asociación de la infección viral con el desarrollo de la HT está apoyada por la agrupación de los diagnósticos de HT durante los meses otoñales5,7 o invernales6, así como por las investigaciones de laboratorio que confirman una infección viral o protozoaria reciente2. Behúlová et al5 observaron un agrupamiento estacional de casos, ya que el 43% de los 194 casos de HT en Eslovaquia apareció entre septiembre y noviembre, y un estudio británico sobre 25 casos mostró un patrón similar7. Los casos de un estudio australiano sobre 21 casos de HT se agruparon en los meses invernales6. Nuestro estudio es el primero en examinar esta teoría comparando la estación de presentación en lactantes y preescolares sanos con y sin HT, y no pudimos confirmar la predilección estacional antes publicada en revisiones retrospectivas de los casos de HT.
Durante el mes anterior a la inclusión, dos terceras partes de los participantes en nuestro estudio con HT mostraron síntomas compatibles con una infección viral. Esta estimación de la prevalencia de los síntomas no debe estar alterada por un sesgo de recuerdo, porque estos datos de síntomas se notificaron antes del diagnóstico de HT. Aunque esta prevalencia de síntomas puede parecer elevada, es probable la existencia de una gran prevalencia de síntomas respiratorios y gastrointestinales en los lactantes y preescolares que acuden a visitas de puericultura. Los datos indican que los lactantes y los preescolares padecen de 2 a 8 episodios anuales de infección respiratoria aguda19,20, con una incidencia máxima durante el primer año de vida21. La incidencia de enfermedad diarreica aguda en los niños de < 2 años de edad se ha estimado en 1 a 3 episodios por niño y año22.
No encontramos una asociación entre el estado de vitamina D y el riesgo de HT. Observamos una concentración media de 25-hidroxivitamina D similar en los 3 grupos de PA, lo que concuerda con un estudio que informó de valores normales de 25-hidroxivitamina D en 7 niños con HT23. Nuestros hallazgos contrastan con los de Crofton7, que informó que los niños con HT observada entre octubre y enero tuvieron una mayor concentración media de 25-hidroxivitamina D (55,4 nmol/l o 22,1 ng/ml) que un grupo de control de niños hospitalizados (media 30,9 nmol/l o 12,4 ng/ml). Al restringir nuestros análisis a los 109 niños incluidos entre octubre y enero no encontramos diferencia de los valores de 25hidroxivitamina D entre los 3 grupos de PA (p = 0,42, datos no ofrecidos). En el estudio de Crofton7, el bajo valor medio de 25-hidroxivitamina D del grupo de control concuerda con la deficiencia en vitamina D, y su estado clínico no se describe detalladamente. Los menores valores de vitamina D del grupo de control de este estudio pueden explicarse por un sesgo de selección en los niños del grupo de control, que padecían alteraciones clínicas suficientemente graves para limitar su exposición al sol o su ingestión de vitamina D.
El mecanismo del aumento de la PA sigue siendo controvertido. En las personas se ha identificado 4 isoenzimas de la PA: tisular inespecífica, que se encuentra en el hígado, el hueso y el riñón; placentaria; intestinal y de la célula germinal24. En la HT parece aumentar el valor de la isoenzima hepática, ósea, o ambas1,2,7. El aumento de la PA sérica en la HT puede originarse en un aumento temporal de la liberación de PA del hígado o del hueso, o en un aumento de la sialilación de la enzima, que provoca una disminución de la eliminación hepática de la circulación7,18. La PA sérica ósea se correlaciona directamente con la actividad osteoblástica, aunque también puede aumentar en situaciones con escasa formación ósea, como el raquitismo25. La osteocalcina sérica, otro marcador de la formación ósea, también se ha informado como normal en la HT26. Un estudio alemán26 informó de valores elevados de hidroxiprolina urinaria, un marcador de la resorción ósea, en 1 de 5 sujetos con HT, un estudio checoeslovaco27 en 3 de 5 sujetos y otro informa28 en 11 de 33 niños con HT. Ninguno de estos estudios pareció haber controlado respecto a la ingestión dietética de colágeno, que pudo influir sobre los valores urinarios de hidroxiprolina29. Cinco de 6 niños que desarrollaron HT tras un trasplante hepático o renal tuvieron valores normales de PTH30 y se informó de una proporción urinaria normal de hidroxiprolina/creatinina en un chico de 15 años de edad31. En nuestro estudio, los similares valores medios de calcio, magnesio, fósforo y PTH en los grupos de PA no apoyan el aumento de resorción ósea en los niños con HT.
Estudios adicionales, de mayor tamaño, que utilicen marcadores biológicos óseos más específicos pueden ayudar a determinar si el metabolismo óseo contribuye al aumento de la PA sérica en la HT. En la formación ósea, la concentración sérica de propéptidos procolágeno de tipo I carboxi o aminoterminales refleja la síntesis de nuevo colágeno; los marcadores específicos de la resorción ósea incluyen la excreción urinaria de metabolitos específicos del colágeno no influida por la ingestión dietética de colágeno, como los enlaces cruzados de α-1 fijado a péptido a α-2-N-telopéptido, o el enlace cruzado c-telopéptido32. En un análisis de 33 niños con HT, los enlaces cruzados de procolágeno sérico carboxiterminal de tipo I y c-telopéptido fueron normales o estuvieron ligeramente elevados28.
Es necesario reconocer y considerar las fortalezas y las limitaciones de este estudio. Las fortalezas del estudio son el diseño con recogida prospectiva de datos, los datos antropométricos disponibles y los marcadores bioquímicos del metabolismo del calcio y la vitamina D, incluyendo la 25-hidroxivitamina D, la PTH y los minerales séricos. Examinamos rigurosamente la asociación entre los supuestos factores de riesgo y la prevalencia de HT, incluyendo el agrupamiento estacional, el fracaso de crecimiento y el estado de la vitamina D. Nuestro estudio también tuvo algunas limitaciones. El protocolo inicial de inclusión no incluyó el análisis de las isoenzimas ni la medición de otras enzimas hepáticas o la realización de pruebas de la función hepática. Sin embargo, los casos de HT no presentaron síntomas o signos evidentes de otra enfermedad hepática u ósea y cubrieron los demás criterios habitualmente aceptados para el diagnóstico de la HT1. Los criterios de exclusión del estudio y los valores normales de PA en el seguimiento también apoyaron el diagnóstico de HT. Otra limitación del estudio fue el relativamente escaso número de casos de HT, lo que pudo explicar nuestra imposibilidad de confirmar una predilección estacional en la presentación. No pudimos determinar la concentración sérica de seguimiento de la PA en la mayoría del grupo de PA intermedia, lo que limita nuestra capacidad de describir la historia natural de estos niños. Resultaría útil contar con estudios prospectivos adicionales sobre mayores datos poblacionales para determinar la historia natural del grupo de PA intermedia y la incidencia de HT.
CONCLUSIONESLa HT parece ser una situación relativamente frecuente en lactantes y preescolares sanos. La prevalencia de HT no se asoció con las medidas antropométricas o los marcadores bioquímicos del metabolismo del calcio y la vitamina D. Esta situación se resuelve sin intervención. Por lo tanto, no recomendamos la determinación rutinaria de la concentración sérica de PA para detectar sistemáticamente la HT en los lactantes y los preescolares sanos. Si incidentalmente se detecta una elevada concentración sérica de PA en un lactante o un preescolar sano sin rasgos clínicos sugerentes de enfermedad hepática u ósea, recomendamos repetir la determinación al cabo de unos meses para confirmar la resolución. El reconocimiento de esta situación benigna es importante para evitar investigaciones adicionales innecesarias.
AGRADECIMIENTOSEste trabajo fue financiado por la Allen Foundation, la McCarthy Family Foundation, la beca M01-RR-2172 de los National Institutes of Health al Children’s Hospital Boston General Clinical Research Project y el proyecto T71 MC00009 del Maternal and Child Health Bureau, US Health Resources and Services Administration. Los patrocinadores del estudio no intervinieron en el diseño del estudio, la recogida y el análisis de los datos ni la preparación o la remisión del manuscrito.
Correspondencia: Susanna Y. Huh, MD, MPH, Children’s Hospital Boston, Division of Gastroenterology and Nutrition, 300 Longwood Ave, Boston, MA 02115, Estados Unidos.
Correo electrónico: susanna.huh@childrens.harvard.edu