La polineuropatía desmielinizante inflamatoria crónica (CIDP) se define como una neuropatía inmunomediada con recaídas y remisiones o un curso progresivo en el tiempo superior a 2 meses. En la mayoría de los casos el tratamiento con glucocorticoides, inmunoglobulina intravenosa (IgIV) o plasmaféresis (PE) permite la estabilización del cuadro clínico o logra la remisión completa.
Un grupo de pacientes, sin embargo, bien es refractario a dichos tratamientos o dependiente de los mismos, convirtiéndose en verdaderos desafíos, por lo cual hay necesidad de opciones terapéuticas eficaces y seguras como segunda o tercera línea de tratamiento.
ObjetivoEl objetivo de la siguiente revisión es analizar la eficacia y la seguridad del rituximab y otros inmunomoduladores propuestos para el tratamiento de la CIDP refractaria.
DesarrolloSe realizó una revisión de la literatura científica sobre los distintos tratamientos en la CIDP. Para la búsqueda bibliográfica se utilizaron las bases de datos PubMed y Cochrane, utilizando como palabras claves: azatioprina, ciclofosfamida, micofenolato, CIDP y rituximab. Se incluyeron artículos en inglés, francés y español. Finalmente se seleccionaron 33 artículos.
ConclusionesEl rituximab es una buena opción terapéutica en aquellos pacientes con CIDP refractaria que requieren tratamientos de segunda línea, siendo particularmente efectivo en las nodo-paranodopatías seropositivas. Aunque no existen trabajos comparativos entre los inmunosupresores de segunda línea randomizados doble ciego, el rituximab demostró una considerable efectividad, escasos efectos adversos y potencialmente menor tiempo de respuesta, en comparación con otros agentes inmunomoduladores utilizados.
Chronic inflammatory demyelinating polyneuropathy (CIDP) is defined as an immune-mediated neuropathy with relapses and remissions or a progressive course over time greater than 2 months. In most cases, treatment with Glucocorticoids, intravenous immunoglobulin (IVIG) or plasmapheresis (PE) allows stabilization of the clinical picture or achieve complete remission. However, a group of patients is either refractory to these treatments or depends on them, becoming real challenges, for which there is a need for effective and safe therapeutic options as a second or third line of treatment.
ObjectiveThe objective of the following review is to analyze the efficacy and safety of rituximab and other proposed immunomodulators for the treatment of refractory CIDP.
DevelopmentA review was carried out on the scientific literature that addressed the topic of treatment of CIDP. The PubMed and Cochrane databases were used for the bibliographic search. Keywords: Azathioprine, Cyclophosphamide, Mycophenolate, Inflammatory Demyelinating Polyneuropathy, Rituximab. Articles in English, French and Spanish were included. Finally, 33 articles were selected.
ConclusionsRituximab is a good therapeutic option in those patients with refractory CIDP who require second-line treatments, being particularly effective in seropositive node-paranodopathies. Although there are no comparative studies between double blind randomized second line immunosuppressants, rituximab demonstrated considerable effectiveness, few adverse effects, and potentially shorter response time, compared to other immunumodulatory agents used.
La polineuropatía desmielinizante inflamatoria crónica (CIDP) se define como una neuropatía inmunomediada con recaídas y remisiones o un curso progresivo en el tiempo superior a 2 meses.
La etiología y la fisiopatología de la CIDP es desconocida, pero la evidencia disponible indica que en la patogénesis del daño a la mielina periférica están involucrados mecanismos inmunológicos que incluyen respuestas mediadas por células B y T1.
La inmunidad celular es sugerida por encontrar que la desmielinización está mediada por la invasión y la eliminación (delaminación) de la mielina por células T y macrófagos. La inmunidad humoral es sugerida por la inducción de desmielinización en animales por IgG o sueros de pacientes con CIDP, y por el hallazgo de anticuerpos contra P0 (proteína cero), proteína de mielina P2, proteína de mielina periférica 22 (PMP22) o neurofascina en una minoría de pacientes2.
Las fibras nerviosas mielinizadas de pacientes con CIDP muestran depósitos de inmunoglobulina y complemento, lo que también indica un proceso mediado por anticuerpos2.
Varios estudios sugieren que factores genéticos contribuyen al desarrollo de la CIDP. Las células B en pacientes con CIDP exhiben alteración de la expresión del receptor inhibidor de Fc-gamma IIB, que es fundamental para el equilibrio entre tolerancia y autoinmunidad. La apoptosis de las células T por la expresión del receptor de Fas (una proteína de superficie con un dominio citoplasmático de muerte celular conservado) en su membrana se altera en la CIDP, lo que sugiere un defecto en la desconexión de la respuesta inmune. En la CIDP, el gen SH2DA tiene un bajo número de repeticiones de guanina-adenina (GA) que pueden resultar en una eliminación defectuosa de las células T activadas2.
En el estudio de Vital et al.3, donde reexaminaron las biopsias de nervios periféricos de 42 pacientes con CIDP, 27 varones y 15 mujeres de 9 a 84 años, se concluyó que en todos los casos de CIDP los macrófagos estaban presentes en el endoneuro. La desmielinización asociada a macrófagos es el rasgo característico de las formas desmielinizantes. Por otro lado, las formas axonales primarias aisladas, que se conocen desde 1989, son relativamente frecuentes y propensas a recaídas. De los 42 pacientes 13 tuvieron recaídas y ningún paciente presentó vasculitis, gammapatía monoclonal, tumor, diabetes mellitus, enfermedad de Lyme, neuropatía familiar, VIH o cualquier otra inmunodeficiencia. Esto último sugiere aún más el rol de los mecanismos de inmunidad celular y humoral, así como de anticuerpos y factores genéticos en el desarrollo de la CIDP.
Actualmente se plantea la posibilidad de clasificar algunos tipos de CIDP como nodo-paranodopatías (seropositivas), ya que varios estudios han observado la presencia de anticuerpos contra proteínas nodales y paranodales específicas, como son el caso de neurofascina-155 (NF155), NF140/186, y el complejo contactina-1/proteína-1 asociada a contactina (CNTN1/CASPR1), las mismas que serían el target inmunológico en este grupo de pacientes, en los que se observan características clínicas particulares y poca respuesta al tratamiento convencional2,4,5.
Un subconjunto de pacientes (<10%) con CIDP, con características fenotípicas homogéneas tiene anticuerpos contra las proteínas en el nodo de Ranvier, como CNTN1 y la NF155. La CNTN1 es una proteína paranodal que es esencial para organizar la unión axo-glial y preservar la función del nodo de Ranvier. Se informa que los pacientes con anticuerpos contra CNTN1 presentan una neuropatía agresiva con un fenotipo predominantemente motor, daño axonal al inicio y a diferencia de la mayoría de los pacientes con CIDP, una mala respuesta a la inmunoglobulina intravenosa (IgIV). Es importante que los anticuerpos anti-CNTN1 en estos pacientes sean del isotipo IgG4, ya que en estos, los informes patológicos preliminares y los experimentos in vitro sugieren que pueden ser patógenos4.
La NF155 es la contraparte glial de la CNTN1, y también juega un papel esencial en la estructura y en la función del nodo de Ranvier, son del isotipo IgG4 y están asociados con un fenotipo clínico específico que incluye afectación motora predominantemente distal, temblor de intención prominente de alta amplitud y baja frecuencia, ataxia con características cerebelosas, características desmielinizantes en EMG y malas respuestas a la IgIV4,5.
Se ha informado de una menor cantidad de pacientes con la presencia de anticuerpos anti-CASPR1 con neuropatías inflamatorias de tipo CIDP, con cuadro clínico de intenso dolor neuropático. Si este dolor estaba relacionado con la presencia de anticuerpos anti-CASPR1 necesita confirmación adicional5.
También existen informes de otros autoanticuerpos contra proteínas nodales, como NF186, NF140 y gliomedin, y como los pacientes que albergan una clara correlación clínica-inmunológica, como anti-CNTN1 o anticuerpos anti-NF155, representan <10% de todos los pacientes con CIDP, se enfatiza que muchas dianas de antígeno deben caracterizarse en los ganglios, paranodos, microvellosidades de células de Schwann o vaina de mielina que aún no se han identificado5.
El subconjunto de pacientes que albergan anticuerpos contra las isoformas nodales de NF186 y NF140, comparten características clínicas específicas como glomeruloesclerosis focal y segmentaria. Estos hallazgos necesitan replicarse en otras cohortes de pacientes para determinar la relevancia clínica y las características de la enfermedad asociadas con estos anticuerpos5.
Aunque la proporción de pacientes en los que se pueden detectar autoanticuerpos nodales o paranodales es baja, el reconocimiento de estos tiene varias implicaciones potencialmente importantes. A pesar de que el diagnóstico de CIDP todavía se basa en el uso de criterios estándares, la presencia de anticuerpos identifica un subconjunto de pacientes con fenotipo particular y características clínicas que difieren de los pacientes seronegativos, estos marcadores pueden, por tanto, ayudar al diagnóstico, pronóstico, selección de tratamiento y seguimiento en estos pacientes5.
La presentación clínica clásica es simétrica, con debilidad de músculos proximales y distales, reflejos disminuidos o ausentes y poca afectación de nervios craneales.
Los pacientes con los anticuerpos contra las proteínas del nodo-paranodo suelen mostrar agresividad al inicio de la enfermedad y pueden ser diagnosticados inicialmente como el síndrome de Guillain-Barré (GBS)4,5.
La CIDP tiene una buena respuesta al tratamiento con glucocorticoides, IgIV o plasmaféresis (PE), con estabilización o recuperación del cuadro clínico.
La tasa de respuesta es variable entre las 3 líneas de tratamiento: entre el 40-60% a IgIV, entre el 54-63% a corticosteroides y entre el 53-80% a PE6, entre el 1-20% de los pacientes no responden a ninguno de los 3 tratamientos7.
El abordaje de tratamiento se convierte en un verdadero desafío en el grupo de pacientes no respondedores, en donde hasta un 45% para los tratados con IgIV y un 50% para los tratados con corticoesteroides presentan una recaída en los 6 meses posteriores a la suspensión del tratamiento8,9, algunos siendo refractarios al tratamiento, por lo cual existe la necesidad de terapias alternativas que puedan beneficiar a estos pacientes.
Clasificación de la actividad de la enfermedadUna dificultad a la hora de encarar el tratamiento de la CIDP es que no existe un consenso estricto sobre la definición de CIDP refractaria, sin embargo, la mayoría de los autores la definen como aquella que no respondió o respondió parcialmente a 2 o más inmunoterapias que incluyan IgIV, glucocorticoides, intercambio de plasma, ciclofosfamida, micofenolato y azatioprina10,11.
De igual forma, otra de las complicaciones el tratamiento de la CIDP es determinar cuándo la enfermedad es clínicamente activa o inactiva, para decidir la continuación de la terapia.
Un panel de expertos diseñó un instrumento de estadificación de la actividad de la enfermedad «CDAS» que clasifica a los pacientes en 5 categorías: curado, en remisión, enfermedad activa estable, mejorando y enfermedad activa inestable (tabla 1)12.
Categorías del estado de la enfermedad en CIDP
| Curado | ≥5 años sin tratamiento | A. Examen normalB. Examen anormal, estable/mejorando |
| Remisión | <5 años sin tratamiento | A. Examen normalB. Examen anormal, estable/mejorando |
| Enfermedad activa estable | ≥1 año en tratamiento | A. examen normalB. Examen anormal, estable/mejorando |
| Mejorando | ≥3 meses a <1 año en tratamiento | A. Examen normalB. Examen anormal, estable/mejorando |
| Enfermedad activa inestable | Examen anormal con curso progresivo o recidivante | A. Sin tratamiento previo o <3 mesesB. Tratamiento refractario previoC. Tratamiento en curso |
CIDP: polineuropatía desmielinizante inflamatoria crónica.
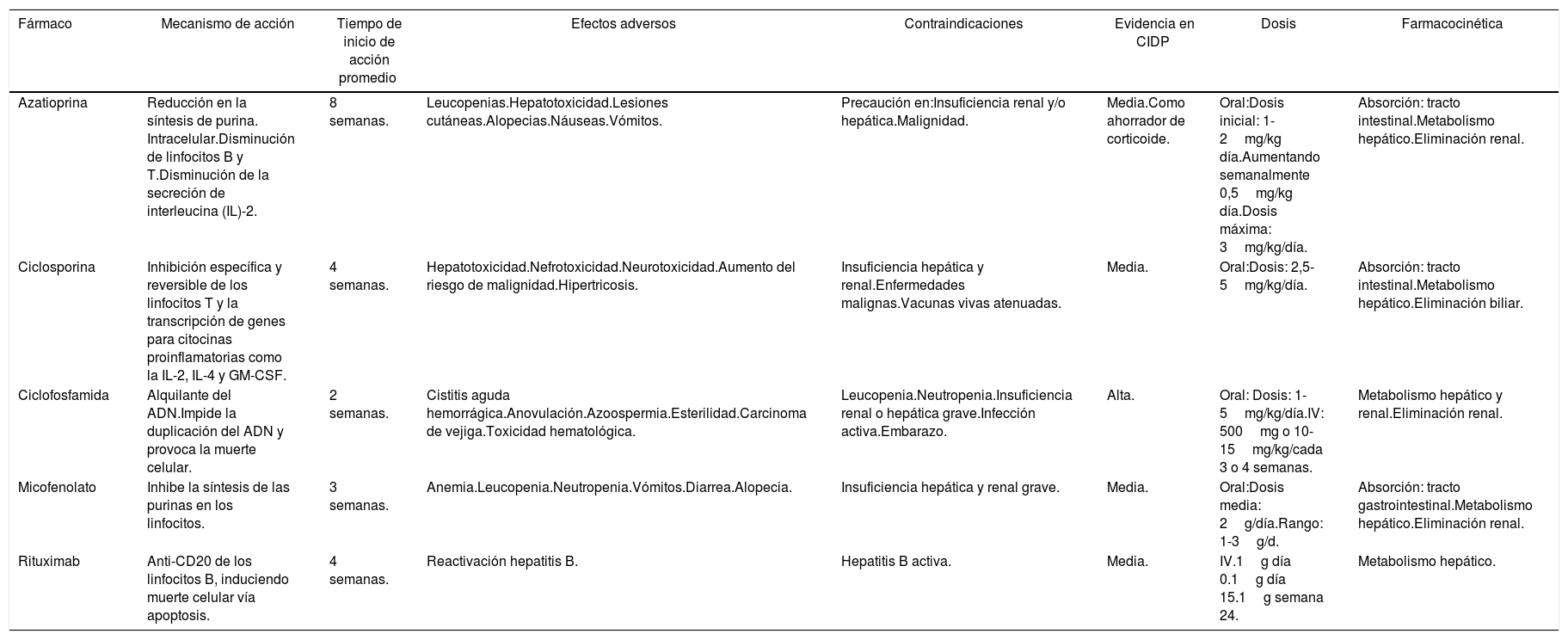
Numerosos inmunosupresores e inmunomoduladores fueron propuestos para el tratamiento de la CIDP. A continuación, se realizará una descripción de los fármacos de segunda línea que tienen mayor nivel de evidencia para el tratamiento de la CIDP (tabla 2).
Características farmacológicas de los diferentes inmunomoduladores
| Fármaco | Mecanismo de acción | Tiempo de inicio de acción promedio | Efectos adversos | Contraindicaciones | Evidencia en CIDP | Dosis | Farmacocinética |
|---|---|---|---|---|---|---|---|
| Azatioprina | Reducción en la síntesis de purina. Intracelular.Disminución de linfocitos B y T.Disminución de la secreción de interleucina (IL)-2. | 8 semanas. | Leucopenias.Hepatotoxicidad.Lesiones cutáneas.Alopecias.Náuseas.Vómitos. | Precaución en:Insuficiencia renal y/o hepática.Malignidad. | Media.Como ahorrador de corticoide. | Oral:Dosis inicial: 1-2mg/kg día.Aumentando semanalmente 0,5mg/kg día.Dosis máxima: 3mg/kg/día. | Absorción: tracto intestinal.Metabolismo hepático.Eliminación renal. |
| Ciclosporina | Inhibición específica y reversible de los linfocitos T y la transcripción de genes para citocinas proinflamatorias como la IL-2, IL-4 y GM-CSF. | 4 semanas. | Hepatotoxicidad.Nefrotoxicidad.Neurotoxicidad.Aumento del riesgo de malignidad.Hipertricosis. | Insuficiencia hepática y renal.Enfermedades malignas.Vacunas vivas atenuadas. | Media. | Oral:Dosis: 2,5-5mg/kg/día. | Absorción: tracto intestinal.Metabolismo hepático.Eliminación biliar. |
| Ciclofosfamida | Alquilante del ADN.Impide la duplicación del ADN y provoca la muerte celular. | 2 semanas. | Cistitis aguda hemorrágica.Anovulación.Azoospermia.Esterilidad.Carcinoma de vejiga.Toxicidad hematológica. | Leucopenia.Neutropenia.Insuficiencia renal o hepática grave.Infección activa.Embarazo. | Alta. | Oral: Dosis: 1-5mg/kg/día.IV: 500mg o 10-15mg/kg/cada 3 o 4 semanas. | Metabolismo hepático y renal.Eliminación renal. |
| Micofenolato | Inhibe la síntesis de las purinas en los linfocitos. | 3 semanas. | Anemia.Leucopenia.Neutropenia.Vómitos.Diarrea.Alopecia. | Insuficiencia hepática y renal grave. | Media. | Oral:Dosis media: 2g/día.Rango: 1-3g/d. | Absorción: tracto gastrointestinal.Metabolismo hepático.Eliminación renal. |
| Rituximab | Anti-CD20 de los linfocitos B, induciendo muerte celular vía apoptosis. | 4 semanas. | Reactivación hepatitis B. | Hepatitis B activa. | Media. | IV.1g día 0.1g día 15.1g semana 24. | Metabolismo hepático. |
CIDP: polineuropatía desmielinizante inflamatoria crónica.
La azatioprina es un inhibidor de la síntesis de purinas y consecuentemente bloquea la síntesis de nucleótidos de adenina y guanina de ADN celular, y finalmente reduce la proliferación de linfocitos B y T, y también reduce la secreción de interleucina (IL)-2. La azatioprina es una prodroga de la 6-mercaptopurina. La 6-mercaptopurina se utilizó inicialmente para prevenir el rechazo de órganos trasplantados, pero luego se demostró que la azatioprina tenía un mejor perfil de seguridad, y desde entonces se ha usado para esta indicación y como inmunosupresor en una diversidad de trastornos autoinmunes13.
Luego de su ingestión, la azatioprina se absorbe en todo el tracto gastrointestinal y es metabolizada en la pared intestinal, el hígado y los eritrocitos a 6-mercaptopurina. Esta a su vez es transformada en intermediarios citotóxicos responsables de la inhibición de la proliferación celular o en moléculas inertes. El balance entre estas 2 especies moleculares determina la eficacia y la tolerancia al tratamiento con azatioprina. Las enzimas xantina oxidasa (XO) y tiopurina S metiltransferasa (TSMT) metabolizan la 6-mercaptopurina en moléculas inertes reduciendo su toxicidad. Por lo tanto, los fármacos que reducen la actividad de la XO como el Alopurinol®, o ciertas variantes genéticas que reducen la actividad de la enzima TSMT, pueden incrementar la toxicidad de la azatioprina y limitar su tolerancia. Evidencia reciente sugiere que la genotipificación y cuantificación de estas enzimas previo a iniciar el tratamiento permitiría ajustar individualmente la dosis de azatioprina para lograr la máxima eficacia con la menor toxicidad13.
La eficacia de la azatioprina en el tratamiento de la CIDP se evaluó en un estudio clínico controlado14, y también existen reportes de casos aislados o series de casos15–18.
En el estudio de Dyck et al., no se detectó un efecto beneficioso significativo con las mediciones de eficacia utilizadas. Sin embargo, considerando que en este estudio se incluyó un número reducido de pacientes y que la duración del tratamiento se extendió solo 9 meses, los expertos sugieren que un estudio de mayor tamaño, con dosis más altas o una extensión del tratamiento de hasta 12 meses aportaría evidencia concluyente para determinar su eficacia14,19.
En el estudio de Cocito et al. donde trataron a 77 pacientes con azatioprina, 21 pacientes fueron respondedores, 16 presentaron efectos adversos y 10 no pudieron continuar con el estudio por efectos adversos18.
La dosis comúnmente utilizada y efectiva para azatioprina es de 100-200mg/día o 1-3mg/kg/día15,18.
Los principales efectos adversos de la azatioprina son leucopenia y hepatotoxicidad. En una serie de 64 pacientes afectados por enfermedad neuromuscular que recibieron azatioprina los efectos tóxicos limitaron las dosis en el 42% y provocaron la discontinuación del tratamiento en el 20% de los casos20.
Otros efectos adversos menos severos incluyen: náuseas, vómitos, diarrea y erupciones cutáneas18,20.
MicofenolatoEl micofenolato de mofetilo (MMF), un pro-fármaco del ácido micofenólico (MPA), en un inicio aprobado por la FDA para la prevención de rechazo de órganos trasplantados, se ha utilizado en varias especialidades clínicas, en particular para el tratamiento de enfermedades reumáticas13.
Se absorbe casi por completo en el intestino delgado, y luego se desesterifica por plasma esterasas para formar MPA, el 98% de este, está unido a proteínas. Solo pequeñas cantidades de MPA entran en las células y una gran proporción de MPA se metaboliza en glucurónido fenólico, que es eliminado en la orina. Los inhibidores de la bomba de protones pueden afectar la absorción de MMF13.
El MPA disminuye la síntesis de guanina, un nucleótido base de purina necesario para la producción de ADN, por lo tanto, en su acción molecular el MPA dificulta la síntesis de ADN, reduce la proliferación de linfocitos y la producción de anticuerpos13.
El MMF ha sido usado en la CIDP en dosis media de 2g/día, con un rango de 1-3g/día21. En otras especialidades ha sido usada a una dosis superior a 7g/día, con efectos adversos similares a la dosis promedio22.
La seguridad del MMF es buena, si bien los efectos adversos como leucopenia, anemia y pancitopenia no son infrecuentes, no está relacionado con efectos adversos graves. En un estudio en el que se siguieron pacientes hasta por 13 años, que incluyo a 85 pacientes con psoriasis, con una edad media al inicio de tratamiento de 44,3 años (rango: 20-73 años), los efectos adversos reportados fueron: gastrointestinales prominentes en los primeros años, 11,6% de los pacientes desarrollaron herpes zóster no complicado, no se observó evidencia clínica de inmunosupresión. Se presentaron 7 neoplasias malignas que surgieron en 6 de los pacientes, que no serían inusuales considerando la edad de la población de estudio. Seis pacientes murieron por condiciones que se cree no están relacionadas con la terapia con medicamentos22,23.
En cuanto a su uso en la CDIP, en un estudio de 8 pacientes con CIDP refractaria, que recibieron MMF (dosis media 2g/día) con un tiempo de duración promedio de tratamiento de 15,2 meses, 6 de estos 8 pacientes pudieron suspender las terapias de primera línea (corticosteroides, inmunoglobulina intravenosa) o reducir sus dosis y frecuencia21.
En otro estudio que se trató con MMF a 12 con CIDP no respondedores a las terapias convencionales, solo 3 pacientes respondieron al MMF, y 3 presentaron efectos adversos menores18.
CiclosporinaLa ciclosporina es un inmunosupresor que actúa particularmente sobre la inmunidad mediada por linfocitos T. Inhibe la transcripción de genes para varias citocinas proinflamatorias como la interleucina-2, interleucina-4 y GM-CSF. Es un péptido lipofílico de 11 aminoácidos, metabolizado en el hígado por la isoenzima 3A4 de citocromo P450. Este hecho explica el riesgo significativo de interacciones medicamentosas24.
La dosis inicial puede ser de 2,5mg/kg/día según el objetivo terapéutico, posteriormente se ajusta a la respuesta clínica y puede aumentarse hasta un máximo de 5mg/kg/día, en particular en ausencia de una respuesta suficiente entre uno y 2 meses en los obesos. En caso de sobrepeso, la asociación con una dieta hipocalórica puede ejercer un efecto terapéutico sinérgico, y la dosis debe calcularse en función del peso corporal ideal24,25.
En cuanto a la estrategia terapéutica, se sugieren 2 posibilidades: o bien un tratamiento en cursos cortos intermitentes 8 a 12 semanas, o bien un tratamiento de mantenimiento continuo a la dosis efectiva más pequeña. Algunos protocolos recomiendan no exceder los 2 años de tratamiento continuado24.
La nefrotoxicidad es el efecto secundario a largo plazo más común de preocupación por ciclosporina. Se manifiesta principalmente en caso de tratamiento crónico. La nefrotoxicidad aguda es reversible al suspender la ciclosporina. Después de varios años de tratamiento, pueden producirse lesiones de fibrosis del parénquima renal24.
También se observa hipertensión arterial, hipertrofia e hipertricosis gingival, y síntomas generales y digestivos que son comunes al inicio del tratamiento: anorexia, náuseas, diarrea, parestesia de las extremidades, dolor de cabeza y temblores24.
Se ha reportado eficacia en la CIDP, aunque los estudios tienen limitaciones metodológicas y los efectos secundarios son considerables como se ha mencionado.
Cocito et al. describieron 12 pacientes tratados con ciclosporina de los cuales 9 no respondieron, 6 presentaron efectos adversos y en 5 se suspendió el tratamiento por dichos efectos18.
Un estudio de 7 pacientes, 6 varones y una mujer; en rango de edad de 22-53 años, con diagnóstico de CIDP refractaria, mostraron una mejora aparente en los síntomas neurológicos junto con una disminución en la proteína total en LCR dentro de los 3 meses posteriores al inicio del tratamiento con el fármaco, aunque se pudieron detectar cambios significativos en pocos parámetros neurofisiológicos. Se consideró que el efecto de la ciclosporina alcanzaba un pico de 3-6 meses después del inicio. No se reportaron efectos adversos de relevancia en este estudio25.
En mujeres embarazadas se puede utilizar ciclosporina, sin embargo, puede aumentar las complicaciones del embarazo como hipertensión arterial, eclampsia y prematuridad, por lo cual se debe tener estrecha vigilancia24.
Tiene varias contraindicaciones como la hipertensión arterial no controlada, insuficiencia hepática y renal, enfermedades malignas y vacunas vivas atenuadas24.
El riesgo de infección se refiere principalmente a la mayor incidencia de infecciones virales (herpes) y foliculitis. La ciclosporina puede promover la progresión de lesiones por papilomavirus del cuello uterino y un mayor riesgo neoplásico referido principalmente a carcinoma de células escamosas en la piel. El linfoma es poco común24.
CiclofosfamidaLa ciclofosfamida es un profármaco biológicamente inactivo que sufre un extenso metabolismo hepático. Los metabolitos activos tienen acciones alquilantes independientes en el ciclo celular, lo que resulta en reticulación de hebras de ADN y, en consecuencia, la inhibición de la replicación de ADN y apoptosis26.
La sensibilidad a la ciclofosfamida difiere entre las poblaciones de células linfoides, y es mayor en las células B que en las células T26.
El metabolismo hepático implica la conversión de ciclofosfamida por las enzimas del citocromo P-450 (CYP) en metabolito activo 4-hidroxiciclofosfamida, que forma y existe en equilibrio con la aldofosfamida. La aldofosfamida se escinde intracelularmente a fosforamida mostaza y acroleína. Estos metabolitos activos ejercen efectos alquilantes del ADN. La ciclofosfamida y sus metabolitos se excretan por vía renal26.
Es muy utilizada por otras especialidades para el tratamiento de neoplasias y enfermedades autoinmunes.
Para el tratamiento de enfermedades autoinmunes, se administra ciclofosfamida por vía oral o IV. La dosis de ciclofosfamida oral generalmente es de 1-5mg/kg por día, rara vez más de 2-2,5mg/kg por día y la duración del tratamiento es variable, no se requiere hospitalización, es más barata que la administración IV y se pueden hacer ajustes de dosis para limitar los efectos secundarios. La terapia IV incluye pulsos de ciclofosfamida, típicamente en dosis de 500mg o 10-15mg/kg de ciclofosfamida (diluida en dextrosa al 5%), administrada cada 3-4 semanas. La frecuencia de los pulsos es a menudo en disminución según la respuesta del paciente, y la duración del tratamiento es variable26.
Revisiones y metaanálisis han sugerido que ciclofosfamida IV es más seguro (menor riesgo de efectos adversos) que los regímenes orales diarios, debido a la reducción de exposición a dosis acumulada, pero los datos no son concluyentes26.
Sobre la ciclofosfamida en la CDIP refractaria, hay reportes de estudios pequeños que indican que es eficaz, sin embargo, por sus severos efectos secundarios potencialmente mortales, debe evaluarse cuidadosamente su aplicación.
Un estudio que administró ciclofosfamida en dosis altas (200mg/kg) a 5 pacientes con CIDP grave definida, con síntomas incapacitantes continuos a pesar del tratamiento con IgIV, PE y corticosteroides, con un seguimiento promedio de 2,9 años, los resultados mostraron una mejoría clínica significativa en 4 de los 5 pacientes reflejada en las escalas de la calidad de vida, también se vio mejoría en los estudios de conducción nerviosa. Permanecieron con estabilización de la enfermedad y fuerza motora, y sin tratamientos inmunomoduladores. No se reportaron los efectos adversos en el estudio27.
En otro estudio en el que se trataron a 13 pacientes con ciclofosfamida, 5 respondieron al fármaco, 2 presentaron efectos adversos y en uno se tuvo que suspender el tratamiento por efectos adversos graves18.
Su perfil de toxicidad se asemeja al de otros agentes quimioterapéuticos. Sus efectos adversos incluyen: Mielosupresión, mayor riesgo de infecciones, teratogenicidad, esterilidad, carcinogénesis (cáncer de vejiga) y cistitis hemorrágica, por tanto, en enfermedades autoinmunes su uso se limita generalmente a casos graves, enfermedades recalcitrantes, donde otros inmunosupresores ahorradores de esteroides han fallado o están contraindicados26.
Las contraindicaciones absolutas incluyen embarazo y mujeres en periodo de lactancia, pacientes en quienes conservar la fertilidad es una preocupación, hipersensibilidad a los medicamentos, depresión de la médula ósea y antecedentes de cáncer de vejiga. Otras contraindicaciones incluyen infección activa y deterioro función hepática o renal26.
RituximabEl rituximab es un anticuerpo monoclonal quimérico (murino/humano), dirigido contra el antígeno CD20, que se encuentra presente en los linfocitos pre-B y B maduros. Provoca la destrucción de las células B a través de la citotoxicidad celular, la activación del complemento y la inducción de la apoptosis. Esta depleción evitaría que los linfocitos B cumplan su papel como células presentadoras de antígeno y, por tanto, activen a los linfocitos T, así como impedir la diferenciación de los linfocitos B en nuevas células plasmáticas que podrían producir anticuerpos autorreactivos y liberar citocinas, con el consecuente daño al sistema nervioso28.
El rituximab se administra por vía IV, y en lo que respecta a la dosificación, se han utilizado diferentes esquemas en enfermedades autoinmunes en neurología, como en otras especialidades, que se pueden ajustar o continuar de acuerdo a la respuesta clínica de cada paciente.
Los esquemas de dosificación más utilizados son: dos ciclos de 1.000mg por vía intravenosa, con un intervalo de 14 días entre ellos, repetido a las 24 semanas28. Dos dosis de 1g con 2 semanas de diferencia y 500mg/cada 6 meses. Dos dosis de 1g de rituximab como inducción seguida de 1g administrado a 3 meses y 6 meses y dosis adicionales cuando el recuento de linfocitos CD19 supere el 1%10.
Otros esquemas incluyen 375mg/m2 en las semanas 0, 1, 2 y 3, así como también 1.000mg por vía intravenosa en las semanas 0, 2, 24 y 2628.
Si bien, la incidencia de efectos adversos en pacientes tratados con rituximab fue alta, la mayoría corresponde a reacciones asociadas a la infusión y de intensidad leve a moderada. Se observó un notable descenso de estas reacciones con las sucesivas infusiones, y se alcanzó un valor comparable o inferior al grupo placebo. Los efectos más comúnmente descritos fueron malestar general, cefalea, náusea, prurito, rubor, fiebre, escalofríos, rigidez, dolor faringolaríngeo, vértigo, fatiga e hipotensión28.
Respecto al riesgo de infecciones, se observó una incidencia similar entre el grupo tratado y placebo. Se describieron con mayor frecuencia infecciones del tracto respiratorio superior y de las vías urinarias. Las infecciones graves fueron poco frecuentes y similares al grupo placebo. No se ha comunicado ningún caso de infección oportunista, específicamente de leucoencefalopatía multifocal progresiva. Tampoco se han descrito casos de reactivación del virus de la hepatitis B, a pesar de ello, y de acuerdo con la ficha técnica, es necesario realizar la detección del virus de la hepatitis B antes de comenzar el tratamiento28.
La mayoría de los reportes en CIDP muestran que tiene similar o mayor efectividad que otros tratamientos inmunomoduladores utilizados históricamente, pero con un tiempo más rápido de inicio de la respuesta al tratamiento y además con efectos adversos menores.
En un estudio monocéntrico en 28 pacientes con CIDP, 21 pacientes (75%) respondieron al rituximab. El tiempo medio ante la respuesta fue de 6 meses. Solo 2 pacientes necesitaban ser tratados nuevamente durante un seguimiento medio de 2 años, sin efectos adversos significativos7.
Benedetti et al., trataron a 13 pacientes con rituximab después de la falla parcial o total de las terapias convencionales. Los resultados arrojaron que nueve pacientes respondieron a rituximab. No se registraron efectos adversos importantes1.
En otro estudio donde se recolectaron datos de CIDP refractaria en 10 centros italianos, se incluyeron un total de 110 pacientes, sometidos a 158 intervenciones terapéuticas con diferentes inmunomoduladores. Setenta y siete fueron tratados con azatioprina, 18 rituximab, 13 ciclofosfamida, 12 micofenolato de mofetilo, 12 ciclosporina, 12 metotrexato, 11 interferón alfa y 3 con interferón beta-1a. El porcentaje de pacientes que respondieron a azatioprina (27%) fue similar al porcentaje de pacientes que respondieron a otras terapias y a rituximab18.
Es de destacar que en la CIDP con características inmunológicas específicas (NF155, NF140/186, CNTN1-CASPR1), se observa poca respuesta al tratamiento convencional, pero buena respuesta al rituximab10,29,30.
Además, el rituximab se asocia con respuestas profundas y duraderas en otras enfermedades mediadas por IgG4, lo que también sugiere que sería eficaz en pacientes con IgG4 anti-CNTN1/NF155 que son resistentes a IgIV y corticosteroides4,5.
Importante mencionar que al momento se están realizando dos estudios fase II sobre la efectividad del rituximab en CIDP; uno es del centro médico de la Universidad de Kansas, en el que refieren que se tratará 3 grupos homogéneos de 16 pacientes con CIDP, cada uno con rituximab para determinar si hay subgrupos en el que pueden eliminarse medicamentos actuales y ponerlos en remisión a largo plazo. Se obtendrán anticuerpos anti-gangliósidos para aprender sobre la patogenia de la enfermedad y posiblemente la terapia dirigida. El otro estudio fase II es de la Universidad de Nagoya en Japón, en el que se evaluara la eficacia y seguridad del rituximab (recombinación genética) por vía intravenosa, administrado a pacientes con CIDP con autoanticuerpo IgG4 positivo o negativo. Esperamos que estos estudios tengan resultados concluyentes respecto al rituximab en CIDP.
Otros inmunomoduladoresSe ha planteado el uso de otros inmunomoduladores como fingolimod, metotrexate, interferón, etanercept, tacrolimus, pero con ninguno de estos hay reportes que indiquen beneficio en la CIDP.
También se ha investigado la eficacia de bortezomib, un inhibidor del proteasoma que aborda tipos de células metabólicas altamente activas, como las células plasmáticas. En una serie de casos de 10 pacientes con CIDP refractarios al tratamiento con ciclofosfamida y rituximab, uno o 2 ciclos de tratamiento con bortezomib (cada ciclo con 1,3mg/m2 administrado subcutáneo los días 1, 4, 8 y 11) estabilizó a 6 de los 10 pacientes durante el tratamiento e incluso mejoró los parámetros clínicos y electrofisiológicos de 4 pacientes hasta un año después. No se informaron efectos secundarios relevantes30. El bortezomib podría ser una opción de tratamiento, pero faltarían estudios concluyentes.
El trasplante autólogo de células madre hematopoyéticas (AHSCT) también se ha utilizado como tratamiento de último recurso en CIDP refractaria, en algunos casos se reportó beneficio, pero no mayor al encontrado en tratamientos convencionales y además se asoció con efectos adversos graves, como riesgo de reactivación del citomegalovirus (CMV) y del virus de Epstein-Barr, enfermedad por CMV, cistitis hemorrágica y pancreatitis31.
Discusión y conclusionesLa CIDP generalmente responde a las terapias convencionales como los glucocorticoides, IgIV y plasmaféresis, y continúan siendo los tratamientos de primera línea, dado que son los que mayor grado de evidencia tienen.
Para la mayoría de los pacientes con CIDP que no han recibido tratamiento previo y que su afectación es importante, o para los pacientes con afectación leve pero que están empeorando rápidamente, se recomienda un tratamiento inmunomodulador inicial con IgIV, recambio plasmático o glucocorticoides. Los efectos secundarios son generalmente menores después del tratamiento con IgIV y potencialmente más frecuentes y graves después del uso prolongado de corticosteroides, además los pacientes pueden tener una respuesta más rápida con IgIV a la observada con los corticosteroides. El intercambio de plasma, aunque eficaz, es invasivo y poco práctico para la mayoría de los pacientes32.
En los pacientes que no responden a terapia convencional o al cambio a esteroides, inmunoglobulinas o plasmaféresis, en primer lugar, es necesario determinar la exactitud del diagnóstico y luego investigar la presencia de comorbilidades, tales como diabetes y/o enfermedades hematológicas que pueden tener una influencia negativa en la respuesta a la terapia convencional17. Un diagnóstico temprano y preciso es importante para iniciar el tratamiento y prevenir un daño adicional a los nervios32.
La tasa de respuesta es variable entre las 3 líneas de tratamiento de primera línea: 40-60% a IgIV, 54-63% a corticosteroides y 53-80% a PE5, 1-20% de los pacientes no responden a ninguno de los 3 tratamientos7.
Para aquellos pacientes que responden de manera parcial a la terapia inicial, se debe sustituir una dosis escalada o una terapia diferente. Por ejemplo, la falta de respuesta a la IgIV podría dar paso a un tratamiento con PE y/o corticoesteroides33.
En aquellos pacientes que son refractarios al tratamiento convencional (no respondió o respondió parcialmente a 2 o más inmunoterapias que incluyan IgIV, glucocorticoides, intercambio de plasma, ciclofosfamida, micofenolato y azatioprina10,11), existe la necesidad de terapias de segunda línea. Entre las alternativas se encuentran: azatioprina, micofenolato, ciclosporina, ciclofosfamida, rituximab, fingolimod, metotrexato, interferón, etanercept, tacrolimus, bortezomib y el trasplante autólogo de células madre hematopoyéticas (AHSCT).
En cuanto al fingolimod, metotrexato, interferón, etanercept y tacrolimus, no hay reportes que indiquen beneficio en la CIDP.
La azatioprina no mostro beneficios considerables en la CIDP14,18,19. El bortezomib ha mostrado beneficio en serie de casos muy pequeñas30, y faltarían estudios que lo respalden.
Fármacos como el micofenolato, la ciclosporina y la ciclofosfamida mostraron en algunos estudios, tener beneficio en la CIDP, pero la demora en el inicio de la respuesta y los efectos adversos graves limitarían su uso, como es el caso del micofenolato en el primer caso18,21–23, y de la ciclosporina y de la ciclofosfamida en el segundo18,24–26.
El AHSCT reportó beneficio, no mayor al de otros fármacos y se asoció con efectos adversos graves31.
El rituximab mostro beneficio en la CIDP refractaria, siendo particularmente efectivo en las nodo-paranodopatías seropositivas específicas (presencia de anticuerpos contra NF155, NF140/186, CNTN1-CASPR1 del isotipo IgG4), las mismas que presentan poca respuesta al tratamiento de primera línea y a otras terapias inmunomoduladoras4,10,20.
Aunque no existen estudios controlados, comparativos, entre los inmunosupresores de segunda línea, en publicaciones recientes basadas en series de casos y nuestra experiencia indica que rituximab es la alternativa preferida, por su eficacia y favorable perfil de seguridad, en comparación con otros agentes inmunomoduladores utilizados4,10,20. Por lo cual nosotros recomendamos la utilización del rituximab como terapia de segunda línea en la CIDP refractaria.
Es relevante el reconocimiento de los anticuerpos contra el nodo-paranodo (NF155, NF140/186 y el complejo CNTN1-CASPR1), ya que tienen varias implicaciones potencialmente importantes, al identificar un subconjunto de pacientes con características particulares y, por tanto, ayudar al diagnóstico, pronóstico, selección de tratamiento y seguimiento en estos pacientes5.
FinanciaciónLos autores no recibieron financiación para la realización del artículo.
Conflicto de interesesLos autores no presentan ningún conflicto de intereses.