La degeneración walleriana (DW) se refiere al proceso patológico de degeneración secundaria de axones y vainas de mielina que ocurre distal al sitio de la lesión aguda en el soma neuronal o axón proximal. Se presenta un caso poco frecuente, de un paciente varón con tumor intracerebral que desarrollo DW, luego de recibir radioterapia externa. Clínicamente presentaba un síndrome de Weber. La resonancia magnética (RM) de cerebro en secuencias FLAIR y T2 el tracto corticoespinal se mostraba hiperintenso. Se presentan los diagnósticos diferenciales y posibles tratamientos.
Wallerian degeneration (WD) refers to the pathological process of secondary degeneration of axons and myelin sheaths that occurs distal to the site of acute injury in the neuronal soma or proximal axon. A rare case is presented of a male patient with an intracerebral tumor who developed WD after receiving external radiotherapy. Clinically, he presented Weber syndrome. Magnetic resonance imaging of the brain in FLAIR and T2 sequences showed hyperintense corticospinal tract. Differential diagnoses and possible treatments are presented.
La degeneración walleriana (DW) se refiere al proceso patológico de degeneración secundaria de axones y vainas de mielina que ocurre distal al sitio de la lesión aguda en el soma neuronal o axón proximal1,2. En el cerebro, puede ocurrir después de una agresión; entre las más frecuentes están el ataque cerebrovascular, esclerosis múltiple, lesión cerebral traumática y hemorragia intracerebral3,4.
Se presenta el caso de un paciente con tumor intracerebral que desarrolló DW sintomática y con cambios en la resonancia magnética (RM) luego de recibir radioterapia externa.
Reporte de casoPaciente varón de 42 años, que debuta con hemiparesia derecha 2/5, se le diagnosticó un oligodendroglioma grado 2, corticosubcortical localizado en el lóbulo frontal izquierdo (fig. 1). Se indicó citorreducción quirúrgica del tumor y posterior radioterapia entregando 5600 cGy en 28 sesiones a nivel del lecho posoperatorio en campos planificados 3D. Posterior al acto quirúrgico, hubo una mejoría en la hemiparesia derecha que era de 4/5. El paciente tuvo una evolución estacionaria tanto clínica como imagenológica. Después de cinco años posradiación, la hemiparesia derecha se acentuó. El examen clínico neurológico mostró el globo ocular izquierdo dirigido hacia abajo y afuera, con ptosis palpebral izquierda, hemiparesia derecha 2/5, reflejos miotáticos del hemicuerpo derecho ligeramente aumentados con respecto al lado contralateral, el reflejo cutáneo plantar en flexión bilateralmente (fig. 2). Una RM mostró en secuencias T2 y FAIR la expansión conocida con señal hiperintensa que se extendían desde el parénquima subcortical frontal izquierdo, infiltrando mesencéfalo ipsilateral hasta la protuberancia (fig. 3). Estos hallazgos se interpretaron compatibles con DW inducida por el tratamiento radiante. El paciente recibió tratamiento corticosteroideo con dexametasona 8mg cada 24 horas durante 1 mes; asimismo, 10 sesiones de terapia con oxígeno hiperbárico (TOHB), en sesiones de 60 minutos/día. Continuó en seguimiento por un año sin mostrar cambios clínicos e imagenológicos.
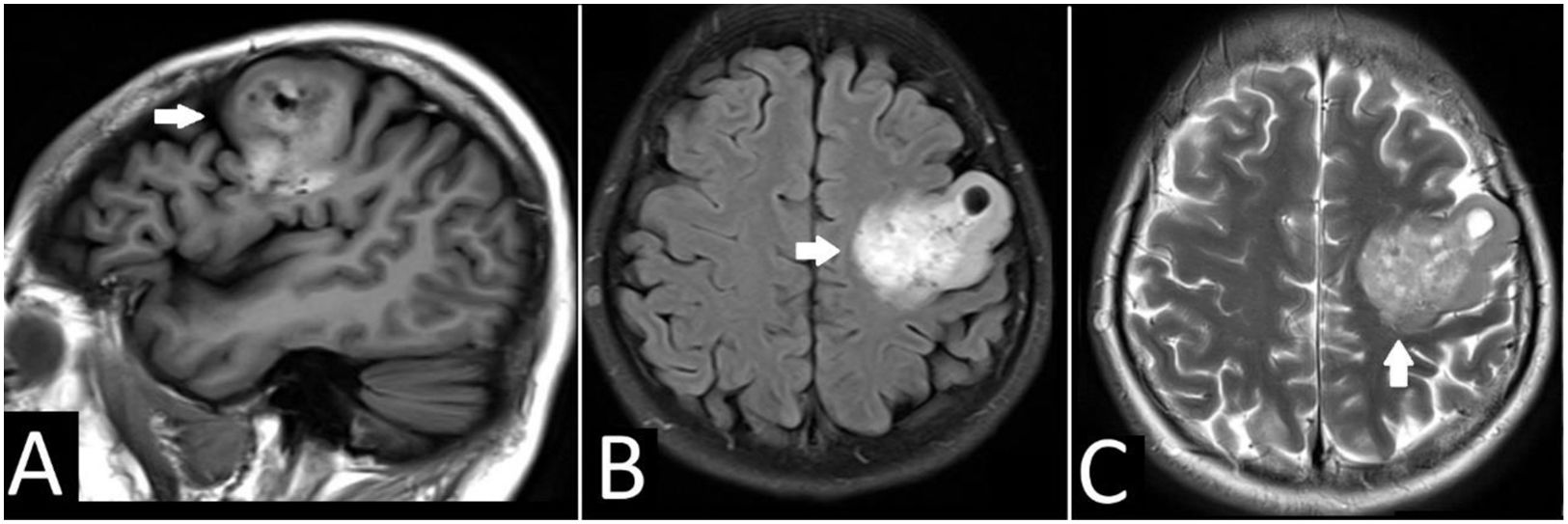
Resonancia magnética cerebral. A) Corte sagital, en secuencia en T1, con una gran masa frontal izquierda (flechas blancas). B) En la secuencia T2 – TIRM se observa hiperintensidad heterogénea con quiste intratumoral. C) En la secuencia T2 – TSE se observa la afectación de la corteza y sustancia blanca.
Se solicitó al paciente que mire al frente; el ojo izquierdo se desvía hacia afuera acompañado por una ptosis palpebral incompleta por compromiso del III nervio craneal ipsilateral (se muestra hiperintenso en la Figura 3B).
Resonancia magnética cerebral. A) Corte coronal, en secuencia en T2, con señal hiperintensa en la vía cortico espinal izquierda (flechas blancas), compatible con degeneración walleriana en tercera fase. B) En la secuencia FLAIR se observa hiperintensidad a nivel del pie del pedúnculo cerebral izquierdo (obsérvese el III nervio craneal hiperintenso). C) En la secuencia FLAIR, a nivel del pie protuberancial izquierdo.
El daño axonal secundario (DAS) o degeneración neuronal distal son términos que definen el proceso de desmielinización y desintegración de una neurona o un circuito neuronal como consecuencia de una lesión localizada a distancia. Existen dos tipos de DAS, la DW y la degeneración transináptica. La DW es una cascada de eventos bioquímicos catabólicos mediados por una respuesta inmune innata a la lesión neuronal5. También se denomina degeneración ortógrada o anterógrada, ya que este proceso se aleja del cuerpo celular. Lleva el nombre del neurofisiólogo Augustus Volney Waller, quien describió el proceso en 18501,2. La agresión a la neurona puede deberse a diversas etiologías como infarto cerebral, hemorragia, necrosis, desmielinización, traumatismo, tumor, química o radiación3,4.
La afectación de la vía corticoespinal puede presentarse a diferentes niveles, habitualmente con síntomas de hemiparesia faciobraquiocrural; en la ubicación mesencefálica con III nervio craneal ipsilateral afectado, y en protuberancia con VII nervio craneal y hemiparesia contralateral6. En el caso aquí presentado, la vía corticoespinal se vio afectada desde el lóbulo frontal hasta la protuberancia (fig. 3). En su paso por el mesencéfalo configuró un característico síndrome alterno de Weber.
Se encuentra establecido su presentación, en eventos vasculares, siendo visible a las dos semanas el edema y la disociación de los lípidos libres con la grasa neutra7. El proceso catabólico ocurre en cuatro pasos: La primera etapa implica la degeneración de los axones y las vainas de mielina con reclutamiento de macrófagos y liberación de factores de necrosis tumoral e interleucinas (0 a cuatro semanas). En la segunda etapa, se produce una rápida destrucción de los fragmentos de proteína de mielina degenerada, mientras que los lípidos permanecen intactos (cuatro a 14 semanas). En tercera etapa, la degeneración de lípidos de la mielina produce gliosis (> 14 semanas). En la etapa final (4ta. etapa), hay atrofia de los tractos de sustancia blanca (ocurre en meses o años)5,7. Sin embargo, en el escenario de posradioterapia, no se tiene intervalo exacto de presentación8.
Es conocido que el tratamiento radiante a nivel cerebral, en especial el holocraneal, provoca daños neurológicos a largo plazo, afectando en especial el sistema límbico. Sin embargo, la irradiación parcial del cerebro, como en nuestro paciente, tendría menos efectos secundarios por la preservación de estructuras mediales. Sin embargo, existe evidencia que la irradiación ionizante provoca daño en los tractos de fibras blancas que están compuestas por axones mielinizados9,10.
Debe aclararse que la presencia de DW puede ser consecuencia del quirúrgico; cuando se presenta suele hacerlo antes de los seis meses posteriores a la resección tumoral11. Asimismo, se puede utilizar la RM con la secuencia tensor de difusión (DTI) en el pre y posquirúrgico, como predictor sobre cuáles pacientes tendrán una buena recuperación del tracto corticoespinal12. En nuestro caso, no desarrolló complicaciones posquirúrgicas que pudiera asociarse a la DW, ni presentó empeoramiento neurológico durante el primer año postratamiento. Estas condiciones alejan la causa quirúrgica y abre la del efecto adverso tardío neurológico de la radioterapia al presentarse luego de cinco años del tratamiento. La lesión cerebral inducida por la radioterapia puede provocar daño en la red microvascular, desmielinización y una respuesta inflamatoria con activación de astrocitos y microglia. Los cambios moleculares y celulares agudos como la neuroinflamación, pueden provocar efectos secundarios a largo plazo que pueden no manifestarse meses o años después del tratamiento13,14. Es así que su baja incidencia de presentación se vincula estrechamente con la expectativa de vida de los pacientes con tumores cerebrales. En Los casos con tumores de bajo grado con una expectativa de sobrevida mayor al año, pueden observarse los efectos adversos neurológicos a largo plazo de la radiación ionizante y cambios en las neuroimágenes, tal como ocurrió con el paciente aquí presentado.
La tomografía computarizada (TC) y RM, son técnicas ampliamente disponibles que puede usarse. En la TC aparece como hipodensidad a lo largo de la vía del tracto cortico espinal en fases avanzadas. La RM es importante en el diagnóstico temprano, evaluando cambios patológicos y químicos. Mientras que los valores de difusión anisotrópica, se han utilizado como marcadores de inflamación para determinar la integridad de la mielina neuronal en la sustancia blanca, que puede ser correlativa de rendimiento cognitivo14. La secuencia DTI con la tractografía, puede proporcionar información del estado microestructural de la sustancia blanca de forma objetiva y cuantitativa15–18. La secuencia DTI podría ser útil en pacientes con ataque cerebrovascular en el periodo agudo, ya que podría ser un predictor sobre la recuperación de la función motora. En el escenario de DW posradioterapia no está establecido ya que el periodo agudo pasa desapercibido19.
La RM se correlaciona con cambios histológicos y metabólicos, clásicamente estudiados en pacientes post accidentes cerebrovasculares, ya que post radioterapia es escasa. Se describe que, en la primera fase, no suele haber signos. En la segunda fase, desde el día 20 hasta dos a cuatro meses, resulta en una señal hipointensa en secuencias de tiempo de repetición largo e identificándose mejor en secuencia densidad protónica por el mejor contraste con el fondo de sustancia blanca íntegra. En la tercera fase, la reabsorción de lípidos, gliosis y cambios en el contenido produce aumento de señal en secuencia T2 y FLAIR. En la cuarta fase o fase final, tras varios años existe una pérdida de volumen por atrofia que puede observarse en secuencias morfológicas20 relacionando con el caso, por presentar alta señal en FLAIR y en T2, se asume que el paciente es equivalente a encontrarse en la tercera fase de DW, teniendo un daño permanente de la vía cortico espinal (fig. 3).
Desde un punto de vista terapéutico, no existen recomendaciones para la DW posradioterapia, como tampoco cómo prevenirla. Se han utilizado diversos tratamientos para secuelas neurológicas posradiación, como TOHB, anticoagulantes, antiagregantes plaquetarios y corticosteroides, con respuestas dispares (nivel de evidencia U)21. En nuestro paciente utilizamos corticosteroides más sesiones de TOHB, evidenciándose una estabilización de la DW.
Actualmente no contamos con algún marcador funcional que identifique a las personas susceptibles a una lesión cerebral inducida por radiación. Pero las imágenes seriadas con RM, pueden ser una herramienta valiosa14. Además, recordar que existen estructuras intracerebrales, en donde su tolerancia probablemente no sea los 54Gy de dosis máxima clásica. Asimismo, se reporta, que al superar la dosis media de 40Gy al cuerpo calloso, se relaciona con disminución de las funciones cognitivas9. Es probable que las estructuras como la capsula interna presenten tolerancias similares. Radica la importancia en aplicar técnica de precisión y ahorro de tejido sano, como al utilizar ciertas modalidades, como radioterapia de intensidad modulada (IMRT), terapia de arco volumétrico modulado (VMAT) y radiocirugía en los pacientes con expectativa de vida mayor a un año. Para prevenir o minimizar la injuria radiante en los hipocampos y su secuela neurocognitiva, se han introducido campos de protección de los hipocampos con técnica de intensidad modulada22, y para prevención del deterioro cognitivo posradioterapia, el uso de memantina como neuroprotector 20mg/día por un año23.
ConclusiónEn la actualidad no existe una recomendación terapéutica para este grupo específico de pacientes, sin embargo, se puede emular el tratamiento de la radionecrosis.
FinanciaciónEste estudio no presentó financiación.
Conflicto de interesesNo existen potenciales conflictos de intereses con esta investigación.
Los autores agradecen a la Universidad Peruana Los Andes, y al Centro Especializado María Auxiliadora.