El mieloma múltiple (MM) es una neoplasia hematológica caracterizada por proliferación de células plasmáticas anormales y producción de paraproteínas, con afectación multisistémica. Puede provocar complicaciones neurológicas, como neuropatía periférica y afectación de nervios craneales. Se presenta un caso de un paciente con MM diagnosticado en 2014, con múltiples líneas de tratamiento y progresiones. Desarrolló debilidad muscular, disartria y síntomas bulbares. Estudios neurológicos sugirieron afección por múltiples mecanismos. A pesar del tratamiento, el paciente presentó deterioro neurológico progresivo y falleció tras broncoaspiración. El caso destaca la complejidad clínica del MM avanzado y sus manifestaciones neurológicas atípicas.
Multiple myeloma (MM) is a hematologic malignancy characterized by the proliferation of abnormal plasma cells and the production of monoclonal proteins, frequently leading to multisystem involvement. Neurological complications, including peripheral neuropathy and cranial nerve involvement, may occur during the course of the disease. We report the case of a patient diagnosed with MM in 2014, who underwent multiple lines of therapy due to successive relapses. Over time, he developed progressive muscle weakness, dysarthria, and bulbar symptoms. Neurological assessment revealed evidence of multifactorial involvement. Despite ongoing treatment, the patient's neurological condition deteriorated, and he ultimately died due to bronchoaspiration. This case underscores the clinical complexity of advanced MM and highlights its potential for atypical neurological manifestations.
El mieloma múltiple (MM) es una neoplasia hematológica caracterizada por la proliferación clonal de células plasmáticas anormales, con capacidad para secretar una inmunoglobulina monoclonal (paraproteína), lo que puede derivar en manifestaciones clínicas multisistémicas. Representa la segunda neoplasia hematológica más frecuente, después del linfoma1.
Es la décima causa de mortalidad por cáncer en términos absolutos, con una tasa estimada de 3,8 muertes por cada 100.000 habitantes por año. La edad media al momento del diagnóstico es de aproximadamente 69años, siendo infrecuente en individuos menores de 50años1.
Los pacientes pueden presentar una variedad de manifestaciones clínicas, entre las que destacan el dolor óseo secundario a lesiones líticas, anemia y disfunción renal. Asimismo, pueden desarrollarse complicaciones neurológicas, ya sea por infiltración directa del sistema nervioso central, o como consecuencia de los efectos neurotóxicos mediados por citocinas o paraproteínas circulantes. La complicación neurológica más frecuente es la compresión medular o radicular secundaria a masas plasmocitarias o colapso vertebral2.
Del 3% al 5% de los pacientes con MM pueden presentar neuropatía periférica. También podrían verse involucrados los nervios craneales3-5.
El mecanismo subyacente a la afectación de los nervios craneales permanece insuficientemente esclarecido. Una hipótesis implica la presencia de plasmocitomas intracraneales, neoplasias localizadas dentro del parénquima cerebral que, asociadas a las lesiones óseas en cráneo o base de cráneo, pueden generar compresión directa de los nervios craneales6.
Se ha observado la presencia de mielomatosis leptomeníngea (LMM) por diseminación hematógena de linfocitos progenitores de las células plasmáticas del mieloma múltiple7,8.
La prevalencia de LMM en estos pacientes ha sido estimada en un 1,1% en una serie de 23 casos, cifra notablemente inferior a la observada en otras neoplasias hematológicas, donde se han reportado tasas de hasta un 75% en la leucemia linfoblástica aguda y del 25% en determinados linfomas9.
Otras etiologías comprenden fracturas vertebrales por compresión, alteraciones metabólicas secundarias al mieloma (hipercalcemia, alteración de la urea, otras), síndrome de hiperviscosidad y amiloidosis, así como la toxicidad y las complicaciones derivadas de las intervenciones terapéuticas.
En un caso reportado de MM con afectación del nervio cranealXII10 se ha postulado que dicha manifestación podría estar relacionada con una destrucción osteolítica severa mediada por citocinas proinflamatorias, en particular la interleucina-1 (IL-1). Esta citocina induce la expresión del ligando del receptor activador del factor nuclear kappa B (RANK-L) en los osteoclastos, promoviendo su activación y aumentando la resorción ósea. En contextos de enfermedad significativamente descontrolada, se evidencia un remodelado óseo exacerbado y lisis ósea generalizada, lo que puede conllevar compromiso del sistema nervioso central por extensión ósea o invasión directa de nervios craneales.
Reportamos un caso de MM con afectación sistémica que se manifestó como paraparesia flácida y síntomas bulbares de curso subagudo. En un principio se sospechó una enfermedad neurodegenerativa; sin embargo, los hallazgos en estudios de neuroimagen y electromiografía (EMG) permitieron descartar dicha hipótesis.
Caso clínicoPaciente de 61años con antecedentes patológicos de hipertensión arterial, dislipemia, síndrome de hipopnea del sueño y MM diagnosticado en junio de 2014 a partir de un control de salud. En 2015 se realizó trasplante autólogo de médula ósea y luego completó 6ciclos de quimioterapia con esquema VCD (bortezomib, ciclofosfamida, dexametasona [DXM]). Por progresión de enfermedad por imágenes inicia esquema VRD (bortezomib, lenalidomida (Revlimid) y DXM) realizando 9ciclos. Se evidenció progresión bioquímica en el año 2020, por lo que realiza 6ciclos de Ixazomib, y luego Elotuzumab/Pomalidomida/DXM. Rota a carfilzomib/DXM en 2023, agregando posteriormente denosumab, realizando 12 ciclos. Se realiza punción aspiración de médula ósea posterior, en la cual se evidencia progresión. Inicia esquema DVTD (daratumumab, bortezomib, talidomida y DXM).
Además de esta terapia sistémica, realizó radioterapia localizada a lesión de fémur derecho en 2022 y en columna dorsolumbar, arterias sacroilíacas en 2024.
En diciembre de 2024 comienza con debilidad en miembros inferiores asociada a lumbalgia y deterioro de la capacidad funcional para actividades de vida diaria. Cinco días después comienza con disartria, por lo que la hematóloga tratante decide internación para estudio y tratamiento.
Al examen físico neurológico de ingreso se encontraba vigil, con leve disartria y cuadriparesia; escala mRC: braquial derecha 3/5, braquial izquierda 4/5, crural derecha 4-/5, crural izquierda 4/5. Sin otras alteraciones.
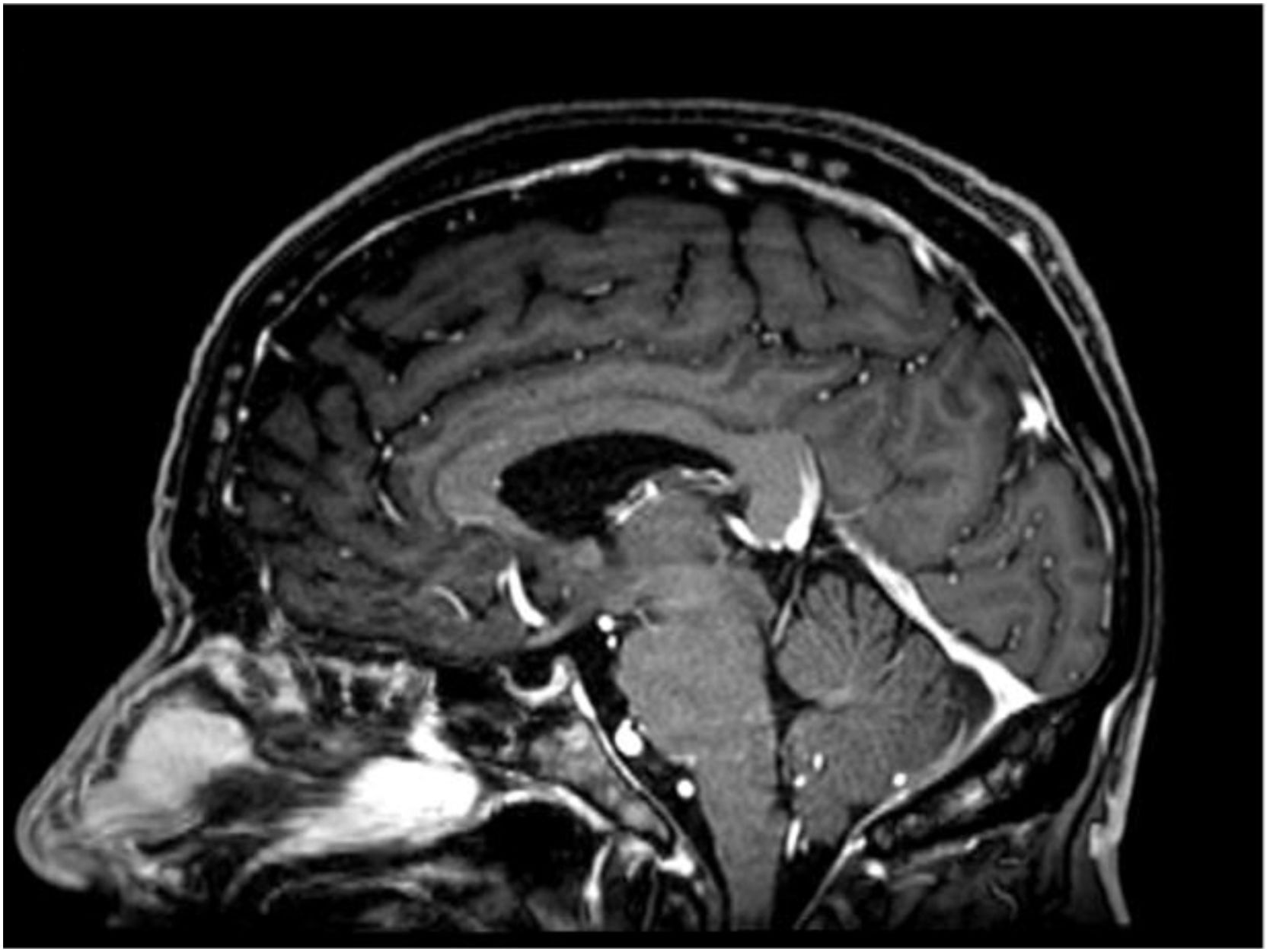
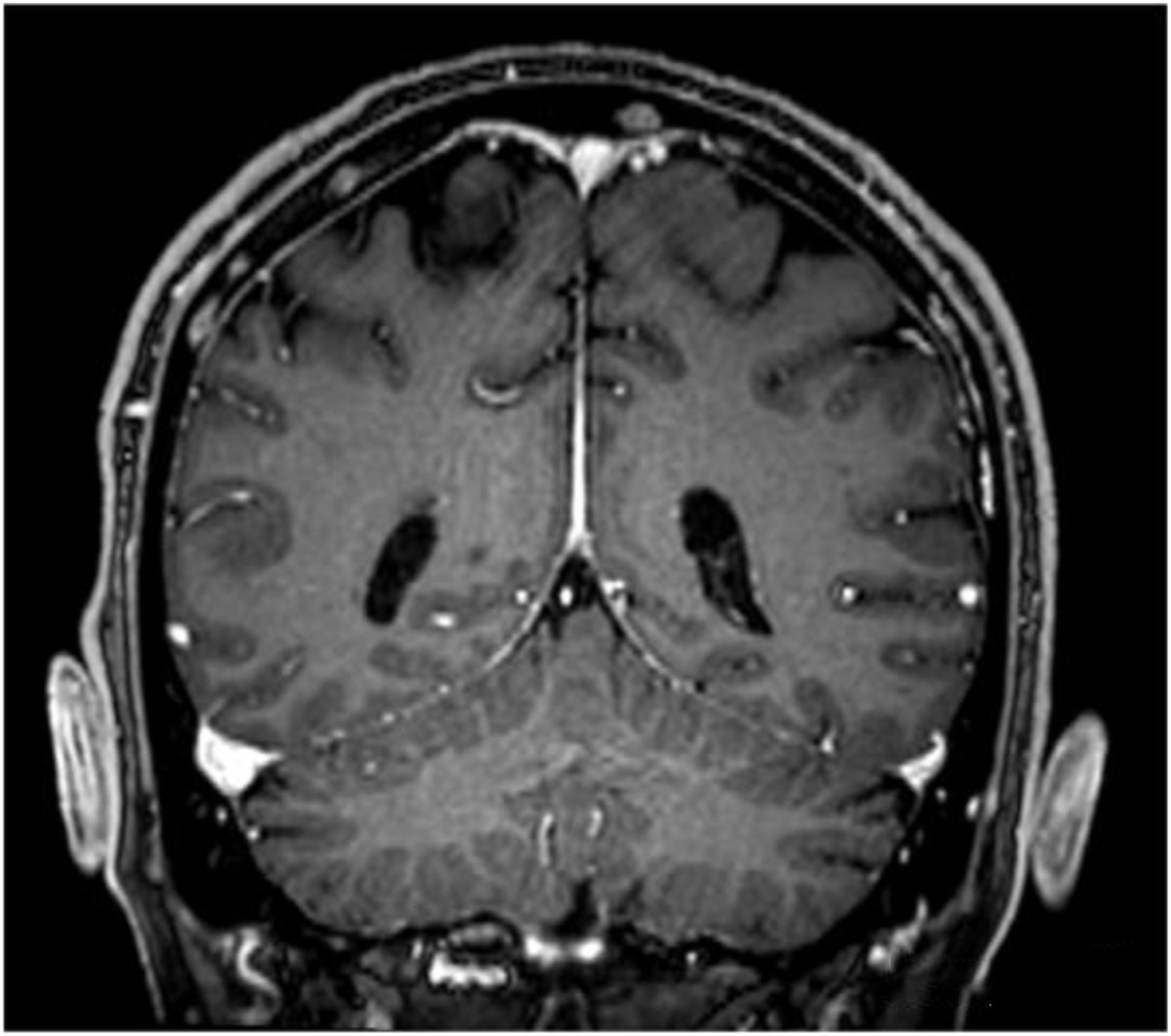
Los estudios de imágenes con contraste solicitados (resonancia magnética nuclear [RMN]) evidenciaron alteración difusa de la señal con múltiples imágenes pseudonodulares en calota y base del cráneo que realzan tras la administración del medio de contraste endovenoso, así como alteración ósea en arcos costales, vértebras dorsales, lumbares, sacro y huesos ilíacos en relación con enfermedad de base, sin alteración de médula espinal y raíces nerviosas (fig. 1).
Se realizó EMG, donde se observó límite inferior normal de CMAP para ambos nervios peroneos comunes y tibial posterior izquierdo, pudiendo revelar una pérdida axonal incipiente de los nervios motores de miembros inferiores (fig. 2).
En análisis sanguíneo presentaba calcemia de 14,1mg/dl, uremia 52mg/dl y una creatinina de 1,48mg/dl. Se interpretó entonces la signosintomatología del paciente como debilidad muscular generalizada secundaria a neuropatía de predominio axonal, principalmente de MMII secundaria a enfermedad de base más probable.
El servicio de Clínica Médica decide alta hospitalaria por presentar mejoría sintomática asociada a correcciones de medio interno.
Un mes más tarde, al presentar dolor intenso en hombros y muslos con marcada impotencia funcional, junto con dificultad para la elevación cefálica, es valorado por la hematóloga de cabecera, que, al objetivar progresión de enfermedad de base en laboratorio de control (componente monoclonal 7,63g/dl para previo de 4,9g/dl), decide nueva internación.
Es evaluado nuevamente por nuestro servicio, donde se objetiva dificultad para la flexión y lateralización cefálica, impotencia funcional de miembros superiores a predominio proximal y paresia escala mRC crural derecha 3/5.
El servicio de Fonoaudiología realiza examen, donde constata musculatura de la mímica con debilidad marcada en músculo orbicular de párpados, paranasales y mecanismo buccinador; debilidad y alteraciones en la coordinación de musculatura lingual, labial, ascenso asimétrico de velo del paladar, y reflejo deglutorio demorado asociado a incoordinación fonorrespiratoria.
Se interpreta como debilidad muscular generalizada probablemente secundaria a polineuropatía paraproteinémica a predominio axonal no IgM (lambda) asociada a su MM (hipercalcemia, anemia y lesiones óseas).
Se inicia pulso de metilprednisolona por alto componente proteico monoclonal y se realizan numerosas transfusiones sanguíneas para el control de la enfermedad.
Por sospecha de patología de placa neuromuscular, y al realizar estimulación repetitiva donde no se evidencia patología, se solicitan anticuerpos contra el receptor de acetilcolina, autoanticuerpos que se dirigen contra la tirosina quinasa muscular (MuSK) y anticuerpos contra los canales de calcio dependientes de voltaje por baja sensibilidad del estudio. Pero al presentar hiperviscosidad sanguínea, no fue posible obtener muestra de suero.
Se realiza prueba de neostigmina, indicando atropina 0,5mgEV. Luego de 30minutos se indica neostigmina 0,5, evaluando al paciente luego de 30minutos de la administración de medicación, sin observar cambios.
Se realiza punción lumbar, en la que se constatan proteínas en líquido cefalorraquídeo (LCR) elevadas (0,06) asociadas a un directo con 1elemento, 100% mononucleares.
La citología del LCR mostró muy aislados linfocitos con ausencia de atipias, siendo negativa para células neoplásicas.
Durante la internación fue evaluado por el equipo de cuidados continuos para el manejo del dolor y el acompañamiento de enfermedad crónica.
Aproximadamente un mes luego de ingresar al hospital intercurre con episodio de broncoaspiración con mala mecánica ventilatoria, desaturación, cianosis periférica y deterioro del sensorio.
Se decide con la esposa priorizar el confort del paciente, y ante la respiración agónica se inicia sedoanalgesia, falleciendo un día más tarde.
ConclusiónEl caso descrito representa una manifestación neurológica poco frecuente del MM, con afectación de nervios craneales y compromiso motor generalizado, en el contexto de una enfermedad sistémica avanzada y refractaria. La combinación de síntomas bulbares, debilidad muscular progresiva y alteraciones estructurales óseas sugiere un mecanismo fisiopatológico multifactorial que incluye la destrucción osteolítica mediada por citocinas proinflamatorias como la interleucina-1 (IL-1), la activación osteoclástica a través del eje RANK/RANK-L, así como posibles mecanismos neurotóxicos relacionados con paraproteínas circulantes.
Una única punción lumbar con citología negativa no es suficiente para descartar con certeza la presencia de células neoplásicas en el LCR, especialmente en el contexto de sospecha de compromiso leptomeníngeo o infiltración del sistema nervioso central en enfermedades hematológicas como el MM. La sensibilidad de una sola citología de LCR es del 50%, y puede aumentar hasta el 85-90% con tres punciones seriadas11,12. Así pues, en nuestro caso, si la evolución hubiera sido diferente, se deberían haber realizado múltiples estudios de LCR y complementarlos con citometría de flujo e imágenes por RMN con contraste para aumentar la sensibilidad diagnóstica13.
Este caso subraya la importancia de considerar el compromiso del sistema nervioso central y periférico en pacientes con mieloma múltiple, especialmente ante síntomas neurológicos atípicos o progresivos. Asimismo, destaca la necesidad de un abordaje diagnóstico integral y multidisciplinario que permita identificar complicaciones neurológicas tempranas, optimizar el manejo terapéutico y orientar adecuadamente las decisiones clínicas en etapas terminales de la enfermedad.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.