El ependimoma mixopapilar (EM) es una lesión tumoral infrecuente de linaje glial que afecta predominantemente a los adultos jóvenes, con una incidencia de 0,08 casos por 100 000 personas. El EM del cono medular, la cauda equina y el filum terminal de la médula espinal generalmente se consideran tumores benignos de crecimiento lento. En ocasiones, los EM pueden extenderse hacia los huesos sacros, siendo difícil determinar si el tumor tiene origen intra o extradural. Generalmente se encuentran confinados al canal espinal y la destrucción de las estructuras óseas, vertebrales o iliacas adyacentes al tumor, son eventos extremadamente raros, así como las lesiones metastásicas viscerales.
Nuestro caso tuvo una lesión voluminosa a nivel del sacro con compromiso extenso, con diseminación visceral. Se realizó biopsia seguida de radioterapia con resultado local estacionario, pero siguió progresando a nivel sistémico. Hemos discutido la presentación clínica, las características radiológicas y las estrategias de manejo de esta enfermedad.
Myxopapillary ependymoma (ME) is a rare tumor of glial lineage that predominantly affects young adults, with an incidence of 0.08 cases per 100,000 people. ME of the conus medullaris, cauda equina, and filum terminale of the spinal cord are generally considered slow-growing, benign tumors. Occasionally, ME can extend to the sacral bones, making it difficult to determine whether the tumor is of intradural or extradural origin. They are generally confined to the spinal canal and the destruction of bony, vertebral or iliac structures adjacent to the tumor are extremely rare events, as are visceral metastatic lesions.
Our case had a voluminous lesion at the level of the sacrum with extensive involvement, with visceral dissemination. A biopsy was performed followed by radiotherapy with a locally stationary result, but continued to progress systemically. We have discussed the clinical presentation, radiological features, and management strategies of this disease.
El ependimoma mixopapilar (EM) es una lesión tumoral infrecuente de linaje glial que afecta predominantemente a los adultos jóvenes, con una incidencia de 0,08 casos por 100 000 personas.1 Los ependimomas se desarrollan a partir de las células ependimarias de los ventrículos cerebrales y del canal central de la médula espinal. Comprenden solo de 5 a 6% de los gliomas intracraneales y 60% de los gliomas de la médula espinal.2,3
En ocasiones, los EM pueden extenderse hacia los huesos sacros, siendo complejo determinar si el tumor tiene origen intra o extradural. Generalmente se encuentran confinados al canal espinal y la destrucción de las estructuras óseas, vertebrales o iliacas adyacentes al tumor, son eventos extremadamente raros.4 Contienen vacuolas microquísticas, estructuras mucoides y tejido conectivo. No hay anaplasia y rara vez se ha informado diseminación sistémica, pero puede diseminarse por todo el eje neural a través del líquido cefalorraquídeo (LCR).5
Nuestro caso presentó una lesión voluminosa a nivel del sacro con diseminación sistémica visceral. Se realizó biopsia seguida de radioterapia con resultado local estacionario, pero continuó progresando a nivel sistémico a pesar de la quimioterapia.
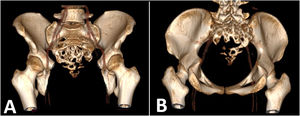
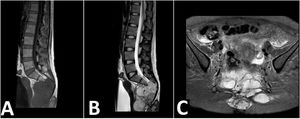
Reporte de casoPaciente femenino de 25 años natural de la sierra peruana, sin antecedentes patológicos ni familiares de relevancia. Debuta con tiempo de enfermedad de seis meses caracterizada por un dolor de intensidad 2/10 al esfuerzo en la región sacra, se agrega a los cuatro meses disnea. Ante la sospecha de infección por COVID-19 recibe manejo sin encontrar mejoría. Por lo que le realizan tomografía de tórax, evidenciándose múltiples nódulos pulmonares captadores de contraste compatible con metástasis asociado a derrame pleural. Al examen clínico no se evidencia déficit motor ni sensitivo, sin embargo, presenta saturación de oxígeno de 90%. Se realiza búsqueda del primario, mediante tomografía de abdomen y pelvis, evidenciándose metástasis única en segmento IVA de hígado, y un proceso expansivo lítico de aspecto neoformativo en vértebras sacras de 8,6 cm con extensión a partes blandas (figs. 1 y 2). Se realiza resonancia magnética (RM) de pelvis, evidenciándose que la masa depende del filum terminal y la duramadre (fig. 3). Se realiza biopsia de la lesión con resultado de estroma con extenso cambio quístico-mixoide y actividad mitótica discreta. Se realizaron pruebas de inmunohistoquímica (IHQ) con los siguientes resultados: la proteína ácida fibrilar glial (GFAP) fue positivo en las células tumorales y el antígeno de membrana epitelial (EMA) mostró positividad de punto focal. La pancitoqueratina fue negativa y el marcaje de MIB-1 estaba disperso, siendo compatible con EM. Se completan estudios hematológicos, bioquímicos, extendido celular del LCR, reportándose dentro de los parámetros normales, y la RM del neuroeje completo, no evidenció depósitos tumorales. Recibe radioterapia a la totalidad de la lesión tumoral a dosis de 3.900 cGy en 13 sesiones, continuando con quimioterapia bajo esquema de cisplatino y etopósido cada tres semanas, siendo suspendido en el cuarto ciclo por deterioro clínico a nivel respiratorio. La paciente a los seis meses del diagnóstico presenta incremento en el número de lesiones pulmonares por lo que pasa a manejo paliativo.
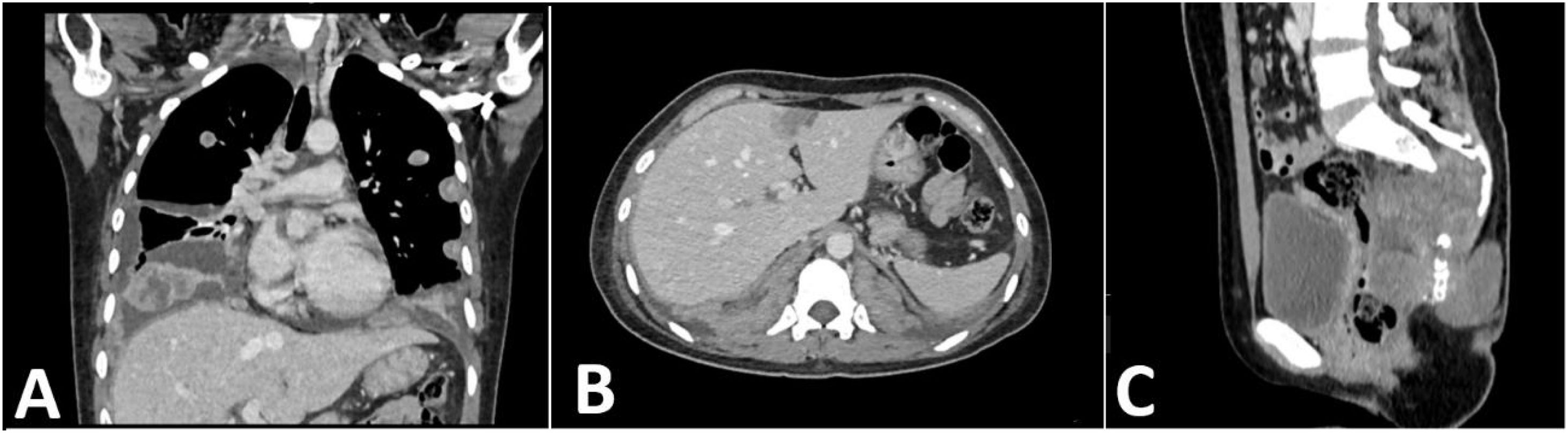
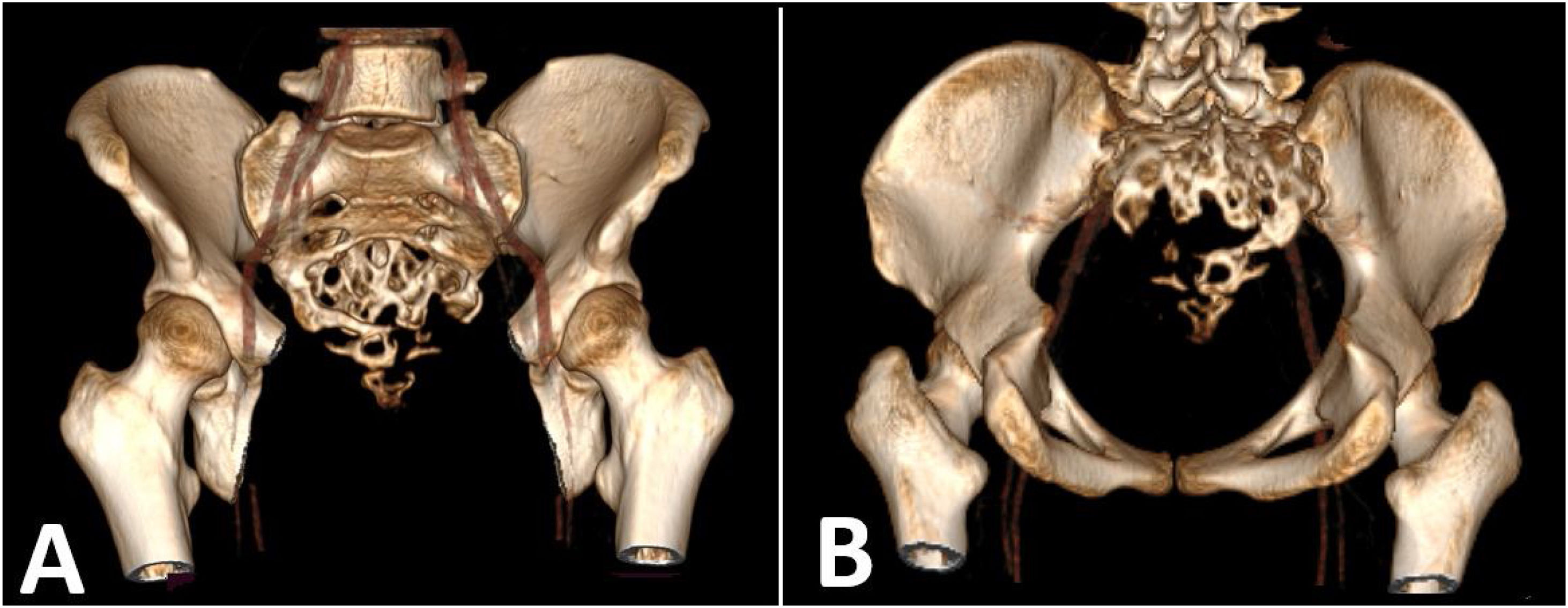
Tomografía helicoidal multicorte. A) Tomografía de pulmones en corte coronal: múltiples nódulos sólidos pulmonares con necrosis central de distribución difusa en ambos campos pulmonares, algunos adosados a pleura, los de mayor tamaño se ubican en segmento anterior del lóbulo superior derecho que mide 26 mm de diámetro y base de lóbulo inferior izquierdo que mide 62 mm x 37 mm. Asociado a derrame pleural bilateral. B) Tomografía de abdomen en corte axial: nódulo sólido que muestra captación del medio de contraste, ubicado en segmento IVA, mide 18 mm x 17 mm. C) Tomografía de pelvis en corte sagital: proceso expansivo de aspecto lítico a nivel de S3 a S5 con extensión a partes blandas en forma de masa de bordes poco circunscritos que realza al medio de contraste mide 61 mm x 86 mm x 60 mm, aparenta infiltrar recto, con extensión a partes blandas.
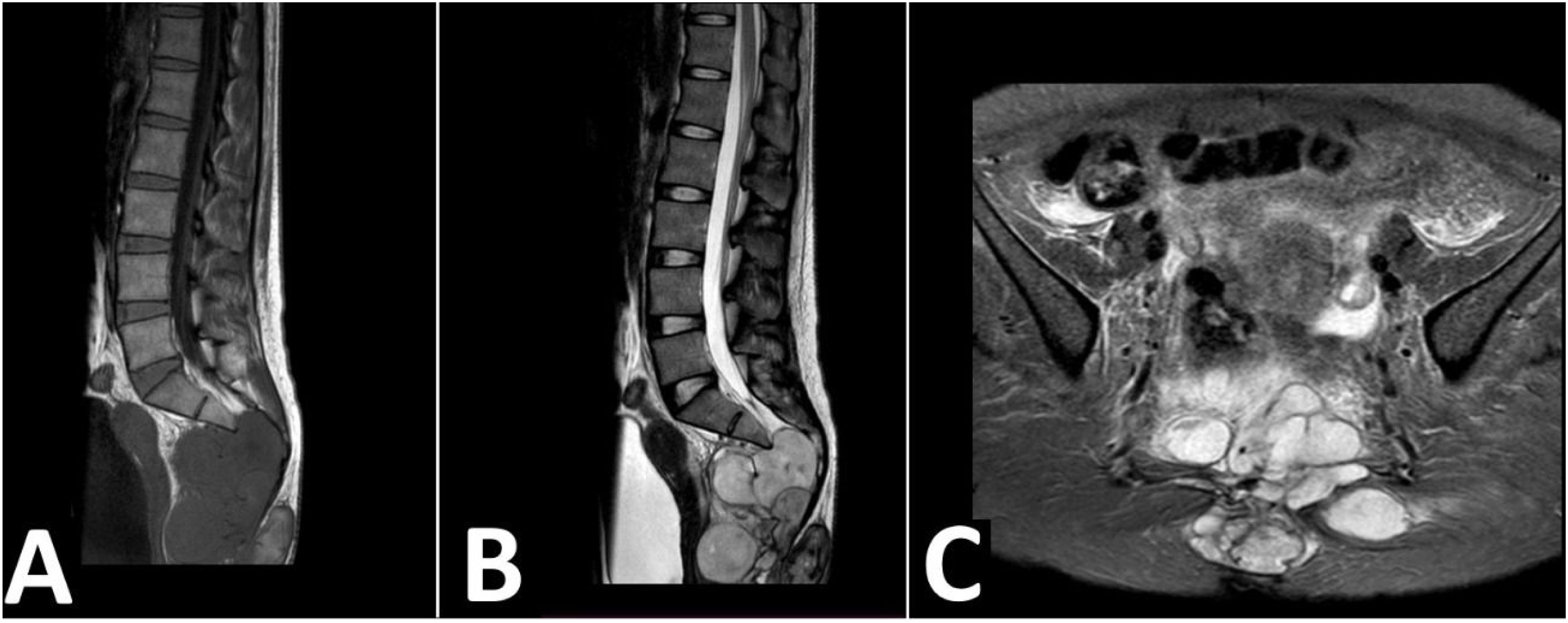
Resonancia magnética. A) Resonancia magnética sagital en T1: masa isointensa que se extiende por los agujeros sacros, mostrando apariencia multinodular. B) Resonancia magnética sagital en T2: masa hiperintensa de bordes lobulados que aparenta nacer del filum terminal y de la duramadre. C) Resonancia magnética en STIR, corte axial: la masa lobulada no suprime la señal, se muestra halo hipointenso marcado, masa adyacente a paredes de recto y de útero, sin signos de infiltración.
El EM clínicamente se caracteriza por crecimiento lento y localización casi exclusiva en la médula espinal terminal o cono medular, cola de caballo y el filum terminal. La serie más extensa fue desarrollada por el grupo cooperativo de la Rare Cancer Network durante 38 años consecutivos donde se encontraron 85 casos, de los cuales 53% eran de localización lumbosacra, 41% toracolumbar y 6% cérvico-torácico.6 Fan F et al. en su serie describen las edades que oscilaron entre los 15 y los 59 años, con una media de edad de 35,2 años.7 Las manifestaciones principales son: lumbago, debilidad de miembros inferiores, dolor y disfunción del esfínter. Algunos pacientes varones se quejaron de disfunción sexual, que fácilmente se diagnostica erróneamente como enfermedad degenerativa lumbar o hernia de disco lumbar, retrasando el momento óptimo para la cirugía.7 Siendo compatible con nuestra paciente, por ser joven y haber presentado inicialmente dolor lumbar leve.
La localización primaria extradural estaría relacionada con derivados embrionarios de células ependimarias, probablemente de restos extradurales del filum terminal o el vestigio coccígeo medular que sufriría el proceso de transformación neoplásica. Durante el tercer mes embrionario el extremo distal de la médula espinal se encuentra en el punto más caudal del canal vertebral. El crecimiento desproporcionado de la columna vertebral en comparación con la médula espinal explica la presencia de la ubicación del cono medular a nivel del punto medio del canal espinal lumbar durante la vida fetal avanzada. Por este motivo, algunas células ependimarias pueden quedar rezagadas, fijándose entre el cono medular y la segunda vértebra sacra. Los sitios frecuentes de localización extradural son: 1) el canal espinal extradural en asociación con la parte dural del filum terminal; 2) huesos sacros; 3) cavidad pélvica anterior hasta el sacro y 4) tejidos subcutáneos detrás de la columna vertebral y huesos sacros.3,8 En nuestro caso la paciente presentaba compromiso extenso que dependía del filum terminal, anteriormente hasta contactar al recto, y posteriormente con extensión a partes blandas del glúteo. Es probable que la masa no ocasionara dolor ni incomodidad por el hecho de que la cavidad pélvica se adaptó a su crecimiento lento.
Los diagnósticos diferenciales de EM incluyen otros tumores de la médula espinal, metástasis o hernia del disco. El diagnóstico va a depender especialmente de los hallazgos radiográficos y patológicos. La RM es el mejor procedimiento imagenológico para este diagnóstico. Dentro de los hallazgos incluye una masa intradural que tiende a ser hipointensa o isointensa con la médula espinal en las imágenes ponderadas en T1, hiperintensa en las imágenes ponderadas en T2 y tendrá un intenso realce homogéneo con material de contraste intravenoso.9,10 En nuestro caso cumplía con los criterios imagenológicos para alta sospecha de un EM, pero llamaba la atención la osteólisis sacra y el compromiso en el glúteo, ya que es muy rara la localización en partes blandas y la destrucción ósea.
En la histología mediante hematoxilina-eosina, muestra una superficie papilar que se encuentra unida a una o varias multicapas de células tumorales con acumulación de moco. Es de importancia realizar la IHQ, siendo positivos a GFAP y a vimentina, puede o no ser positivo para la proteína S-100, y EMA. Siendo negativo para EMA, CK5/6 y D2-40.7 Antes de la biopsia teníamos otras patologías probables, sin embargo, este patrón de IHQ nos ayudó a diferenciar de otras neoplasias como cordoma, condrosarcoma y meningioma cordoide.
Solo existen algunos reportes de casos de EM que producen cambios osteolíticos en las vértebras adyacentes, el sacro y/o los huesos iliacos.4,11–13 La serie más numerosa fue reportada por Quraishi et al., quienes lograron identificar tan solo seis casos.4 Se cree que el comportamiento destructivo de las estructuras óseas circundantes estaría relacionado con el volumen tumoral, ya que usualmente estas lesiones han alcanzado un volumen suficiente para ocupar todo el diámetro del canal vertebral.
Las metástasis ocurren en todas las partes del neuroeje, pero se localizan principalmente en la columna torácica y sacra en 38,9 y 33,3%, respectivamente.14 Sin embargo, la metástasis por fuera del neuroeje es sumamente rara. Los principales órganos diana de las metástasis son el parénquima pulmonar, hígado, huesos y ganglios linfáticos, lo cual sugiere una vía de diseminación predominantemente hematógena.15–17 En nuestro caso por la destrucción ósea es probable que ha logrado llegar a las vísceras por vía hematógena.
El EM es más agresivo en la infancia, pero tiene un buen pronóstico en adultos con un riesgo muy bajo de metástasis.17 Según el informe de la Organización Mundial de la Salud (OMS) de 2015, se detectó metástasis en solo 17 casos de 183 casos, 11 de los cuales involucraron metástasis cerebral (neuroeje), todos estos casos eran en pacientes jóvenes.18 En adultos, se ha informado que la ubicación sacro-coccígea de metástasis de EM es extremadamente rara y, a menudo, se presenta como metástasis en tejidos blandos o en huesos.17,19 En nuestro caso no había metástasis en el neuroeje, pero si la existencia de los múltiples depósitos tumorales en pulmón con compromiso marcado por la necesidad de oxígeno permanente y hepático, otorgándole un pronóstico desfavorable a pesar de ser considerado como un tumor grado I de la OMS.
Tradicionalmente, el tratamiento de los ependimomas espinales consistía en biopsia o cirugía de extirpación parcial seguida de radioterapia porque se creía que la resección total era imposible.20 Sin embargo, las mejoras tecnológicas y el uso de microscopios han permitido a los cirujanos realizar una resección total macroscópica con pocas complicaciones.21,22 Huang et al. informaron que la resección total es posible en 80 a 90% de los pacientes con ependimomas espinales.23 Por lo tanto, en la medicina actual, el tratamiento de EM implica principalmente la extirpación quirúrgica del tumor. Los tumores localizados alrededor del filum terminal suelen tener un gran volumen y abundante riego sanguíneo, lo que dificulta la operación. Se debe realizar estimulación eléctrica para identificar si se trata de tejido nervioso y luego se debe realizar una resección fragmentaria. Para prevenir la recurrencia, los nervios y el terminal parental pueden cauterizarse y cortarse. Sin embargo, el corte del nervio puede conducir a una disfunción sensoriomotora de las extremidades inferiores o del esfínter, lo que requiere que el cirujano sopese la importancia de la recurrencia del tumor y el daño de la función neurológica posoperatoria.7 En términos de asegurar la estabilidad de la columna, la reconstrucción tridimensional de la columna mediante tomografía computarizada es útil para evaluar el grado de destrucción ósea.
No existe un estándar unificado para la radioterapia posoperatoria, teniendo un lugar entre las opciones de tratamiento cuando no se puede lograr la escisión en bloque.24,25 Tsai et al. encontraron que la mediana de supervivencia de los pacientes sometidos a radioterapia tras la resección total era mayor que la de los pacientes sometidos únicamente a la resección total del tumor espinal.26 Akyurek et al. encontraron que la radioterapia adyuvante podría retrasar significativamente el desarrollo de tumores, independientemente de que se realizara una resección total.27 Abdulaziz et al. encontraron que aunque la radioterapia adyuvante posoperatoria podía reducir la tasa de recurrencia, sin embargo, no fue estadísticamente significativo.28 Una dosis de 5.400 cGy es adecuada para el EM espinal, siendo también aceptable la dosis de 5.040 cGy para preservar los órganos de riesgo. Si existe compromiso de LCR o implantes en el neuro eje, se optaría por irradiación cráneo-espinal.14 En la paciente, por estar en un escenario metastásico visceral, se descartó la opción quirúrgica y se brindó radioterapia a título paliativo.
El pronóstico general de EM es favorable, con una tasa de supervivencia general a 10 años de 97%.27 Fan et al. encontraron que la tasa de recurrencia a uno, dos y 10 años fue de 8,3, 29,2 y 41,7%, respectivamente. La tasa de supervivencia a uno, dos y 10 años fue de 100, 100 y 95,8%, respectivamente. Sugiriendo que el grado de resección quirúrgica fue un factor clave que afectó el pronóstico y la función neurológica de los pacientes.7
ConclusiónEl EM es un tumor de crecimiento lento, el retraso en el diagnóstico y el tratamiento podría conducir a malos resultados, por lo tanto, la resección del tumor debe ser el objetivo en los EM espinales para garantizar la continuidad de la atención y preservación de la capacidad funcional. Las lesiones por EM en partes blandas son raras, así como las lesiones metastásicas viscerales, sin embargo, existe la necesidad de descartar dichos compromisos, ya que modificará el pronóstico. Para tumores más grandes, la resección total del tumor es extremadamente difícil, con un alto riesgo de recurrencia y una baja tasa de mejoría de la función neurológica.
FinanciamientoEste estudio no presentó financiamiento.
Conflicto de interesesNo existen potenciales conflictos de intereses con esta investigación.
Los autores agradecen al Instituto Regional de Enfermedades Neoplásicas del Centro.