La uveítis constituye un reto diagnóstico y una de las principales causas de ceguera.
Caso clínicoPresentamos el caso de un rápido déficit de agudeza visual bilateral en un paciente con fondo de ojo compatible con una coriorretinopatía de Birdshot (BCR) y determinación de antígeno leucocitario humano A29 (HLA-A29) positiva. Discutimos el diagnóstico diferencial y las pruebas realizadas que, junto con el tiempo de seguimiento con el tratamiento instaurado, permite realizar el diagnóstico de neurosarcoidosis.
ConclusionesLa búsqueda de síntomas sistémicos debería ser algo inherente a los hallazgos de un fondo de ojo compatible con una BCR. La positividad de HLA-A29 no permite confirmar por sí misma un diagnóstico.
Uveitis is one of the major causes of visual impairment and remains a challenge.
Clinical caseWe present a case of a rapid bilateral visual acuity deficit in a patient with fundus compatible with Birdshot's chorioretinopathy (BCR) and human leukocyte antigen A29 (HLA-A29) positivity. We discuss the differential diagnosis and the tests performed that, together with the follow-up time with the established treatment, allow the diagnosis of neurosarcoidosis.
ConclusionsScreening for systemic clinical manifestations should be consubstantial with the findings of a fundus compatible with BCR. HLA-A29 positivity does not allow a diagnosis to be confirmed by itself.
La uveítis es una de las causas principales de ceguera en los países desarrollados. Incluye un grupo heterogéneo de enfermedades cuya filiación y manejo constituye un reto.
Caso clínicoVarón de 52 años con antecedentes de tics motores simples desde la infancia, talasemia menor y padre con artritis reumatoide. Ingresa por astenia, fiebre sin foco evidente y lumbalgia que, tras estudios negativos de etiología infecciosa y de imagen vertebral y abdominal, se etiqueta como probable viriasis con resolución de la fiebre. Tres semanas después inicia una alteración visual que describe como visión de pequeñas manchas oscuras, que se distorsionan y fluctúan. Cuatro semanas después añade disminución de agudeza visual bilateral con destellos de luz naranjo-amarillentos, motivo por el que una semana más tarde acude a un oftalmólogo que objetiva un edema de papila bilateral, e ingresa en el Servicio de Neurología de nuestro centro. En ese momento como única clínica extraocular persistían astenia y lumbalgia de características mecánicas.
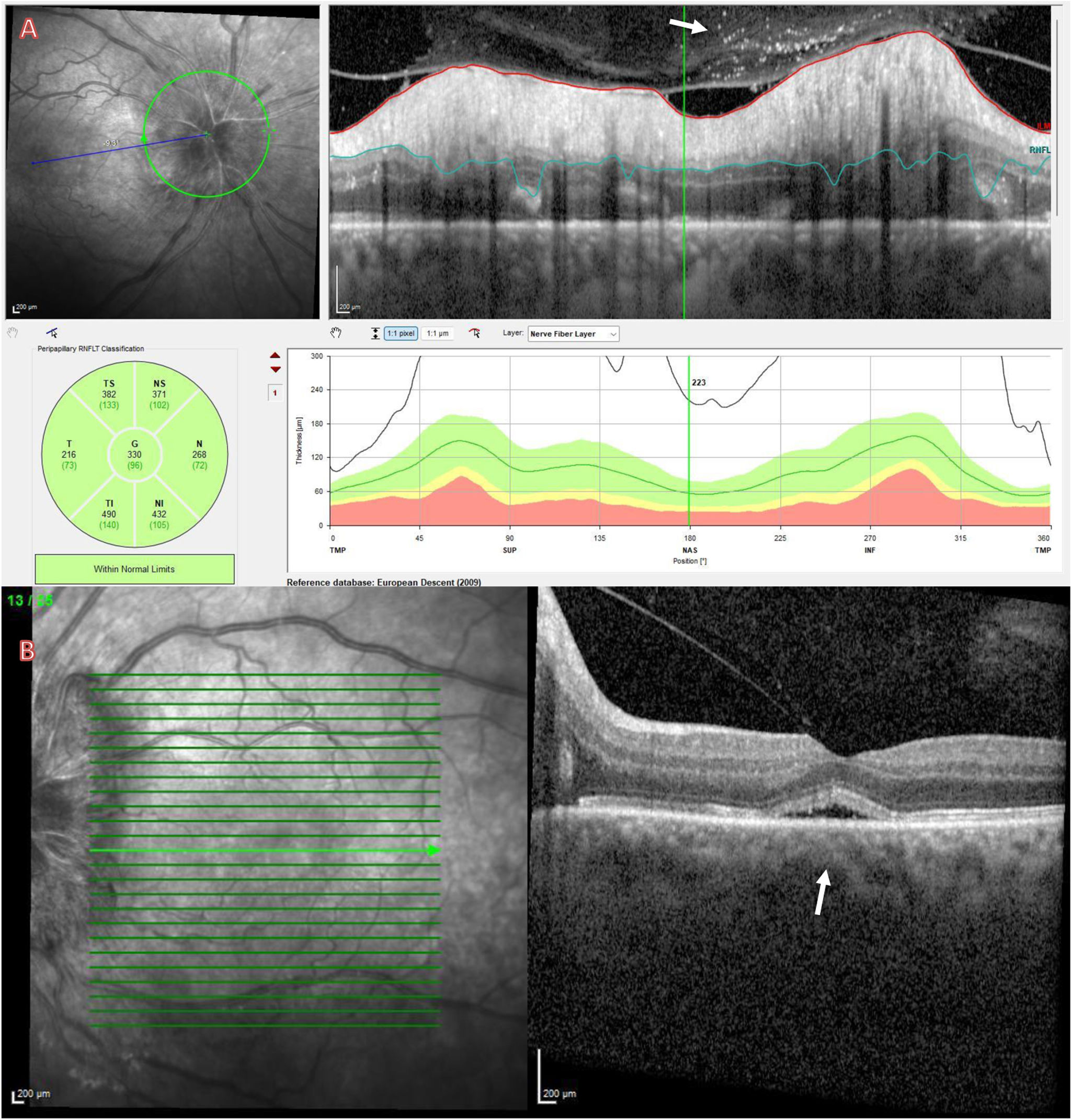
La exploración física general y neurológica revela únicamente un temblor fino de acción simétrico y no reemergente. La agudeza visual del paciente con su mejor corrección óptica es de 0,6 en ojo derecho y 0,7 en izquierdo. El fondo de ojo objetiva un marcado edema papilar bilateral (fig. 1) y múltiples lesiones compatibles con coriorretinopatía de Birdshot (BCR) (fig. 2). En el estudio con tomografía óptica de coherencia (OCT) se objetiva, aparte de la marcada sobreelevación del disco óptico, datos compatibles con aumento de la celularidad vítrea prepapilar, así como un desprendimiento neurosensorial de la retina a nivel macular (fig. 3).
A) OCT papilar de ojo derecho, donde se observan puntos de mayor hiperreflectividad (flechas), indicativos de aumento de celularidad vítrea (vitritis) a nivel prepapilar. B): OCT macular de ojo izquierdo. Además de un aumento de la celularidad vítrea prerretiniana, se constata un desprendimiento neurosensorial macular (flecha).
Se realiza un amplio estudio diagnóstico que incluye analítica general, de inmunidad y microbiológica con resultado normal, prueba de liberación de interferón-gamma negativa y determinación HLA-A29 positiva. En la punción lumbar se obtiene líquido cefalorraquídeo con presión de apertura normal, pleocitosis mononuclear policlonal (95 células/mm3, 100% mononucleares), proteinorraquia (1,19g/L), glucorraquia de 49mg/dL (con glucemia simultánea 109mg/dL) y presencia de bandas oligoglonales de Inmunoglobulina G con patrón en espejo (patrón tipo 3). La resonancia magnética cerebral y medular no muestran hallazgos relevantes. En la TC toracoabdominal se evidencian aisladas adenopatías de tamaño centimétrico y subcentimétrico a nivel mediastínico e hiliar izquierdo, inespecíficas radiológicamente. En el PET-TC corporal total se confirma hipermetabolismo en adenopatías hilio-mediastínicas.
Dada la gravedad de la clínica y la rapidez de su evolución se instaura un tratamiento con corticoides (metilprednisolona IV, un gramo al día durante 5 días) obteniéndose una mejoría significativa de la astenia, lumbalgia y clínica visual, y con una buena evolución del fondo de ojo en las revisiones posteriores. Ante un cuadro consistente en edema de papila con lesiones coriorretinianas bilaterales, meningitis aséptica de marcado predominio mononuclear, síndrome general y adenopatías hilio-mediastínicas captantes en estudio PET-TC, y habiéndose descartado razonablemente otras posibilidades como tuberculosis, lúes y linfoma, se realiza un diagnóstico presuntivo de neurosarcoidosis encontrándose pendiente el resultado de la biopsia ganglionar. El paciente mantiene una pauta de prednisona oral descendente con un estrecho seguimiento ambulatorio neurológico y oftalmológico. El resultado de la anatomía patológica reveló linfadenitis granulomatosa focalmente necrotizante y estudio de micobacterias negativo, por lo que finalmente cumple criterios de neurosarcoidosis probable. En la actualidad permanece sin recidivas de su clínica oftálmica ni general tras un seguimiento de treinta y ocho meses, se encuentra bajo tratamiento con infliximab sin corticoides.
ComentariosLa BCR es una inflamación multifocal coroidal con células inflamatorias mononucleares que se manifiesta como lesiones ovoideas de color crema o naranjo-amarillentas, al que se añade edema macular. Tanto la pérdida de fotorreceptores como el edema producen inicialmente síntomas como miodesopsias, destellos, visión borrosa o pérdida de visión periférica. Se ha descrito que en torno al 90-95% de los pacientes con BCR son HLA-A29 positivos, frente al 7-8% de la población general de raza caucásica1. La BCR es una enfermedad poco frecuente que supone el 7% de todas las uveítis posteriores, que a su vez constituyen menos del 20% de todas las uveítis2. La enfermedad es de predominio femenino y caucásico, bilateral y de curso crónico. Los criterios diagnósticos del grupo SUN se basan en el examen oftalmológico con o sin el apoyo de HLA-A29, pero exigen excluir otras posibilidades diagnósticas como lúes, sarcoidosis o linfoma intraocular3. En el diagnóstico diferencial se han propuesto patologías infecciosas (tuberculosis, lúes, síndrome de histoplasmosis ocular) y no infecciosas, incluida el linfoma4. Si el cuadro clínico asocia manifestaciones extraoculares los diagnósticos diferenciales se reducen a: tuberculosis, sarcoidosis, lúes, linfoma y síndrome de Vogt-Koyanagi-Harada (que cursa con panuveítis). No obstante, de todas ellas, las que mejor mimetizan la BCR son la sarcoidosis y el linfoma.
La sarcoidosis es una enfermedad inflamatoria granulomatosa como respuesta a antígenos aún no identificados5, cuya clínica varía según donde asienten las lesiones. Afecta principalmente a pulmón, piel y ojos; y en el 5-20% de los casos al sistema nervioso6, denominándose entonces neurosarcoidosis (NS). En un metaanálisis7 se observó que el 84% de los pacientes con NS tienen manifestaciones sistémicas, siendo las pulmonares (57%), oculares (20%) y linfadenopatías (18%) las más frecuentes. La manifestación más frecuente en NS es la afectación de pares craneales, seguida de la meningitis crónica aséptica8. Los criterios diagnósticos para NS del Neurosarcoidosis Consortium Consensus Group9 establecen el granuloma como el elemento crítico en el diagnóstico probabilístico de la enfermedad. Su ausencia permite únicamente un diagnóstico en grado de posible, la demostración fuera del sistema nervioso un grado de probable y en sistema nervioso el grado de definida; siempre que se acompañe de una clínica compatible con pruebas complementarias de apoyo y la exclusión razonable de otras posibilidades diagnósticas. Otras patologías que cursan con afectación granulomatosa incluyen enfermedades infecciosas, inflamatorias, inmunodeficiencias, neoplasias y reacción a sustancias extrañas, como es el caso de la silicosis. Cuando el granuloma es necrotizante se debe descartar especialmente causas infecciosas como las micobacterias y hongos. La respuesta al tratamiento también puede, inicialmente, ayudar a aclarar el diagnóstico. Tanto la BCR como la NS tienen a los corticoides como primera línea de tratamiento, seguido de otros inmunosupresores4,10. En el caso de infecciones por micobacterias u hongos es previsible un empeoramiento del paciente, por lo que conviene descartar las mismas en la medida de lo posible antes de instaurar el mismo. En la NS puede haber una respuesta favorable hasta en un 71% de los pacientes7, si bien en el caso de la clínica visual la respuesta puede ser más pobre. En el caso del linfoma puede haber una respuesta inicial a corticoides, que no será sostenida en el tiempo.
Una búsqueda bibliográfica en PubMed de los términos «birdshot» y «sarcoidosis» con el operador booleano «AND» arroja un total de 64 resultados, de los cuales 14 son casos clínicos cuyo diagnóstico diferencial incluye ambas patologías. En ellos, en resumen, se plantean dos escenarios posibles: coexistencia de ambas enfermedades o confusión de NS con BCR. Respecto al primero, los conocimientos actuales hacen poco probable la asociación de dos entidades poco frecuentes con susceptibilidades genéticas y mecanismos inmunes diferentes, por lo que un debut debería relacionarse con una sola patología. Respecto a la segunda, distintos autores resaltan la importancia de pruebas paraclínicas para su discriminación, con un papel especial para la determinación de HLA-A29. Nuestro caso tiene la particularidad de ser, que conozcamos, el único con un resultado HLA-A29 positivo. Si bien un resultado negativo prácticamente descarta una BCR, su positividad no tiene un valor confirmatorio, dada su presencia sin valor patológico en un porcentaje de la población como en nuestro paciente.
En conclusión, nuestro caso ilustra e incide en una idea fundamental: la búsqueda de síntomas sistémicos debería ser algo inherente a los hallazgos de un fondo de ojo compatible con una BCR. Una valoración que permita identificar síntomas y signos extraoculares en el momento inicial permitirá discriminar causas y dirigir el estudio, disminuyendo tiempo diagnóstico y costes sanitarios y sociales. La positividad de HLA-A29, aunque de gran valor, no permite confirmar ni descartar por sí misma ninguna hipótesis. En último término, dado que no hay un marcador que permita realizar un diagnóstico de certeza, debe reevaluarse al paciente con sentido crítico, estando especialmente atentos tanto a la tuberculosis como al linfoma. Sólo la sagacidad del clínico, la meticulosidad en su ejercicio y el tiempo permitirán confirmar el diagnóstico.
FinanciaciónEl presente trabajo no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasSe han seguido los protocolos de los centros de trabajo sobre la publicación de datos de pacientes, se ha respetado su privacidad y se cuenta con el consentimiento del paciente para su publicación.
Conflicto de interesesAlfredo Puy Núñez ha recibido honorarios como ponente de Almirall, Biogen, Ferrer, Krka, Merck y UCB; y patrocinio para asistencia a congresos de Almirall, Alter, Bial, Biogen, Eisai, Krka, Lundbeck, Merck, Novartis, Roche, UCB y Zambon. Nuria redondo Rafales: declaraciones de interés: ninguna. Francisco Javier Cores González: declaraciones de interés: ninguna. Julia Barreiro Honrado: declaraciones de interés: ninguna. Luis Anibarro García: declaraciones de interés: ninguna. Ana Rodríguez Regal ha recibido honorarios como ponente de Merck, Roche, BMs, Janssen, Sanofi, Novartis y Biogen; y patrocinio para asistencia a congresos de Merck, Roche, BMs, Janssen, Sanofi, Novartis y Biogen.