El ictus representa en España la primera causa de muerte por entidades específicas en mujeres, la primera causa de invalidez en los adultos y supone un enorme coste tanto humano como económico. En los últimos años se han producido avances importantes tanto en el tratamiento de la fase aguda como en el proceso neurorrehabilitador; sin embargo, continúa sin quedar claro cuál es el momento óptimo en el que debe iniciarse la neurorrehabilitación después de un ictus y cuáles son las consecuencias de retrasar este inicio. El objetivo de este estudio es comprobar el efecto que supone cada día de retraso en el inicio de la neurorrehabilitación en la recuperación funcional y su influencia en la tasa de institucionalización al alta.
MétodosEstudio retrospectivo en el que se incluyeron los pacientes ingresados entre abril de 2005 y septiembre de 2008, en la Unidad de Neurorrehabilitación de Ictus (UNRHI) del Hospital Parkwood (Universidad de Western Ontario, Canadá). Se obtuvo la edad, la puntuación FIM al ingreso y al alta, los días entre la aparición del ictus y el ingreso en la Unidad de Neurorrehabilitación y el destino al alta.
ResultadosDespués de ajustar por edad y FIM al ingreso, se encontró una asociación estadísticamente significativa entre la mejoría funcional de los pacientes (ganancia de FIM) y el retraso por cada día en comenzar la rehabilitación. Existe una correlación estadísticamente significativa entre el retraso en iniciar esta terapia y el grado de institucionalización al alta.
ConclusionesPor cada día que se retrase el inicio del tratamiento neurorrehabilitador empeora el pronóstico funcional de los pacientes al alta. Este retraso se relaciona también con una mayor tasa de institucionalización al alta.
In Spain, stroke is the leading cause of death in women as well as the leading cause of disability in adults. This translates into a huge human and economic cost. In recent years there have been significant advances both in the treatment of acute stroke and in the neuro-rehabilitation process; however, it is still unclear when the best time is to initiate neurorehabilitation and what the consequences of delaying treatment are. To test the effect of a single day delay in the onset of neurorehabilitation on functional improvement achieved, and the influence of that delay in the rate of institutionalisation at discharge.
MethodsA retrospective study of patients admitted to Parkwood Hospital's Stroke Neurorehabilitation Unit (UNRHI) (University of Western Ontario, Canada) between April 2005 and September 2008 was performed. We recorded age, Functional Independence Measurement (FIM) score at admission and discharge, the number of days between the onset of stroke and admission to the Neurorehabilitation Unit and discharge destination.
ResultsAfter adjustment for age and admission FIM, we found a significant association between patient functional improvement (FIM gain) and delay in starting rehabilitation. We also observed a significant correlation between delay in initiating therapy and the level of institutionalisation at discharge.
ConclusionsA single day delay in starting neurorehabilitation affects the functional prognosis of patients at discharge. This delay is also associated with increased rates of institutionalisation at discharge.
La enfermedad cerebrovascular o ictus supone la primera causa de discapacidad física y la segunda de demencia en las personas adultas según la Organización Mundial de la Salud (OMS)1,2. Se estima que el ictus consume el 3-4% del gasto sanitario total en los países desarrollados3,4, suponiéndose un gasto directo medio de 4.000 euros por paciente durante los tres primeros meses5.
La neurorrehabilitación, entendida como el conjunto de métodos cuya finalidad es recuperar las funciones neurológicas perdidas o disminuidas como consecuencia de un daño cerebral o medular6, supone hoy en día uno de los ejes fundamentales en el tratamiento del ictus junto con la atención neurológica precoz (ingreso en las unidades de ictus y aplicación del tratamiento fibrinolítico).
El ingreso de los pacientes en el momento agudo en las unidades de ictus y posteriormente en unidades especializadas de neurorrehabilitación, dotadas de equipos multidisciplinares que tratan exclusivamente el daño cerebral, disminuye la mortalidad y las secuelas, mejorando el pronóstico funcional a largo plazo en estos pacientes7–9. Se han publicado estudios10–12 que sugieren que una vez ocurrido el ictus existe un período de tiempo en el cual el cerebro muestra un aumento de la sensibilidad para experiencias rehabilitadoras, capacidad que va disminuyendo con el paso del tiempo. Estos datos se han corroborado tanto a través de estudios de neuroimagen funcional13–18, como en estudios con animales19 y humanos20. Los primeros nos han mostrado cómo el cerebro es capaz de responder al daño vascular desde las fases más tempranas13, siendo capaz de readquirir funciones perdidas tras el ictus. En modelos animales se ha demostrado cómo el inicio temprano de la rehabilitación conlleva una mejor recuperación funcional21,22 y en humanos los pacientes que iniciaban rehabilitación en los primeros 30 días tras el infarto presentaban una mejor recuperación funcional, que en los que el inicio se demoraba más allá de los 30 días20.
Además, la mejor recuperación funcional no es la única ventaja del inicio temprano del proceso neurorrehabilitador, ya que se ha comprobado que muchas de las complicaciones inmediatas del ictus se relacionan con la inmovilidad, por lo que estas podrían evitarse con una movilización precoz23.
Ante este panorama cada vez cobra mayor relevancia el inicio precoz del proceso neurorrehabilitador, más aún si atendemos a los últimos estudios que reflejan que el inicio del tratamiento neurorrehabilitador dentro de las primeras 24 horas es seguro24,25, en contra de lo que se pensaba26.
Sin embargo, todos estos estudios analizan la influencia de iniciar el tratamiento neurorrehabilitador basados en «franjas temporales» y no en la unidad de tiempo día. Por ello nos planteamos en este estudio analizar la influencia que tiene retrasar el tratamiento neurorrehabilitador (atendiendo a la unidad de tiempo día) en el pronóstico funcional de los pacientes con ictus y su relación con la institucionalización al alta (utilizando «franjas temporales»).
ObjetivoComprobar el efecto que supone cada día de retraso en el inicio de la neurorrehabilitación en la recuperación funcional, así como la influencia de retrasar el tratamiento neurorrehabilitador en la tasa de institucionalización al alta.
Pacientes y métodosSe trata de un estudio retrospectivo realizado con los pacientes ingresados entre abril de 2005 y septiembre de 2008, en la Unidad de Neurorrehabilitación de Ictus del Hospital Parkwood (Universidad de Western Ontario, Canadá). Los pacientes ingresaban en la Unidad de Neurorrehabilitación si estaban estables clínicamente y eran capaces de permanecer un mínimo de 30 minutos en silla de ruedas. Una vez en la Unidad eran valorados por un equipo multidisciplinar compuesto por neurólogos, rehabilitadores e internistas, así como por personal de enfermería, auxiliares de enfermería, nutricionistas y diversos terapeutas (fisioterapeuta, logopeda, neuropsicólogo, terapeuta ocupacional). Se recogieron un total de 753 pacientes.
Los pacientes recibieron tratamiento individualizado 5 días a la semana, 3 horas al día. Por otra parte se administraron sesiones de terapia grupal 2 horas a la semana. De todos los pacientes se recogió la edad, días de ingreso en la Unidad de Neurorrehabilitación, puntuación en la escala functional independent measure (FIM)27 al ingreso y al alta, ganancia de FIM y tiempo en iniciar el tratamiento neurorrehabilitador.
Para analizar la influencia de retrasar un día el inicio del tratamiento neurorrehabilitador, se utilizaron los pacientes que ingresaron en los primeros 30 días tras el ictus, puesto que se ha postulado que el retraso más allá de este tiempo no modifica el resultado funcional20. Para valorar los factores asociados al cambio en el FIM fue llevado a cabo un análisis mediante regresión lineal múltiple, ajustando por edad, y FIM al ingreso.
Para analizar la influencia de retrasar el inicio del tratamiento en el grado de institucionalización al alta, se agrupó a los pacientes en función del período de tiempo en el que se comenzó la intervención, realizando un estudio de correlación no paramétrico mediante una Rho de Spearman.
Todos los análisis estadísticos se han realizado con SPSS versión 15.0.
ResultadosLos resultados de las variables a estudio dentro de los primeros 30 días (N=536, 71% del total) se reflejan en la tabla 1. La edad media de los pacientes incluidos en el estudio fue de 69 años. Los pacientes permanecieron ingresados una media de 40 días, iniciando la rehabilitación con un tiempo medio de 14 días desde el ictus (rango 3-29 días). El FIM total medio al ingreso era de 81,5 puntos, apreciándose una variación del FIM de 21,8 puntos de media, principalmente a expensas del FIM motor.
Variables recogidas. Pacientes tratados en los primeros 30 días
| Variables a estudio | |
| Edad media en años (DS) | 69 (15) |
| FIM medio al ingreso (DS) | |
| Total | 81,5 (24,1) |
| Motor | 55,5 (20,8) |
| Cognitivo | 26 (6,1) |
| FIM medio al alta (DS) | |
| Total | 103,3 (24,3) |
| Motor | 74,8 (19,3) |
| Cognitivo | 28,5 (6,4) |
| Duración media del ingreso en días (DS) | |
| Alta-Ingreso | 40 (28) |
| Tiempo medio en días en iniciar RHB (DS) | 14 (7) |
| Variación media en FIM (DS) | |
| Total | 21,8 (20,4) |
| Motor | 19,3 (17,3) |
| Cognitivo | 2,5 (5,0) |
| Eficiencia del FIM | 0,4 (2) |
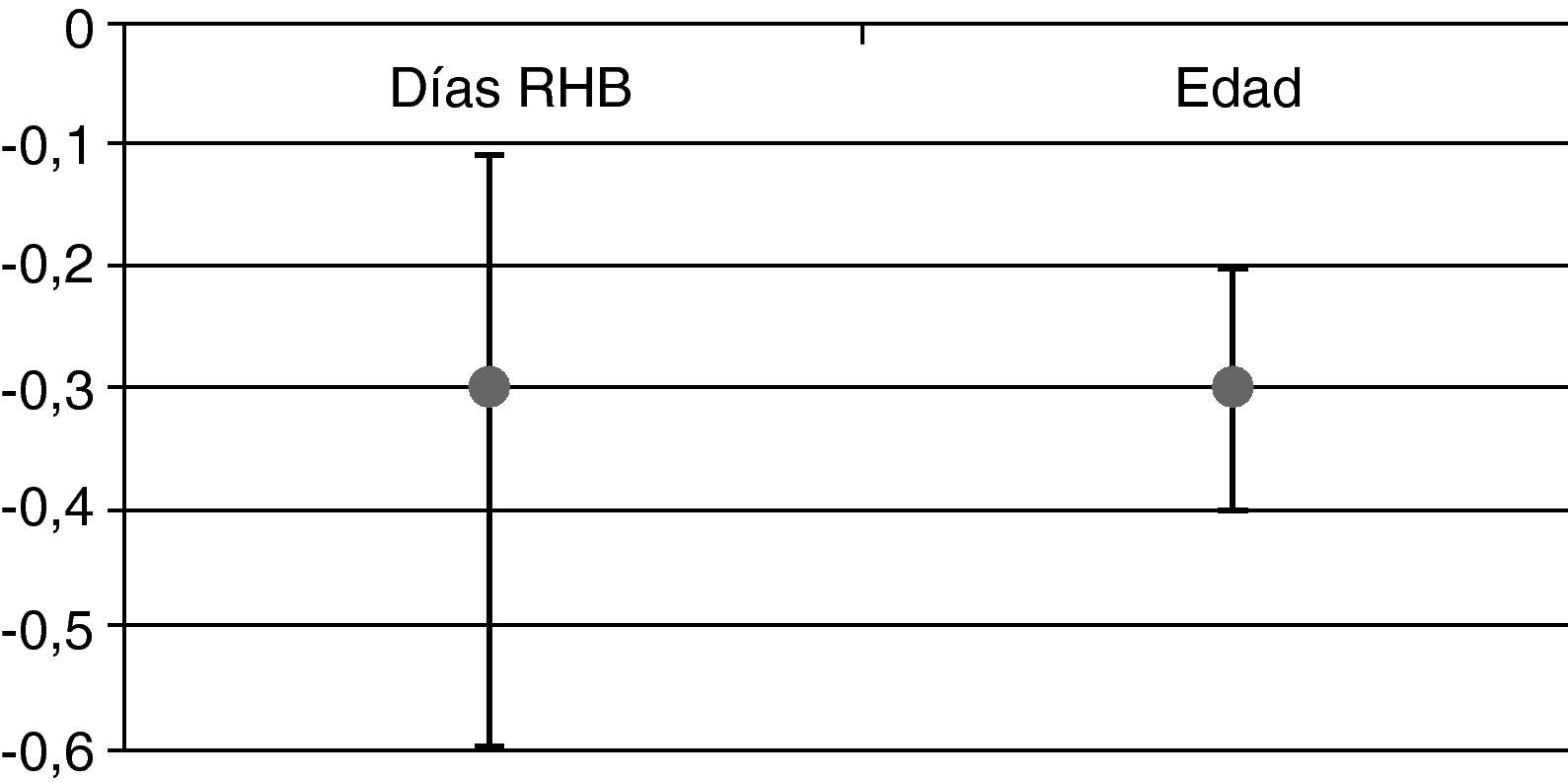
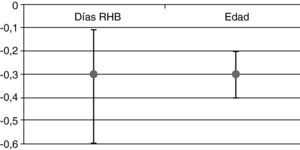
Se observó que una vez ajustado por edad y puntuación FIM al ingreso, por cada día que se retrasa el inicio del tratamiento neurorrehabilitador, se perdían 0,3 puntos en la escala FIM al alta (fig. 1). Así mismo, se encontró una asociación estadísticamente significativa entre la mejoría funcional de los pacientes (ganancia de FIM) y cada día de retraso en comenzar la rehabilitación. También se obtuvo una asociación estadísticamente significativa entre la ganancia FIM y la edad de los pacientes (fig. 1), de forma que a mayor edad menor ganancia se aprecia en la variación de FIM.
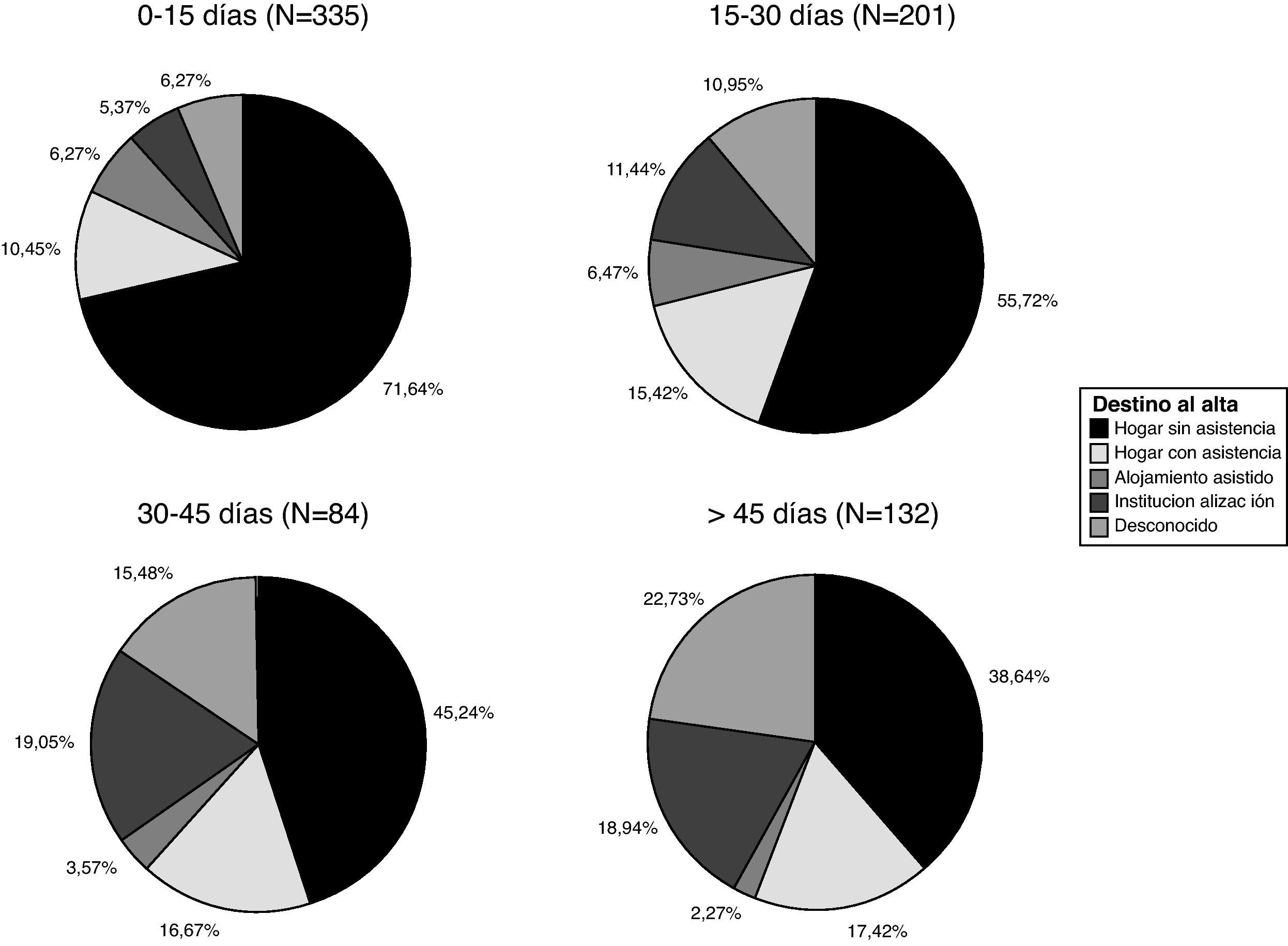
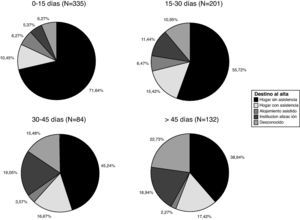
El destino al alta de todos los pacientes ingresados en la Unidad de Neurorrehabilitación de Ictus, incluyendo aquéllos en los que la rehabilitación se comenzó más allá de 30 días tras el ictus, se resume en la figura 2. Casi 3 de cada 4 pacientes (72,3%) fueron dados de alta a su domicilio. Se encontró una correlación estadísticamente significativa entre el retraso en iniciar esta terapia y el grado de institucionalización al alta, con un coeficiente de correlación de Spearman estadísticamente significativo (p<0,01) de 0,308 para un nivel de confianza del 95%.
Los porcentajes de los diferentes destinos al alta, en función del momento en el que se inició el tratamiento neurorrehabilitador, se muestran en la figura 2. El porcentaje de destino al domicilio sin asistencia varía desde el 71,64% en el grupo de inicio en los primeros 15 días, hasta el 38,64% del grupo de inicio del tratamiento más allá de los 45 días. Mientras que la institucionalización va desde el 5,37% en el primer grupo frente al 18,94% en el último grupo.
DiscusiónDe acuerdo con la literatura previa, las Unidades de Neurorrehabilitación se establecen como uno de los pilares fundamentales en la recuperación funcional de los pacientes que han sufrido un ictus28. Una de sus principales ventajas es su amplia ventana terapéutica, mucho mayor que en otros tratamientos usados en la fase aguda del ictus como la fibrinolisis29.
Los resultados del presente estudio ratifican la idea de que el inicio precoz del tratamiento neurorrehabilitador conlleva una mejor recuperación funcional30,31. O dicho de otra forma, el retraso en el inicio de este tratamiento se asocia con una mayor discapacidad al alta. En este estudio el inicio más precoz fue al tercer día tras el ictus, por lo que se evitó el posible efecto dañino del inicio en fase aguda26.
En otros ejes del tratamiento del ictus también se ha demostrado como su aplicación precoz conlleva un mejor pronóstico funcional, y dentro de éstas el beneficio es mayor cuanto antes se administre el tratamiento32. Por lo que la idea del tratamiento precoz no debe sorprendernos. Sin embargo, la realidad en la práctica habitual difiere de la situación ideal. Los pacientes en las unidades de ictus permanecen la mayor parte del tiempo inactivos y solos25 llegando incluso a estar el 88% en la cama o al lado de la misma y pasan un 60% del tiempo solos; esta tendencia se aprecia independientemente de la severidad del ictus. Además en las unidades de ictus falta especialización en neurorrehabilitación y neurólogos implicados33.
La mayor ganancia del FIM se aprecia en el FIM motor principalmente, mientras que la ganancia media del FIM cognitivo es discretamente menor. Esto puede atribuirse a que la recuperación cognitiva precisa de un tiempo mayor34, y es probable que la media de estancia de 40 días no nos haya dejado apreciar una valoración cognitiva mayor.
El inicio precoz, no solo se asocia con una mejoría funcional, sino que tal y como se aprecia en el presente estudio, está asociado también con una menor tasa de institucionalización. Estos resultados están en consonancia con la literatura existente al respecto35,36. Además en el estudio Post-Stroke Rehabilitation Outcomes Project (PSROP)37 se demostró que el inicio precoz del tratamiento neurorrehabilitador asociaba una menor estancia hospitalaria y por consiguiente un menor gasto económico, siendo ésto cierto tanto para ictus moderados como severos.
La principal limitación de este estudio es su carácter retrospectivo. Por otro lado, no se diferencia entre la etiología isquémica o hemorrágica del ictus, y se limita a aquellos ictus que cumplen los criterios de inclusión en la Unidad de Neurorrehabilitación.
Como conclusiones del presente trabajo, podríamos afirmar que cada día que se retrasa el inicio del tratamiento neurorrehabilitador en pacientes con un ictus y candidatos a dicho tratamiento, repercute de forma negativa en la recuperación funcional del paciente al alta de la Unidad de Neurorrehabilitación. Además el retraso en el inicio del tratamiento neurorrehabilitador en pacientes candidatos al mismo, se asocia con una mayor tasa de institucionalización. Sin embargo, hay que tener en cuenta que los resultados presentados, únicamente nos permiten establecer conclusiones a corto plazo, de forma que se requieren estudios para saber si el inicio precoz del tratamiento neurorrehabilitador, además de favorecer la recuperación funcional al alta de la Unidad de Neurorrehabilitación consigue que esa mejoría permanezca en el tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.