El tratamiento mediante cierre percutáneo está extendiendo su uso en el ictus asociado a foramen oval permeable (FOP). El objetivo del estudio es analizar la práctica clínica del cierre percutáneo de FOP y conocer las variables que determinan esta indicación.
MétodoRegistro observacional prospectivo de casos de ictus isquémico/ataque isquémico transitorio criptogénico asociado a FOP diagnosticados en la red de hospitales NORDICTUS en el periodo 2018-2021. Se registraron datos clínicos, patrón radiológico, datos de ecocardiograma y factores vinculados al ictus asociado a FOP (enfermedad tromboembólica y criterios de embolia paradójica) Se analizó la indicación de cierre según edad (≤/> 60 años) y de las características del FOP.
ResultadosEn el grupo ≤60 años (n=488) se indicó cierre en 143 pacientes (29,3%). Las variables predictoras de esta indicación fueron: detección de un FOP de alto riesgo (OR 4,11; IC 2,6-6,5, p<0,001), criterio de embolismo paradójico (OR 2,61; IC 1,28-5,28; p=0,008) y el uso previo de antitrombóticos (OR 2,67; IC 1,38-5,18; p=0,009). En el grupo de> 60 años (n=124), el cierre se indicó en 24 casos (19%). Las variables relacionadas con esta opción fueron: antecedente de tromboembolismo pulmonar, predisposición a enfermedad tromboembólica, criterios de embolismo paradójico y FOP de alto riesgo.
ConclusionesEn la indicación de cierre percutáneo, el factor principal es la detección de un FOP de alto riesgo (cortocircuito masivo, cortocircuito con aneurisma asociado). Otros factores de interés en la selección de pacientes son: antecedentes de enfermedad tromboembólica, criterios de embolismo paradójico o el uso previo de antitrombóticos.
There is an extending use of percutaneous closure of patent foramen ovale (PFO) as therapy for PFO-associated cryptogenic strokes. The aim of our study was to investigate the clinical practice of percutaneous closure of PFO and to analyse the variables for decision-making on the selection of patients for this procedure.
MethodA prospective observational multicentric survey was conducted using all the cases of cryptogenic stroke/transient ischemic attack associated with PFO recorded in the NORDICTUS hospital registry during the period 2018-2021. Clinical data, radiological patterns, echocardiogram data and factors related to PFO-associated stroke (thromboembolic disease and paradoxical embolism criteria) were recorded. The indication for closure was analysed according to age (≤/> 60 years) and the characteristics of the PFO.
ResultsIn the group ≤60 years (n=488), 143 patients (29.3%) underwent PFO closure. The most influential variables for this therapy were detection of a high-risk PFO (OR 4,11; IC 2,6-6,5, p<0,001), criteria for paradoxical embolism (OR 2,61; IC 1,28-5,28; p=0,008) and previous use of antithrombotics (OR 2,67; IC 1,38-5,18; p=0,009). In the group>60 years old (n=124), 24 patients had PFO closure (19%). The variables related to this option were history of pulmonary thromboembolism, predisposition to thromboembolic disease, paradoxical embolism criteria and high-risk PFO.
ConclusionsThe detection of a high-risk PFO (large shunt, shunt with associated aneurysm) is the main criterion for a percutaneous closure-based therapy. Other conditions to consider in the eligibility of patients are the history of thromboembolic disease, paradoxical embolism criteria or the previous use of antithrombotics.
La incidencia de ictus en España es de 150-200 casos/100000 habitantes y la tasa de prevalencia ajustada por edad es de un 7,6%1,2. Según las series, un 20-40% de los ictus isquémicos son clasificados como criptogénicos tras una evaluación completa. Cuando se realiza el estudio etiológico se puede detectar en este subtipo un 40% de pacientes con foramen oval permeable (FOP). Estos datos nos muestran, que en la práctica clínica habitual, nos vamos a encontrar con un número importante de casos de ictus asociado a FOP a los que deberemos hacer recomendaciones terapéuticas fundamentadas en conocimientos convincentes3.
Los pacientes con ictus y FOP constituyen un grupo heterogéneo con importantes variaciones en cuanto a la implicación del FOP en el desarrollo del evento cerebrovascular. Esto ha originado ciertas controversias en lo que respecta a diversos aspectos, que van desde la patogenia (embolismo paradójico y otros mecanismos) hasta la prevención secundaria (cierre endovascular y tratamiento médico)4–8. Las investigaciones clínicas orientadas a documentar la evaluación, que pudiera considerarse más óptima para este proceso, han encontrado dificultades metodológicas relacionadas con las múltiples variables difíciles de controlar que están vinculadas a la relación ictus-FOP. Así, toda esta información ha generado inseguridades en la práctica clínica sobre cómo manejar de la forma más precisa el FOP en pacientes que han sufrido un ictus criptogénico4.
Los ensayos clínicos aleatorizados publicados en los años 2017-189–12 y los posteriores metaanálisis realizados permitieron confirmar la mayor eficacia del cierre percutáneo del FOP comparado con el tratamiento antiagregante13–17. Fundamentándose en estos resultados, las sociedades científicas han elaborado guías e informes de posicionamiento indicando que la selección de pacientes y la evaluación rigurosa de los casos en equipos coordinados es la estrategia más adecuada18–20. Las guías más recientes establecen una clase de recomendación 2A para la indicación de cierre percutáneo para el FOP de alto riesgo (cortocircuito masivo o aneurisma atrial) en pacientes de 18-60 años, sobre todo si no presentan una puntuación baja en la escala de RoPE, ni necesidad de tratamiento anticoagulante18. El uso de programas con equipos coordinados (Cardiología-Neurología) para evaluar las opciones que puedan plantearse, y también informar al paciente de los beneficios y riesgos de las estrategias de tratamiento que se le pueden proponer, garantiza una mayor corrección en las decisiones18,19. Esta evaluación multidisciplinar puede ser útil en grupos de pacientes en los que los estudios no han proporcionado una información con aplicabilidad clínica. En esta línea es necesario ampliar experiencia en grupos que fueron excluidos de los ensayos (mayores de 60 años, pacientes con ataque isquémico transitorio sin lesión en imagen)9–11, o en otros en los que podría plantearse un beneficio del cierre de FOP (edades de 61 a 69 años, FOP de bajo riesgo)4,21
La información procedente de registros cooperativos puede ser útil para evaluar cómo es su asistencia en la práctica clínica real y resolver dudas que los ensayos clínicos no son capaces de abordar. Por ello, las sociedades científicas recomiendan el diseño de registros prospectivos del manejo práctico de estos pacientes en nuestros hospitales para evaluar datos acerca de las diversas variables de este proceso, de las intervenciones terapéuticas empleadas y de los resultados acerca de su eficacia y seguridad19,20.
Por estas razones y con la intención de ampliar conocimientos sobre el tratamiento del ictus asociado a FOP se ha diseñado este registro cooperativo con los siguientes objetivos:
- 1.
Evaluar los criterios de selección de pacientes para cierre percutáneo según las recomendaciones actuales.
- 2.
Analizar las indicaciones que se hacen en pacientes de más de 60 años y en otros grupos específicos (AIT), franja de edad de 61 a 69 años y FOP considerado de bajo riesgo.
- 3.
Determinar la seguridad y eficacia de los procedimientos.
El estudio fue realizado en 14 centros pertenecientes al Grupo de Patología Cerebrovascular (NORDICTUS) que está integrado por hospitales del norte de España (Aragón, Navarra, País Vasco, Cantabria, Asturias, Galicia y Castilla-León). Los Comités de Ética e Institutos de Investigación Sanitaria aprobaron el protocolo en cada centro. El registro de datos incluía la obtención de un consentimiento informado del paciente participante o sus representantes legales. El estudio fue promovido por el «Proyecto Ictus» del Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología.
Diseño del estudio y selección de pacientesRegistro observacional prospectivo de casos de ictus isquémico no lacunar criptogénico asociado a FOP diagnosticados en la red de hospitales NORDICTUS en el periodo 2018-2021.
Los investigadores de cada centro incluyeron pacientes con ictus isquémico o ataque isquémico transitorio en los que el estudio etiológico no identificaba una causa determinada para el evento cerebrovascular y se detectaba un FOP (clasificación según los criterios de la SEN)22.
La evaluación etiológica incluyó: pruebas de laboratorio habituales (hemograma, bioquímica, perfil lipídico), test de trombofilia, determinación de tóxicos si existía indicación, exploración de sistema venoso con ultrasonografía si existía indicación, estudio cardiológico (electrocardiograma, telemetría en Unidad de Ictus o Holter ECG-24 h, ecocardiograma) y examen neurovascular (Doppler de troncos supraórticos y transcraneal, angiorresonancia o angio-TAC).
El sistema utilizó una plataforma digital de recogida de datos periódicamente revisada, para asegurar su control y cumplimento.
Registro de variables, datos de neuroimagen y del FOPVariables clínicasSe registraron en cada paciente los siguientes datos:
- 1)
Demográficos: (edad, sexo); factores de riesgo vascular: antecedentes de hipertensión arterial, diabetes mellitus, dislipemia, cardiopatía isquémica, enfermedad vascular periférica, tabaquismo, abuso de alcohol, ictus/AIT previo, migraña, tratamiento antitrombótico (antiplaquetarios/anticoagulantes), uso de tóxicos/drogas (determinación en orina).
- 2)
Factores relacionados con ictus asociado a FOP: en este apartado se diferenciaron estas variables: historia de trombosis venosa profunda (TVP), tromboembolismo pulmonar (TEP), predisposición a enfermedad tromboembólica (historia de TVP/TEP, varices, inmovilidad, estado protrombótico), factores fisiológicos facilitadores durante el evento (Valsalva, ejercicio, levantar cargas pesadas, tos, bostezo, defecación, actividad sexual) y criterios de embolia paradójica (embolismo cerebral/presencia de trombosis venosa profunda o tromboembolismo pulmonar/existencia de cortocircuito derecha izquierda)23,24.
Respecto al ictus se incluyeron: horario de inicio, la gravedad (medida mediante la escala del National Instituteof Health Stroke Scale [NIHss])25, tipo según clasificación Oxfordshire26, estudio de hipercoagulabilidad, escala de riesgo de embolismo paradójico (RoPE)27 y tratamiento médico preventivo.
En las características radiológicas del evento cerebrovascular se incluyeron: topografía (circulación anterior, posterior, ambas, sin lesión) y patrón de neuroimagen (territorial, fragmentado, lesión en territorio de arterias perforantes).
Se definió como patrón embólico: patrón fragmentado (lesión múltiple en uno o varios territorios vasculares) o patrón territorial (lesión córtico-subcortical o cortical aislada en un territorio vascular)28.
Procedimientos diagnósticos para el FOPDoppler transcranealEl estudio se realizó mediante la monitorización vía transtemporal de la arteria cerebral media con una sonda de 2.5MHz. Para la obtención del contraste se introdujeron en una jeringa 1ml de aire y 9ml de suero salino isotónico estéril. El estudio se realizó un mínimo de dos veces en reposo y dos veces tras maniobra de Valsalva. Según su tamaño el foramen se clasificó como: pequeño (1 a 10 microburbujas); moderado (>10 microburbujas sin patrón ducha o cortina) y masivo (ducha o cortina)29.
Ecografía cardiacaEl estudio cardiológico incluía la realización de ecocardiograma transtorácico, ecocardiograma transesofágico o ambas exploraciones. Para el diagnóstico de FOP se empleó el test de contraste utilizando suero fisiológico agitado con inyección en reposo y durante la maniobra de Valsalva.
El grado del cortocircuito se cuantificó como mínimo (< 10 microburbujas), moderado (10-30 microburbujas) o severo (>30 microburbujas).
En el estudio se exploró la presencia de otras alteraciones anatómicas: aneurisma de septo auricular (definido como una excursión del septo de más de 10mm y una base de más de 15mm), y de restos embrionarios (red de Chiari, válvula de Eustaquio)30,31.
Se consideró FOP de alto riesgo a aquel que tenía un grado de cortocircuito severo o al que asociaba un aneurisma de septo auricular18–20.
Seguimiento de pacientes y variables pronósticas (de respuesta)El reclutamiento se inició el 1 de febrero de 2018 y finalizó el 31 de diciembre de 2021. A los casos incluidos se les realizó un seguimiento con controles periódicos hasta el cierre del registro. Se registraron los días transcurridos desde el ictus hasta el cierre. Asimismo, se evaluaron como variables de respuesta en el grupo con indicación de cierre de FOP: complicaciones durante el procedimiento de instalación del dispositivo, complicaciones tardías (presentadas después de 7 días tras el procedimiento) y recurrencia de eventos cerebrovasculares.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS versión 15.0 para Windows. Las variables cualitativas se expresaron como número de casos (n) y porcentaje (%) y las variables cuantitativas como media y desviación estándar, mediana y rango intercuartílico (RIQ).
El análisis univariante se desarrolló con la prueba de Chi-cuadrado o el test exacto de Fisher para las variables categóricas. Para variables cuantitativas de distribución normal se utilizó la prueba t-Student, y para aquellas variables que no seguían una distribución normal se utilizó el test no paramétrico U de Mann-Whitney.
Para el análisis multivariante se seleccionaron las variables con un nivel de significación inferior a 0,1 y, mediante un análisis de regresión logística utilizando una selección paso a paso, los posibles factores que pudieran predecir la elección de cierre de FOP. Se consideraron valores de p≤0,05 como estadísticamente significativos.
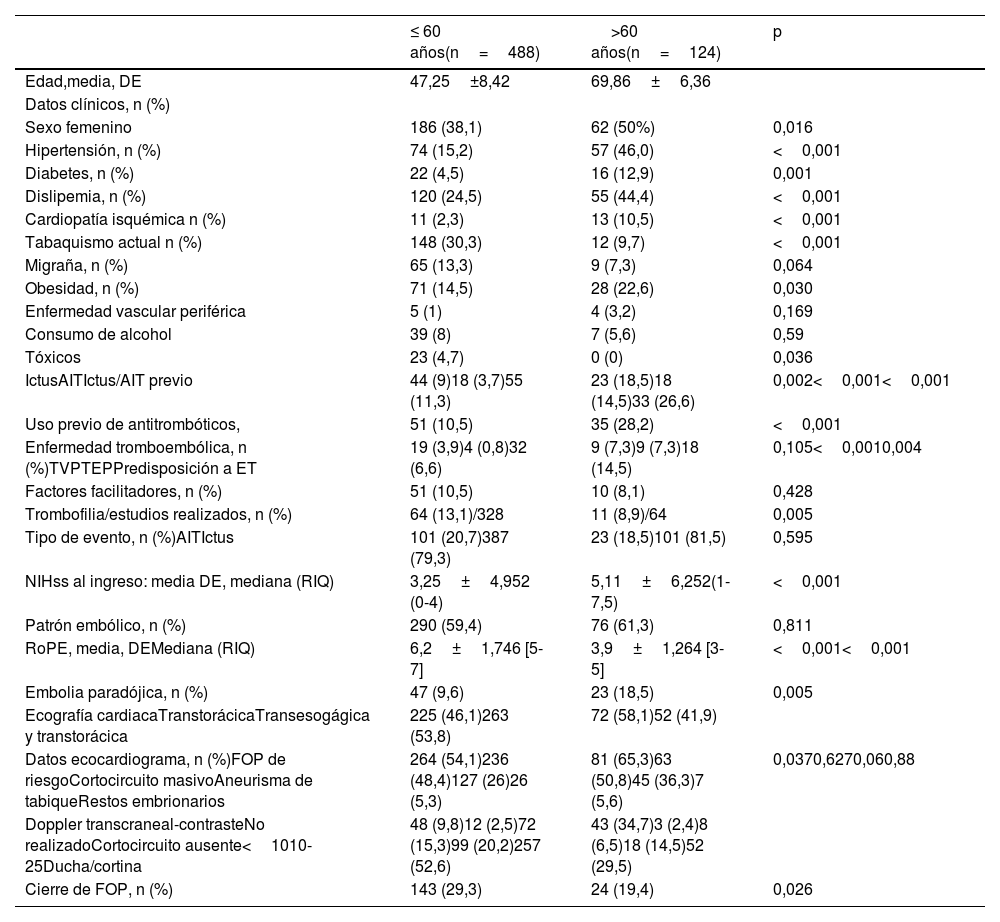
ResultadosCaracterísticas de los pacientesEl registro incluyó un total de 612 pacientes; 488 en el grupo ≤ de 60 años y 124 en el de más de 60 años (tabla 1). Como era predecible, en el grupo de más edad se observó una mayor presencia de factores de riesgo con la excepción del tabaquismo. En la evaluación cardiológica para la detección de FOP se realizó ecocardiograma transtorácico y transesofágico en 315 pacientes (51,4%) y el resto disponían de una exploración transtorácica. No se encontraron diferencias cuando se evaluaban las características anatómicas ecocardiográficas por separado (detección de cortocircuito masivo, aneurisma de tabique y reconocimiento de restos embrionarios). Sin embargo, la presencia de lo que es definido como FOP de alto riesgo (cortocircuito masivo o cortocircuito asociado a aneurisma), se identificó con mayor proporción en el grupo de>60 años (65,3% vs. 54,1%; p=0,037).
Características basales de los pacientes, distribuidos según la edad ≤/> 60 años
| ≤ 60 años(n=488) | >60 años(n=124) | p | |
|---|---|---|---|
| Edad,media, DE | 47,25±8,42 | 69,86±6,36 | |
| Datos clínicos, n (%) | |||
| Sexo femenino | 186 (38,1) | 62 (50%) | 0,016 |
| Hipertensión, n (%) | 74 (15,2) | 57 (46,0) | <0,001 |
| Diabetes, n (%) | 22 (4,5) | 16 (12,9) | 0,001 |
| Dislipemia, n (%) | 120 (24,5) | 55 (44,4) | <0,001 |
| Cardiopatía isquémica n (%) | 11 (2,3) | 13 (10,5) | <0,001 |
| Tabaquismo actual n (%) | 148 (30,3) | 12 (9,7) | <0,001 |
| Migraña, n (%) | 65 (13,3) | 9 (7,3) | 0,064 |
| Obesidad, n (%) | 71 (14,5) | 28 (22,6) | 0,030 |
| Enfermedad vascular periférica | 5 (1) | 4 (3,2) | 0,169 |
| Consumo de alcohol | 39 (8) | 7 (5,6) | 0,59 |
| Tóxicos | 23 (4,7) | 0 (0) | 0,036 |
| IctusAITIctus/AIT previo | 44 (9)18 (3,7)55 (11,3) | 23 (18,5)18 (14,5)33 (26,6) | 0,002<0,001<0,001 |
| Uso previo de antitrombóticos, | 51 (10,5) | 35 (28,2) | <0,001 |
| Enfermedad tromboembólica, n (%)TVPTEPPredisposición a ET | 19 (3,9)4 (0,8)32 (6,6) | 9 (7,3)9 (7,3)18 (14,5) | 0,105<0,0010,004 |
| Factores facilitadores, n (%) | 51 (10,5) | 10 (8,1) | 0,428 |
| Trombofilia/estudios realizados, n (%) | 64 (13,1)/328 | 11 (8,9)/64 | 0,005 |
| Tipo de evento, n (%)AITIctus | 101 (20,7)387 (79,3) | 23 (18,5)101 (81,5) | 0,595 |
| NIHss al ingreso: media DE, mediana (RIQ) | 3,25±4,952 (0-4) | 5,11±6,252(1-7,5) | <0,001 |
| Patrón embólico, n (%) | 290 (59,4) | 76 (61,3) | 0,811 |
| RoPE, media, DEMediana (RIQ) | 6,2±1,746 [5-7] | 3,9±1,264 [3-5] | <0,001<0,001 |
| Embolia paradójica, n (%) | 47 (9,6) | 23 (18,5) | 0,005 |
| Ecografía cardiacaTranstorácicaTransesogágica y transtorácica | 225 (46,1)263 (53,8) | 72 (58,1)52 (41,9) | |
| Datos ecocardiograma, n (%)FOP de riesgoCortocircuito masivoAneurisma de tabiqueRestos embrionarios | 264 (54,1)236 (48,4)127 (26)26 (5,3) | 81 (65,3)63 (50,8)45 (36,3)7 (5,6) | 0,0370,6270,060,88 |
| Doppler transcraneal-contrasteNo realizadoCortocircuito ausente<1010-25Ducha/cortina | 48 (9,8)12 (2,5)72 (15,3)99 (20,2)257 (52,6) | 43 (34,7)3 (2,4)8 (6,5)18 (14,5)52 (29,5) | |
| Cierre de FOP, n (%) | 143 (29,3) | 24 (19,4) | 0,026 |
No se realizó anàlisis comparativo con las exploraciones de detección del FOP: ecografía cardiaca y doppler transcraneal.
DE: desviación estándar; ET: enfermedad tromboembólica; NIHss: National Institute of Health stroke scale; RIQ: rango intercuartílico; RoPE: Escala de Riesgo de Embolismo paradójico; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda.
En cuanto a las variables más vinculadas al mecanismo fisiopatológico de embolismo paradójico: el antecedente de TEP (7,3% vs. 0,8%; p<0,001) e historia de predisposición a enfermedad tromboembólica (14,5% vs. 6,6%; p=0,004) se observaban con mayor frecuencia en el grupo de más edad. Asimismo, los casos con criterios de embolismo paradójico se reconocían con más frecuencia en este grupo (18,5% vs. 9,6%; p=0,005).
Se realizó un estudio de trombofilia en 392 pacientes (64%) detectándose alteraciones en el 17% de estos. Estas fueron: anticoagulante lúpico en 20 pacientes, anticuerpos anticardiolipina en 6, hiperhomocisteinemia en 13, heterocigosis mutación factor Leyden en 11, heterocigosis mutación gen protrombina en 11, déficit de proteína s en 3, homocigosis factor Leyden en 1 y déficit proteína C en 1.
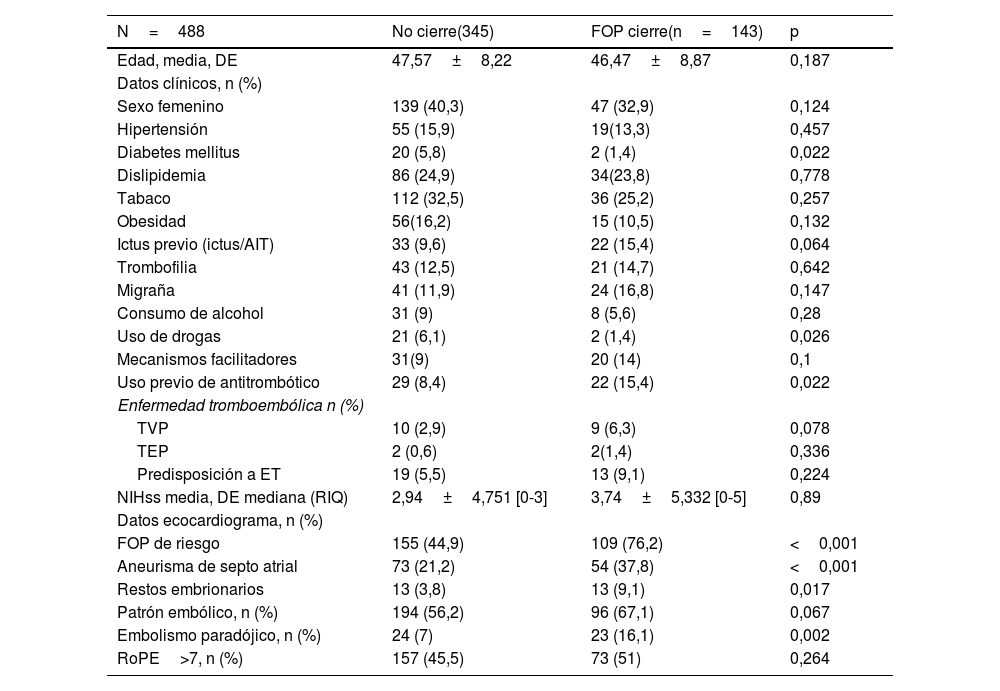
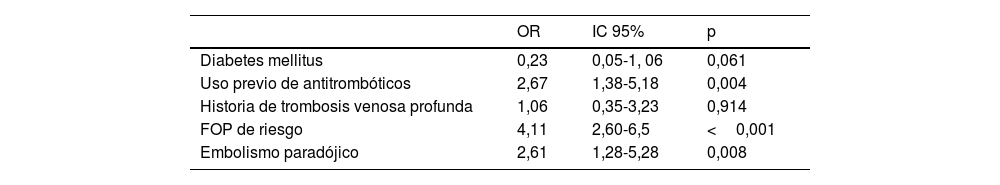
Análisis exploratorio de datos sobre la indicación de cierre en los grupos de pacientes según edad (≤60 años y>60 años)En el grupo de pacientes de ≤60 años (n=488) se indicaron 143 cierres de FOP (29,3%). El análisis comparativo univariante estableció que las variables que se asociaban con la indicación de cierre eran: ausencia de diabetes, historia de ictus/AIT previo, uso previo de antitrombóticos, no uso de drogas, patrón radiológico embólico, predisposición a eventos tromboembólicos y los datos ecográficos de FOP de alto riesgo (tabla 2). En el análisis de regresión logística, las variables predictoras de indicación de cierre fueron: la detección ecográfica de un FOP de alto riesgo (OR 4,11; IC 2,6-5; p<0,001), criterio de embolismo paradójico (riesgo OR 2,61; IC 1,28-5,28; p=0,008) y el uso previo de antitrombóticos (riesgo OR 2,67; IC 1,38-5,18; p=0,009) (tabla 3).
Variables relacionadas con la indicación de cierre en el Grupo ≤ 60 años. Análisis univariante
| N=488 | No cierre(345) | FOP cierre(n=143) | p |
|---|---|---|---|
| Edad, media, DE | 47,57±8,22 | 46,47±8,87 | 0,187 |
| Datos clínicos, n (%) | |||
| Sexo femenino | 139 (40,3) | 47 (32,9) | 0,124 |
| Hipertensión | 55 (15,9) | 19(13,3) | 0,457 |
| Diabetes mellitus | 20 (5,8) | 2 (1,4) | 0,022 |
| Dislipidemia | 86 (24,9) | 34(23,8) | 0,778 |
| Tabaco | 112 (32,5) | 36 (25,2) | 0,257 |
| Obesidad | 56(16,2) | 15 (10,5) | 0,132 |
| Ictus previo (ictus/AIT) | 33 (9,6) | 22 (15,4) | 0,064 |
| Trombofilia | 43 (12,5) | 21 (14,7) | 0,642 |
| Migraña | 41 (11,9) | 24 (16,8) | 0,147 |
| Consumo de alcohol | 31 (9) | 8 (5,6) | 0,28 |
| Uso de drogas | 21 (6,1) | 2 (1,4) | 0,026 |
| Mecanismos facilitadores | 31(9) | 20 (14) | 0,1 |
| Uso previo de antitrombótico | 29 (8,4) | 22 (15,4) | 0,022 |
| Enfermedad tromboembólica n (%) | |||
| TVP | 10 (2,9) | 9 (6,3) | 0,078 |
| TEP | 2 (0,6) | 2(1,4) | 0,336 |
| Predisposición a ET | 19 (5,5) | 13 (9,1) | 0,224 |
| NIHss media, DE mediana (RIQ) | 2,94±4,751 [0-3] | 3,74±5,332 [0-5] | 0,89 |
| Datos ecocardiograma, n (%) | |||
| FOP de riesgo | 155 (44,9) | 109 (76,2) | <0,001 |
| Aneurisma de septo atrial | 73 (21,2) | 54 (37,8) | <0,001 |
| Restos embrionarios | 13 (3,8) | 13 (9,1) | 0,017 |
| Patrón embólico, n (%) | 194 (56,2) | 96 (67,1) | 0,067 |
| Embolismo paradójico, n (%) | 24 (7) | 23 (16,1) | 0,002 |
| RoPE>7, n (%) | 157 (45,5) | 73 (51) | 0,264 |
DE: desviación estándar; ET: enfermedad tromboembólica; NIHss: National Institute of Health stroke scale; RIQ: rango intercuartílico; RoPE: Escala de Riesgo de Embolismo paradójico; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda.
Análisis multivariante para el cálculo de variables predictoras de indicación de cierre en pacientes de ≤ 60 años
| OR | IC 95% | p | |
|---|---|---|---|
| Diabetes mellitus | 0,23 | 0,05-1, 06 | 0,061 |
| Uso previo de antitrombóticos | 2,67 | 1,38-5,18 | 0,004 |
| Historia de trombosis venosa profunda | 1,06 | 0,35-3,23 | 0,914 |
| FOP de riesgo | 4,11 | 2,60-6,5 | <0,001 |
| Embolismo paradójico | 2,61 | 1,28-5,28 | 0,008 |
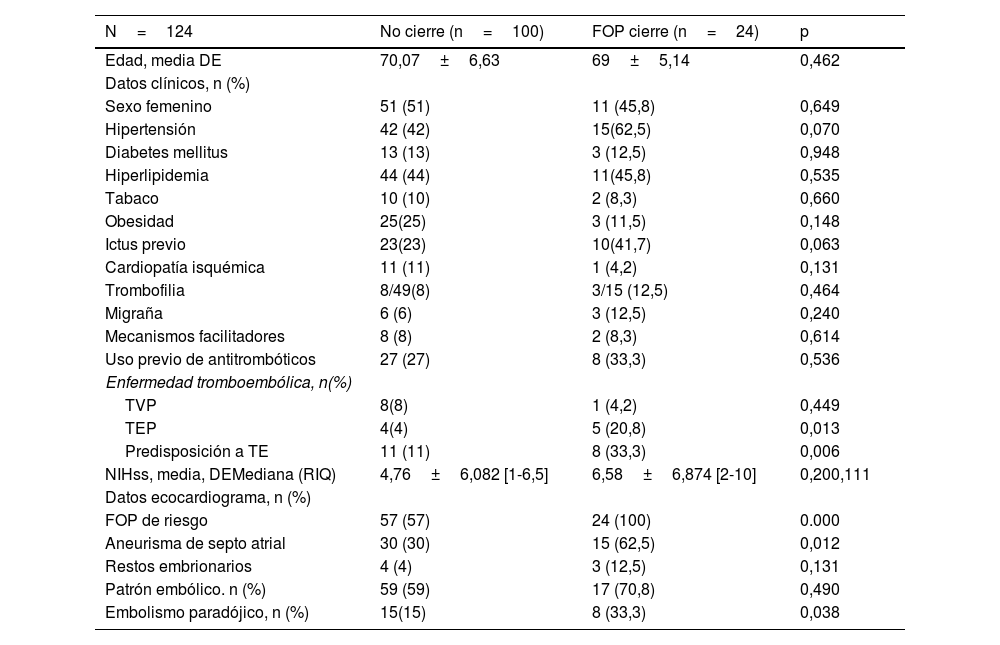
En el grupo de> 60 años (n=124), la indicación para realizar el cierre de FOP se llevó a cabo en 24 casos (19%). Las variables que se asociaron con esta opción fueron: antecedente de tromboembolismo pulmonar, predisposición a enfermedad tromboembólica, criterio de embolismo paradójico y FOP de alto riesgo (tabla 4).
Variables asociadas con la indicación de cierre en el Grupo>60 años
| N=124 | No cierre (n=100) | FOP cierre (n=24) | p |
|---|---|---|---|
| Edad, media DE | 70,07±6,63 | 69±5,14 | 0,462 |
| Datos clínicos, n (%) | |||
| Sexo femenino | 51 (51) | 11 (45,8) | 0,649 |
| Hipertensión | 42 (42) | 15(62,5) | 0,070 |
| Diabetes mellitus | 13 (13) | 3 (12,5) | 0,948 |
| Hiperlipidemia | 44 (44) | 11(45,8) | 0,535 |
| Tabaco | 10 (10) | 2 (8,3) | 0,660 |
| Obesidad | 25(25) | 3 (11,5) | 0,148 |
| Ictus previo | 23(23) | 10(41,7) | 0,063 |
| Cardiopatía isquémica | 11 (11) | 1 (4,2) | 0,131 |
| Trombofilia | 8/49(8) | 3/15 (12,5) | 0,464 |
| Migraña | 6 (6) | 3 (12,5) | 0,240 |
| Mecanismos facilitadores | 8 (8) | 2 (8,3) | 0,614 |
| Uso previo de antitrombóticos | 27 (27) | 8 (33,3) | 0,536 |
| Enfermedad tromboembólica, n(%) | |||
| TVP | 8(8) | 1 (4,2) | 0,449 |
| TEP | 4(4) | 5 (20,8) | 0,013 |
| Predisposición a TE | 11 (11) | 8 (33,3) | 0,006 |
| NIHss, media, DEMediana (RIQ) | 4,76±6,082 [1-6,5] | 6,58±6,874 [2-10] | 0,200,111 |
| Datos ecocardiograma, n (%) | |||
| FOP de riesgo | 57 (57) | 24 (100) | 0.000 |
| Aneurisma de septo atrial | 30 (30) | 15 (62,5) | 0,012 |
| Restos embrionarios | 4 (4) | 3 (12,5) | 0,131 |
| Patrón embólico. n (%) | 59 (59) | 17 (70,8) | 0,490 |
| Embolismo paradójico, n (%) | 15(15) | 8 (33,3) | 0,038 |
* En este grupo de>60 años no se aplicó un anàlisis multivariente debido a que el procedimiento por pasos es detenido por la magnitud del efecto de la variable FOP de riesgo.
DE: desviación estándar; ET: enfermedad tromboembólica; NIHss: National Institute of Health stroke scale; RIQ: rango intercuartílico; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda.
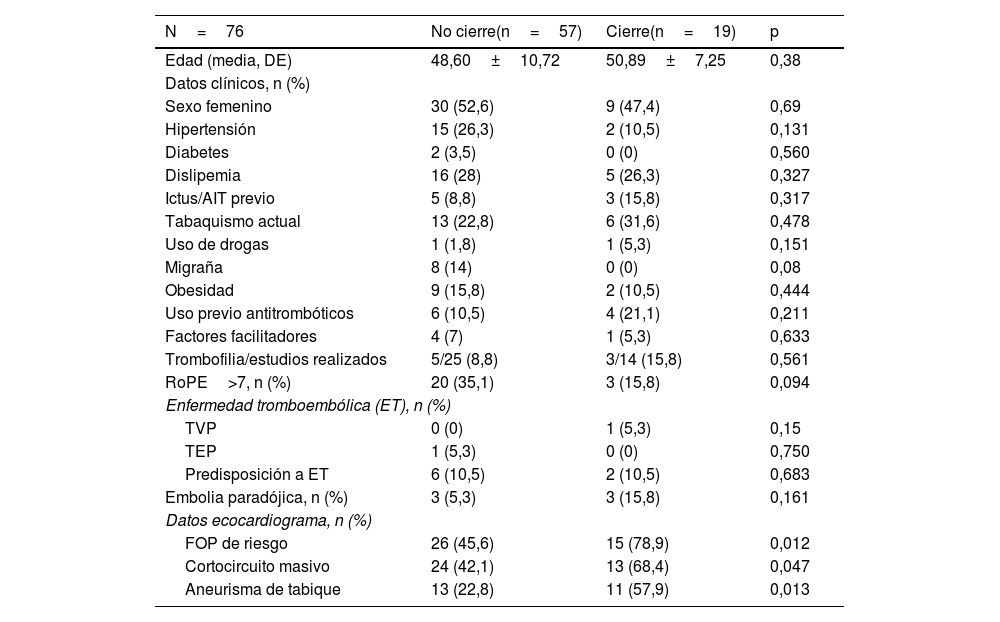
Se incluyeron 76 pacientes con ataque isquémico transitorio, de los cuales 19 (25%) recibieron la indicación de cierre percutáneo (tabla 5). El análisis comparativo de variables observó que la mayoría de los pacientes con opción de cierre de FOP (78,9% frente a 45,6%; p=0,012) tenían un cortocircuito con datos de alto riesgo. No se encontraron diferencias con respecto al resto de factores evaluados.
Variables asociadas con la indicación de cierre en el grupo de pacientes con ataque isquémico transitorio
| N=76 | No cierre(n=57) | Cierre(n=19) | p |
|---|---|---|---|
| Edad (media, DE) | 48,60±10,72 | 50,89±7,25 | 0,38 |
| Datos clínicos, n (%) | |||
| Sexo femenino | 30 (52,6) | 9 (47,4) | 0,69 |
| Hipertensión | 15 (26,3) | 2 (10,5) | 0,131 |
| Diabetes | 2 (3,5) | 0 (0) | 0,560 |
| Dislipemia | 16 (28) | 5 (26,3) | 0,327 |
| Ictus/AIT previo | 5 (8,8) | 3 (15,8) | 0,317 |
| Tabaquismo actual | 13 (22,8) | 6 (31,6) | 0,478 |
| Uso de drogas | 1 (1,8) | 1 (5,3) | 0,151 |
| Migraña | 8 (14) | 0 (0) | 0,08 |
| Obesidad | 9 (15,8) | 2 (10,5) | 0,444 |
| Uso previo antitrombóticos | 6 (10,5) | 4 (21,1) | 0,211 |
| Factores facilitadores | 4 (7) | 1 (5,3) | 0,633 |
| Trombofilia/estudios realizados | 5/25 (8,8) | 3/14 (15,8) | 0,561 |
| RoPE>7, n (%) | 20 (35,1) | 3 (15,8) | 0,094 |
| Enfermedad tromboembólica (ET), n (%) | |||
| TVP | 0 (0) | 1 (5,3) | 0,15 |
| TEP | 1 (5,3) | 0 (0) | 0,750 |
| Predisposición a ET | 6 (10,5) | 2 (10,5) | 0,683 |
| Embolia paradójica, n (%) | 3 (5,3) | 3 (15,8) | 0,161 |
| Datos ecocardiograma, n (%) | |||
| FOP de riesgo | 26 (45,6) | 15 (78,9) | 0,012 |
| Cortocircuito masivo | 24 (42,1) | 13 (68,4) | 0,047 |
| Aneurisma de tabique | 13 (22,8) | 11 (57,9) | 0,013 |
DE: desviación estándar; ET: enfermedad tromboembólica; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda.
En el grupo de edad ≤ 60 años, 224 pacientes no tenían datos de FOP de alto riesgo (cortocircuito de moderada o baja intensidad/ausencia de aneurisma). Se realizó cierre percutáneo en 34 (15,1%). El análisis comparativo de las variables del estudio no estableció que ninguna de ellas se asociara significativamente a esta opción de tratamiento.
En el grupo de edad de 61 a 69 años (n=69) se detectaron 45 casos (65,2%) con FOP de alto riesgo. El tratamiento de cierre de FOP se indicó en 15 casos (21,7%). Los factores relacionados con enfermedad tromboembólica venosa (40% vs. 0%; p<0,001), junto con la presencia de un FOP de alto riesgo (100% vs. 55,6%; p=0,001) fueron los que se asociaron significativamente a la indicación del cierre percutáneo.
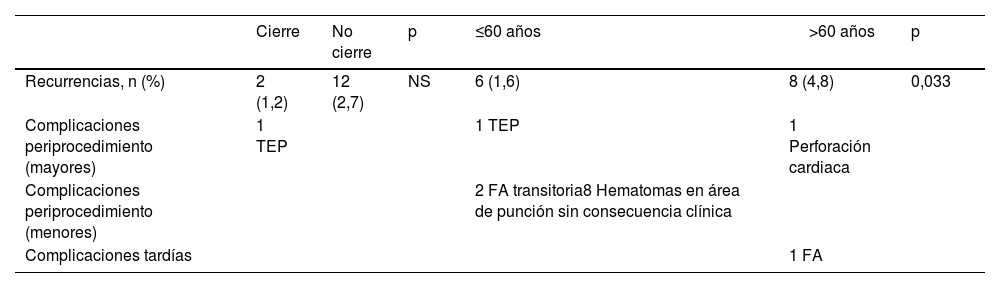
Seguimiento de pacientes y variables pronósticas (de respuesta)La mediana de seguimiento en la cohorte de estudio fue de 16 meses (RIC; 8-24). El seguimiento fue completo en todos los pacientes. En los pacientes en los que se realizó el cierre de FOP la mediana de días desde el evento hasta la intervención fue de 133 días (RIQ: 34-261,5). Las complicaciones periprocedimiento fueron (tabla 6): 1 perforación cardiaca; 1 caso de tromboembolismo pulmonar, 2 fibrilaciones auriculares transitorias y 8 hematomas en área de punción sin consecuencia clínica. Entre las complicaciones tardías, se registró un paciente con fibrilación auricular crónica.
Seguimiento de los pacientes, recurrencias cerebrovasculares y complicaciones. Comparación en grupos cierre y no cierre; y en grupos de edad (≤60 y>60 años)
| Cierre | No cierre | p | ≤60 años | >60 años | p | |
|---|---|---|---|---|---|---|
| Recurrencias, n (%) | 2 (1,2) | 12 (2,7) | NS | 6 (1,6) | 8 (4,8) | 0,033 |
| Complicaciones periprocedimiento (mayores) | 1 TEP | 1 TEP | 1 Perforación cardiaca | |||
| Complicaciones periprocedimiento (menores) | 2 FA transitoria8 Hematomas en área de punción sin consecuencia clínica | |||||
| Complicaciones tardías | 1 FA |
FA: fibrilación auricular; TEP: tromboembolismo pulmonar.
Un total de 14 pacientes presentaron eventos de ictus recurrente; 2 en el grupo de cierre de FOP (1,2%) y 12 en el de tratamiento preventivo sin cierre (2,7%; p=0,207). Las recurrencias fueron más frecuentes en el grupo de mayor edad (6[4,8%%] vs. 8 [1,6%]; p=0,033).
DiscusiónCon los conocimientos actuales, la indicación de una opción terapéutica para un paciente con un ictus criptogénico asociado a FOP puede realizarse de forma razonable y convincente. Los estudios epidemiológicos, los ensayos clínicos y, finalmente, las guías de reciente publicación han proporcionado información eficiente para apoyar el cierre percutáneo en pacientes correctamente seleccionados. Aún así, las características particulares de la entidad ictus asociado a FOP (prevalencia, heterogeneidad, niveles de evidencia de la indicación cierre) han motivado que las propias guías e informes de posicionamiento promuevan la realización de registros prospectivos para conocer cómo es la práctica clínica en el mundo real.
Los principales resultados de nuestro registro cooperativo pueden resumirse en:
- a)
El factor de mayor peso, para establecer la indicación de cierre percutáneo, es la detección ecográfica de un FOP de alto riesgo.
- b)
En los pacientes con edad inferior a 61 años, se consideran candidatos a cierre los casos con criterios de embolia paradójica o con el antecedente de uso previo de tratamiento preventivo antitrombótico.
- c)
En los pacientes con edad superior a 60 años, la historia de enfermedad tromboembólica es un factor importante para decidir la realización de cierre.
- d)
Los pacientes con AIT sin lesión en neuroimagen pueden ser candidatos a cierre percutáneo, aquellos casos en los que se detecte un FOP de alto riesgo.
- e)
El registro permitió observar que también se han seleccionado pacientes con FOP de bajo riesgo para cierre, aunque no se han encontrado variables claramente asociadas a esta decisión.
- f)
La tasa de ictus recurrente fue baja y se apreció una tendencia superior en los pacientes de mayor edad.
La presencia de un aneurisma del septo, de restos embrionarios (red de Chiari, válvula de Eustaquio) o la detección de un cortocircuito masivo se han asociado con el FOP como agente causal del ictus criptogénico (31-35). Numerosos estudios respaldan esta relación32–36. En dos de los ensayos clínicos positivos se incluyeron solo pacientes con cortocircuito grande o aneurisma11,12, por lo que el beneficio del cierre frente al tratamiento médico era mayor en estos pacientes. Por otro lado, el planteamiento de que los FOP con cortocircuitos pequeños o moderados también pueden asociarse con mayor riesgo está confirmado en estudios observacionales y colaborativos37,38.
En este debate, las guías e informes de sociedades se han posicionado recomendando el potencial beneficio del cierre para FOP con cortocircuito grande y una probable menor ventaja en los casos de cortocircuito pequeño18,19.
El registro presentado confirma que el FOP de alto riesgo es la principal indicación. Nuestro estudio aborda la indicación de cierre en pacientes mayores de 60 años. En estudios recientes39,40 se ha comprobado que la edad es un factor determinante en el riesgo de recurrencia en pacientes con ictus criptogénico con FOP y que este incremento de riesgo no puede ser atribuido exclusivamente a la mayor carga de factores de riesgo cerebrovascular vinculada al envejecimiento. Por ello, se ha planteado la utilidad de realizar ensayos clínicos en estos grupos de edad. En el registro se constata que el grupo de más de 60 años además de mayor carga de factores de riesgo tienen una mayor proporción de casos con predisposición a enfermedad tromboembólica, con criterios de embolia paradójica y con FOP de alto riesgo. Estos datos determinan que la selección de pacientes sea más compleja, pero que el cierre pueda ser una opción preventiva razonable y justificada. Este grupo de edad presenta también mayor tasa de recurrencias y es más sensible a los efectos adversos, aunque estos últimos en niveles aceptables para esa indicación.
Otros grupos de interés clínico como son los casos con ataque isquémico transitorio o los que están en un rango de edad de 61 a 69 años fueron analizados. Los pacientes con AIT sin evidencia de lesión en imagen fueron excluidos de los ensayos clínicos por lo que las recomendaciones de tratamiento se hacen extrapolando la información obtenida en estos estudios y excluyendo simuladores de ictus. El grupo de edad de 61 a 69 años tiene interés por presentar muchos de ellos un perfil clínico con menor presencia de enfermedad aterotrombótica o cardioembólica. En estos dos grupos, el principal factor de selección de pacientes para cierre percutáneo fue la detección de un FOP de alto riesgo. En los pacientes de 61 a 69 años, la historia o predisposición a enfermedad tromboembólica venosa fue otro factor asociado a la opción de cierre.
Los datos obtenidos en el seguimiento apoyan la eficacia y seguridad de la técnica en nuestros centros. Las tasas de ictus recurrente son bajas con frecuencias similares a las recogidas en los estudios observacionales y ensayos clínicos3.
Un resultado de interés práctico es el relacionado con el tiempo transcurrido desde el evento hasta la implantación del dispositivo de cierre. La mediana de 133 días refleja el manejo actual de estos pacientes: evaluación etiológica completa, presentación en los comités de cardiología-neurología y espera hasta el día fijado para el procedimiento.
Las limitaciones de este estudio son las inherentes a este tipo de registros multicéntricos observacionales. La primera es la relacionada con la recogida de datos. Esta tarea es compleja dentro de la asistencia clínica, y puede condicionar una variabilidad en la interpretación de algunas exploraciones (datos anatómicos de la ecografía cardiaca, patrones de lesión en la neuroimagen y diferentes grados de realización de pruebas), con lo que pueden producirse sesgos en la clasificación de los sujetos. Otras limitaciones que se pueden considerar son las relativas al tamaño de la muestra y al tiempo de seguimiento de los pacientes. El tamaño muestral debería ser mayor para obtener mayor validez en los resultados con los grupos específicos (mayores de 60 años, ataque isquémico transitorio y FOP de bajo riesgo). Y el periodo de seguimiento debería ser mayor, debido a la baja tasa de recurrencia del ictus asociado a FOP. No obstante, y considerando que el ictus asociado a FOP es un importante problema de salud, y que su prevención secundaria es prioritaria, nuestro registro ofrece una información útil acerca de la aplicabilidad de las recomendaciones actuales y los usos en nuestros centros, que pueden ser de interés para la comparación con otros, así como para la previsión y gestión de los recursos necesarios.
ConclusionesEn la práctica clínica del ictus criptogénico asociado a FOP, el factor principal en la selección de pacientes para la indicación de cierre percutáneo es la detección de un FOP de alto riesgo (cortocircuito masivo o aneurisma del septo interauricular). Otros factores, identificados como significativos en la decisión de cierre, son los antecedentes de enfermedad tromboembólica, criterios de embolismo paradójico o el uso previo de antitrombóticos.
FinanciaciónAyuda de Abbott Vascular y Fundación EPIC (Educación y Promoción de la Investigación Cardiovascular) mediante beca no condicionada para la gestión de los datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.